酒曲,又名酒药,是以粮食谷物类为原料,经微生物接种或天然繁殖后,具有糖化和发酵能力的发酵剂[1]。大量研究表明,酒曲中主要有三大类微生物,即霉菌、酵母菌和细菌。霉菌主要包括根霉(Rhizopus sp.)和毛霉(Mucor sp.)两个属,酵母菌包括酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母,细菌则以乳酸菌(Lactobacillus)、醋酸菌(Acetobacter aceti)、芽孢杆菌(Bacillus)等产酸细菌为主[2]。甜酒曲中微生物的多样性是酿造米酒的关键[3]。现代工业化生产的甜酒曲主要含有酵母菌和根霉,纯种的根霉曲中只有单一的根霉,而传统土曲是由根霉、毛霉、细菌、酵母菌等多种微生物及米粉、辣蓼草等中草药制作而成,酿制的米酒芳香独特[4]。
米酒,俗称醪糟,是以大米为原料,酒曲为发酵剂酿造而成的一种传统发酵酒精饮料,米酒的酿造具有悠久的历史,据文献[5]报道,中国酒的历史很可能源于米酒。米酒虽以醇类和水为主要成分,但其所含的较为丰富的营养物质和活性健康成分不容忽视,如氨基酸、有机酸、生物活性肽、维生素、无机盐及微量元素等[6]。在米酒发酵过程中,糖化阶段是米酒发酵的重要阶段之一,糖化主要是由酒曲中的根霉菌起作用,将大米中的淀粉质转化为单糖、麦芽糖、糊精等糖类,糖类再经过酿酒酵母(Saccharomyces cerevisiae)的作用转化为乙醇[7]。根霉的糖化能力直接影响到了大米中淀粉的转化能力,即出酒率,同时也会影响到米酒的风味以及其口感[8]。
由于目前的甜酒曲以纯种根霉曲居多,其酿制的米酒产品口味趋同[9]。本研究选择不同地区的代表性酒曲,筛选糖化力及液化力较好的酒曲中的根霉菌,并通过分子生物学技术对其进行菌种鉴定。将分离得到的根霉与不同酿酒酵母和细菌进行多样化复配制备风味型甜酒曲,再进行固态发酵制备甜米酒,测定米酒的理化指标,采用气相色谱-质谱联用技术(gas chromatograph-mass spectrometer,GC-MS)分析挥发性风味成分,考察米酒香气物质特征,同时,采用高效液相色谱法(high performance liquid chromatography,HPLC)测定甜米酒中的有机酸,采用高效液相色谱-蒸发光散射法(high performance liquid chromatography-evaporative light-scatteringdetector,HPLC-ELSD)测定米酒中的葡萄糖、麦芽糖含量,最终比较确认出最佳复配方案,为大规模复合酒曲的开发和规模化生产提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
糯米:孝感市朱湖农场;宜昌某酒曲(Ⅰ)、贵阳某酒曲(Ⅱ)、江西某酒曲(Ⅲ)、孝感某酒曲(Ⅳ):市售;对照酒曲:宜昌某酒曲;酿酒酵母(Saccharomyces cerevisiae)PF4、Sx、4-16、食窦魏斯氏菌(Weisseria sinonas)W-R-1、热带杆菌(Bacillus tropicus)CS-1、枯草芽孢杆菌(Bacillus subtilis)B-3:实验室菌种库。
1.1.2 培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基[10]:土豆200 g,琼脂20 g,葡萄糖20 g,蒸馏水1 000 mL,pH自然,121 ℃高压蒸汽灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[11]:酵母膏10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1 000 mL,pH自然,121 ℃高压蒸汽灭菌20 min。
肉汤培养基[12]:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,蒸馏水1 000 mL,pH自然,121 ℃高压蒸汽灭菌20 min。
MRS培养基:青岛海博生物技术有限公司。
1.1.3 试剂
硫酸铜、酒石酸钾钠、葡萄糖、氯化钠、磷酸二氢钾、氢氧化钠、冰醋酸、醋酸钠、亚甲基蓝、碘化钾(均为分析纯):国药集团化学试剂有限公司;葡萄糖、麦芽糖标准品(均为分析纯):上海源叶生物科技有限公司;磁珠法细菌和真菌基因组提取试剂盒:武汉纳磁生物科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)产物磁珠法纯化试剂盒:上海硕美生物科技有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
LRH-250恒温生化培养箱:上海智城分析仪器有限公司;HH-6数显恒温水浴锅:浙江金坛市富华仪器有限公司;LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂;5977B-7890B气相色谱-质谱联用仪:美国安捷伦公司;U3000高效液相色谱仪:赛默飞世尔科技公司;9700 PCR仪:美国ABI公司;5417R离心机:德国Eppendorf公司;DYY-8C电泳仪:北京六一仪器厂。
1.3 方法
1.3.1 根霉的分离纯化[13]
选取酒曲1 g加入无菌水中,稀释涂布于PDA培养基上,30 ℃培养36 h。选取较为典型的单一霉菌菌落,进行3次纯化后保藏待用。
1.3.2 分子生物学鉴定
采用DNA提取试剂盒提取根霉菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对分离菌株的18S rDNA基因序列进行PCR扩增。PCR扩增条件:96 ℃预变性5 min;96 ℃变性20 s、56 ℃复性30 s、72 ℃延伸30 s,35个循环;72 ℃再延伸10 min,于4 ℃终止反应。PCR扩增体系:PCR Mix 21 μL,上下游引物各1 μL,模板2 ng/μL。PCR扩增产物经1%琼脂糖凝胶电泳检测后委托武汉华大基因进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索,选取同源性较高的模式菌株的18S rDNA,采用MEGA 6软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 风味型甜酒曲的制备
复配菌种接种量参考张新武等[14]的方法并稍加修改,具体见表1。
表1 风味型甜酒曲的复配方案
Table 1 Compound scheme of flavored sweet Jiuqu
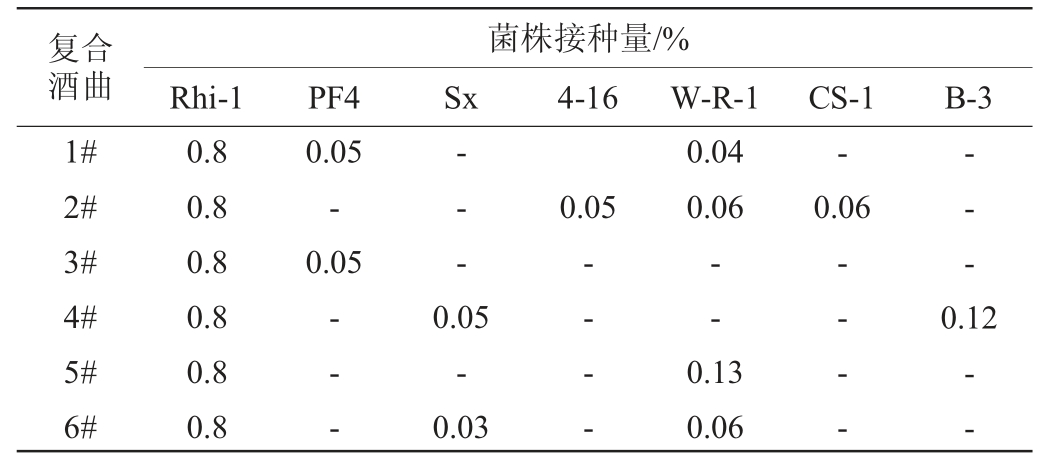
注:“-”表示未添加。
采用以根霉菌为主要配方的市售宜昌某酒曲作为对照,将籼米粉碎,过60目筛后灭菌,接种0.8%根霉菌孢子悬液,同时再接入一定比例的酵母液和细菌悬液,加入30%无菌水后拌匀,将其置于培养器皿中压实,30 ℃培养24 h,随后打散翻面并继续培养至60 h,于35 ℃烘箱中烘干。
1.3.4 甜米酒的制作流程及操作要点
糯米浸泡→蒸煮→摊凉降温→接种、拌曲→糖化发酵→过滤→灌装→杀菌→成品
操作要点[15]:
浸泡:糯米应在清洗干净后,用水浸泡6~8 h,冬天适当延长时间,浸泡至米粒无硬心,用手指能轻松碾碎即可。
蒸煮:浸泡完成后的米沥干,再置于蒸屉上蒸至米粒白心消失。
摊凉降温:使用冷水冲凉或自然冷却至30 ℃左右。
接种、拌曲:按照实验设计加入0.8%的酒曲并搅拌均匀,搅拌过程中应尽量保持米粒的完整。
发酵:将搅拌均匀的米饭装入发酵器皿中,置于30 ℃培养箱中恒温培养48 h。
过滤、杀菌:使用纱布对发酵液进行过滤,于72~75 ℃保持15~20 s杀菌,冷却后即得甜米酒成品。
1.3.5 测定方法
(1)酒曲糖化力及液化力的测定
糖化力的测定:参照文献[16];液化力的测定:采用比色法[17]。
(2)甜米酒理化指标的测定
总糖含量的测定:根据国标GB/T 13662—2018《黄酒》,采用廉爱农法[18];总酸含量的测定:参照国标GB/T 12456—2021《食品中总酸的测定》;酒精度的测定[19]:采用酒精计。
(3)甜米酒的感官评定
由8位具有相应专业水平的同行组成评分小组,根据GB/T 13662—2018《黄酒》对甜米酒的外观、香气、色泽、风味进行评判(满分100分),具体评分标准见表2[20]。
表2 甜米酒感官评定标准
Table 2 Sensory evaluation standards of sweet rice wine

续表

(4)甜米酒挥发性风味物质的测定
采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)结合GC-MS[21]法对甜米酒的主要挥发性风味成分进行检测。
(5)甜米酒中有机酸的测定
采用HPLC法对甜米酒中的草酸、乙酸、乳酸、柠檬酸、α-酮戊二酸、琥珀酸和苹果酸进行测定[22]。样品处理方法:将酒样稀释20倍,过0.22 μm滤膜待用;HPLC检测条件:Hypeisil GOLD C18色谱柱(250 mm×4.6 mm,5 μm),流动相为95%磷酸二氢钾溶液(0.02 mol/L,pH值2.60)-5%甲醇,流速0.5 mL/min,进样量10 μL。
(6)甜米酒中葡萄糖与麦芽糖的测定
采用HPLC-ELSD检测葡萄糖与麦芽糖含量[23]。样品处理方法:将酒样稀释100倍,过0.22 μm滤膜待用;HPLC检测条件:HypersilGOLDAmino色谱柱(250mm×4.6mm,5μm);流动相为75%乙腈-25%水溶液;柱温30℃。ELSD条件:漂移管温度80℃,喷雾管温度30℃,载气流速3.0mL/min。
2 结果与分析
2.1 4个地方特色酒曲糖化力和液化力的测定及菌株的分离
有研究表明,糯米甜酒还原糖的含量与霉菌降解淀粉的能力密不可分,通过测定酒曲中酶的最高活力,可以指导与优化发酵条件[24]。4种地方特色酒曲的糖化力及液化力见表3。由表3可知,4种酒曲的糖化力差异显著(P<0.05),液化力存在一定的差异,其中酒曲Ⅱ的糖化力、液化力均最高,分别为246.93 mg/(g·h)、0.27 g/(g·h),说明酒曲Ⅱ具有较好的分解淀粉、生成葡萄糖的能力。故选择酒曲Ⅱ作为目标酒曲。采用传统培养分离法从酒曲Ⅱ中分离得到一株根霉菌株,编号为Rhi-1。
表3 酒曲糖化力及液化力的测定结果
Table 3 Determination results of saccharification power and liquefaction power of Jiuqu

注:同列字母不同表示差异显著(P<0.05)。下同。
2.2 菌株Rhi-1的分子生物学鉴定
基于18S rDNA基因序列菌株Rhi-1的系统发育树见图1。由图1可知,菌株Rhi-1与少根根霉(Rhizopus arrhizus)亲缘关系最近,因此,鉴定该菌株为少根根霉(Rhizopus arrhizus)。
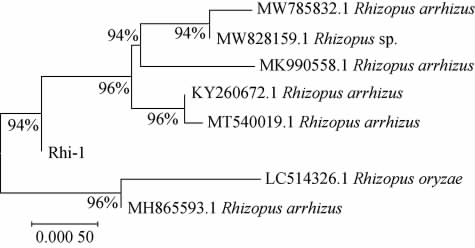
图1 基于18S rDNA基因序列菌株Rhi-1的系统发育树
Fig.1 Phylogenetic tree of strain Rhi-1 based on 18S rDNA gene sequences
2.3 甜米酒品质的分析
2.3.1 感官评价
对6种风味型甜酒曲和对照组酒曲发酵制备的甜米酒进行感官评价,结果见图2。由图2可知,7种甜米酒的感官评分有较明显差异,其中,6#复合酒曲发酵的甜米酒的滋味、香气和整体协调度得分最高,分别为22分、23分、22分,但外观得分(20分)略低于对照组。综合比较得知,6#复合酒曲发酵的甜米酒感官评价分最高,为87分,表明6#复合酒曲发酵制备的甜米酒有较好的风味与香味,酒体协调,在感官方面优于其他方案。
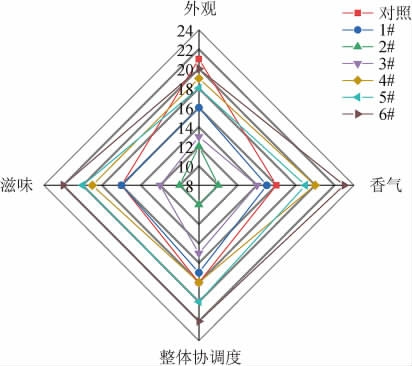
图2 甜米酒的感官评价结果
Fig.2 Sensory evaluation results of sweet rice wine
2.3.2 理化指标
7种甜米酒的理化指标见图3。由图3a可知,1#、2#、3#以及4#复合酒曲发酵制备的甜米酒的酒精度差异不显著(P>0.05),但显著高于与其他组(P<0.05),其中,对照组甜米酒酒精度最低为1.8%vol。这可能与复配方案中酵母添加量有关,糖类物质在酿酒酵母的作用下更多的转化为乙醇,使得米酒酒精度升高,而对照组作为纯种根霉甜酒曲,只有少量糖类物质被转化为乙醇,因此,其酒精度最低。
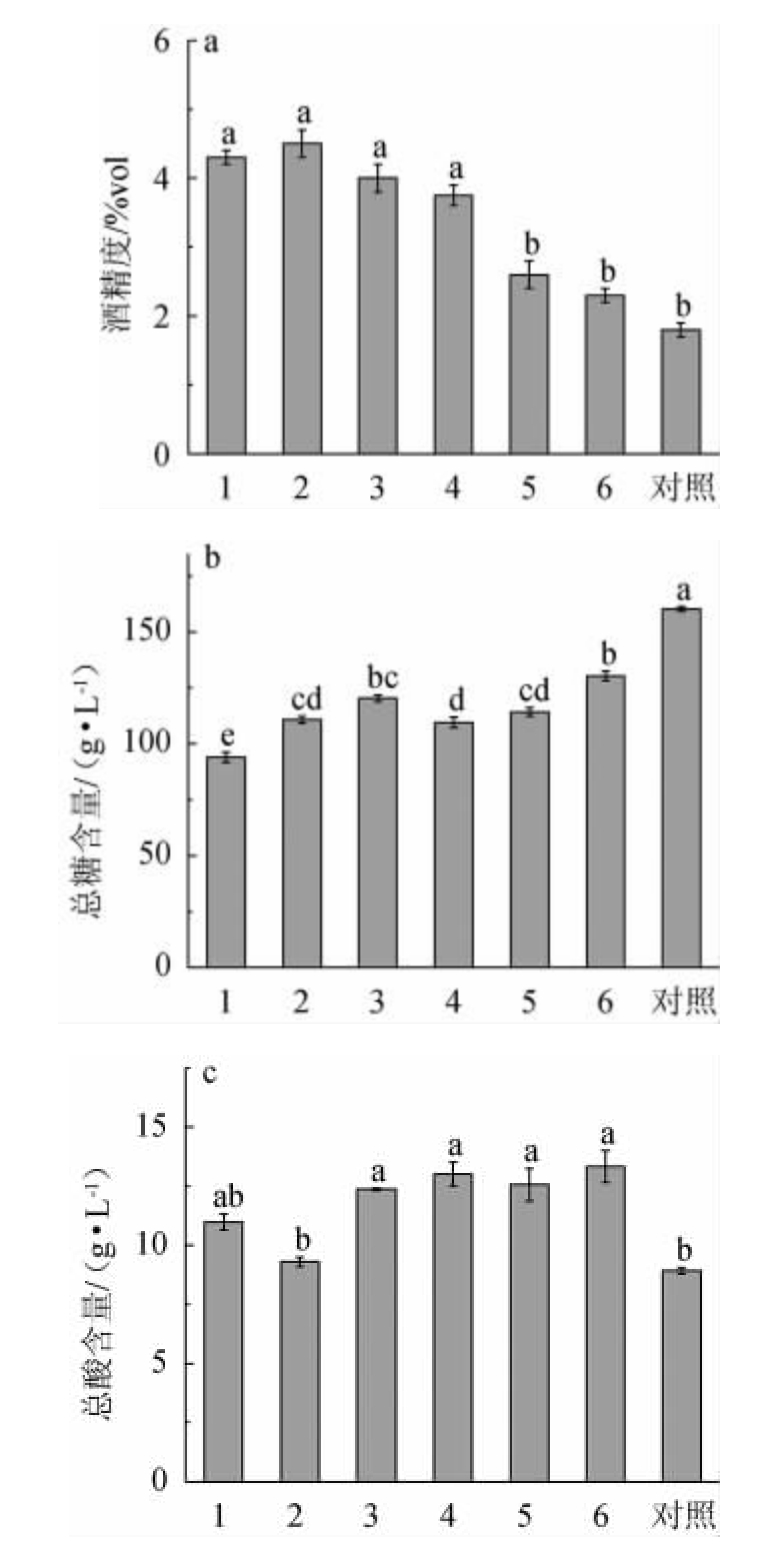
图3 甜米酒理化指标的测定结果
Fig.3 Determination results of physicochemical indicators of sweet rice wine
不同小写字母表示差异显著(P<0.05)。
由图3b可知,对照组甜米酒的总糖含量(160.3 g/L)显著高于复配组(P<0.05),分析原因可能是对照组甜米酒发酵过程中,只有少量糖类物质被转化为乙醇,而复配组甜米酒由于酿酒酵母或细菌作用的原因,部分糖类会被转化为醇类或酯类等其他化合物[25]。复配组中,6#复合酒曲发酵制备的甜米酒总糖含量最高为130.4 g/L。
由图3c可知,1#、3#、4#、5#和6#复合酒曲发酵制备的甜米酒的总酸含量差异性不显著(P>0.05),但显著高于对照组(P<0.05),分别为10.98 g/L、12.37 g/L、13.01 g/L、12.56 g/L和13.33 g/L。其中,5#和6#复合酒曲发酵制备的甜米酒的总酸含量有些许差异可能与乳酸菌添加量上的差别有关[26]。
以上结果表明,在6组复配方案中,6#复合酒曲发酵制备的甜米酒酒精度为2.3%vol,总糖和总酸含量分别为130.4g/L、13.33 g/L,高于其他复配方案,结合感官评价中的滋味与整体协调度来看,6#复合酒曲发酵制备的甜米酒具有较好的酸甜融合感,在丰富了米酒中营养物质含量的同时提升了米酒的风味。
2.3.3 挥发性风味成分分析
采用HS-SPME-GC-MS对甜米酒中挥发性风味成分进行检测,考察不同甜米酒的香气特征,结果见表4。由表4可知,从7种甜米酒中共检出28种挥发性风味物质,包括醇类物质8种,酯类物质10种,酸类物质8种以及乙偶姻和糠醛。
表4 甜米酒主要挥发性风味化合物GC-MS分析结果
Table 4 Results of major volatile flavor compounds in sweet rice wine analyed by GC-MS
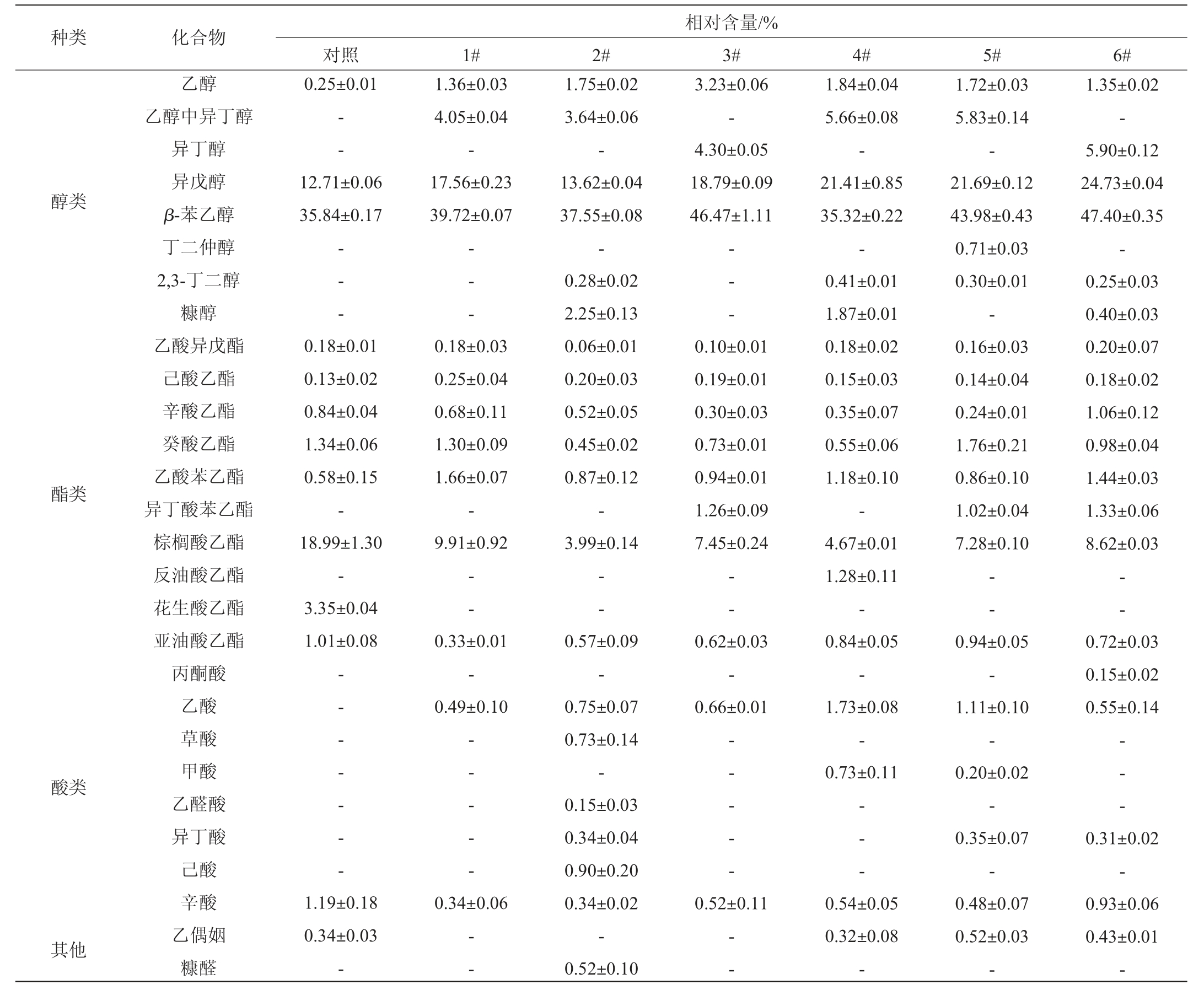
注:“-”表示未检出。
酯类物质是具有芳香气味的一类化合物,也是酒中重要的呈香物质,在酒中呈现出果香和花香[27]。由表4可知,甜米酒中的酯类物质主要为乙酸异戊酯、己酸乙酯和辛酸乙酯等。乙酸异戊酯属高级醇乙酸酯类,高级醇乙酸酯是通过酒精发酵过程中酵母的醇类乙酰转移酶(alcohol acetyltransferases,ATF)催化乙酰辅酶A与糖或氨基酸降解代谢产生的高级醇反应形成的[28]。其中,6#甜米酒中乙酸异戊酯的相对含量最高,为0.20%,1#、4#、对照组甜米酒中乙酸异戊酯的相对含量次之,均为0.18%。6#甜米酒还具有较高含量的异丁酸苯乙酯(1.33%),异丁酸苯乙酯具有玫瑰花香,可以有效地提升6#甜米酒的香味。其他酯类如己酸乙酯具有甜香、水果香[29],辛酸乙酯具有白兰地酒香味[30],这些酯类对酒体复合香有较好的促进作用。
醇类物质也是米酒中主要的风味物质之一,赋予米酒醇香的口感[31]。醇类物质是7种甜米酒中含量最高的化合物,其相对含量达50%以上,主要为β-苯乙醇、异戊醇和异丁醇等。β-苯乙醇有玫瑰香、紫罗兰香、茉莉花香等多种香味,持久性强,微带一些苦味[32],是米酒的质量指标之一,其在酒中的含量直接影响酒的品质[15]。1#、2#、3#、5#、6#甜米酒中的β-苯乙醇含量均高于对照组(35.84%),且6#甜米酒中的β-苯乙醇相对含量最高,达到了47.4%,较好的提升了6#甜米酒的品质。适量的异戊醇和异丁醇等高级醇可以使酒体丰满、口感醇厚[33],这些醇类可以增加酒体的协调性,亦对甜米酒的复合香气有积极的贡献,其原因主要是通过氨基酸降解途径(Ehrilich途径)和糖合成代谢途径(Harris机制)生成[34]。
酸类物质是影响米酒风味的一项重要指标,在米酒中具有缓冲作用,可协调其他风味物质[35]。7种甜米酒中检测到的主要挥发性酸为乙酸和辛酸,低含量的乙酸和辛酸能赋予米酒水果香和花香[36]。6#甜米酒中特有的挥发性酸为丙酮酸(0.15%),丙酮酸呈醋酸香气和愉快酸味,在人体内可通过乙酰辅酶A和三羧酸循环实现体内糖、脂肪和氨基酸间的相互转化,因此,丙酮酸在三大营养物质的代谢联系中起着重要的枢纽作用[37]。
同时,在对照组、4#、5#和6#甜米酒中均检测到了乙偶姻,且6#甜米酒中的乙偶姻相对含量较高,为0.43%。乙偶姻是四甲基吡嗪(tetramethylpyrazine,TTMP)的前体物质,会进一步与游离态氨基反应生成TTMP,TTMP也是酒中重要风味物质的组成成分,具有一定的保健作用,对心脑血管疾病、血小板聚集和保护肝脏有一定的疗效[38]。
进一步对7种甜米酒中的醇类、酯类和酸类物质的相对含量进行对比,结果见图4。由图4可知,复合酒曲制作的甜米酒中醇类、酯类和酸类物质含量较高,尤其是醇类物质,醇类物质相对含量最高,其次为酯类物质,而酸类物质相对含量较低。这可能与多种因素有关,如酒曲中添加的微生物种类与数量。复合酒曲中含有的酵母和细菌可能在米酒发酵过程中能产生较多的醇类、酯类和酸类等风味化合物,使得酿造出的米酒风味更为突出。
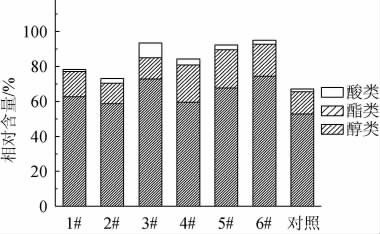
图4 甜米酒中主要挥发性风味物质的相对含量
Fig.4 Relative contents of major volatile flavor substances in sweet rice wine
为了研究和表征7种甜米酒在挥发性风味组分上的异同,根据风味化合物的种类和相对含量,对7种甜米酒进行热图分析,结果见图5。由图5可知,复配组与对照组甜米酒在风味化合物的种类和相对含量上有明显的区别。经过聚类分析可知,甜米酒酒样被归为3类,1#、3#、6#甜米酒和对照组甜米酒为类1,4#和5#甜米酒为类2,2#甜米酒单独为1类。除对照组外,类1中3种甜米酒的复合酒曲中细菌或酵母的添加量低于另外3种甜米酒,分析菌种添加量可能是导致1#、3#和6#甜米酒产生相关性的原因。
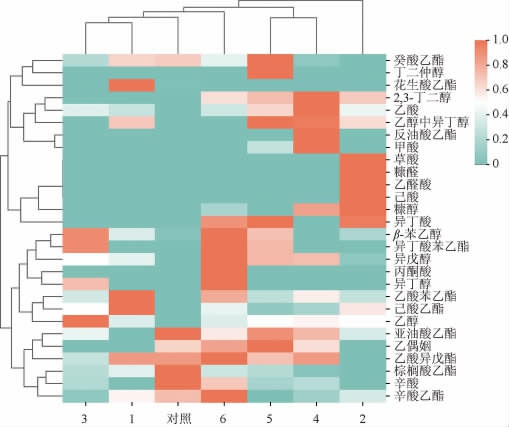
图5 基于挥发性风味物质甜米酒的热图分析
Fig.5 Heat map analysis of sweet rice wine based on volatile flavor compounds
2.3.4 有机酸分析
有机酸是形成甜米酒风味的主要成分,同时也是生成酯类物质的前体物质,适量的有机酸对改善酒体的风味有一定贡献作用[39]。甜米酒中的有机酸除来源于酒的酿造原料外,也会由酿造过程中微生物代谢形成[40]。通过HPLC对甜米酒中7种有机酸含量进行检测分析,结果见表5。由表5可知,7种甜米酒中的有机酸均以乳酸为主,其次为乙酸、琥珀酸和柠檬酸。乙酸属于挥发性酸,会提升酒体的醇厚感,乳酸和琥珀酸属于非挥发性酸,是提升酒体回味感的主要物质[41-42]。同时,它们还赋予米酒独特的风味,如乳酸赋予酒微酸、微甜的风味,在酒体中略有浓厚感,能稳定酒体香气,同时还能减轻酒的苦涩味,使酒质浓厚、回甜;乙酸则是温和、爽快酸味、有新鲜感,后苦短;琥珀酸能赋予酒酸、咸、苦的复合味[43-44]。
表5 甜米酒中有机酸含量的测定结果
Table 5 Determination results of organic acid content in sweet rice wine
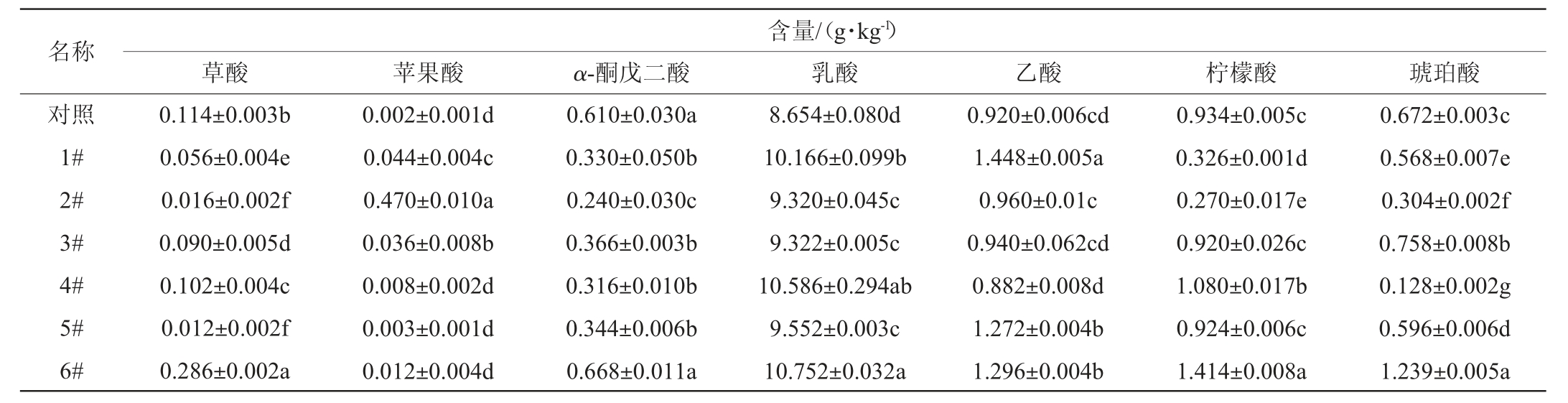
注:同列不同小写字母表示差异显著(P<0.05)。下同。
1#、4#、6#甜米酒中的乳酸含量均>10 g/kg,其中6#甜米酒乳酸含量最高,为10.752 g/kg,对照组甜米酒乳酸含量最少,为8.654 g/kg。同时1#、4#、6#甜米酒中的乙酸含量均>1 g/kg,其中1#甜米酒乙酸含量最高,为1.44 g/kg。这可能与3种甜米酒复合酒曲中乳酸菌的分解代谢有关。而2#甜米酒中乳酸含量较低,为9.32 g/kg,苹果酸含量较高,为0.47 g/kg,可能与添加的两种细菌的协同作用有关。乳酸、乙酸、琥珀酸与柠檬酸是甜米酒中有机酸的重要组成部分,此外也检测到少量的草酸、苹果酸和α-酮戊二酸。这些有机酸都是米酒中重要的营养物质,它们之间的协同作用也赋予了米酒独特的风味。综上,6#复合酒曲在用于甜米酒发酵时产有机酸能力优于其他复合酒曲。
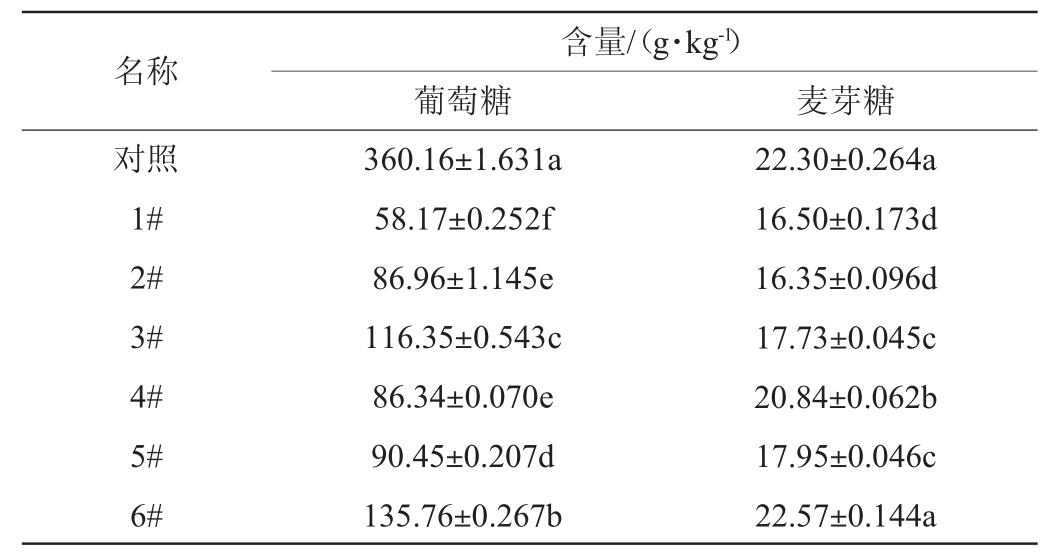
2.3.5 葡萄糖与麦芽糖含量分析
米酒中常见的糖类有葡萄糖、麦芽糖,这些糖类会赋予甜米酒柔和、厚实的口感特征[45]。7种甜米酒中的葡萄糖和麦芽糖含量见表6。由表6可知,复配组甜米酒中的葡萄糖含量均低于对照组,分析原因可能是复配组甜米酒中的酿酒酵母或细菌在发酵后期消耗和利用了葡萄糖,酵母在厌氧条件下会利用葡萄糖产生CO2和乙醇[46]。6#甜米酒的葡萄糖含量最高,为135.76 g/kg。除6#甜米酒,其他复配组甜米酒中的麦芽糖含量均显著低于对照组(P<0.05),6#甜米酒的麦芽糖含量最高,为22.57 g/kg。可知6#复合酒曲在甜米酒发酵时产还原糖能力较强。
表6 甜米酒中葡萄糖及麦芽糖含量的测定结果
Table 6 Determination results of glucose and maltose content in sweet rice wine
3 结论
通过测定4个地方特色酒曲的糖化力和液化力可知,酒曲Ⅱ的糖化力和液化力最高,分别为246.93 mg/(g·h)、0.27 g/(g·h)。采用传统培养分离方法从酒曲Ⅱ中分离得到一株根霉菌,编号为Rhi-1,通过分子生物学技术鉴定其为少根根霉(Rhizopus arrhizus)。采用少根根霉Rhi-1与酿酒酵母和细菌复配制备风味型甜酒曲,结果发现,6#风味型甜酒曲(少根根霉Rhi-1添加量0.8%,酿酒酵母Sx添加量0.03%,食窦魏斯氏菌W-R-1添加量0.06%)发酵制备的甜米酒感官评分最高,为87分,酒精度为2.3%vol,其总糖、总酸、有机酸、还原糖含量均高于其他5种复配曲制备的甜米酒,分别为130.4 g/L、13.33 g/L、15.66 g/kg、158.33 g/kg,醇类与酯类物质相对含量(92.66%)最为丰富。综上,6#复配曲最佳,其能有效地提升甜米酒的风味。
[1]吴琼燕.中草药对甜酒曲微生物发酵性能及酒酿香气成分研究[D].广州:华南农业大学,2016.
[2]姚淑敏,闫华文,陈璐.不同甜酒曲中可培养真菌的多样性分析[J].中国酿造,2015,34(12):48-54.
[3]向凡舒,邓风,魏冰倩,等.不同来源酒曲酿制米酒中乳酸菌的分离与鉴定[J].中国酿造,2019,38(5):67-72.
[4]周金虎,毛志海,等.甜酒曲中一株高产淀粉酶根霉的筛选与鉴定[J].酿酒科技,2019(1):37-40.
[5]孙宝国.中国酒在世界上是独一无二的[J].中国酒,2021(4):52-53.
[6]张瑞雪,符鑫雨,杨生玉,等.新型米酒的营养及其发展趋势研究[J].轻工科技,2022,38(1):28-31.
[7]CAI H Y,ZHANG T,ZHANG Q,et al.Microbial diversity and chemical analysis of the starters used in traditional Chinese sweet rice wine[J].Food Microbiol,2018,73:319-326.
[8]BORA S S,KEOT J,DAS S,et al.Metagenomics analysis of microbial communities associated with a traditional rice wine starter culture (Xapitha)of Assam,India[J].Biotech,2016,6(2):1-13.
[9]王玉荣,张俊英,胡欣洁,等.湖北孝感和四川成都地区来源的酒曲对米酒滋味品质影响的评价[J].食品科学,2015,36(16):207-210.
[10]郑自强,卫春会,张立伟,等.中高温大曲中霉菌的分离及其麸曲制备[J].现代食品科技,2022,38(1):165-172.
[11]全昌彬,姚玉仙.贵州黔南地区泡制酸菜中酵母菌的分离与鉴定[J].食品安全质量检测学报,2022,13(13):4273-4281.
[12]刘小改,李洪媛,周林艳,等.清香型大曲中产香细菌的分离筛选及鉴定[J].中国酿造,2022,41(5):96-100.
[13]吕思行,明飞平,夏枫耿,等.一株根霉菌的特性初探[J].天津科技,2016,43(12):28-29,32.
[14]张新武,黄继红,杨公明,等.客家糯米酒药曲开发的工艺技术研究[J].中国酿造,2011,30(10):45-46.
[15]母应春,姜丽,苏伟.两种酒曲制备米酒品质对比研究[J].中国酿造,2019,38(3):114-119.
[16]黄慧芬.米香型白酒酿造产香酵母的筛选鉴定及其产酯规律研究[D].长沙:中南林业科技大学,2018.
[17]马群,张梦阳,李宜波,等.大曲液化酶活力测定方法的对比研究[J].酿酒科技,2019(10):68-72.
[18]国家市场监督管理总局,中国国家标准化管理委员会.GB/T 13662—2018黄酒[S].北京:中国标准出版社,2018.
[19]邸利娜,杨增,高波.奶酒中乙醇浓度和总酯的联合测定[J].中国卫生检验杂志,2014,24(3):328-329.
[20]朱思洁,苏伟,刘莉.红稗黑糯米混合发酵酒的工艺研究[J].食品研究与开发,2018,39(13):105-109.
[21]袁琦,王家胜,毛豪,等.稻花香馫香型白酒风味特征分析[J].中国酿造,2022,41(2):53-59.
[22]杨成聪,沈馨,马雪伟,等.高效液相色谱法测定米酒中有机酸的含量[J].食品研究与开发,2018,39(10):116-123.
[23]贾茹,黄学者,贾光群,等.超高效液相色谱-蒸发光散射检测法测定蜂蜜中12种糖组分[J].分析测试学报,2022,41(6):851-857.
[24]王有芳,童应凯,任健,等.互助青稞酒酒曲酶系的活力测定[J].食品研究与开发,2013,34(19):17-19.
[25]康宪,李良红,林捷.传统桂林甜酒曲中酵母分离鉴定及发酵性能研究[J].食品工业,2017,38(1):126-129.
[26]袁先铃,周莺茹,郑连强,等.酸菜中乳酸菌生长曲线、产酸性能及抑菌性能探究[J].食品研究与开发,2022,43(14):199-203.
[27]FRANITZA L,GRANVOGL M,SCHIEBERLE P.Influence of the production process on the key aroma compounds of rum:From molasses to the spirit[J].J Agr Food Chem,2016,64(47):9041-9053.
[28]SAERENS S M G,DELVAUX F R,VERSTREPEN K J,et al.Production and biological function of volatile esters in Saccharomyces cerevisiae[J].Microb Biotechnol,2010,3(2):165-177.
[29]张洋洋,张伟国,徐建中,等.米酒液态发酵过程中理化指标和风味物质变化规律[J].东北农业大学学报,2020,51(12):79-89.
[30]秦立芹,殷欢,成柳洁,等.一株高产己酸乙酯酵母菌株的筛选、鉴定及发酵条件优化[J].食品与发酵工业,2022,48(1):55-61.
[31]袁国亿,何宇淋,王春晓,等.米酒风味品质形成相关因素的研究进展[J].食品与发酵工业,2022,48(9):286-294.
[32]吴轩德,周世水.二步法酿造β-苯乙醇调味酒的工艺优化[J].中国酿造,2017,36(9):45-49.
[33]任津莹,马艳蕊,刘港,等.一种新型产乙酸乙酯酿酒酵母菌株的构建[J].中国酿造,2020,39(8):162-169.
[34]黄桂东,吴子蓥,唐素婷,等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造,2018,37(1):7-11.
[35]李冬琴,杨萌,文笑雨,等.黄酒的挥发性风味成分研究进展[J].食品研究与开发,2022,43(2):202-207.
[36]史学琴,张琳,陈航,等.酿酒酵母与异常威克汉姆酵母混菌发酵铁皮石斛米酒品质分析[J].食品与发酵科技,2022,58(2):38-46.
[37]王翔,魏源.丙酮酸补充与运动能力[J].北京体育大学学报,2002(2):207-210.
[38]张颖,李霄霄,李景辉,等.高产四甲基吡嗪芽孢杆菌的筛选及其对酱香型白酒堆积过程的影响[J].食品工业科技,2022,43(2):142-149.
[39]乔世玉,王洪琳,杨宏,等.贵州不同地区发酵糯米酒风味对比分析[J].酿酒科技,2021(10):17-23,35.
[40]贺江,李博恩,段亚丽,等.三叶木通果酒抗氧化活性及有机酸组成研究[J].食品工业,2019,40(2):181-184.
[41]MAJIDANO S A,KHUHAWAR M Y,ZOUNR R A,et al.Determination of amino acids in jams,fruits and pharmaceutical preparations by gas chromatography using trifluoroacetylacetone and ethylchloroformate as derivatizing reagents[J].Anal Methods,2015,7(7):3148-3156.
[42]林晓婕,魏巍,何志刚,等.离子排斥色谱法测定黄酒中的13种有机酸[J].色谱,2014(3):304-308.
[43]陈红兰,吴宗文,谢广发.贮存酸败黄酒有机酸分析[J].酿酒科技,2017(2):78-81.
[44]MO X,FAN W,XU Y.Changes in volatile compounds of Chinese rice wine wheat Qu during fermentation and storage[J].J I Brewing,2009,115(4):300-307.
[45]张高楠,苏钰亭,赵思明,等.4种甜米酒主要营养成分与滋味特征对比及分析[J].华中农业大学学报,2018,37(2):89-95.
[46]袁国亿,何宇淋,王春晓,等.米酒风味品质形成相关因素的研究进展[J].食品与发酵工业,2022,48(9):286-294.