高级醇又称高级脂肪醇,指含有三个碳原子以上一元醇的混合物,是酒中重要的呈香物质,主要由酿酒酵母在酿造的主发酵时间段生成,它能够增加发酵酒的协调感和饱满感,赋予白酒特殊的香气[1],并起衬托酯香的作用,给人愉悦的感觉,若浓度过高,则有令人不快的杂异味,并且由于人体代谢高级醇的速度相对较慢,在人体中的停留时间较长,使饮用者易醉并且饮用后容易“上头”,危害人体的健康;若浓度较低,则会使酒体不丰满,口感较差。国家标准GB 2757—2012《蒸馏酒及其配制酒》中对于高级醇含量指标没有明确的规定。通过监测高级醇含量的变化可以反映出发酵过程的情况,从而及时调控生产工艺保证原酒质量。酒醅中高级醇含量的检测方法已经由化学分析方法转变为仪器分析方法,逐渐由离线检测向在线检测转变。
酒类发酵是一个复杂连续的过程,是多菌种参与的发酵体系,菌种的代谢影响着高级醇的生成。结合高级醇含量检测方法,根据高级醇合成途径研究发酵酒中高级醇的减控策略。冯鹏鹏等[2]总结了啤酒酵母中高级醇的生成途径、关键基因、代谢调控机理及选育低产高级醇优良菌株方法,为降低啤酒中高级醇含量提供理论基础。高级醇的生成受菌种的影响但不仅限于菌种,还受环境等各种因素影响。黄志久等[3]探究了蛋白酶添加量、糖化酶添加量、曲药添加量和发酵时间对小曲清香型白酒中高级醇、总酸、总酯含量的影响。结果表明,糖化酶添加量、曲药添加量和发酵时间会高级醇影响高级醇的生成,具有一定的调控作用。本文介绍了发酵酒中高级醇的合成途径,总结了高级醇含量的主要检测方法,阐述了微生物、前体物质合成、发酵工艺条件等因素对高级醇生成的影响,并通过这三方面的解析实现对高级醇的调控,并对高级醇的未来研究方向进行展望,为控制白酒中高级醇含量,提高白酒品质提供了参考。
1 发酵酒中高级醇的合成途径
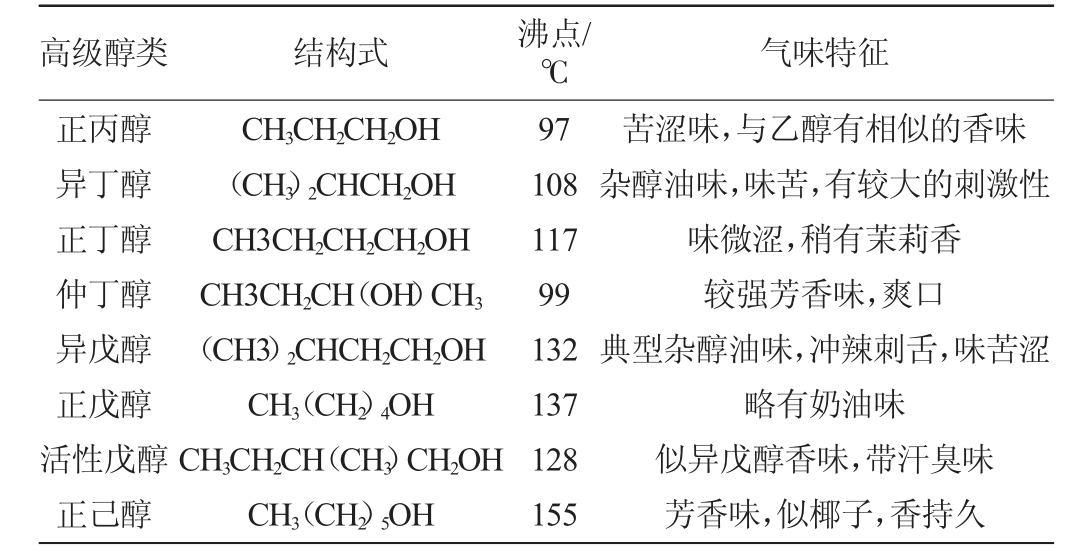
高级醇是构成酒类风味的特殊微量物质,酒类中的高级醇包括异戊醇、正丙醇、异丁醇、异戊醇、正戊醇、活性戊醇、正己醇等。其化学结构式、沸点、气味特征见表1。
表1 高级醇化学结构、沸点及气味特征
Table 1 Structure,boiling point and odor characteristics of higher alcohols
高级醇因其特性又被称为杂醇油(碳原子数>2的脂肪醇混合物),杂醇油主要是由酵母菌利用糖及氨基酸的代谢而形成的[4],代谢途径主要如图1所示,又可分为氨基酸降解合成途径(Ehrlich代谢机制)以及糖代谢合成途径(Harri代谢机制)。
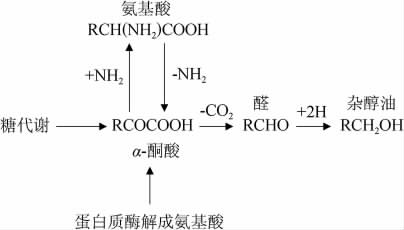
图1 高级醇生成的糖代谢合成途径
Fig.1 Glycometabolic pathways of higher alcohols formation
氨基酸降解合成途径是由氨基酸脱氨生成α-酮酸,α-酮酸脱羧(CO2)生成醛,最终还原为高级醇。这种反应在酵母细胞内进行,氨基酸降解合成高级醇反应式如下:
RCH(NH2)COOH+H2O→RCH2OH+NH3+CO2
糖代谢合成途径是由糖代谢生成丙酮酸,丙酮酸会与氨基酸发生作用,生成α-酮酸以及另一种氨基酸,α-酮酸经脱羧后生成醛,醛最终被还原为高级醇。
2 高级醇的主要检测方法
高级醇作为一种风味物质在发酵酒中的含量占比很少,这导致对其的检测精度要求更高,传统的化学分析方法已不能满足现代精度要求并且不适用于工业生产实践,渐渐淡出人们的视线,现今对于高级醇的检测方法已由传统化学分析方法(分光光度法等)向仪器分析方法(气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)、气相色谱法、近红外光谱分析(near infrared spectrometry,NIR)等)转变。
2.1 分光光度法
分光光度法是测定物质在一定波长范围内或特定波长内的吸光度值,通过吸光度值对其进行定性或定量分析的方法。分光光度法是生物化学实验中最常用的实验方法,它的灵敏度较高,通过人工操作较为简便,并且可以较快的得到检测结果。袁国亿等[5]建立了酶标仪比色法检测浊米酒中6种高级醇(异丁醇、异戊醇、苯乙醇、正丙醇、正丁醇、己醇)的单一混合标准曲线,并将酶标仪比色法的检测效果与气相色谱法的检测效果进行对比。结果表明,两种检测方法对6种高级醇含量测定结果的相对标准偏差(relative standard deviation,RSD)分别为0.06%~3.94%和0.72%~1.58%,酶标仪比色法测定结果高于气相色谱法。杜威等[6]采用分光光度法对黄酒中的高级醇进行了检测,检测波长为520 nm,以标准曲线法定量,测得相对标准偏差(RSD)为2.457%,操作简单,且能给企业减少开支,在条件有限的情况下,同样可以测定产品中的高级醇。王雅楠等[7]在国标GB/T 5009.48—2003《蒸馏酒与配制酒卫生标准的分析方法》的基础上,将葡萄酒酒样再梯度稀释20倍,加样静置1 min,80 ℃水浴30 min且以体积分数为50%硫酸溶液作为稀释剂的条件下进行检测,精密度试验结果相对标准偏差(RSD)为1.665%,加标回收率为99.11%,均优于国标法。分光光度法虽然设备简单、操作简便,但存在无法同时测定产品中高级醇各组分的含量的缺点,并且将其应用于工业生产上十分耗时耗力,难以实现快速及时的检测条件。当前分光光度法只存在于实验室的实验研究,其检测条件的局限性无法将其应用于工业生产中。
2.2 气相色谱法
当前气相色谱法是用于检测高级醇最常用的方法,其分离效果好、效率高、检测精密度高。林玲等[8]采用毛细管气相色谱法对黄酒中的高级醇含量进行测定,结果表明此方法的相对标准偏差(RSD)为1.496%~3.331%,加标回收率为72.20%~115.02%。唐开永等[9]为实现对米酒酿造过程中乙醇、正丙醇、异丁醇、异戊醇、己醇、β-苯乙醇的实时检测,采用气相色谱(GC)外标法同时测定米酒中6种醇类含量。结果表明,乙醇在0.15%vol~19.2%vol、高级醇在0.75~208 mg/L范围内呈线性相关(相关系数R2>0.999),定量限与检测限均<0.05 mg/L,重复性试验和精确度试验结果的相对标准偏差(RSD)均<5%;在添加高、中、低3个水平标准浓度下的平均回收率为90.89%~96.53%,RSD为0.11%~3.02%。张雪雪等[10]采用气相色谱仪,选用DB-WAX(UI)色谱柱,以程序升温的方式,用乙酸正戊酯作为内标物对白酒中的甲醇、乙醛、正丙醇、正丁醇、异丁醇、异戊醇进行了分析,对白酒中各组分的含量进行定量。
2.3 气相色谱-质谱联用法
为提高气相色谱法的准确度与精密度,研究人员一般采用气相色谱-质谱联用法(GC-MS)并结合各种样品预处理方法来对高级醇进行分析,排除杂质等的干扰。范三红等[11]采用涡旋辅助分散液液微萃取(dispersive liquid-liquid microextraction,DLLME)-气相色谱(GC)法测定清香型白酒中5种高级醇的含量。结果表明,此方法的检出限为0.01~0.03 mg/L,定量限为0.05~0.10 mg/L。其结果相对标准偏差(RSD)<7.0%,回收率为83.1%~108.3%。郭亚芸等[12]通过建立静态顶空气相色谱-质谱法(static headspace-gas chromatography-mass spectrometry,SH-GC-MS)分析测定葡萄蒸馏酒中高级醇。结果表明,在最优条件下,5种高级醇的检出限为0.25~1.27 mg/L,加标回收率为80.0%~87.0%,相对标准偏差(RSD)(n=3)<10%。本方法具有简单、快速和准确度高等优点,适用于葡萄蒸馏酒中高级醇的测定。
在对高级醇进行定性定量分析的检测方法中气相色谱法是一种十分成熟的方法,其分离效果好、精密度高,但气相色谱法的设备庞大,且需要复杂的样品预处理,无法及时得出检测结果来控制生产工艺。
2.4 近红外光谱分析技术
近红外光谱分析(NIR)技术是近现代以来检测器件的迅速发展而重新发展起来的检测技术,其检测速度快、精密度高、多项指标可同时检测,可实现在线无损监测等特点。通过近红外光扫描采集样品的近红外光谱建立近红外光谱模型可对高级醇进行定量定性分析。吴同等[13]通过结合近红外光谱与区间偏最小二乘法(partial least-square method,PLS),筛选出定量白酒中总酯和杂醇油含量的最优波长区间,在将变量空间压缩87%的基础上,获得了预测能力优于全谱偏最小二乘法的校正模型,在独立的测试集上进行了系统验证,其结果表明此模型大大降低计算的时间和空间复杂度,并且显示出强的推广能力。刘建学等[14]将气相色谱法作为建立近红外预测模型的对照化学计量方法,采用偏最小二乘法和内部交互验证法处理得到的近红外光谱数据,并建立基酒中正丙醇、正丁醇、正戊醇和异戊醇的快速检测模型。叶萌祺[15]采用傅里叶变换近红外光谱分析技术对苹果酒中高级醇类的风味物质建立了近红外偏最小二乘(PLS)定量分析模型,所有校正模型的决定系数R2均在0.83以上,相对分析误差(relative percent deviation,RPD)在2.43~3.02之间,预测集决定系数R2均在0.88以上,相对分析误差(RPD)在2.90~3.50之间。说明将近红外光谱分析技术应用于发酵过程高级醇的在线检测是可行的,具有良好的预测能力。
现今采用近红外光谱技术对酒中高级醇的研究较少,因为高级醇在整个酒类的生产过程中含量占比很小,并且由于在整个生产过程有各种因素会影响建立的近红外模型,想要建立一个精确适用的近红外模型需要大量的数据来完善模型,这需要消耗大量的人力物力。在实际应用中对其进行检测的方法还是以气相色谱法为主,但采用近红外光谱技术能迅速预测酒中高级醇的含量,并能实现在线无损检测,通过针对高级醇生成途径及时调整生产工艺来达到提高原酒质量目的。
3 影响高级醇生成的因素研究
传统酒类发酵过程高级醇的合成受各种因素影响,包含环境、物质、微生物种类数量等方面的作用。任宇婷等[16]从环境和物质两方面探讨清香型白酒发酵过程中高级醇合成规律。根据其实验结果推断出高级醇的合成前期主要通过糖代谢合成代谢途径,随着发酵的进行,游离氨基酸大量产生,高级醇的合成逐渐向氨基酸降解途径。梁清文等[17]通过考察酵母种类与初始菌浓度、发酵起始温度、大曲酶活力等因素对浓香型白酒发酵过程异戊醇合成的影响,为研究减控策略提供参考。控制各类因素的变化来推断高级醇的生成与何种条件有关是当前白酒发酵过程高级醇研究的重点。
3.1 微生物
高级醇是酵母代谢后的产物[18],微生物对高级醇的生成起着至关重要的作用,针对微生物对高级醇的影响,从基因工程育种、选育天然优良酵母、调整酵母接种量这三方面完成对高级醇的调控。范培文等[19]采用冗余分析(redundancy analysis,RDA)得到浓香兼香型白酒酒醅的水分、氨基酸态氮、总酸、乳杆菌属(样品N41328中相对丰度93.95%)、曲霉属(样品N41328中相对丰度21.63%)、伊萨酵母属(样品N41328中相对丰度11.11%)、嗜热子囊菌属(Thermoascus)(样品N30930中相对丰度17.36%)、毕赤酵母属(Pichia)(样品N40217中相对丰度14.50%)与正丙醇含量呈负相关,还原糖、毛孢子菌属(Trichosporon)(样品N41328中相对丰度52.55%)、枝芽孢杆菌属(Virgibacillus)(样品N41328中相对丰度1.60%)、克罗彭斯特菌属(Kroppenstedtia)(样品N41328中相对丰度2.53%)与正丙醇的产量呈正相关。王春艳等[20]采用气相色谱-质谱联用(GC-MS)法检测到红谷黄酒中的15种高级醇,以异戊醇、异丁醇为主,分别占高级醇总含量的70.88%~74.36%和15.81%~18.76%。优势细菌门(平均相对丰度≥1%)为变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),发酵前6 d,变形菌门的相对丰度为64.95%~94.98%;发酵第9天至结束,厚壁菌门增长迅速,其相对丰度均>80%。其中对高级醇产生主要贡献的细菌群为大洋芽孢杆菌属(Oceanobacillus)、克鲁沃菌属(Kluyvera)和魏斯氏菌属(Weissella)。李园子等[21]总结了高级醇代谢调控的关键基因以及白酒酿造中适产高级醇酿酒酵母菌株选育研究进展,通过利用基因工程育种的方法对酿酒酵母合成高级醇的关键基因进行定向改造,以期为白酒中高级醇的精细化调控及适产高级醇酿酒酵母菌株的选育提供参考。在酿酒酵母中,过表达ALD6基因可以显著降低高级醇的生成量,但是过多乙酸的生成对细胞的生长和代谢产生抑制。唐新玥等[22]通过筛选合适的糖诱导型启动子调控基因ALD6的表达,在降低高级醇生成量的同时减弱其对细胞生长的抑制作用。作者通过选取6个HXT系列的糖诱导型启动子Phxt1、Phxt2、Phxt3、Phxt4、Phxt5和Phxt7调控乙醛脱氢酶基因ALD6的表达,通过研究结果表明,对比原始菌种,各诱导型重组菌株总高级醇生成量分别有不同程度的下降。对比组成型重组菌株a-Ppgk1-A和诱导型重组菌株a-Phxt3-A发现,二者相较于原始菌种均可显著降低总高级醇的生成,但a-Phxt3-A的生长及发酵性能与原始菌种基本一致,在降低高级醇生成量的同时减弱了过表达基因ALD6产生乙酸对发酵的不利影响。崔丹瑶等[23]利用3种不同的启动子TEF1p、VPS8p、ATF1p,构建过表达醇乙酰基转移酶基因ATF1、同时敲除支链氨基酸转氨酶基因BAT2的重组菌株S5-T、S5-V、S5-A。菌株S5-T、S5-V、S5-A的总高级醇生成量呈下降趋势,分别降低了8.77%、6.92%、8.13%;同时乙酸乙酯的生成量有所提高。林良才等[24]在高温、高酸双胁迫条件下选育的酱香型白酒酒醅中筛选获得11株具有高耐性的库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)可以提高原料利用率20%,提升乙醇产量13%,同时降低正丙醇含量53%,且其他风味物质无显著差异,解决了由于糟醅酸度提高造成的减产降质的实际生产问题。JANSSEN P H等[25]研究表明,一株厌氧羧菌(Clostridium sp.)能够发酵苏氨酸产生丙酸和正丙醇,证明正丙醇是苏氨酸发酵的末端产物。减少酵母增殖也是减少高级醇合成的方式之一,MATEO J J等[26]的研究结果表明,葡萄酒发酵中随着酵母接种量的提高,杂醇油的含量也会增多。KATARINA F等[27]采用全二维气相色谱法(comprehensive two-dimensional gas chromatography,GC×GC)检测本土酵母菌株对葡萄酒中高级醇,挥发性脂肪酸和酯的影响。统计分析后得到,每个菌株都可以根据其挥发性成分进行表征和区分,它不仅以定性的方式而且以定量的方式影响所分析的挥发性化合物(酒的风味)。
虽然基因工程菌的表现很好,在降低高级醇含量的同时还能消除其他影响发酵的不利情况,但其发酵具有不稳定性,并具有一定的安全隐患,目前并不能将其广泛的应用于食品发酵,仅限于实验室研究;通过选育天然优良酵母以及减少酵母接种量都能实现低产高级醇的目的,但这两类方法可能会导致酒中的其他风味物质的含量受到影响。通过微生物手段达到低产高级醇并不影响其他物质的含量是当前的主要研究目标。
3.2 前体物质含量
调整高级醇合成前体物质含量可以控制高级醇的合成。增加氮源或碳氮源供给能达到高级醇的减控作用,LIU S P等[28]对黄酒酿造酵母(Saccharomyces cerevisiae)HJ中可同化氮来源的种类和数量以及调控高级醇合成的基因进行了评估,通过实时荧光定量聚合酶链式反应(realtime fluorescence quantitative-polymerase chain reaction,RTFQ-PCR)得到酿酒酵母HJ基因在不同生长阶段和不同可同化氮水平上均有不同程度的表达,表明可同化氮对黄酒总高级醇浓度有显著影响。谢克英等[29]研究发现,向桑葚原浆添加150 mgN/L硫酸铵可以显著降低丙醇、异丁醇、异戊醇和苯乙醇含量。卢丽娟等[30]向猕猴桃汁中添加100~400 mg/L的可同化氮源磷酸氢二铵(diammonium phosphate,DAP),并对发酵所得猕猴桃酒的基本理化指标、潜在有害醇类物质、营养组分和香气物质进行检测与分析。结果表明,添加100~400 mg/L DAP均可以加快起酵后48 h内的乙醇发酵速度,并显著降低猕猴桃酒中高级醇和甲醇等潜在有害醇类物质产量(P<0.05)。添加300 mg/L DAP时,猕猴桃酒的总高级醇和甲醇产量分别下降了42.84%和20.1%。张双梅等[31]研究发现,在桑葚果汁中添加400 mg/L的异亮氨酸(Ile)可以显著增加活性戊醇、乙酸活性戊酯含量(P<0.05);添加400 mg/L的亮氨酸(Leu)可以显著增加异戊醇、乙酸异戊酯含量(P<0.05);添加400 mg/L的苯丙氨酸(Phe)可以显著增加苯乙醇和乙酸苯乙酯的含量(P<0.05);添加400 mg/L的缬氨酸(Val)可以显著增加异丁醇和乙酸异丁酯含量(P<0.05)。
提高用曲量或添加酶制剂即调整曲种的酶活力也会影响高级醇含量,王亚平等[32]采用酵母、酶制剂和大曲协同发酵生产液态法白酒,表明酸性蛋白酶用量和大曲用量对液态法大曲酒发酵过程中高级醇含量影响较大。酸性蛋白酶的用量为4 U/g时,高级醇总量为431.29 mg/L,比对照下降7.80%;大曲用量为原料的40%时,高级醇总量为207.73 mg/L,比对照下降59.98%。张小娜等[33]研究表明,固态发酵的大曲酒高级醇总量高于小曲酒42.94%。采用小曲发酵时,曲料比在2%时高级醇产量最少,曲料比在4%时高级醇产量最高。
但实际验证中这类方法并不稳定,有时也会造成高级醇含量上升。并且这类影响的调控虽然能降低高级醇的生成,但同样是抑制酵母生长以及使发酵迟缓的原因,通过系统研究发酵前体物质含量的调控优化方案,使发酵过程能正常顺利进行,当前对其还需进行更深一步的研究。
3.3 发酵工艺条件
我国传统酒的酿造工艺主要可分为发酵工艺、蒸馏工艺、陈化工艺以及勾兑工艺,而发酵工艺是所有酒的生产都必须经过的一个工艺流程,是酿酒过程中最重要的一步。发酵工艺的关键就是将酿酒原料中的淀粉糖化,继而酒化的过程,在此过程中就会伴随着高级醇的生成。通过调整发酵工艺以及发酵环境也可以控制高级醇生成[34]。发酵温度与发酵质量息息相关,发酵过程的温度变化呈前期升温较快、中期维持高温、后期温度缓缓下降的趋势,对发酵过程的温度进行调控可影响高级醇的生成。毛青钟[35]研究表明,前发酵温度低,高级醇(仲丁醇、异丁醇、异戊醇)生成量多;前发酵温度高高级醇生成量少。盛凤云等[36]探索了低温发酵工艺在黄酒酿造过程中的可行性和对黄酒风味品质的影响,通过发酵试验验证了低温发酵工艺黄酒中总高级醇含量显著降低,黄酒整体香气品质特别是水果香花香的香气特征显著优于常温酿制黄酒。NTULI R G等[37]采用低温发酵技术将赤霞珠(Cabernet Sauvignon)葡萄酒在不同温度(16 ℃、24 ℃、32 ℃)条件下的颜色、酚、多糖、挥发性和感官特征进行分析,结果表明,较低的发酵温度和较低的固体含量增加了酯类的浓度,反之则增加了杂醇、多糖和甘油的浓度,同时较高的发酵温度也增加了芳樟醇浓度。与传统浸渍发酵条件相比,低温发酵技术处理下的杂醇和1-己醇浓度会有所下降。管莹等[38]将不同香型的白酒放入橡木桶中进行陈酿,每半年对白酒中的骨架酸酯成分、醛类成分、醇类成分以及感官进行分析。实验结果发现白酒经过橡木桶的长期陈酿后,香味成分的变化规律出现了与常规陈酿不一样的情况,酸类物质含量大幅度上升,酯类物质含量也出现上升,乙醛含量上升而乙缩醛含量部分香型出现下降,甲醇变化不明显,但高级醇类在陈酿后半期出现上升的情况。CAI J等[39]研究了冷浸渍(cold maceration,CM)处理在两种不同工业规模发酵罐中发酵对赤霞珠葡萄酒的影响。根据发酵罐的类型,CM处理对葡萄酒香气的影响不同,自动抽水罐(automatic pumping-over tank,PO-tank)比自动冲压罐(automatic punching-down tank,PD-tank)更有效。当使用PO罐时,CM处理的葡萄酒显示一些杂色醇(异丁醇和异戊醇)减少,一些酯(特别是醋酸酯)增加。但在使用PD罐时,在这些化合物中没有检测到明显的变化。ZHANG Q A等[40]为了研究超声辐照对葡萄酒中高级醇的影响,采用响应面法对超声时间、温度和功率等参数进行优化,并利用模型葡萄酒溶液探讨了超声辐照对葡萄酒中高级醇的降低机理。结果发现,在30 min、30 ℃、150 W的超声条件下,高级醇的含量下降幅度最大,最终含量为306.75 mg/L,下降率为40.44%。发酵时间直接决定糟醅的发酵程度,也能明显影响高级醇含量的生成。袁国亿等[41]研究表明,六粮米酒(玉米、大米、小米、黑米、糯米、糯玉米)发酵时间<48 h,香味寡淡,酒体无光泽,发酵时间>72 h,酒味酸涩,颜色暗淡无光泽,而在48 h左右时,米酒口感醇厚,酒香浓郁。黄志久等[3]研究发现,在发酵时间为11 d时,小曲清香型白酒中高级醇含量最低,为1.78 g/L,但此时总酸、总酯、出酒率均未达到最佳点;当发酵时间为15 d时,高级醇含量再次出现低点,并且总酸、总酯明显上升。
发酵工艺条件对发酵酒中高级醇的生成影响较大,通过改善发酵过程的环境以及调整发酵工艺可以实现对高级醇的调控。温度可通过改变各类菌种的代谢强度和酒醅中酶系的水解速度来影响高级醇的合成;采用橡木也可改善发酵环境,橡木具有很好的透气性,提供的微氧环境可以加速微生物的发酵,提高酒体稳定性。但橡木价格相对昂贵且易造成酒的挥发和渗漏;发酵时间可直接决定糟醅的发酵程度,以此影响高级醇含量生成。选择合适的发酵条件方案是实现高级醇减控策略的前提。
4 总结与展望
高级醇对酒类风味的构成具有十分重要的作用,对发酵酒的芳香和口味都有贡献,同时又是生成酯的前体物,但其含量过高会危害人体健康,检测发酵酒中的高级醇并能控制其含量是当前酒类研究的重要方向之一。虽然已知高级醇的两条代谢途径,但在实际发酵过程中两条途径是同时存在于发酵反应当中,由于微生物发酵的复杂性,当前并不能确定出高级醇的准确生成路径,对于高级醇的研究仍处于初步阶段。现阶段对于高级醇的研究主要从这两条途径入手,通过微生物手段、调整前体合成物质、发酵条件来控制高级醇的合成,虽然这些调控手段可以降低发酵酒中高级醇的含量,但有些操作也会对酒中的一些其他物质产生影响,如何在保证不降低原酒质量的前体下降低高级醇含量也是目前发酵酒企业的重要问题之一。通过现阶段的研究目前并没有一套系统的操作流程来调控高级醇的含量。
未来可通过快速在线检测方法来对酒中的高级醇进行检测,对发酵酒高级醇含量进行减控策略,实现白酒生产自动化的同时保证发酵酒的质量。
[1]ARANCHA F B,MARIA S N,VICENTE F.On the effects of higher alcohols on red wine aroma[J].Food Chem,2016,210(1):107-114.
[2]冯鹏鹏,孙丽静,肖冬光,等.啤酒酵母高级醇的代谢与调控研究进展[J].食品研究与开发,2021,42(8):153-159.
[3]黄志久,薛瑞琪,张雨,等.不同工艺参数对小曲清香型白酒的品质影响[J].食品与发酵科技,2022,58(4):32-38.
[4]肖冬光.白酒生产技术[M].北京:化学工业出版社,2011:132-133.
[5]袁国亿,王春晓,何宇淋,等.酶标仪比色法检测浊米酒中高级醇含量[J].食品与发酵工业,2021,47(6):221-227.
[6]杜威,林玲,张兴亚,等.分光光度法测定黄酒中的高级醇[J].酿酒科技,2011(7):105-107.
[7]王雅楠,王倩,刘延琳,等.葡萄酒高级醇检测方法的优化及其在本土酿酒酵母筛选中的应用[J].中国酿造,2020,39(6):47-52.
[8]林玲,王丽,张兴亚,等.气相色谱法测定黄酒中的高级醇[J].中国酿造,2011,30(5):170-172.
[9]唐开永,周鸿翔,刘彩婷,等.米酒中6种醇的气相色谱外标法测定研究[J].中国酿造,2019,38(4):183-187.
[10]张雪雪,蔡敏佳,周耀明,等.白酒杂质的气相色谱分析[J].当代化工研究,2018(7):104-106.
[11]范三红,李颖星,白宝清.涡旋辅助分散液液微萃取-气相色谱法测定清香型白酒中5种高级醇[J].中国酿造,2020,39(4):194-200.
[12]郭亚芸,史红梅,丁杰,等.静态顶空/气相色谱-质谱联用法测定葡萄蒸馏酒中的高级醇[J].中外葡萄与葡萄酒,2022(4):30-34.
[13]吴同,谭超.近红外光谱同时测定白酒中总酯和杂醇油[J].化学研究与应用,2016,28(10):1460-1463.
[14]刘建学,杨国迪,韩四海,等.白酒基酒中典型醇的近红外预测模型构建[J].食品科学,2018,39(2):281-286.
[15]叶萌祺.苹果酒酿造过程香气物质调控及FT-NIRS分析方法研究[D].杨凌:西北农林科技大学,2015.
[16]任宇婷,乔美灵,孙子羽,等.清香型白酒发酵过程中高级醇形成规律研究[J].食品与发酵工业,2023,49(4):38-44.
[17]梁清文,方芳.糖耗速率对浓香型白酒发酵过程异戊醇合成的影响[J].食品与发酵工业,2022,48(15):33-40.
[18]曾朝珍,张永茂,康三江,等.发酵酒中高级醇的研究进展[J].中国酿造,2015,34(5):11-15.
[19]范培文,刘蒲临,张明春,等.浓酱兼香型白酒发酵酒醅微生物群落及理化指标对正丙醇产出的影响[J].中国酿造,2022,41(7):32-37.
[20]王春艳,邓洲,武思雨,等.红谷黄酒发酵过程中细菌群落结构分析及其对高级醇的影响[J].中国酿造,2022,41(6):112-116.
[21]李园子,田伏锦,王凤寰,等.白酒酿造中适产高级醇酿酒酵母菌株选育研究进展[J].食品与发酵工业,2022,48(15):316-324.
[22]康新玥,魏敏,江森,等.糖诱导型启动子调控ALD6基因表达降低黄酒中的高级醇生成量[J].食品与发酵工业,2022,48(23):17-24.
[23]崔丹瑶,慕济锗,张卜升,等.利用不同启动子调控啤酒酵母产醇酯比的研究[J].食品研究与开发,2022,43(17):168-174.
[24]林良才,白茹,高滢,等.高耐性库德里阿兹威氏毕赤酵母的筛选及应用[J].食品与发酵工业,2023,49(3):60-67.
[25]JANSSEN P H.Propanol as an end product of threonine fermentation[J].Arch Microbiol,2004,182(6):482-486.
[26]MATEO J J,JIMENEZ M,PASTOR A,et al.Yeast starter cultures affecting wine fermentation and volatiles[J].Food Res Int,2001,34(4):307-314.
[27]KATARINA F,KATARINA M,IVAN Š.Effect of indigenous S.cerevisiae strains on higher alcohols,volatile acids and esters in wine[J].Czech J Food Sci,2017,36(2):2017-2131.
[28]LIU S P,MA D L,LI Z H,et al.Assimilable nitrogen reduces the higher alcohols content of huangjiu[J].Food Control,2020,121(5):107660.
[29]谢克英,刘冠慧,钱志伟,等.酵母可同化氮类型对桑葚酒发酵的影响[J].食品工业,2022,43(3):18-22.
[30]卢丽娟,钟瑶,秦义.可同化氮源磷酸氢二铵对发酵型猕猴桃酒品质的影响[J].食品科学,2022,43(14):256-263.
[31]张双梅,郑莹媛,张秀艳.外源添加单一氨基酸对桑葚酒风味品质的影响[J].中国酿造,2021,40(12):29-34.
[32]王亚平,邢爽,孙中贯,等.液态法大曲酒发酵过程中高级醇影响因素的研究[J].天津科技大学学报,2019,34(5):39-44.
[33]张小娜,宋翠颖,郭世鑫,等.白酒发酵过程中高级醇影响因素的研究[J].食品与发酵工业,2023,49(1):67-72.
[34]勾文君.浓香型白酒发酵过程正丁醇合成机制与减控策略研究[D].无锡:江南大学,2021.
[35]毛青钟.不同前发酵温度对黄酒质量的影响研究[J].酿酒,2015,42(5):58-62.
[36]盛凤云,徐俊敏,宋科峰,等.发酵温度对黄酒酿造及风味物质形成影响研究[J].酿酒科技,2021(5):56-61.
[37]NTULI R G,SALTAM Y,PONANGI R,et al.Impact of fermentation temperature and grape solids content on the chemical composition and sensory profiles of Cabernet Sauvignon wines made from flash détente treated must fermented off-skins[J].Food Chem,2022,369(1):130861.
[38]管莹,杨强,乐细选,等.橡木桶陈酿对白酒中微量成分的影响研究[J].酿酒,2022,49(3):87-92.
[39]CAI J,ZHU B Q,WANG Y H,et al.Influence of pre-fermentation cold maceration treatment on aroma compounds of Cabernet Sauvignon wines fermented in different industrial scale fermenters[J].Food Chem,2014,154(7):217-229.
[40]ZHANG Q A,ZHANG Q A,ZHANG Q A,et al.Ultrasound as an effective technique to reduce higher alcohols of wines and its influencing mechanism investigation by employing a model wine[J].Ultrason Sonochem,2020,61:104813.
[41]袁国亿,何宇淋,王春晓,等.米酒风味品质形成相关因素的研究进展[J].食品与发酵工业,2022,48(9):286-294.