丁酸梭菌(Clostridium butyricum)又名酪酸菌,隶属于厚壁菌门(Firmicutes)芽孢杆菌科(Bacillaceae)梭菌属(Clostridium),是一种严格厌氧、可产生孢子的革兰氏阳性菌,其代谢产物丁酸、乙酸、丙酸以及各种消化酶等可修复损伤的肠道黏膜及调节肠道微生态环境,有益于动物健康及生长发育[1-4],是理想的饲料用抗生素替代品。目前,对于丁酸梭菌的研究多集中于菌株筛选及生物学功能分析[5-8],小规模发酵提高菌体量和产孢率[9-11]等方面。然而,为获得较大生物产量菌制剂,需要采用生物发酵罐进行扩大培养,尽管采用大型发酵罐发酵的过程中可以较好地控制小规模培养发酵过程中不可控因素[12],但是扩大培养后菌株的存在形式影响贮存期。国内外最常见的是液体和半固体的保藏方式,但这两种方式不仅容易造成过多的菌体失活,而且对保藏温度具有较高要求,通常要在4~10 ℃低温保藏,既增加了成本又限制了其产品流通[13]。鉴于此,研究丁酸梭菌扩大培养后的干燥方式具有重要意义。
真空冷冻干燥法[20-21]和喷雾干燥法[21-22]均是将益生菌发酵液制成活菌制剂/粉剂,是较为理想的保藏方法。真空冷冻干燥技术是利用原料中水分升华原理,将含水物料冻结到共晶点温度以下,并在真空条件下升温,以达到水分直接升华形成蒸汽并从物料中排出的效果[23]。喷雾干燥技术是指菌体浓缩液经喷雾干燥分散于热空气中,料液水分快速蒸发形成固体粉末的过程,此法用时较短、制粉迅速、可使料液由液态经雾化和干燥直接变成为固体粉末。两种干燥方式均可最大程度的保留物料的营养价值,使产品实现常温下的长期保存与便捷运输[24]。目前,已有采用喷雾干燥技术制备乳杆菌和双歧杆菌菌粉的相关研究,但未见采用该技术制备丁酸梭菌菌粉的研究报道。
综上所述,为解决丁酸梭菌产量低、保持菌体的稳定性和延长保质期等问题,本研究以丁酸梭菌(Clostridium butyricum)BLCC1-0022为研究对象,利用前期实验室优化的发酵条件[10],进一步利用生物发酵罐扩大培养并利用真空冷冻干燥法和喷雾干燥法制备菌粉,并以菌株存活率为评价指标,对其温度耐受性及贮存稳定性进行研究,以期获得最佳贮存效果,为丁酸梭菌的大规模生产及应用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
丁酸梭菌(Clostridium butyricum)BLCC1-0022:由山东宝来利来生物工程股份有限公司研究院提供。
1.1.2 化学试剂
葡萄糖(分析纯)、可溶性淀粉(生化试剂)、CaCO3(分析纯):山东祥瑞药业有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;牛肉浸膏(生化试剂):天津市英博生化试剂有限公司;氯化钠、MgSO4·7H2O、MnSO4·H2O(均为分析纯):天津博迪化工股份有限公司;D-环丝氨酸:青岛海博生物技术有限公司。
1.1.3 培养基
胰胨-亚硫酸盐-环丝氨酸琼脂基础培养基:青岛海博生物技术有限公司。
梭菌增殖培养基[25]:葡萄糖30 g/L,蛋白胨20 g/L,牛肉浸膏15 g/L,CaCO3 20 g/L,pH 7.0±0.2,固体培养基中添加琼脂15 g/L。118 ℃高压灭菌30 min。
梭菌计数培养基[25]:取47 g胰胨-亚硫酸盐-环丝氨酸琼脂基础培养基加热溶解于1 000 mL蒸馏水中,分装于500 mL三角瓶中,每瓶250 mL,121 ℃灭菌15 min。冷却至(50±1)℃时,每250 mL培养基中加入过滤除菌的0.5%的D-环丝氨酸溶液20 mL,混匀。
丁酸梭菌发酵培养基[18]:可溶性淀粉24.2 g/L、蛋白胨32.7 g/L、牛肉浸膏33.1 g/L、CaCO3 24.7 g/L、MgSO4·7H2O 0.25 g/L、MnSO4·H2O 0.25 g/L,pH 7.0±0.2,121 ℃灭菌20min。为防止产气过多造成污染,发酵培养基需加入1.0g/L泡敌。
1.2 仪器与设备
DHP-9082电热恒温培养箱:上海一恒科技有限公司;THZ-C恒温振荡器:扬州培英实验仪器有限公司;HH-4数显恒温水浴锅:国华电器有限公司;LABS厌氧培养箱:美国PLAS-LABS;T6新世纪紫外可见分光光度计:上海普元仪器有限公司。
1.3 试验方法
1.3.1 丁酸梭菌原代种子液的制备
用接种铲取丁酸梭菌沙土管1/4铲于装有100 mL丁酸梭菌增殖培养基的丝口瓶中,拧紧瓶盖,于37 ℃静置培养12 h,4 ℃保存,作为原代种子液(N0)。
1.3.2 丁酸梭菌种子液传代次数对其液体发酵的影响
用原代种子液接种于装有100 mL丁酸梭菌发酵培养基的丝口瓶中,拧紧瓶盖,37 ℃静置培养12 h时,镜检观察菌体形态,取3 mL培养液作为下一批发酵的种子液,作为第一代传代种子液(N1),培养至N4,直至镜检观察出现异性菌体(不是典型的梭状),且不再形成芽孢为止。每个代数3个平行。
1.3.3 丁酸梭菌生长曲线的绘制
将20 L发酵罐空消(121 ℃、30 min)后,装入丁酸梭菌发酵培养基16 L进行实消(121 ℃、30 min),待培养基温度降至40 ℃以下时,按照3%(V/V)的接种量接入原代种子液,罐压0.02 MPa,搅拌混匀(记为0 h)。37 ℃静置、厌氧培养至22 h,每隔2 h取样,检测发酵液pH值、活菌数和芽孢形成率。每个处理3个平行。
1.3.4 丁酸梭菌菌粉的制备
种子液制备:用接种铲取丁酸梭菌沙土管1铲于装有3 L丁酸梭菌增殖培养基的三角瓶中,共接种12 L,均密封,于37 ℃静置培养12 h,得到12 L种子液。
发酵罐培养:500 L发酵罐121 ℃空消30 min;接入丁酸梭菌发酵培养基400 L,121 ℃实消30 min,待培养基温度降至40 ℃以下时,将上述培养好的12 L种子液全部接入,搅拌混匀,37 ℃静置、厌氧培养,罐压0.02 MPa,根据产气升压情况,6 h开始每隔2 h取样镜检,测定发酵液pH值。当镜检菌体芽孢增多,肉眼可见芽孢率达到90%以上,pH降至5.20或者pH在2 h内不再下降时,停止发酵。每个发酵试验重复3次以上。
干燥工艺:发酵结束后将发酵液搅拌混匀,取10 L发酵液,5 000 r/min于4 ℃离心10 min,取菌泥加1%无菌水搅拌均匀,-80 ℃预冻1 h,然后利用真空冷冻干燥机冷冻干燥(-80 ℃、真空度25 Pa)48 h,得到冻干菌粉;其余发酵液喷雾冷冻干燥(进口温度120 ℃,流速为130 mL/h,转速为50 r/min,压力为1.0×104Pa,出口温度100 ℃),制成喷干菌粉。
1.3.5 丁酸梭菌菌粉温度耐受性试验
(1)高温耐受试验
将丁酸梭菌冻干菌粉和喷干菌粉分别置于电热恒温培养箱中,设置温度为60 ℃、70 ℃、80 ℃、90 ℃、100 ℃、110 ℃、120 ℃,处理10 min。自然冷却至室温,各取1.00 g菌粉于100 mL带有玻璃珠的0.9%灭菌生理盐水瓶中,振荡混匀,检测活菌数,并计算存活率。
(2)模拟储运温度耐受试验
分别取丁酸梭菌冻干菌粉和喷干菌粉1.00 g于100 mL带玻璃珠的0.9%灭菌生理盐水瓶中,于35 ℃和45 ℃各处理8 h,期间不间断摇匀,自然冷却至室温,振荡混匀,检测活菌数,并计算存活率。
1.3.6 丁酸梭菌存贮稳定性试验
将丁酸梭菌冻干菌粉和喷干菌粉分别在-20 ℃、4 ℃、37 ℃和室温条件下(18~25 ℃)贮存180 d,各取1.00 g菌粉于100 mL带有玻璃珠的0.9%灭菌生理盐水瓶中,振荡混匀,分别在贮存0、7 d、14 d、60 d、90 d、150 d、180 d时检测活菌数。
1.3.7 测定方法
活菌数的测定:准确吸取发酵液1 mL(菌粉1.00 g),用稀释平板计数法[26],取适当稀释度的样品至丁酸梭菌计数培养基,待培养基完全凝固后,装入2.5 L厌氧培养袋中,每个袋中放置不多于10个平板,加入厌氧产气包,封口,培养箱37℃培养24h左右,结果用CFU/mL发酵液(CFU/g菌粉)表示。
芽孢率:先将发酵液/菌粉按照上述方法进行活菌计数,另取适当梯度的稀释液于80 ℃水浴处理10 min后再用稀释平板计数法测定芽孢数[27],重复3次,计算芽孢率,其计算公式如下:
2 结果与分析
2.1 丁酸梭菌BLCC1-0022种子液传代次数对其液体发酵的影响
丁酸梭菌BLCC1-0022种子液传代次数对其液体发酵的影响见表1。
表1 丁酸梭菌BLCC1-0022种子液传代次数对其液体发酵的影响
Table 1 Effect of passage times of Clostridium butyricum BLCC1-0022 seed liquid on its liquid fermentation

注:同行肩标不同小写字母表示差异显著(P<0.05)。下同。
由表1可知,传代次数为N1、N2时,菌体开始产气较快,随着时间延长,产气增多,说明菌体活化速率快,生长旺盛;当传代次数为N3时,产气缓慢,活化时间长,菌体生长缓慢。因此,需要保证种子液生长至对数生长期,此时,接入发酵罐中菌株产气旺盛,生长速率最快[28];丁酸梭菌可产生内生芽孢,生长后期还会形成脱落芽孢,这也是一种休眠后再繁殖的表现,因此芽孢形成时间长短与菌体生长周期的成正比[29]。N1和N2代种子液产生芽孢时间短(12 h),芽孢率均在90%以上,而N3代芽孢形成力弱。此外,丁酸梭菌在发酵过程中会产生大量氢气,同时代谢产生大量的醋酸、丁酸和乙酸,能大幅度的降低发酵液的酸碱度,而较低的pH影响菌体生长。丁酸梭菌BLCC1-0022传代次数为N1、N2、N3时,发酵液pH值分别为5.15、5.31、5.78,活菌数分别为1.97×108 CFU/mL、1.89×108 CFU/mL、0.42×108 CFU/mL。说明丁酸梭菌BLCC1-0022种子液传代次数在3次以内,可保证转接后菌体快速生长,N1和N2代的生长性能优于N3。
2.2 丁酸梭菌BLCC1-0022生长曲线的研究
丁酸梭菌BLCC1-0022生长过程中的活菌数与pH值的变化见图1,菌体生长情况见图2。
由图1可知,0~4 h为生长迟缓期,活菌数开始增加,pH较发酵初期降低了1.72;6~16 h为对数生长期,活菌数持续升高至1.06×108 CFU/mL,pH持续下降至5.19;16~20 h为稳定期,pH值降低不明显,pH值约5.15,活菌数稳定在3×108 CFU/mL;20~22 h后进入衰亡期,活菌数降低,pH值有所升高,pH值升高至5.30。因此,6~16 h为对数生长期,此时转接可保证菌体旺盛,快速提高生物产量。
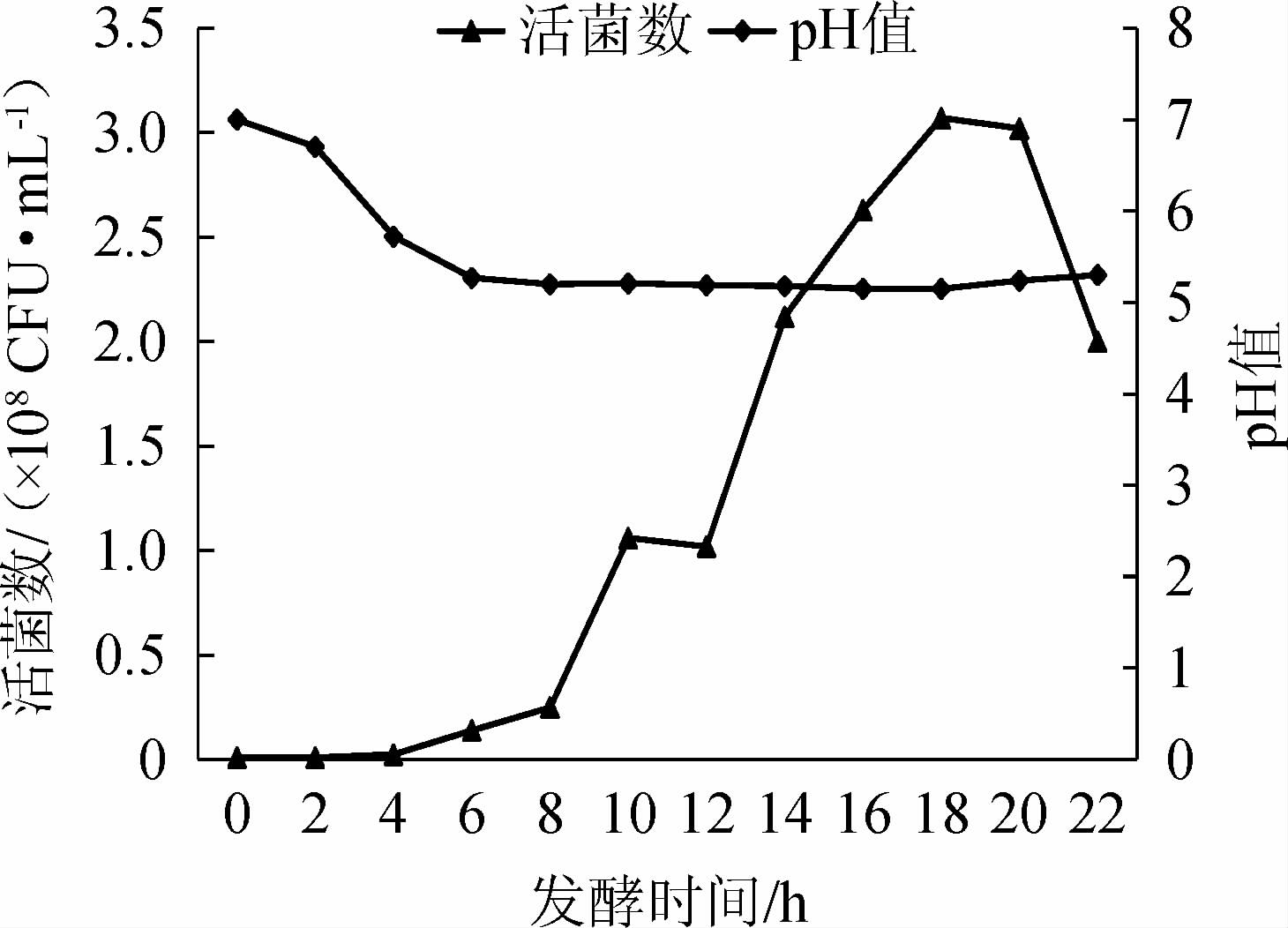
图1 丁酸梭菌BLCC1-0022发酵过程中活菌数及pH值的变化
Fig.1 Changes of viable bacteria count and pH value of Clostridium butyricum BLCC1-0022
由图2可知,丁酸梭菌BLCC1-0022菌体形态变化与生长曲线基本一致。0~4 h菌体形态多为直杆状或多杆状;6~16 h菌体形态由直杆形态中间分裂,变成两两短杆相连的菌形态,然后分开变为两个短杆状形态,逐渐膨大呈梭形;16~20 h菌体形态多为典型的中间膨胀形成梭状形态,或是梭形菌形态从菌体中间形成芽孢,最后芽孢脱落,变为空心型的脱落芽孢;22 h后可出现异性菌体,逐渐衰亡。

图2 丁酸梭菌BLCC1-0022菌体形态在6 h(A)、10 h(B)、14 h(C)及20 h(D)的变化
Fig.2 Changes of Clostridium butyricum BLCC1-0022 mycelial morphology at 6 h (A),10 h (B),14 h (C) and 20 h (D)
2.3 丁酸梭菌BLCC1-0022的扩大培养
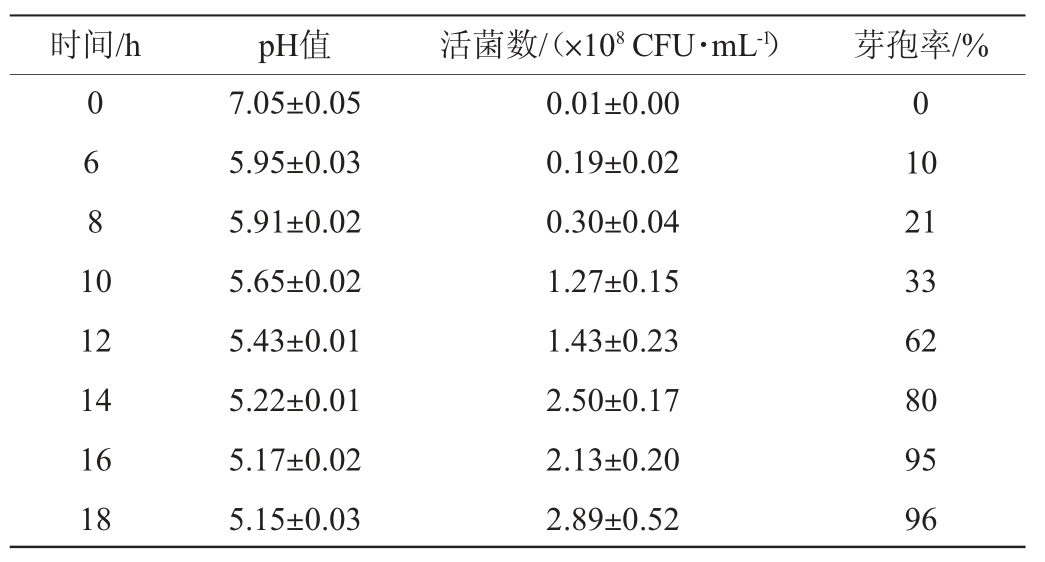
丁酸梭菌BLCC1-0022 500 L发酵罐生长情况见表2。
由表2可知,丁酸梭菌BLCC1-0022在500 L发酵罐扩大培养时,随着发酵时间的延长,pH值逐渐降低;发酵时间为16 h时,pH值降至5.17;此后,pH值降低幅度很小。因此,18 h时停止发酵。此时,酸梭菌BLCC1-0022发酵液的pH值为5.15;当发酵时间为0~18 h时,活菌数整体呈逐渐增加的趋势,发酵时间为18 h时,活菌数最高,为2.89×108 CFU/mL;发酵时间为6 h时,开始出现芽孢,芽孢率为10%,当发酵时间为6~18 h时,芽孢率逐渐升高,发酵时间为18 h时,芽孢率最高,为96%。这均与生长曲线基本一致。以发酵18 h的菌液经过干燥处理制成菌粉,得到的喷干菌粉活菌数为3.7×109 CFU/g,冻干粉活菌数4.1×1010 CFU/g,均于-20 ℃保存。因此,丁酸梭菌BLCC1-0022在500 L发酵罐扩大培养时间为18 h,冻干菌粉活菌数高于喷干菌粉。
表2 丁酸梭菌BLCC1-0022在500 L发酵罐中的生长情况
Table 2 Growth of Clostridium butyricum BLCC1-0022 in 500 L fermenter
2.4 丁酸梭菌BLCC1-0022菌粉温度耐受性
丁酸梭菌BLCC1-0022菌粉温度耐受试验结果见表3。
表3 丁酸梭菌BLCC1-0022菌粉温度耐受试验结果
Table 3 Results of temperature tolerance test of Clostridium butyricum BLCC1-0022 powder
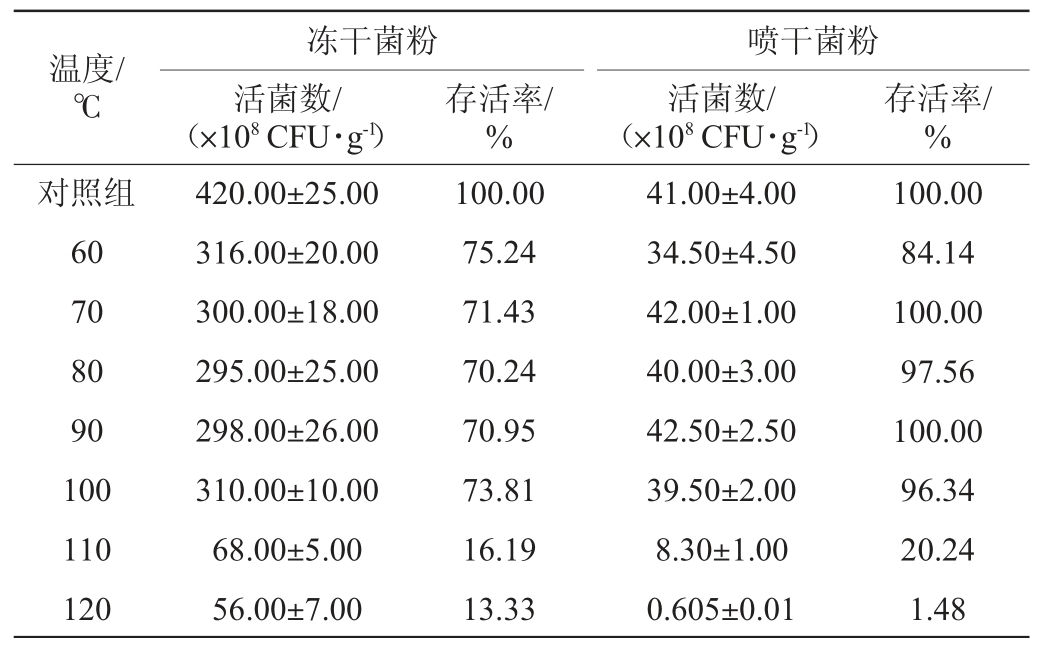
由表3可知,冻干菌粉在60~100 ℃条件下处理10 min,活菌数保持在1010CFU/g,与对照组在一个数量级,存活率>70%;110~120 ℃条件下处理10 min,活菌数下降1个数量级,存活率>10%,表明冻干菌粉在10 min的处理条件下的耐受温度为100 ℃。喷干菌粉在60~100 ℃条件下处理10 min,活菌数保持在109 CFU/g,与对照组相比,几乎无损失;当温度为110 ℃时,活菌数下降一个数量级,存活率为20.24%;当温度为120 ℃时,活菌数下降2个数量级,存活率只有1.48%。若以<50%的存活率为标准,丁酸梭菌BLCC1-0022喷干菌粉和冻干菌粉置于100 ℃条件下处理10 min的存活率分别为96.34%和73.81%,耐受性能好。因此,丁酸梭菌BLCC1-0022菌粉可耐受高温条件(100 ℃、10 min),且喷干菌粉温度耐受性优于冻干菌粉。
2.5 丁酸梭菌BLCC1-0022菌粉模拟储运温度耐受性
丁酸梭菌BLCC1-0022菌粉模拟储运温度耐受试验结果见表4。
表4 丁酸梭菌BLCC1-0022模拟储运温度耐受试验结果
Table 4 Results of simulated storage and transportation temperature tolerance test of Clostridium butyricum BLCC1-0022
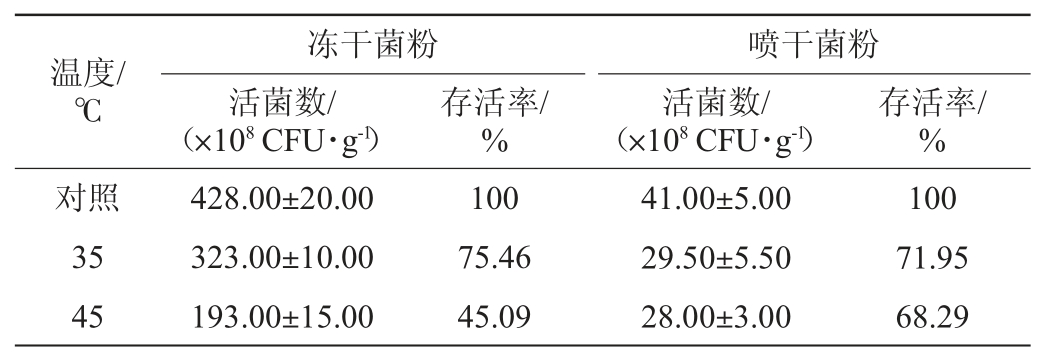
丁酸梭菌作为一种益生菌,其运输过程多采用冷链物流,但是不可避免的是冷藏物质的保质期和高品质可能在运输过程中由于冷链中断而丧失。如在贮藏、运输和销售过程中,为了节省能源间歇性关闭制冷,以及货物的装卸等都会带来强烈的温度波动,导致连续的低温体系得不到保障,尤其是夏季高温期,容易引起运输物质的持续升温,造成活性物质损失[30]。由表4可知,冻干菌粉于35 ℃和45 ℃处理8 h时,活菌数均在1010 CFU/g水平,与对照样品处于同一数量级,35 ℃条件下的存活率高于45 ℃。喷干菌粉在35 ℃和45 ℃处理8 h时,活菌数均在109 CFU/g水平,与对照样品同一个数量级,35 ℃存活率高于45 ℃。说明冻干菌粉和喷干菌粉在储运过程中会受温度的影响,温度越高活菌损失较大,但当温度为45 ℃时,活菌数均与对照样品在一个数量级水平,说明菌粉模拟储运性能均较好。因此,丁酸梭菌BLCC1-0022菌粉可耐受模拟储运条件(45 ℃、8 h),且冻干菌粉优于喷干菌粉。
2.6 丁酸梭菌BLCC1-0022存贮稳定性
丁酸梭菌BLCC1-0022存贮稳定性试验结果见表5。
表5 丁酸梭菌BLCC1-0022存贮稳定性试验结果
Table 5 Results of storage stability test of Clostridium butyricum BLCC1-0022
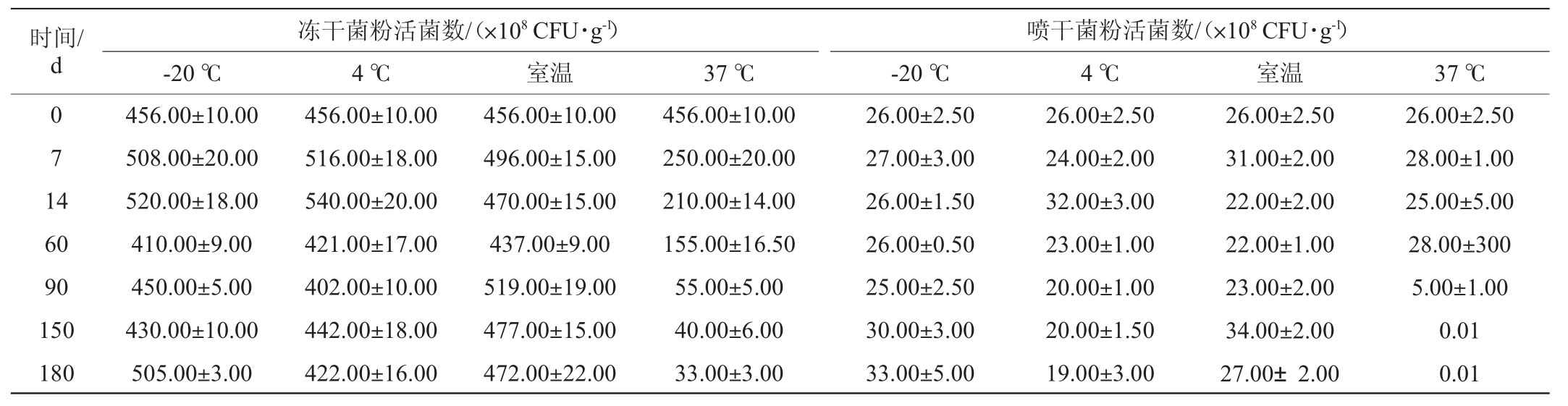
菌粉贮藏也受多种因素的影响,如存贮空间、储存环境、产品自身特性等[31-32]。由表5可知,冻干菌粉和喷干菌粉在-20 ℃、4 ℃和室温条件下存放180 d,活菌数分别在1010 CFU/g和109 CFU/g水平,均与0 d时的原样品的活菌数处于一个数量级水平,存活率均>73.08%,说明在此条件下冻干菌粉和喷干菌粉的存贮性能均较好;而在37 ℃条件下,随着存贮时间延长,活菌数降低,损失率升高,至60 d时,冻干菌粉和喷干菌粉的活菌数分别与0 d时的原样品的活菌数处于一个数量级水平,存活率分别为33.99%和100%;存贮时间至90 d时,冻干菌粉和喷干菌粉的活菌数分别在109 CFU/g和108 CFU/g水平,均与0 d时的原样品降低1个数量级,存活率分别为12.06%和19.23%。说明冻干菌粉和喷干菌粉在-20 ℃、4 ℃和室温条件下可贮存180 d(存活率均>73.08%),在37 ℃贮存不宜超过60 d。表明冻干菌粉的活菌数更高,而喷干菌粉的存贮稳定性更高。
3 结论
该研究以丁酸梭菌(Clostridium butyricum)BLCC1-0022为研究对象,对其利用生物发酵罐扩大培养,利用真空冷冻干燥法和喷雾干燥法制备菌粉,对其温度耐受性及贮存稳定性进行研究。结果表明,该菌株种子液传代次数在3次以内,扩大培养至18 h时制备的冻干菌粉活菌数高于喷干菌粉;喷干菌粉和冻干菌粉耐受高温条件(100 ℃、10 min),活菌数分别为3.96×109 CFU/g、3.10×1010 CFU/g,存活率分别为96.34%和73.81%;耐受模拟储运条件(45 ℃、8 h),活菌数分别为2.80×109 CFU/g、1.93×1010 CFU/g,存活率分别为68.29%、45.09%;4 ℃、-20 ℃和室温条件下贮存180 d,活菌数分别在1010 CFU/g和109 CFU/g水平,存活率均>73.08%,在37 ℃贮存不宜超过60 d。表明冻干菌粉活菌数更高,而喷干菌粉的温度耐受性和存贮稳定性更高。
[1]于洁,范雪,赵敏孟,等.丁酸梭菌和枯草芽孢杆菌对肉鹅生长性能、消化酶活性、抗氧化功能和肠道形态的影响[J].动物营养学报,2021,33(2):860-868.
[2]DUAN Y,ZHANG Y,DONG H,et al.Effect of the dietary probiotic Clostridium butyricum on growth,intestine antioxidant capacity and resistance to high temperature stress in kuruma shrimp Marsupenaeus japonicus[J].J Therm Biol,2017,66:93-100.
[3]杨铿,蒋魁,洪敏娜,等.丁酸梭菌拌料投喂对凡纳滨对虾肠道上皮细胞及菌群结构的影响[J].南方农业学报,2022,53(12):3576-3583.
[4]张城瑞,于清源,王季红,等.饲粮添加丁酸梭菌对育肥山羊生长性能和直肠微生物区系的影响[J].动物营养学报,2022,34(8):5146-5155.
[5]高文文,尚佳萃,周雪,等.一株高产丁酸的丁酸梭菌分离鉴定及其生物学性质研究[J].食品工业科技,2020,41(7):82-88,101.
[6]范伟祥,曹艳丽,崔璐璐,等.24株鸡源丁酸梭菌的分离鉴定及耐药基因与毒力基因携带情况[J].微生物学报,2021,61(1):115-126.
[7]衡文,李韬,叶光斌,等.窖泥中高产丁酸梭菌的筛选、鉴定及其生长耐受性研究[J].中国酿造,2021,40(3):134-138.
[8]BANG M S,JEONG H W,LEE Y J,et al.Complete genome sequence of Clostridium butyricum strain DKU_butyricum 4-1,isolated from infant feces[J].Microbiol Resour Ann,2020,9(10):e01341-19.
[9]聂俊辉,王通,曾静,等.抽气负压发酵法对丁酸梭菌生长及芽孢形成的影响[J].中国饲料,2022(5):23-27.
[10]亓秀晔,张志焱,谢全喜,等.丁酸梭菌的生物学特性分析及发酵培养基优化[J].中国酿造,2021,40(7):71-76.
[11]杜全能,区毅恒,余杰豪,等.猪源丁酸梭菌DSY-1产芽孢高密度发酵条件优化[J].江苏农业科学,2021,49(16):148-152.
[12]孙汴京,林建斌,自强,等.响应面法优化木醋杆菌NUST4.2种子扩大培养条件[J].中国酿造,2019,38(5):59-62.
[13]陈胜杰,高翔,袁戎宇,等.真空冷冻干燥法制备益生菌粉的冻干保护剂配方优化[J].食品工业科技,2021,42(1):182-187,196.
[14]FEEDAP,BAMPIDIS V,AZ-IMPSNTI G,et al.Safed and efficacy of the feed additive consisting of Clostridium butyricum FERM BP-2789(Miya-Gold  S) for chickens for fattening,chickena reared for laying,turkeys for fattening,turkeys reared for breeding,minor avian species(excluding laying birds),piglets(sucking and weaned)and minor porcine spedies (Miyarisan Pharmaceutical Co.Ltd.)[J].EFSA,2021,19(3):e06450.
S) for chickens for fattening,chickena reared for laying,turkeys for fattening,turkeys reared for breeding,minor avian species(excluding laying birds),piglets(sucking and weaned)and minor porcine spedies (Miyarisan Pharmaceutical Co.Ltd.)[J].EFSA,2021,19(3):e06450.
[15]何家俊,吴汉葵,杨昕涧,等.丁酸梭菌对犊牛生长性能和血清生化、抗氧化、免疫指标及粪便微生物数量的影响[J].动物营养学报,2021,33(9):5076-5085.
[16]黄翠翠,周若钰,沈媛媛,等.丁酸梭菌对肉鸡屠宰性能、肌肉品质和抗氧化功能的影响[J].动物营养学报,2021,33(6):3250-3258.
[17]申文雪,刘金松,范小燕,等.丁酸梭菌替代金霉素对肉鸡腿肌肉品质和抗氧化功能的影响[J].微生物学报,2022,62(4):1464-1472.
[18]FU J,WANG T H,XIAO X,et al.Clostridium butyricum ZJU-F1 benefits the intestinal barrier function and immune response associated with its modulation of gut microbiota in weaned piglets[J].Cells,2021,10(3):527.
[19]于平,胡淳玉,黄星星,等.产肌醇的植物乳杆菌ZJ2868 菌粉制备工艺[J].中国食品学报,2021,21(9):142-149.
[20]朱永刚.益生菌的微胶囊化及冻干保护剂的研究植物乳杆菌培养及冻干技术研究[D].济南:齐鲁工业大学,2021.
[21]史祯晖.丁酸梭菌发酵配方的优化及喷雾干燥载体的筛选[D].武汉:中南民族大学,2018.
[22]张振民,方海田,刘慧燕,等.益生菌发酵枣粉喷雾干燥条件的优化[J].中国酿造,2022,41(1):180-185.
[23]WARD K R,MATEJTEJTSCHUK P.The principles of freeze-drying and application of analytical technologies[J].Methods Mol Biol,2021,2180:99-127.
[24]CHEN W,CHIU HT,FENG Z,et al.Effect of spray-drying and freezedrying on the composition,physical properties,and sensory quality of pea processing water(Liluva)[J].Foods,2021,10(6):1401.
[25]单宝龙,谷巍,王红,等.一株具有治疗腹泻作用的丁酸梭菌及其作为丁酸钠替代品的应用:CN 201110454790,102559550B[P].2012-07-11.
[26]方超,徐佳,李娜,等.人肠道内Faecalibacterium prausnitzii的分离、鉴定及优良菌株筛选研究[J].基因组学与应用生物学,2018,37(7):2866-2873.
[27]DUNCAN S H,HOLD G L,BARCENILLA A,et al. Roseburia intestinalis sp.nov.a novel saccharolytic,butyrate-producing bacterium from human faeces[J].Int J Syst Evol Microbiol,2002,52(5):1615-1620.
[28]蒋维勇.丁酸梭菌BJ-10产芽孢条件优化及放大培养工艺研究[D].长沙:湖南农业大学,2019.
[29]白茹玉,石彥鹏,张萍,等.不同培养条件对林可链霉菌种子液代谢影响[J].中国兽药杂志,2022,56(3):53-59.
[30]徐云强,孙卫青,汪兰,等.储运过程中温度波动对食品品质及货架期的影响[J].食品工业,2018,39(8):228-231.
[31]HORISON R,SURONO I S.Half-life estimation of encapsulated Enterococcus faecium IS-27526 by accelerated shelf life testing (ASLT)[J].IOP Conf Ser Earth Environ Sci,2020,426:012179.
[32]桑跃,冯海红,蒙璐,等.充氮包装和储藏温度对益生菌粉储藏稳定性的影响[J].食品与发酵工业,2020,46(19):143-147.