益生菌是一种有益的活性微生物,目前在保健食品及药品中广泛应用。乳酸菌是最常见的益生菌,与人体健康有着密切的关系。乳酸菌能够抵抗胃酸和肠道消化液,有黏附在肠管表面黏膜的能力,抑制肠道有害物质的产生,保持胃肠道正常机能,并对外来食源性病原菌具有抑制作用[1]。此外,乳酸菌还具有抗氧化活性,有望代替食补抗氧化药剂达到提高人体抗氧化能力的作用[2]。同时,乳酸菌对抗生素敏感,进入人体内具有一定的安全性[3]。目前报道的乳酸菌大多来源于泡菜、奶酪等发酵食品以及动物肠道菌群。伊力夏提·艾热提等[4]从发酵酸凝硬质奶酪中筛选到一株益生特性优良的植物乳杆菌(Lactobacillus plantarum),其可在模拟人体胃肠道保持较高的存活率。汪攀等[5]从野生海鲈鱼肠道分离出15株乳酸菌,筛选到1株可抑制病原菌并且能够降糖的植物乳杆菌(Lactobacillus plantarum)。
酒醅是蒸煮过后发酵好的粮食,酱香型白酒在每年大生产周期中,分“下沙”、“造沙”两轮投粮发酵,八轮加曲发酵,每个轮次酒醅从原料制备、堆积发酵到入窖发酵过程就是微生物的富集过程[6]。酒醅网罗环境中的酿酒微生物,在发酵过程中迅速繁殖,入窖发酵会抑制有害微生物[7],形成了独一无二的微生物共同繁殖又相互抑制的复杂体系,这种来源于发酵酒醅中的微生物具有绿色、安全、可靠的特点。在各轮次酒醅的微生物体系中,含有大量的乳酸菌,可通过传统可培养方法分离出来。如赵皓静等[8]从浓香型白酒酒醅中分离出一株耐酸产酸特性优良的耐酸乳杆菌(Lactobacillus acetotolerans)。李霄霄[9]从酱香型白酒酒醅、大曲中分离到25株乳酸菌,并筛选出耐乳酸、耐酒精、耐高温植物乳杆菌(Lactobacillus plantarum)、乳酸片球菌(Pediococcus acidilactici)应用于模拟固态发酵,提升了白酒风味。然而,从酱香型白酒酒醅中分离出益生乳酸菌的研究较少。因此,从酱香型白酒酒醅中分离乳酸菌并探究其益生特性具有重要的现实意义。
本研究从酱香型白酒酒醅中分离纯化乳酸菌,对其进行形态学观察及分子生物学鉴定,并研究其耐受性、体外黏附能力、抗氧化及抗菌活性及抗生素敏感性,旨在筛选出酒醅中有益于人体健康的潜在益生菌,为乳酸菌益生特性研究提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
酱香型白酒酒醅:取自天津某酒厂白酒酿造车间;金黄色葡萄球菌(Staphyloccocus aureus)、大肠杆菌(Escherichia coli)、铜绿假单胞菌(Pseudomonas aeruginosa):保存于天津科技大学现代酿造实验室菌库-80 ℃冰箱中。
1.1.2 试剂
胃蛋白酶、胰蛋白酶、猪胆盐:上海源叶生物科技有限公司;放线菌酮、细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;抗生素药敏纸片:北京天坛药物生物技术开发公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、磷酸盐缓冲液(phosphate buffered saline,PBS)、铁氰化钾、无水乙醇(均为分析纯):天津索罗门生物科技有限公司;正己烷、二氯甲烷、乙酸乙酯、十二烷、三氯甲烷、三氯乙酸、三氯化铁(均为分析纯):天津市江天化工技术股份有限公司。
1.1.3 培养基
MRS肉汤培养基、MRS固体培养基:青岛海博生物技术有限公司。
LB液体培养基:NaCl 10 g、蛋白胨10 g、酵母浸粉5 g、蒸馏水1 000 mL;LB固体培养基在LB液体培养基中加入20 g/L琼脂粉。
水琼脂培养基:琼脂粉20 g、蒸馏水1 000 mL。
以上培养基均于115 ℃灭菌20 min。
1.2 仪器与设备
L-550培养箱:湖南湘仪仪器开发有限公司;UV-1200紫外分光光度计:上海美普达仪器有限公司;S-3400N电子显微镜:日本HITACHI(日立)公司;Centrifuge 5430R离心机、nexys SX1聚合酶链式反应(polymerase chain reaction,PCR)仪:德国艾本德有限公司;MS204S电子天平:梅特勒托利多公司;LDZM型立式压力蒸汽灭菌锅:上海申安医疗器械厂;PHS-3C型pH计:上海雷磁仪器厂。
1.3 方法
1.3.1 乳酸菌的分离与纯化
取10 g酒醅,加入90 mL灭菌后的生理盐水中于30 ℃、200 r/min活化30 min,振荡混合均匀,按10倍梯度稀释至10-6,取10-3、10-4、10-5、10-6 4个梯度的菌液,分别涂布于添加10 g/L放线菌酮的MRS固体培养基上,37 ℃倒置有氧培养24 h后观察结果。挑选大小、形状、表面状态、边缘状态、颜色和质地等不同的单菌落,采用三区划线法于MRS平板中划线、有氧培养,纯化3代,得到单菌落。挑取单菌落保存于甘油管,放置于-80 ℃冰箱,备用。
1.3.2 乳酸菌的鉴定
(1)形态学鉴定
将筛选菌株的单菌落接种于MRS固体培养基,37 ℃培养24 h,采用革兰氏染色法进行染色,根据《伯杰细菌鉴定手册》[10]对乳酸菌进行菌落及细胞形态观察。
(2)分子生物学鉴定
DNA的提取:利用细菌基因组提取试剂盒提取菌株的基因组DNA。
PCR扩增:根据张兴吉等[11]的方法略作修改。PCR扩增体系(20 μL):DNA模板1 μL,正反向引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')各1 μL,超纯水7 μL,2×Accurate Taq Master Mix(dye plus)10 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸15 s,30个循环;72 ℃再延伸5 min。
琼脂糖凝胶电泳:取2 μL PCR扩增产物,采用浓度为1%的琼脂糖凝胶电泳检测,选择目标条带产物分子质量1 500 bp的样品送到金唯智测序中心进行测序,测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)中的GenBank数据库中进行局部比对搜索工具(basic local alignment search tool,BLAST)比对,得到与待测物种序列相似性最大的同源序列,采用MEGA11软件的邻接(neighbor-joining,NJ)法bootstrap method值为1 000构建系统发育树,确定属种关系。
1.3.3 筛选菌株的耐受性
(1)耐酸性
将活化后的菌悬液(OD595nm值=1.0)以1%(V/V)的接种量分别接种于pH值2.5和pH值3.0(1 mol/L的浓硫酸调节)的MRS肉汤培养基中,37 ℃培养24 h,将100 μL菌液涂布于MRS培养基平板上,37 ℃培养24 h,测定菌落数。
(2)耐胆盐性
100 μL菌悬液(OD595nm值=1.0)分别接种于含0.3%、0.4%和0.5%猪胆盐的MRS肉汤培养基,37 ℃培养24 h后进行菌落计数。
(3)模拟人体胃、肠液耐受性
模拟人工胃液:将1%胃蛋白酶加入无菌生理盐水中,调节至pH 3.0;模拟人工肠液:将1%胰蛋白酶加入0.68%无菌KH2PO4中,调节至pH 8.0[12]。
将活化后的菌悬液(OD595nm值=1.0)以1%(V/V)接种量加入模拟人体胃、肠液中,放置于37 ℃培养箱中,分别在培养0 h和3 h时,将菌悬液梯度稀释后涂布于MRS固体平板上进行菌落计数,计算存活率[13]。存活率计算公式如下:
式中:Na为模拟胃肠液0 h活菌数,CFU/mL;Nb为模拟胃肠液3 h活菌数,CFU/mL。
1.3.4 筛选菌株体外黏附能力
(1)自凝聚性的测定
将乳酸菌菌悬液(OD595nm值=1.0)于37 ℃培养3 h后,吸取上清液测定其OD595nm值[14]。自凝聚率计算公式如下:
式中:Ai为菌悬液的初始OD595nm值;Aj为培养3 h后的OD595nm值。
(2)疏水性的测定
分别将1 mL正己烷、二氯甲烷、乙酸乙酯、十二烷、三氯甲烷与3 mL菌悬液(OD595nm值=1.0)混合,在37 ℃条件下反应10 min,振荡混匀进行温度平衡,在37 ℃条件下培养3 h。取1 mL水相测得OD595nm值[14]。疏水性计算公式如下:
式中:Ai为加入菌液的初始OD595nm值;Aj为培养3 h的OD595nm值。
1.3.5 筛选菌株抗氧化能力的测定
(1)还原能力
参考杨静秋[15]的方法进行测定。取0.5 mL 乳酸菌菌悬液,加0.2 mol/L PBS及1 g/100 mL铁氰化钾溶液各0.5 mL,混合均匀。50 ℃水浴20 min,冷却至室温。加入0.5 mL 10 g/100 mL三氯乙酸,4 000 r/min离心5 min,取上清液1 mL,加超纯水、0.1 g/100 mL 三氯化铁各1 mL,混匀,静置10 min,测定OD700nm值。用PBS为空白对照。还原能力计算公式如下:
式中:A0为对照组OD700nm值;A1为样品OD700nm值。
(2)DPPH自由基清除能力
根据SZABO M等[16]的方法稍作修改。取2 mL乳酸菌悬液与1 mL DPPH乙醇溶液(0.2 mmol/L)混合,37 ℃黑暗条件下反应30 min,6 000 r/min离心10 min,取上清,测定样品组波长517 nm处的吸光度值A1;空白组以等体积的无水乙醇溶液代替DPPH乙醇溶液测定波长517 nm处的吸光度值A0,对照组以等体积蒸馏水代替样品溶液测定波长517 nm处的吸光度值A2[17]。DPPH自由基清除率计算公式如下:
1.3.6 筛选菌株的抑菌活性测定
用金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌作指示菌。用LB液体培养基活化3种指示菌至菌浓度为106~107 CFU/mL。参考张开屏等[18]的双层琼脂扩散法测定乳酸菌的抗菌活性。双层琼脂扩散法以抑菌圈直径大小为标准,抑菌圈直径>20 mm表示抗菌活性极强;抑菌圈直径15.0~20.0 mm表示抗菌能力强;抑菌圈直径10.0~15.0 mm表示抗菌能力中等;抑菌圈直径7.0~10.0 mm表示抗菌能力弱;抑菌圈直径<7.0表示没有抑菌活性[19]。
1.3.7 筛选菌株的抗生素敏感性
根据GUNYAKTI A等[20]的方法,通过调节乳酸菌悬浮液在波长595 nm处的吸光度值为0.5,可以得到浓度约为106~107 CFU/mL的样品。取100 μL菌悬液涂布于MRS培养基平板上,取抗生素药敏纸片贴于平板表面,37 ℃培养24 h后测量抑菌圈直径。根据美国临床实验室标准化研究所(clinical and laboratory standards institute,CLSI)2012标准对乳酸菌进行抗生素敏感性评价[21]。
1.3.8 数据处理
每组进行3次平行实验,实验数据以“平均值±标准差”表示,数据用Excel 2016分析,并用Origin 2018绘制图表。
2 结果与分析
2.1 乳酸菌的分离及鉴定
从样品中共分离得到23株纯培养物,共筛选得到8株革兰氏阳性菌,菌落形态及细胞特征见图1。由图1可知,8株菌的菌落均为圆形,较小,呈乳白色或者微黄色,显微形态呈杆状或短杆状。基于16S rRNA基因序列构建筛选菌株的系统发育树结果见图2。由图2可知,经过16S rRNA基因序列分析和利用GenBank BLAST程序进行序列同源性比较,菌株Z4.1、Z4.3、Z4.5、Z6.2、DJ2.1、DJ4.1的16S rRNA序列与植物乳杆菌(Lactobacillus plantarum)高度同源,与Lactobacillus plantarum srtain 2189(MT604688.1)聚于一类,亲缘关系较近;菌株DJ3.2的16S rRNA序列与Weissella viridescens高度同源,与绿色魏斯氏菌(Weissella viridescens)IMAUFB098(JQ805716.2)聚于一类,亲缘关系较近;菌株DJ3.3的16S rRNA序列与弯曲乳杆菌(Lactobacillus curvatus)高度同源,与Lactobacillus curvatus strain TMPC36925(OM736019.1)聚于一类,亲缘关系较近。

图1 筛选菌株的菌落形态和细胞形态
Fig.1 Colony and microscopy morphology of screened strains

图2 基于16S rRNA基因序列筛选菌株的系统发育树
Fig.2 Phylogenetic tree of screened strains based on 16S rRNA gene sequence
根据菌株形态观察和序列比对,菌株Z4.1、Z4.3、Z4.5、Z6.2、DJ2.1、DJ4.1被鉴定为植物乳杆菌(Lactobacillus plantarum),菌株DJ3.2被鉴定为绿色魏斯氏菌(Weissella viridescens),菌株DJ3.3被鉴定为弯曲乳杆菌(Lactobacillus curvatus)。
2.2 乳酸菌的耐受性
2.2.1 耐酸性
乳酸菌对人体发挥作用的重要前提之一是其耐酸性。因为乳酸菌进入人体后,要能够在不断变化的肠胃环境中生存。人体进食后胃肠道pH约为3.0。所以,乳酸菌必须能够在pH值为3.0的环境中存活1.5~2.0 h[22]。由表1可知,在pH 3.0环境中,除菌株DJ3.3外,其他菌株菌落数均>106CFU/mL。在pH 2.5环境中,菌株Z6.2、DJ2.1、DJ3.2、DJ4.1菌落数均>106CFU/mL,达到乳酸菌在人体发挥作用的活菌数临界值。由此可以看出,除菌株DJ3.3以外,其余7株菌均具备耐受pH3.0环境的能力。
表1 乳酸菌耐酸性实验结果
Table 1 Acid tolerance tests results of lactic acid bacteria

注:“-”表示不生长。下同。
2.2.2 耐胆盐特性
随着十二指肠中胆汁酸盐浓度的增加,乳酸菌的生长会受到抑制[23]。乳酸菌能否在含胆盐的条件下生存也是考察食补益生菌有效性的重要指标之一。小肠的上部存在浓度约为0.3%~0.5%的胆盐[24],若24 h后活菌数>1×106 CFU/mL,则表明该株乳酸菌能够在人体小肠中存活并对人体发挥有益作用。
由表2可知,8株菌株均能在0.3%胆盐环境中生长,除了菌株Z4.1和DJ3.3,菌株Z4.3、Z4.5、Z6.2、DJ2.1、DJ3.2、DJ4.1在0.4%和0.5%胆盐环境中均能正常生长,且活菌数均>106 CFU/mL。结果表明,菌株Z4.3、Z4.5、Z6.2、DJ2.1、DJ3.2、DJ4.1能在模拟人体小肠环境中生长,选择经过耐酸、耐胆盐实验筛选出的6株乳酸菌(Z4.3、Z4.5、Z6.2、DJ2.1、DJ3.2、DJ4.1)进行益生特性分析。
表2 乳酸菌胆盐耐受性实验结果
Table 2 Bile salt tolerance tests results of lactic acid bacteria
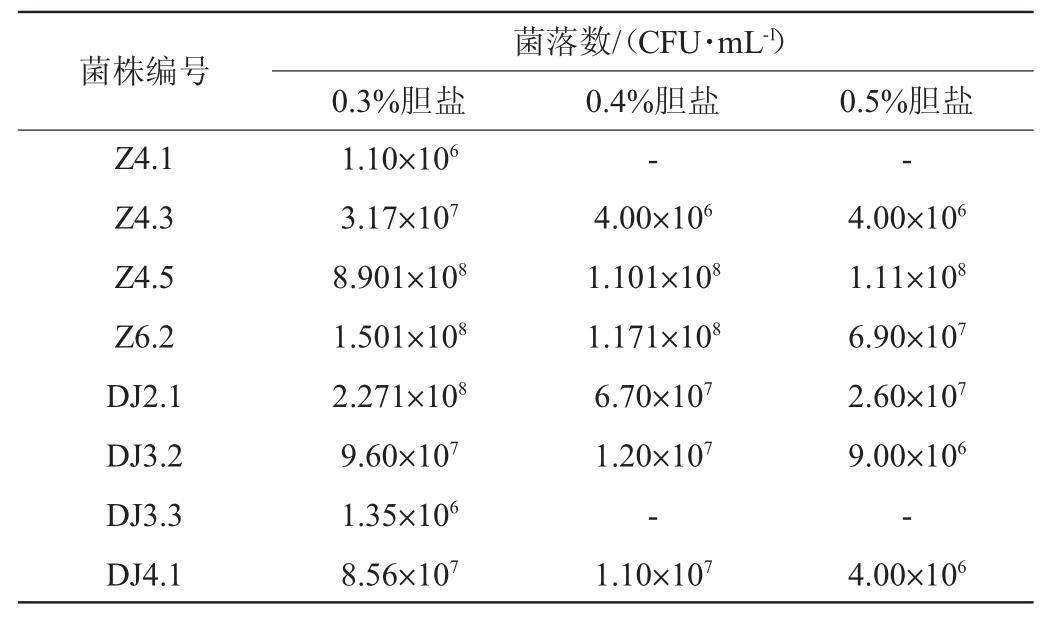
2.2.3 模拟人体胃液耐受性
由图3a可知,乳酸菌进入pH 3.0的模拟人体胃液中3 h后,6株乳酸菌的活菌数均>106 CFU/mL,说明6株乳酸菌均对模拟人体胃液具有耐受性,能够在人体消化吸收食物的3 h之内发挥一定的益生效用。其中菌株DJ2.1、DJ4.1的存活率较高,分别为125%和260%,说明这两株菌不仅能够适应人体胃液环境,且能很好地生长繁殖。由此可知,6株乳酸菌均能适应胃液环境发挥益生作用。
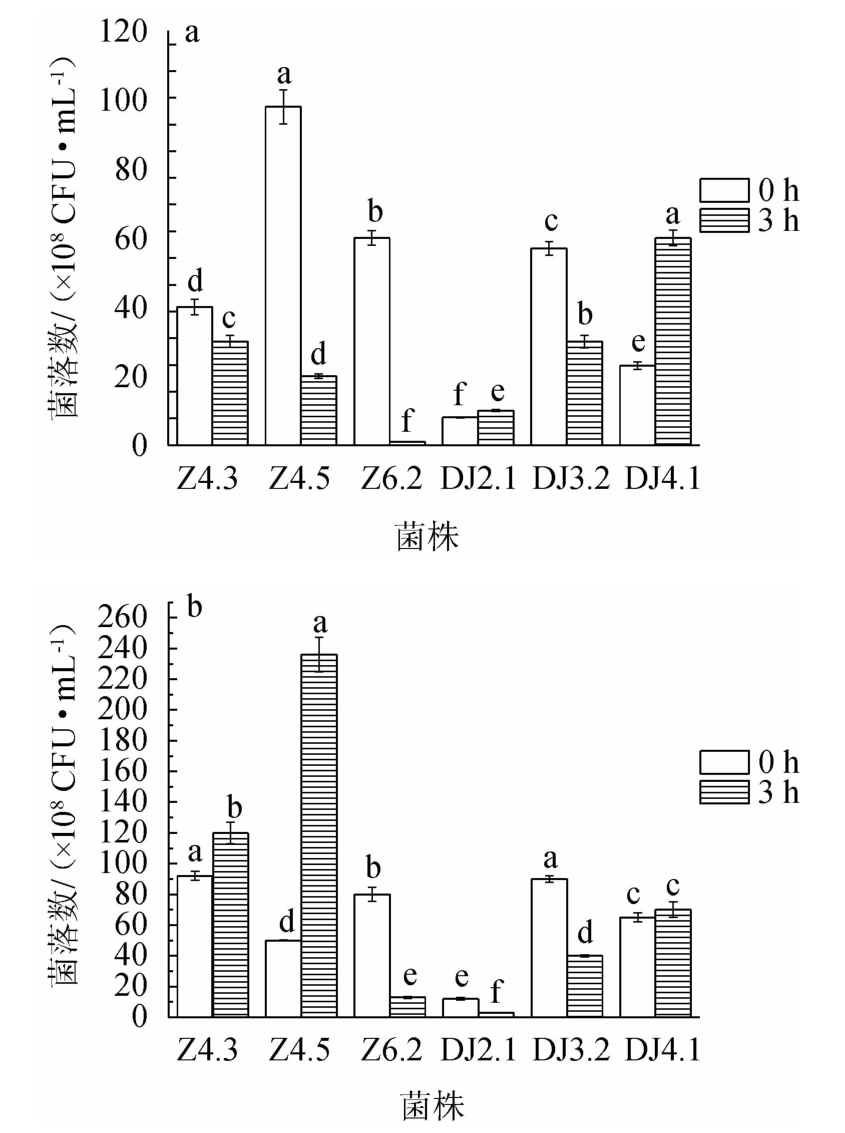
图3 模拟人体胃液(a)及肠液(b)中乳酸菌的活菌数
Fig.3 Viable bacteria count of lactic acid bacteria in simulated human gastric fluid (a) and intestinal fluid (b)
组间不同小写字母代表存在显著性差异(P<0.05)。下同。
由图3b可知,6株菌在模拟人体肠液中反应3 h后,菌株Z4.3、Z4.5、DJ4.1活菌数增加,分别达到1.20×1010 CFU/mL、2.36×1010 CFU/mL、7.00×109 CFU/mL,存活率均>100%,可以在模拟人体肠液中正常生长。菌株Z6.2、DJ2.1、DJ3.2活菌数减少,存活率<50%,但3 h后活菌数均>106 CFU/mL,在人体肠道中也能起到一定的有益作用。由此可知,6株乳酸菌均能适应肠液环境发挥益生作用。
2.3 乳酸菌的体外黏附能力
2.3.1 疏水性
乳酸菌的疏水性是指乳酸菌脱离水相黏附于其他有机相的能力,疏水性越强的乳酸菌越容易黏附于人体胃肠道的上皮细胞上,生成生物膜保护层,起到预防和治疗的益生作用[26]。由图4可知,菌株Z4.5、DJ3.2、DJ4.1对各种有机溶剂的疏水性整体优于其他菌株。菌株Z4.5对乙酸乙酯的疏水性为58.38%,优于对其他溶剂的疏水性。菌株DJ3.2对正己烷(56.57%)、二氯甲烷(64.62%)、乙酸乙酯(53.02%)的疏水性均>50%,有较高疏水性。菌株DJ4.1对二氯甲烷(62.69%)、乙酸乙酯(55.72%)、三氯甲烷(64.28%)的疏水性高于其他菌株。由此可知,菌株Z4.5、DJ3.2、DJ4.1的疏水性较佳。

图4 乳酸菌的疏水性实验结果
Fig.4 Hydrophobicity tests results of lactic acid bacteria
2.3.2 自凝聚性
自凝聚性是乳酸菌之间聚集在一起,有利于在恶劣环境中形成竞争优势的一种性质[27]。由图5可知,6株菌的自凝聚率相差不大,菌株DJ3.2、DJ4.1的自凝聚率>25%,菌株Z4.3、Z4.5、Z6.2的自凝聚率为20%~25%,菌株DJ2.1自凝聚率<20%,由此可知,菌株DJ3.2、DJ4.1自凝聚性表现良好。
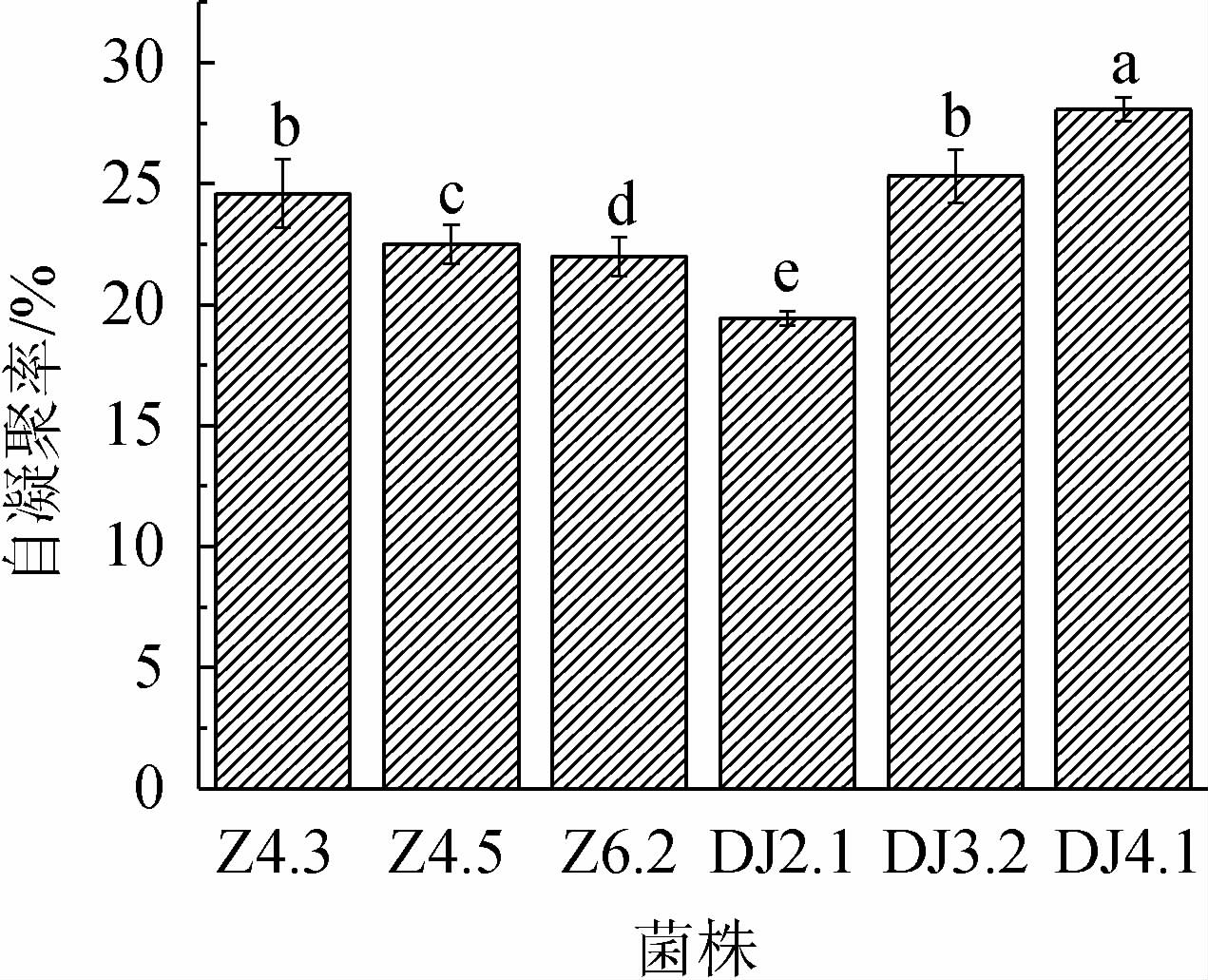
图5 乳酸菌的自凝聚性实验结果
Fig.5 Auto-aggregation test results of lactic acid bacteria
2.4 乳酸菌的抗氧化活性评价
乳酸菌的抗氧化活性可预防人体胃肠道微生物群恶化导致的胃肠道疾病,引起应激性损伤,是评估乳酸菌益生特性的重要指标[28]。
2.4.1 还原能力
乳酸菌具有一定的还原能力,可在一定程度上抵御活性氧的伤害[29]。由图6可知,菌株Z4.3、Z4.5、Z6.2的还原能力分别为40.21%、36.08%、39.18%,强于菌株DJ2.1(20.90%)、DJ3.2(25.77%)、DJ4.1(25.77%)的还原能力。由此可知,菌株Z4.3、Z4.5、Z6.2还原能力较优。
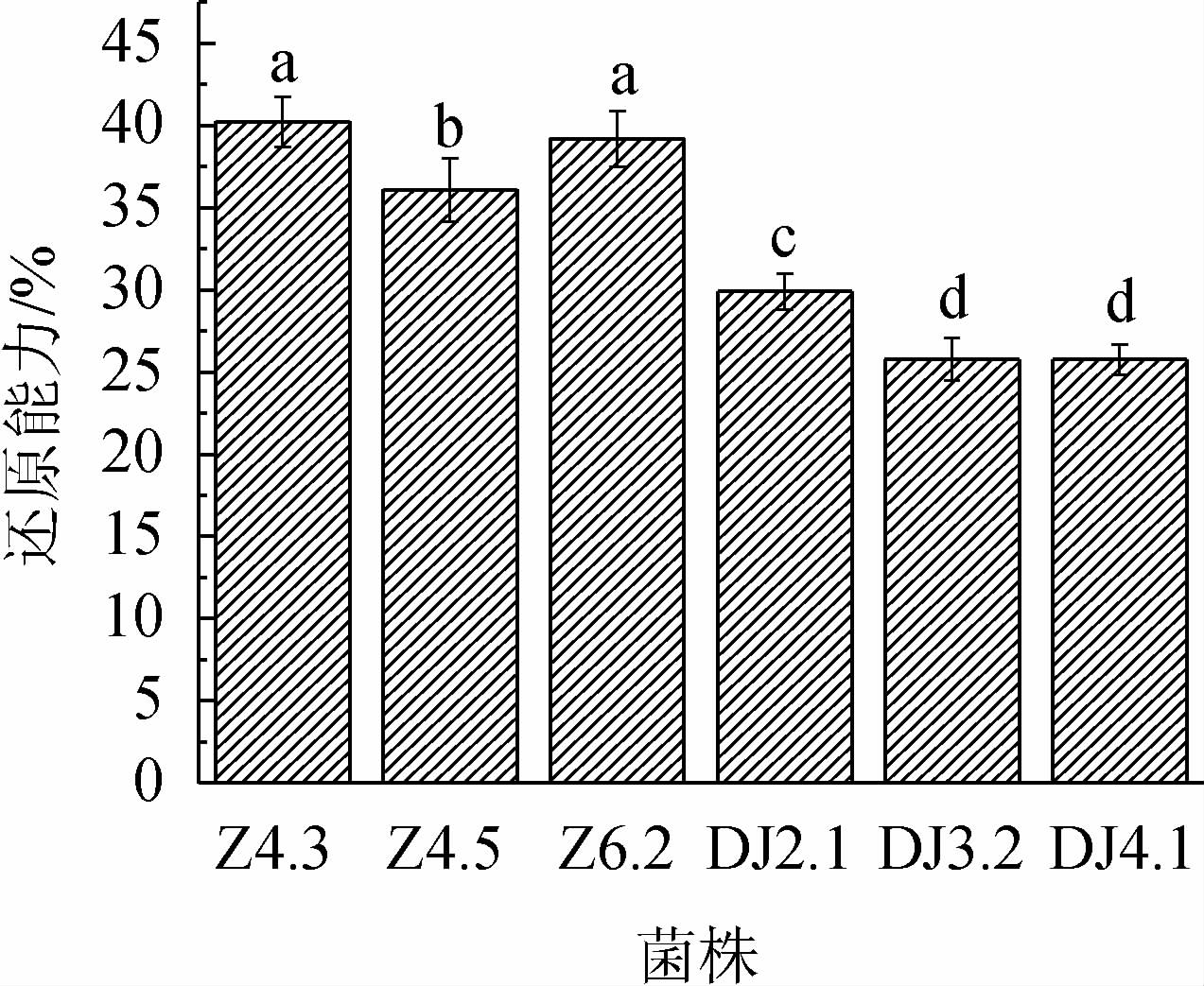
图6 乳酸菌还原能力测定结果
Fig.6 Determination results of reducing ability of lactic acid bacteria
2.4.2 DPPH自由基清除能力
体内存在大量自由基未被清除可能会引起氧化应激反应,会导致蛋白质、DNA、多糖等化合物的损伤[30]。
由图7可知,6株乳酸菌对DPPH自由基的清除率均>50%,其中,菌株Z6.2、DJ4.1的DPPH自由基清除率较高,分别达到70.91%和79.39%,由此可知,菌株Z6.2、DJ4.1的DPPH自由基清除能力较强。
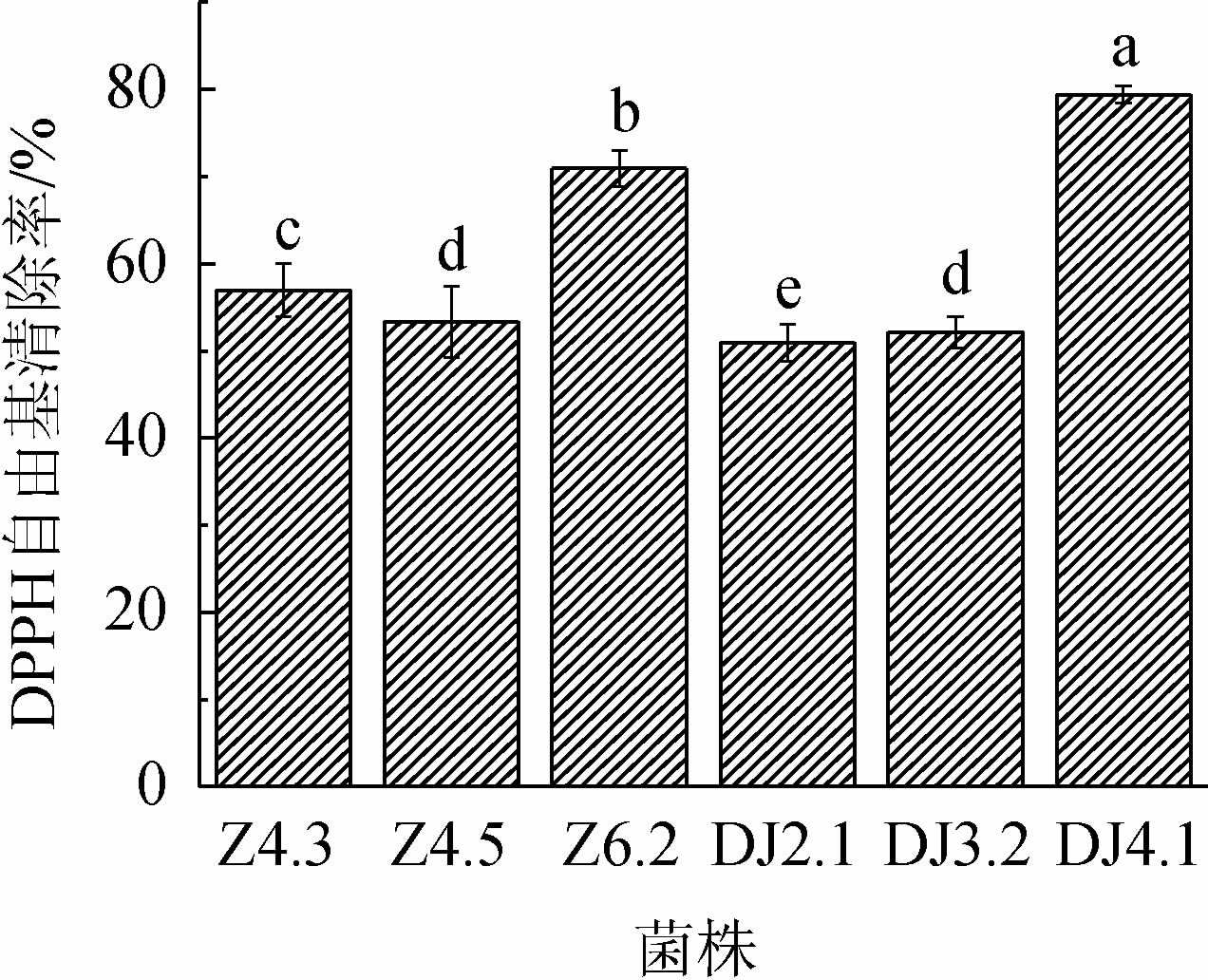
图7 乳酸菌对DPPH自由基清除能力测定结果
Fig.7 Determination results of DPPH radical scavenging ability of lactic acid bacteria
2.5 乳酸菌的抗菌活性
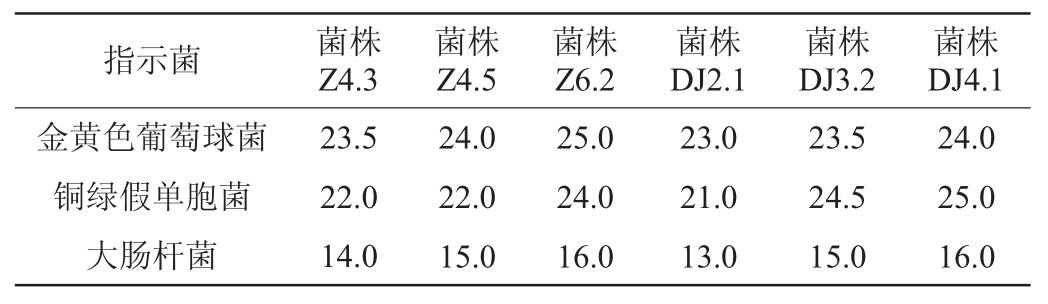
由表3可知,6株菌对金黄色葡萄球菌和铜绿假单胞菌的抗菌活性均极强,其中,菌株Z4.5、Z6.2、DJ4.1对金黄色葡萄球菌抑菌圈分别达到24.0 mm、25.0 mm、24.0 mm;菌株Z6.2、DJ3.2、DJ4.1对铜绿假单胞菌的抑菌圈分别达到24.0 mm、24.5 mm和25.0 mm。菌株Z6.2、DJ4.1对大肠杆菌的抑菌圈直径均为16.0 mm。综上可知,菌株Z6.2、DJ4.1对这3种病原菌的抗菌效果较佳。
表3 乳酸菌对3种病原指示菌的抑菌活性测定结果
Table 3 Determination results of antibacterial activities of lactic acid bacteria against 3 pathogenic indicator bacteria mm
2.6 乳酸菌的安全性评价
乳酸菌进入人体的安全性是益生菌应用的一大重要问题[31]。由于抗生素的使用不当,越来越多的乳酸菌具有耐药性,乳酸菌的耐药性基因进入人体后会使原本敏感的菌表现出耐药表型,甚至出现耐药致病菌,危害人体健康[32]。由表4可知,菌株Z6.2和DJ4.1均对四环素、氨苄西林、氯霉素和红霉素高度敏感。菌株Z6.2对卡那霉素、头孢曲松中度敏感;菌株DJ4.1对头孢噻肟中度敏感。菌株Z6.2、DJ4.1均对万古霉素、庆大霉素、链霉素、环丙沙星和青霉素耐药。有研究显示,很多乳酸菌对链霉素、万古霉素等抗生素的耐药性不会转移给致病菌[33]。综上,菌株Z6.2、DJ4.1对四环素、氨苄西林、氯霉素和红霉素敏感,可被这几种抗生素药物抑制,且对链霉素、万古霉素等的耐药基因不会转移给致病菌,进入人体具有一定安全性。
表4 乳酸菌的抗生素敏感性
Table 4 Antibiotic sensitivity of lactic acid bacteria
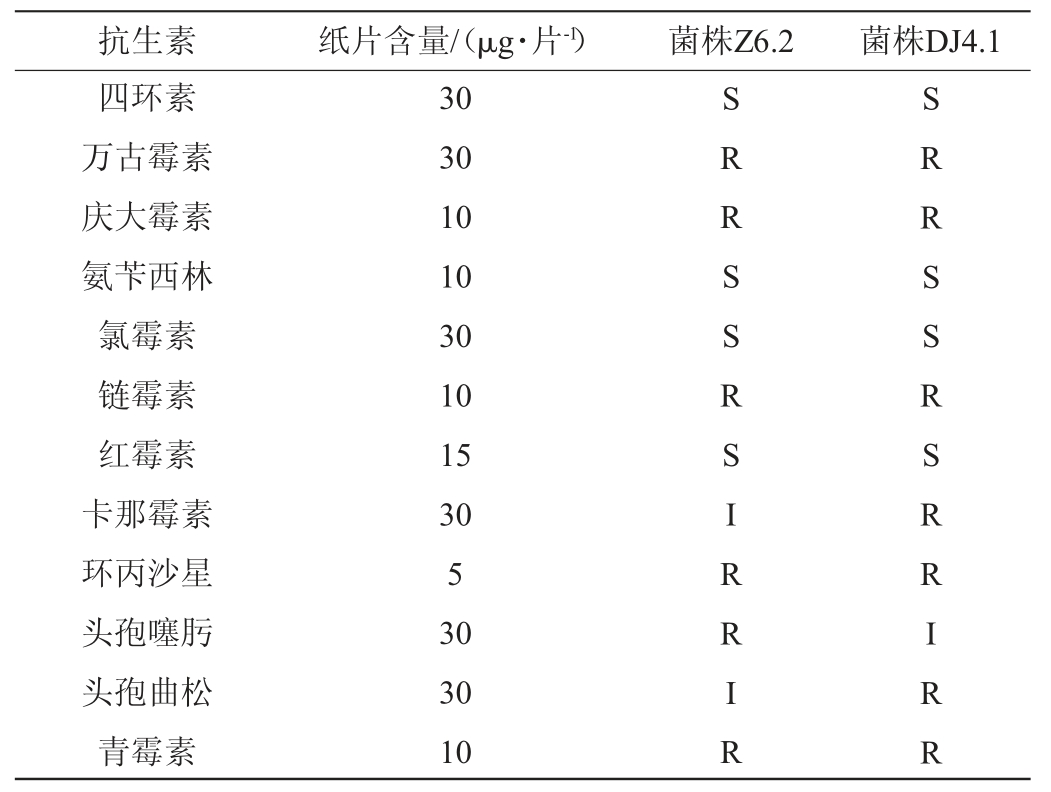
注:“S”表示高度敏感,“I”表示中度敏感,“R”表示耐药。
综合考虑,除菌株Z4.1和DJ3.3外,其余6株菌均可耐受pH 3.0和0.5%胆盐,在模拟人体胃液、肠液中处理3 h后,其活菌数均>106 CFU/mL;其中,菌株DJ4.1具有较高的疏水性、自凝聚性和一定的抗氧化能力,DPPH自由基清除能力最高(79.39%);菌株DJ4.1对3种病原指示菌的抑菌活性具有较强的抑菌效果,且对4种抗生素高度敏感。
3 结论
本研究从酱香型白酒酒醅中筛选出了8株乳酸菌,经鉴定,6株菌(编号为Z4.1、Z4.3、Z4.5、Z6.2、DJ2.1、DJ4.1)为植物乳杆菌(Lactobacillus plantarum)、1株菌(编号为DJ3.3)为弯曲乳杆菌(Lactobacillus curvatus)、1株菌(编号为DJ3.2)为绿色魏斯氏菌(Weissella viridescens)。其中,除菌株Z4.1和DJ3.3外,其余6株菌均可耐受pH 3.0和0.5%胆盐,在模拟人体胃、肠液中处理3 h后存活率较高;其中,菌株DJ4.1具有较高的疏水性和自凝聚性,还原能力和DPPH清除能力较强,对金黄色葡萄球菌、铜绿假单胞菌、大肠杆菌的抗菌效果较好,对四环素、氨苄西林、氯霉素和红霉素高度敏感,具有一定安全性。因此,菌株DJ4.1可作为潜在益生乳酸菌研发。
[1]LANGA S,ARQUÉS J L,MEDINA M,et al.Coproduction of colicin V and lactic acid bacteria bacteriocins in Lactococci and Enterococci strains of biotechnological interest[J].J Appl Microbiol,2017,122(5): 1159-1167.
[2]FENG T,WANG J.Oxidative stress tolerance and antioxidant capacity of lactic acid bacteria as probiotic: a systematic review[J].Gut Microbes,2020,12(1):1801944.
[3]DAVIS E C,WANG M,DONOVAN S M.The role of early life nutrition in the establishment of gastrointestinal microbial composition and function[J].Gut Microbes,2017,8(2):143-171.
[4]伊力夏提·艾热提,李伟,徐杨林,等.传统发酵酸凝硬质奶酪中乳酸菌的分离鉴定及其体外益生特性[J].新疆农业科学,2022,59(6):1491-1501.
[5]汪攀,易敢峰,朱胜男,等.植物乳杆菌FJR分离鉴定及益生特性研究[J].中国畜牧杂志,2022,11(5):1-9.
[6]唐丽云,朱孟江.酱香型白酒生产工艺及关键工艺原理简述[J].中国食品工业,2022(9):101-104.
[7]敞颜,赵辉,凌宏志.传统白酒发酵微生物的研究进展[J].食品工业科技,2010,31(9):425-427,431.
[8]赵皓静,冯婧煕,王晓丹,等.一株耐酸乳杆菌Lactobacillus acetotolerans FBKL1.0204的筛选鉴定及耐酸、产酸特性[J].食品与发酵工业,2022,48(19):50-57.
[9]李霄霄.酱香型白酒中乳酸菌的分离及代谢特性研究[D].天津:天津科技大学,2021.
[10]BUCHANAN R E,GIBBONS N E.伯杰细菌鉴定手册[M].北京:科学出版社,1995:254-259.
[11]张兴吉,葛武鹏,刘阳,等.西部传统发酵乳品中乳酸菌筛分及其亚硝酸盐降解能力[J].食品科学,2018,39(14):199-205.
[12]杨珍珠,潘秭琪,迟海,等.羊奶源产细菌素乳酸菌筛选、鉴定及益生特性研究[J].中国食品学报,2021,21(11):71-77.
[13]SON S H,JEON H L,JEON E B,et al.Potential probiotic Lactobacillus plantarum Ln4 from kimchi: evaluation of β-galactosidase and antioxidant activities[J].LWT-Food Sci Technol,2017,85:181-186.
[14]MALLAPPA R H,SINGH D K,ROKANA N,et al.Screening and selec-tion of probiotic Lactobacillus strains of Indian gut origin based on assessment of desired probiotic attributes combined with principal component and heatmap analysis[J].LWT-Food Sci Technol,2019,105:272-281.
[15]杨静秋.抗氧化乳酸菌的筛选及其对氧化损伤的CT-26细胞的保护作用[D].无锡:江南大学,2009.
[16]SZABO M,IDIT,OIU C,CHAMBRE D,et al.Improved DPPH determination for antioxidant activity spectrophotometric assay[J].Chem Pap,2007,61(3):87-91.
[17]彭倩楠.海南传统发酵食品中益生乳杆菌的筛选及其对高脂血症预防机制研究[D].海口:海南大学,2019.
[18]张开屏,马牧然,曹凯慧,等.肉源乳酸菌抑菌特性分析[J].食品工业科技,2020,41(23):71-77.
[19]秦楠,杨金梅,梁莹支,等.解淀粉芽孢杆菌HRH317菌株抗菌肽发酵条件优化及其抑菌活性研究[J].食品安全质量检测学报,2021,12(15):6169-6176.
[20]GUNYAKTI A,ASAN-OZUSAGLAM M. Lactobacillus gasseri from human milk with probiotic potential and some technological properties[J].LWT-Food Sci Technol,2019,109:261-269.
[21]朱文静,陈四清,谢国驷.三种海螵蛸的处理方法及抗菌活性研究[J].中国海洋大学学报(自然科学版),2021,51(12):50-57.
[22]李尧,张羽竹,张利,等.分离自传统自然发酵食品中降胆固醇乳酸菌的筛选与评价[J].中国食品学报,2019,19(6):212-222.
[23]李红霞.牦牛源益生菌的益生潜能研究[D].杨凌:西北农林科技大学,2022.
[24]胡敏.胆盐对植物乳杆菌NCU116应激基因和关键生理指标的影响[D].南昌:南昌大学,2019.
[25]LI M,YANG D B,MEI L,et al.Screening and characterization of purine nucleoside degrading lactic acid bacteria isolated from Chinese sauerkraut and evaluation of the serum uric acid lowering effect in hyperuricemic rats[J].PLoS One,2014,9(9):e105577.
[26]KOS B,ŠUSKOVIC′ J,VUKOVIC′ S,et al.Adhesion and aggregation ability of probiotic strain Lactobacillus acidophilus M92[J].J Appl Microbiol,2003,94(6):981-987.
[27]DE LA FUENTE B,LUZ C,PUCHOL C,et al.Evaluation of fermentation assisted by Lactobacillus brevis POM,and Lactobacillus plantarum(TR-7,TR-71,TR-14) on antioxidant compounds and organic acids of an orange juice-milk based beverage[J].Food Chem,2021,343:128414.
[28]GOH Y J,KLAENHAMER T R.Functional roles of aggregation-promoting-like factor in stress tolerance and adherence of Lactobacillus acidophilus NCFM[J].Appl Environ Microbiol,2010,76(15): 5005-5012.
[29]PERSICHETTI E,DE MICHELE A,CODINI M,et al.Antioxidative capacity of Lactobacillus fermentum LF31 evaluated in vitro by oxygen radical absorbance capacity assay[J].Nutrition,2014,30(7-8):936-938.
[30]赵荣敏.不同益生菌发酵剂对复合果蔬汁品质的影响[J].食品研究与开发,2021,42(9):144-150.
[31]SANDERS M E,AKKERMANS L M A,HALLER D,et al.Safety assessment of probiotics for human use[J].Gut Microbes,2010,1(3):164-185.
[32]许女,贾瑞娟,李雅茹,等.老陈醋来源乳酸菌的益生特性筛选及安全评价[J].中国食品学报,2020,20(10):23-33.
[33]宋晓敏,李少英,马春艳,等.发酵食品中乳酸菌的耐药性现状分析[J].微生物学通报,2015,42(1):207-213.