谷氨酸棒杆菌(Corynebacterium glutamate)是一种革兰氏阳性菌,兼性厌氧、无芽孢,具有生长速度快、无致病性等特点[1-3]。菌株自1957年鉴定以来,被广泛用于各种L-氨基酸的大规模生产,如L-谷氨酸、L-赖氨酸、L-丝氨酸、L-苏氨酸等[4-9]。据统计每年用谷氨酸棒杆菌生产L-谷氨酸和L-赖氨酸等氨基酸产品超过600万t,其中L-谷氨酸的年产量高达300 t以上,其仍是目前市场需求量最大的氨基酸[10-12]。在我国,谷氨酸最初采用水解法和化学合成法进行生产,但由于这两种方法存在消耗大、成本高、产量低及设备腐蚀严重等问题,很快就被简单方便的微生物发酵法取而代之[13-14]。如今利用微生物法发酵生产谷氨酸已成为主流,且形成了多种生产谷氨酸的发酵工艺。因此在微生物发酵中,合适的发酵培养基和发酵工艺是提高菌株产酸的关键因素。FAHIMITABAR A等[15]利用响应面法优化发酵谷氨酸的培养基组分和培养条件,在最优的发酵工艺条件下,谷氨酸产量为19.84 mg/mL。基于谷氨酸棒杆菌的营养需求,ALHARBI N S等[16]对碳源(葡萄糖、果糖、乳糖等)和氮源(硫酸铵、大豆粉、尿素等)进行筛选,并通过响应面优化,得到谷氨酸最高产量为16.86 g/L。在生产过程中,主要在发酵的某些阶段连续或间歇地补加一定的物料,以此延长菌株的生长和代谢产物的生产时间。然而在发酵过程中,摇瓶因无法流加补料而不能满足菌株后期的生长需要,所以常使用补料分批发酵(流加培养)的方法调节或维持发酵环境中的营养浓度。陈百莹等[17]在研究植物乳杆菌(Lactobacillus plantarum)ZJ316高密度发酵时,为了维持细胞的生长繁殖,采用了间歇分批补料的方法补充碳源,使菌落总数达9.28×109 CFU/mL,比未加补料组提高了70.23%。
本研究以谷氨酸产量为主要评价指标,利用单因素试验和响应面法对谷氨酸棒杆菌(Corynebacterium glutamicum)P169的发酵工艺进行优化,以获得最佳发酵工艺条件,并基于优化的培养基,进行摇瓶和20 L发酵罐分批补料发酵验证,以期为提高谷氨酸产量和促进菌株生长提供一种有效解决策略。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
谷氨酸棒杆菌(Corynebacterium glutamicum)P169:分离自土壤,保藏于湖北工业大学发酵工程教育部重点实验室。
1.1.2 试剂
葡萄糖、乳糖、蔗糖、尿素、鱼粉、琥珀酸、磷酸氢二钾、硫酸镁、硫酸锰、磷酸二氢钾(均为分析纯):国药集团化学试剂有限公司;果糖(分析纯):麦克林生化科技有限公司;麦芽糖(分析纯):上海伯奥生物科技有限公司;酵母浸膏、胰蛋白胨、牛肉膏(均为生化试剂):北京双旋微生物培养基制品厂;酵母粉、蛋白胨(均为生化试剂):安琪酵母股份有限公司;玉米浆(45%):华中农业大学绿康生物工程研究所;维生素B1(分析纯):上海源叶生物科技有限公司;蛋氨酸(纯度≥99%)、生物素(纯度>99%):广州赛国生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
斜面培养基[18]:葡萄糖10.0 g/L,酵母粉10.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L。pH 7.0,115 ℃灭菌20 min。
种子培养基[18]:葡萄糖20.0 g/L,磷酸二氢钾1.5 g/L,硫酸镁0.6 g/L,玉米浆3.0 g/L,尿素3.0 g/L,硫酸锰4×10-3 g/L,硫酸亚铁4×10-3 g/L。pH 7.0,115 ℃灭菌20 min。
基础发酵培养基[19]:葡萄糖20.0 g/L,尿素10.0 g/L,蛋白胨20.0 g/L,琥珀酸1.0 g/L,硫酸镁0.4 g/L,蛋氨酸0.5 g/L,磷酸氢二钾2.4 g/L,生物素3×10-4 g/L,维生素B1 2×10-4 g/L,硫酸锰1×10-2 g/L。pH 7.0,115 ℃灭菌20 min。
1.2 仪器与设备
S-10型生物传感器分析仪:深圳西尔曼生物科技有限公司;V-1300型可见分光光度计:美析仪器(上海)有限公司;FE28型酸度计:上海梅特勒-托利多仪器有限公司:20 L发酵罐:上海保兴生化设备有限公司;HNY-211B型恒温培养振荡器:天津市欧诺仪器仪表有限公司;YXQ-LS-75S11型立式压力蒸汽灭菌器:博迅实业有限公司(上海)医疗设备。
1.3 方法
1.3.1 谷氨酸棒杆菌P169的培养
斜面培养:将谷氨酸棒杆菌(Corynebacterium glutamicum)P169接种于斜面培养基上,于恒温培养箱中30 ℃培养24~48 h后保藏于4 ℃冰箱备用。
摇瓶培养:将保藏于4 ℃冰箱的斜面用无菌牙签接入装有5 mL种子培养基的50 mL西林瓶中,32 ℃、200 r/min活化24 h,然后取1 mL转接到装有50 mL种子培养基的250 mL摇瓶中继续活化12 h后,按2%(V/V)接种量接入含50 mL发酵培养基的250 mL摇瓶中,32 ℃、200 r/min发酵培养36 h。
1.3.2 谷氨酸棒杆菌P169产谷氨酸发酵条件优化单因素试验
在基础发酵培养基基础上,依次考察碳源种类(葡萄糖、麦芽糖、果糖、乳糖和蔗糖)、无机氮源种类(尿素、硝酸钾、硝酸铵、硫酸铵、碳酸氢铵和柠檬酸铵)、有机氮源种类(蛋白胨、酵母粉、牛肉膏、胰蛋白胨和酵母浸膏)、葡萄糖添加量(5 g/L、10 g/L、15 g/L、20 g/L、25 g/L、30 g/L、35 g/L)、尿素添加量(4 g/L、6 g/L、8 g/L、10 g/L、12 g/L、14 g/L、16 g/L)、酵母粉添加量(20 g/L、25 g/L、30 g/L、35 g/L、40 g/L、45 g/L、50 g/L)、生物素添加量(10 mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70 mg/L)、初始pH(6.0、6.5、7.0、7.5、8.0、8.5、9.0)、接种量(1%、2%、3%、4%、5%、6%、7%)对谷氨酸棒杆菌P169产谷氨酸及OD600nm值的影响。
1.3.3 谷氨酸棒杆菌P169产谷氨酸发酵条件优化响应面试验
在单因素试验的基础上,选取对结果影响较大的酵母粉(A)、葡萄糖(B)、尿素(C)和初始pH(D)为考察因素,谷氨酸含量(Y)为响应值,采用Design-Expert 10.0.7软件设计4因素3水平的响应面试验。
1.3.4 20 L发酵罐分批补料发酵
通过三级发酵工艺,经摇瓶活化至对数期(OD600nm值≈18)的谷氨酸棒杆菌P169按2%(V/V)的接种量接入二级种子罐(装液量为200 mL),然后将二级种子罐于摇床32 ℃、200 r/min继续活化12 h至对数期,再以10%(V/V)的接种量从二级种子罐接入20 L发酵罐(装液量为12 L),发酵周期为48 h。发酵罐分批补料参数控制为:罐压维持0.030~0.035 MPa,初始空气流量1.2~1.3 L/min,初始pH 6.5~7.0,补料时通过流加氨水维持pH 7.2~7.5,搅拌转速100~500 r/min,溶氧量设为20%并与搅拌偶联,发酵8 h后通过流加500 g/L的葡萄糖控制发酵过程中葡萄糖的终质量浓度维持在1.0~3.0 g/L。前期温度维持32 ℃,发酵到后期(44 h)升温至37 ℃诱导谷氨酸分泌,发酵结束前2~3 h停止补料,待残糖耗尽时发酵结束。在发酵期间每隔4 h取一次样,分别测定OD600nm值、谷氨酸含量和残糖量[20]。优化前后的发酵培养基分别进行20 L发酵罐分批补料发酵时,均采用上述的发酵工艺。
1.3.5 分析测定
谷氨酸和葡萄糖含量的测定:采用S-10型生物传感器分析仪[21]。OD600nm值的测定:取1 mL发酵液于离心管中,12 000 r/min离心5 min,去上清后,用无菌水稀释至合适倍数,采用可见分光光度计法,在波长600 nm条件下测定吸收光度值[19]。pH值测定:采用FE28型酸度计[15]。
1.3.6 数据处理与分析
每组试验做三组平行,采用GraphPad Prism8.0.1软件进行图表绘制,使用SPSS 23.0软件进行显著性分析,并通过Design-Expert 10.0.7系统软件进行响应面优化分析。
2 结果与分析
2.1 谷氨酸棒杆菌P169产谷氨酸发酵条件优化单因素试验
2.1.1 碳源种类的筛选结果
碳源是促进细胞生长和代谢的主要营养物质,与菌株生长和代谢产物积累直接相关[22]。不同种类的碳源对谷氨酸棒杆菌P169生长及谷氨酸产量的影响见图1。由图1可知,谷氨酸棒杆菌P169可以利用多种碳源,以葡萄糖为单一碳源时,谷氨酸产量最高达到9.0 g/L,显著高于其他碳源(P<0.05)。从生长量看,以蔗糖为单一碳源时,OD600nm值显著高于其他碳源(P<0.05),葡萄糖次之。因此,确定葡萄糖为谷氨酸棒杆菌P169产谷氨酸的最佳碳源,这与ALHARBI N S等[16]的研究结果一致。
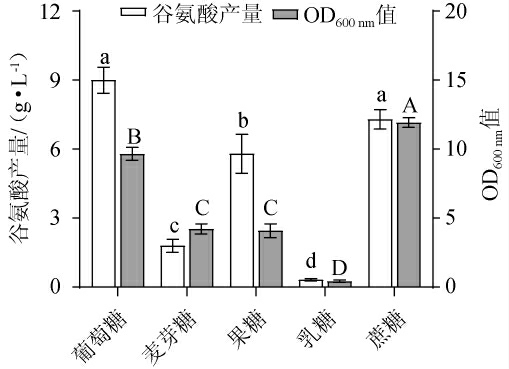
图1 碳源对谷氨酸棒杆菌P169 OD600nm值及谷氨酸产量的影响
Fig.1 Effect of carbon sources on OD600nm value and glutamate production of Corynebacterium glutamicum P169
不同小写字母表示各组谷氨酸产量差异显著(P<0.05),不同大写字母表示各组OD600nm值差异显著(P<0.05)。下同。
2.1.2 氮源种类的筛选结果
氮源分为无机氮源和有机氮源,是促进菌体合成蛋白质、核酸和谷氨酸的原料[23]。在微生物发酵过程中,无机氮源可以调节发酵环境的pH值和满足菌体的代谢生长;微生物则可以直接利用有机氮源的游离氨基酸、蛋白质或肽类等小分子物质,用于合成代谢产物[24]。不同氮源对谷氨酸棒杆菌P169生长及谷氨酸产量的影响见图2。由图2a可知,不同种类的无机氮源对谷氨酸棒杆菌P169的谷氨酸产量和生长均有影响,当以尿素为单一无机氮源时,谷氨酸产量和OD600nm值均显著高于其他组别(P<0.05),分别为11.0 g/L和11.7,ALHARBI N S等[16]研究发现,尿素是高效合成谷氨酸的最佳氮源,本研究与其结果一致,因此确定尿素为谷氨酸棒杆菌P169产谷氨酸的最佳无机氮源。发酵过程中,无机氮和有机氮总是配合着发挥作用[25],由图2b可知,在确定尿素作为无机氮源后,当以酵母粉为单一有机氮源时,谷氨酸产量显著高于其他组(P<0.05),为14.2 g/L,酵母粉属于速效氮源富含丰富的氨基酸、核酸等营养,可以直接参与细胞体内转氨脱氨作用[26],更加适合谷氨酸棒杆菌合成谷氨酸,因此,确定酵母粉为谷氨酸棒杆菌P169产谷氨酸的最佳有机氮源。
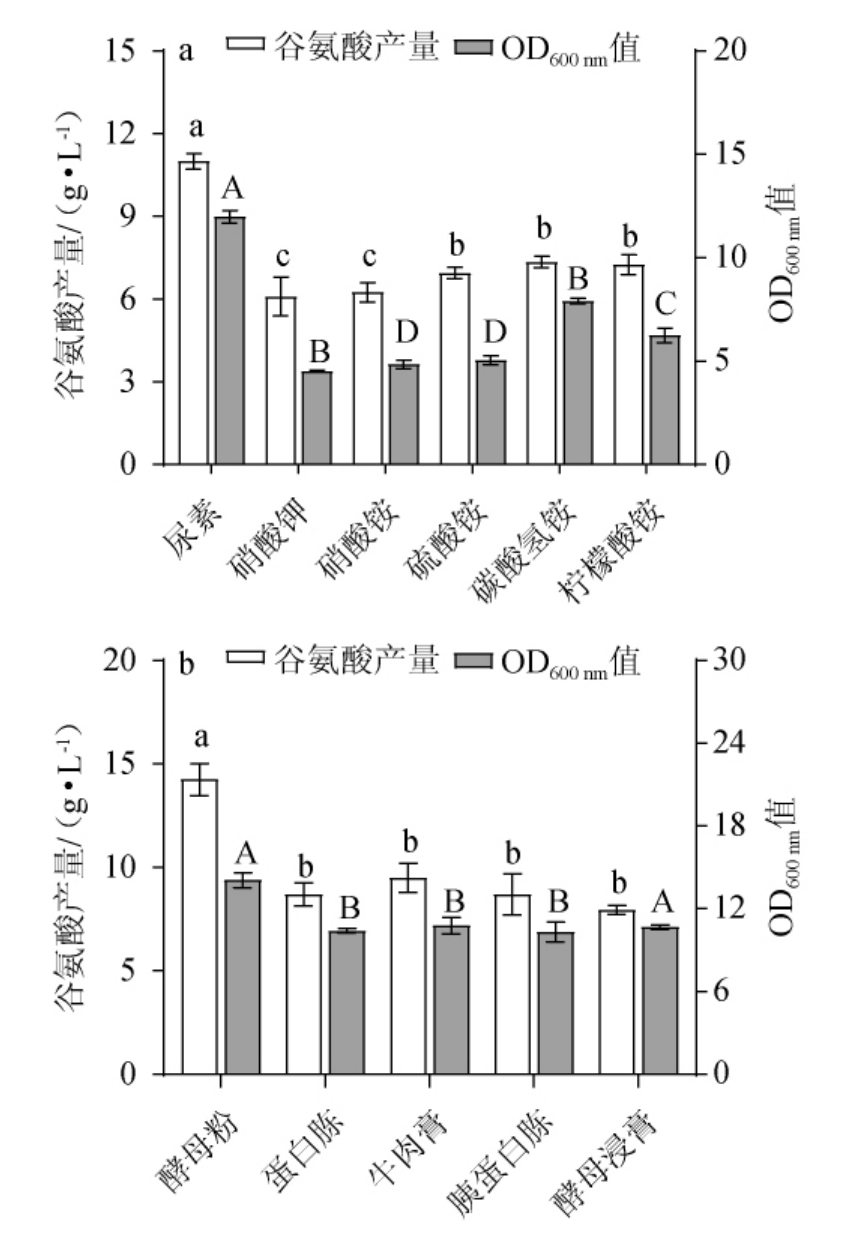
图2 无机氮(a)和有机氮(b)对谷氨酸棒杆菌P169 OD600nm值及谷氨酸产量的影响
Fig.2 Effect of inorganic (a) and organic (b) nitrogen on OD600nm value and glutamate production of Corynebacterium glutamicum P169
2.1.3 葡萄糖添加量的确定
由图3可知,随着葡萄糖添加量的增加,谷氨酸产量及OD600nm值均呈先升高后下降的趋势,当葡萄糖添加量为25 g/L时,谷氨酸产量及OD600nm值均达到最高,分别为14.5 g/L和18.8,分析原因可能是由于在此条件下,糖能补充充足的碳源,使菌株的产物代谢速度加快[27]。当葡萄糖添加量为5~25 g/L时,由于碳源不足,使菌株的正常生长受到抑制,产酸能力显著下降;当葡萄糖添加量>25 g/L之后,因糖浓度过高,渗透压增大,不仅会抑制菌体生长,也会导致谷氨酸产量降低[18]。因此,确定最佳葡萄糖添加量为25 g/L。
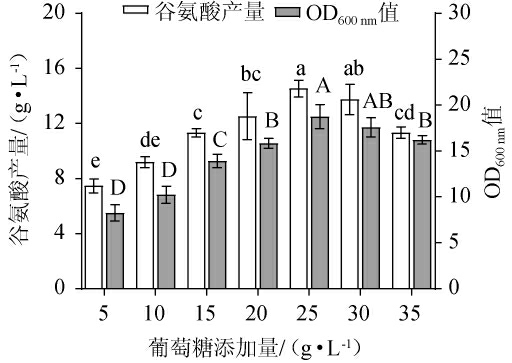
图3 葡萄糖添加量对谷氨酸棒杆菌P169 OD600nm值及谷氨酸产量的影响
Fig.3 Effect of glucose addition on OD600nm value and glutamate production of Corynebacterium glutamicum P169
2.1.4 尿素添加量的确定
由图4可知,随着尿素添加量的增加,谷氨酸产量及OD600nm值均呈先升高后下降的趋势,当尿素添加量为12 g/L时,谷氨酸产量及OD600nm值均达到最高,分别为15.0 g/L和19.7,说明适量的尿素添加量不仅促进菌株生长,且能使菌株更好地积累谷氨酸产量。当尿素添加量为4~12 g/L时,谷氨酸棒杆菌P169会因氮源不足而使谷氨酸产量降低;当尿素添加量>12 g/L之后,由于尿素添加量过高导致对菌体产生一定的毒害,抑制菌体生长,使谷氨酸产量逐渐降低[21]。因此,确定尿素的最佳添加量为12 g/L。
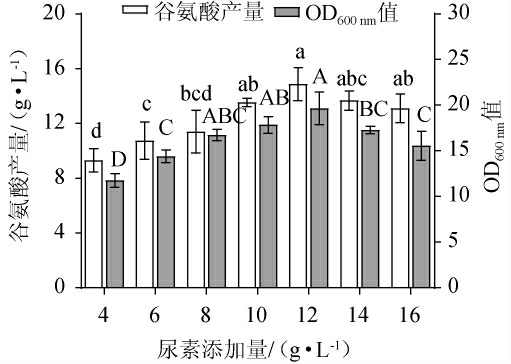
图4 尿素添加量对谷氨酸棒杆菌P169 OD600nm值及谷氨酸产量的影响
Fig.4 Effect of urea addition on OD600nm value and glutamate production of Corynebacterium glutamicum P169
2.1.5 酵母粉添加量的确定
由图5可知,随酵母粉添加量的增加,谷氨酸产量及OD600nm值均呈先升高后下降的趋势,当酵母粉为40 g/L时,谷氨酸产量及OD600nm值均达最高,分别为18.1 g/L和21.7,其原因可能是酵母粉含有丰富的氨基酸、蛋白质、肽等营养物质,能满足谷氨酸生产所需的氮源,适量的添加不仅提高谷氨酸产量同时也加快菌株生长[28]。当酵母粉添加量为20~40g/L时,由于酵母粉营养不能满足菌株的生长需求,使产酸水平较低。但酵母粉添加量>40g/L之后,谷氨酸产量并无明显变化,说明酵母粉的添加量已满足菌体的生长需求,谷氨酸产量趋于稳定。因此,确定最佳酵母粉添加量为40 g/L。
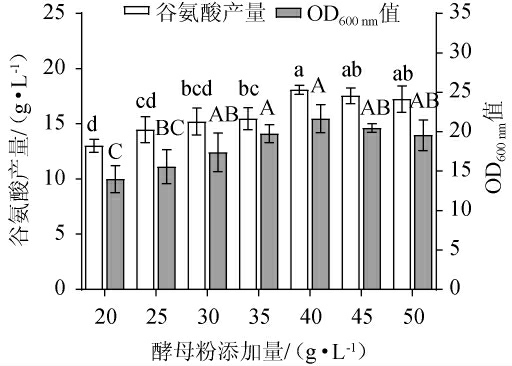
图5 酵母粉添加量对谷氨酸棒杆菌P169 OD600nm值及谷氨酸产量的影响
Fig.5 Effect of yeast powder addition on OD600nm value and glutamate production of Corynebacterium glutamicum P169
2.1.6 生物素添加量的确定
由图6可知,随生物素添加量的增加,谷氨酸产量及OD600nm值均呈先升高后下降的趋势,当生物素添加量为40 mg/L时,谷氨酸产量及OD600nm值均达最高,分别为19.0 g/L和22.1,可能是因为“亚适量”生物素使细胞结构不完整,细胞膜通透性增加,谷氨酸运输蛋白被激活,胞内谷氨酸大量排除[27]。当生物素添加量为10~40 mg/L时,由于生物素不足,菌株生长受到抑制,使谷氨酸产量较低。当生物素添加量>40 mg/L之后,可能是因为生物素过量时,细胞膜结构完整,胞内谷氨酸无法大量排除,导致菌体只会大量繁殖而不产或产少量谷氨酸。因此,确定最佳生物素添加量为40 mg/L。
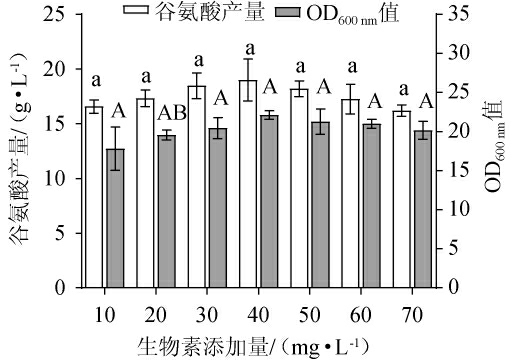
图6 生物素添加量对谷氨酸棒杆菌P169 OD600nm值及谷氨酸产量的影响
Fig.6 Effect of biotin addition on OD600nm value and glutamate production of Corynebacterium glutamicum P169
2.1.7 初始pH值的确定
由图7可知,随初始pH值的增加,谷氨酸产量及OD600nm值均呈先升高后下降的趋势,当初始pH值为6.5时,谷氨酸产量及OD600nm值均达最高,分别为20.0 g/L和22.6,说明初始pH6.5是菌株的最适生产pH。当初始pH为6.0~6.5时,不利于产酸,说明发酵液过酸会严重影响菌体代谢有关酶的活性。而当初始pH值在7.0~8.5时,谷氨酸产量无显著变化,说明初始pH 7.0~8.5对代谢相关酶的活性不产生抑制。在发酵过程中,pH值过高或过低时,代谢相关的酶活性会降低,由于新陈代谢受到阻碍,菌体生长停滞,且细胞膜生物功能会发生改变,影响胞内外物质的进出[21]。因此,确定最佳初始pH值为6.5。
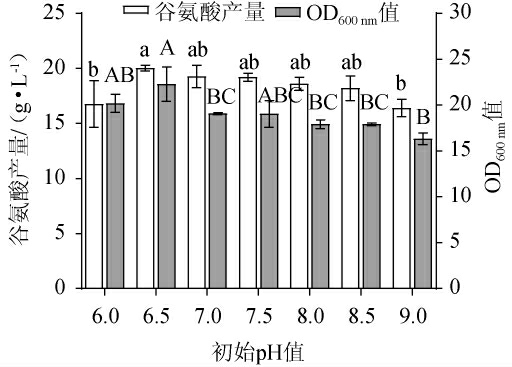
图7 初始pH值对谷氨酸棒杆菌P169 OD600nm值及谷氨酸产量的影响
Fig.7 Effect of initial pH value on OD600nm value and glutamate production of Corynebacterium glutamicum P169
2.1.8 接种量的确定
由图8可知,随接种量的增加,谷氨酸产量及OD600nm值均呈先升高后下降的趋势,当接种量为2%时,谷氨酸产量及OD600nm值均达最高,分别为21.2 g/L和23.3,说明适当的接种量有利于菌株的生长和谷氨酸积累。当接种量为1%~2%时,由于接种量较低,菌株生长的空间相对较大,生长速率慢,谷氨酸代谢产物低。当接种量>2%之后,没有观察到谷氨酸产量的显著变化,这表明接种密度对发酵过程不会产生无限的影响[29]。因此,确定最佳接种量为2%。

图8 接种量对谷氨酸棒杆菌P169 OD600nm值及谷氨酸产量的影响
Fig.8 Effect of inoculum on OD600nm value and glutamate production of Corynebacterium glutamicum P169
2.2 谷氨酸棒杆菌P169产谷氨酸发酵条件优化响应面试验
2.2.1 响应面试验结果与分析
在单因素试验基础上,选取对结果影响较大的因素酵母粉(A)、葡萄糖(B)、尿素(C)、初始pH值(D)为考察对象,以谷氨酸产量(Y)为响应值,采用Design-Expert 10.0.7软件设计4因素3水平的中心组合响应面试验,试验设计及结果见表1,方差分析见表2。
表1 谷氨酸棒杆菌P169产谷氨酸发酵条件优化响应面试验设计及结果
Table 1 Design and results of response surface test for fermentation conditions optimization of glutamate-producing Corynebacterium glutamicum P169
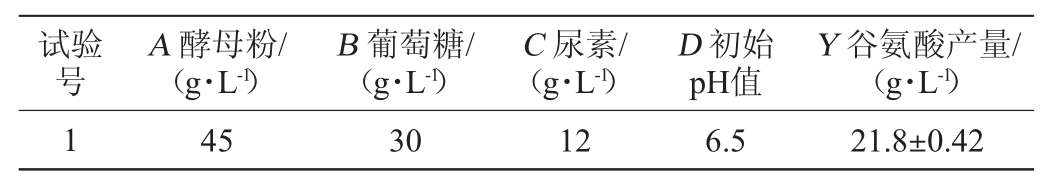
续表
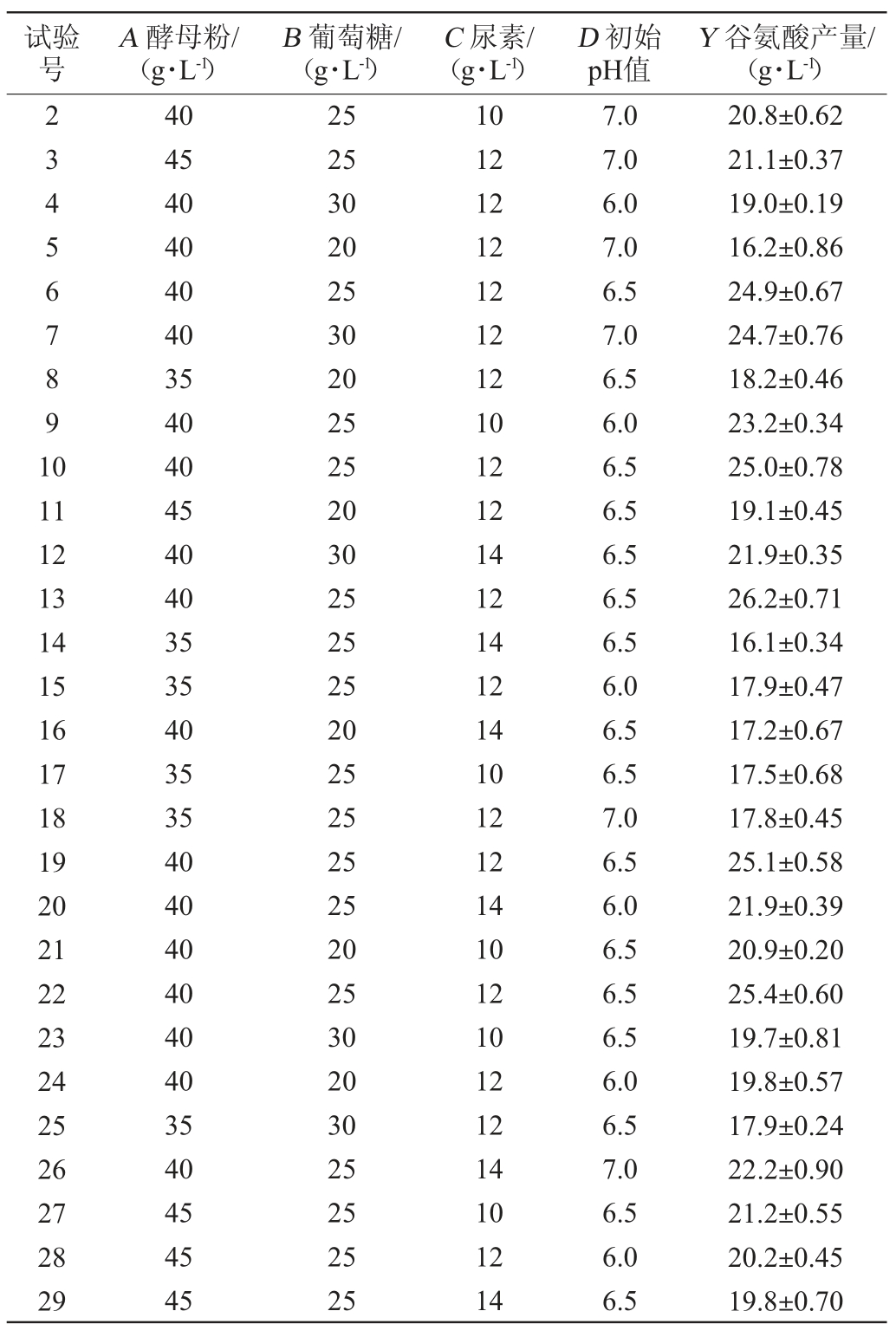
表2 回归模型方差分析
Table 2 Variance analysis of regression model
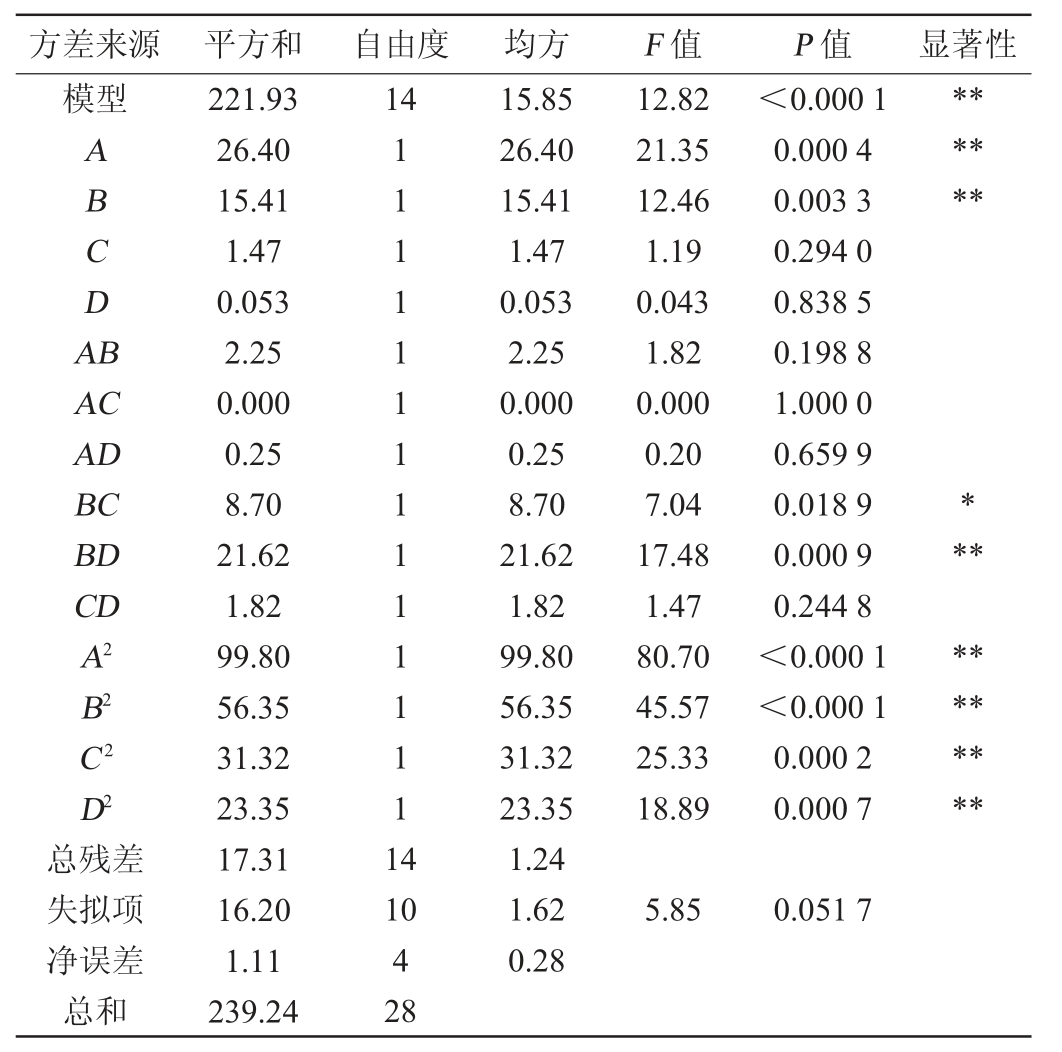
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
采用Design-Expert 10.0.7软件对表1试验结果进行多元二次回归拟合,得到多元二次回归方程:Y=25.32+1.48A+1.13B-0.35C+0.067D+0.75AB+0.25AD+1.47BC+2.33BD+0.67CD-3.92A2-2.95B2-2.2C2-1.9D2。由表2可知,模型极显著(P<0.001),失拟项不显著(P>0.05),说明该模型拟合程度好,可靠性高。模型的决定系数R2为0.927 6,说明回归方程和曲面有较好的拟合,可用于分析和预测谷氨酸产量。由P值可知,一次项A、B、交互项BD及二次项A2、B2、C2、D2对谷氨酸产量影响极显著(P<0.01),交互项BC对谷氨酸含量影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。根据F值可知,4个因素对谷氨酸含量影响的主次顺序为:酵母粉>葡萄糖>尿素>初始pH值,与单因素试验结果保持一致。
2.2.2 各因素间交互作用对谷氨酸含量的影响
利用Design-Expert 10.0.7软件绘制各因素间交互作用对谷氨酸含量影响的响应曲面及等高线图,结果见图9。

图9 各因素间交互作用对谷氨酸产量影响的响应曲面及等高线
Fig.9 Response surface plots and contour lines of effect of interaction between various factors on glutamate production
由图9可知,葡萄糖和尿素及葡萄糖和初始pH值之间的交互作用较强,响应曲面呈凸形,抛物面更陡,等高线呈椭圆形[30-31],这与表4的方差分析结果一致。
2.2.3 响应面优化验证
通过Design-Expert 10.0.7软件对回归方程进行最优求解,得到最优发酵条件为酵母粉41.1 g/L,葡萄糖26.7 g/L,尿素12.1 g/L,初始pH值6.6,谷氨酸产量的预测值为25.7 g/L。为便于实际操作,将最优发酵条件修正为酵母粉41.0 g/L、葡萄糖27.0 g/L、尿素12.0 g/L、初始pH值7.0,在此条件下进行4次验证试验,得到谷氨酸平均产量为25.1 g/L,与预测值较为接近,说明该模型是可靠的。为了将其与未优化的发酵培养基进行比较,在摇瓶条件下,以未优化的基础培养基和发酵工艺为对照组,以响应面优化的培养基和发酵工艺为试验组进行试验。结果表明,试验组的谷氨酸产量和OD600nm值分别为25.1 g/L和24.1,较对照组(16.5 g/L、18.9)分别提高52.1%和27.5%,说明此次的优化效果显著。
2.3 20 L发酵罐分批补料发酵
为了更好地控制优化的发酵工艺,采用上述优化的培养基组分和发酵工艺进行分批补料发酵,使补加的营养物质或工艺调控能最大限度地促进菌株生长和代谢产物的积累。在相同工艺调控下,分别以优化前后的发酵培养基进行20 L发酵罐分批补料发酵,结果见图10。
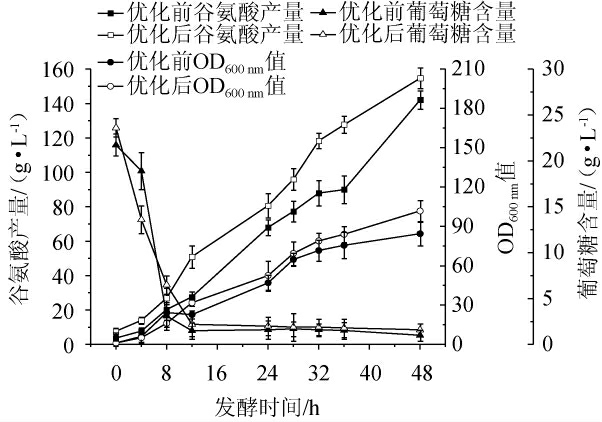
图10 谷氨酸棒杆菌P169发酵条件优化前后分批补料发酵的比较
Fig.10 Comparison of batch replenishment fermentation before and after optimization for fermentation conditions of Corynebacterium glutamicum P169
由图10可知,C.glutamicum P169优化前后的生长曲线相似,葡萄糖消耗的趋势也基本一致,但优化后的生长性能优于优化前,菌体浓度从发酵初就比优化前繁殖速度快。从产谷氨酸水平上看,在整个发酵过程中优化后的谷氨酸含量始终比优化前的高,并维持较高水平。发酵44 h后通过升温诱导谷氨酸分泌,此时谷氨酸生产过剩,产酸速率提高,优化后发酵48 h的谷氨酸产量达155 g/L,较优化前142 g/L提高9.2%(工业化生产的发酵周期一般在48 h以内)。结果表明,采用响应面优化的条件是可行的,并且通过分批补料控制发酵条件有助于进一步提高谷氨酸产量。
3 结论
本研究通过摇瓶培养,以谷氨酸产量为主要评价指标,采用单因素及响应面试验优化谷氨酸棒杆菌P169产谷氨酸的最优发酵条件为酵母粉41.0 g/L,葡萄糖27.0 g/L,尿素12.0 g/L,初始pH值7.0。在最佳条件下摇瓶发酵,谷氨酸产量为25.1 g/L,较优化前(16.5 g/L)提高52.1%。此外,在相同工艺调控下,采用最优发酵培养基进行分批补料发酵,谷氨酸产量达155 g/L,比优化前(142 g/L)提高9.2%。本研究利用优化培养基以分批补料的方式发酵生产谷氨酸能达到较高水平,为工业化发酵生产谷氨酸奠定了良好的基础,但仍有很大的提升空间,进一步研究可以从代谢调控策略提高谷氨酸含量。
[1]PENG F,WANG X Y,SUN Y,et al.Efficient gene editing in Corynebacterium glutamicum using the CRISPR/Cas9 system[J].Microb Cell Fact,2017,16(1):201.
[2] KOGURE T,INUI M.Recent advances in metabolic engineering of Corynebacterium glutamicum for bioproduction of value-added aromatic chemicals and natural products[J].Appl Microbiol Biotechnol,2018,102:8685-8705.
[3]上官玲玲,卢慧芳,夏会丽,等.谷氨酸棒杆菌细胞工厂构建与应用的研究进展[J].食品与发酵工业,2022,48(17):313-320.
[4]BECKER J,WITTMANN C.Bio-based production of chemicals,materials and fuels-Corynebacterium glutamicum as versatile cell factory[J].Curr Opin Biotech,2012,23(4):631-640.
[5]NEŠVERA J,PÁTEK M.Tools for genetic manipulations in Corynebacterium glutamicum and their applications[J].Appl Microbiol Biotechnol,2011,90:1641-1654.
[6] HEIDER S A E,WENDISCH V F.Engineering microbial cell factories:Metabolic engineering of Corynebacterium glutamicum with a focus on non-natural products[J].Biotechnol J,2015,10(8):1170-1184.
[7]YAO C Z,HU X Q,WANG X Y.Construction and application of a CRISPR/Cas9-assisted genomic editing system for Corynebacterium glutamicum[J].AMB Expr,2021,11:70.
[8]TSUGE Y,YAMAGUCHI A.Physiological characteristics of Corynebacterium glutamicum as a cell factory under anaerobic conditions[J].Appl Microbiol Biotechnol,2021,105:6173-6181.
[9]ZHAO N N,QIAN L,LUO G J,et al.Synthetic biology approaches to access renewable carbon source utilization in Corynebacterium glutamicum[J].Appl Microbiol Biotechnol,2018,102:9517-9529.
[10]BECKER J,ROHLES C M,WITTMANN C.Metabolically engineered Corynebacterium glutamicum for bio-based production of chemicals,fuels,materials,and healthcare products[J].Metab En,2018,50:122-141.
[11]LANGE J,MÜNCH E,MÜLLER J,et al.Deciphering the adaptation of Corynebacterium glutamicum in transition from aerobiosis via microaerobiosis to anaerobiosis[J].Genes,2018,9(6):297.
[12] LEE J H,WENDISCH V F.Production of amino acids-Genetic and metabolic engineering approaches[J].Bioresource Technol,2017,245:1575-1587.
[13]YOKOTA A,IKEDA M.Advances in Biochemical Engineering/Biotechnology[M].Tokyo:Springer Tokyo,2017:35-53.
[14] JIN C,HUANG Z,BAO J.High-Titer glutamic acid production from lignocellulose using an engineered Corynebacterium glutamicum with simultaneous co-utilization of xylose and glucose[J].ACS Sustainable Chem Eng,2020,8(16):6315-6322.
[15] FAHIMITABAR A,RAZAVIAN S M H,REZAEI S A.Application of RSM for optimization of glutamic acid production by Corynebacterium glutamicum in bath culture[J].Heliyon,2021,7(6):e07359.
[16] ALHARBI N S,KADAIKUNNAN S,KHALED J M,et al.Optimization of glutamic acid production by Corynebacterium glutamicum using response surface methodology[J].J King Saud Univ Sci,2020,32(2):1403-1408.
[17]陈百莹,郑苗,邓泽元,等.植物乳杆菌ZJ316培养基优化和高密度培养的研究[J].中国食品学报,2020,20(7):65-74.
[18]杨阳.重离子诱变谷氨酸高产菌株选育及阿莫西林诱导发酵机理研究[D].兰州:兰州理工大学,2019.
[19]卢慧芳,上官玲玲,夏会丽,等.发酵玉米粉酶解液制备天然鲜味料[J].食品工业科技,2022,43(17):158-166.
[20]梁玲,黄钦耿,翁雪清,等.产L-谷氨酸工程菌株的诱变选育及其发酵效率[J].生物技术通报,2020,36(6):143-149.
[21]缪建顺.碳离子束辐照谷氨酸棒杆菌高产菌株选育研究[D].兰州:西北师范大学,2015.
[22]马聪聪,罗泽华,蔡斌,等.利于高地芽孢杆菌YC-9生长和芽孢形成的碳源筛选[J].中国农业科技导报,2022,24(7):77-85.
[23]滕婷婷,张智,王荣.发酵谷氨酸生产中氮源补料方案[J].消费导刊,2008(19):216.
[24]焦雯姝,关嘉琦,史佳鹭,等.响应面法优化乳酸乳球菌KLDS4.0325产叶酸的培养基成分及发酵条件[J].食品科学,2020,41(6):123-130.
[25]李海军,王庆波,张英华,等.利用廉价原料生产聚谷氨酸的研究[J].食品与药品,2022,24(1):36-39.
[26]严婷婷.有关有机氮源用于微生物发酵探究[J].食品安全导刊,2020(27):175.
[27]刘慧.基因工程改造谷氨酸棒状杆菌生产N-乙酰氨基萄葡糖[D].北京:北京化工大学,2022.
[28]李艾黎,杜鹏,霍贵成.酵母粉浓度对酸奶菌株发酵动力学参数的影响[J].食品工业科技,2009,30(4):166-167.
[29] TAVAKKOLI M,HAMIDI-ESFAHANI Z,AZIZI M H.Optimization of Corynebacterium glutamicum glutamic acid production by response surface methodology[J].Food Bioproc Technol,2012,5:92-99.
[30]吴兰兰,吴伟菁,王立博,等.响应面法优化苦荞麸皮粉蛋白质提取工艺[J].中国食物与营养,2022,28(3):39-44.
[31]兰林,汪晟羽,张晋森,等.响应面法优化竹叶青茶末中茶氨酸的提取工艺[J].茶叶通讯,2021,48(4):701-706.