胶原蛋白是哺乳动物体内含量最为丰富的蛋白质之一,广泛存在于皮肤、软骨、筋腱和韧带等硬结缔组织和软组织中,占体内蛋白质总量的30%以上。胶原蛋白是由三条左手螺旋结构的α多肽链相互缠绕而形成的右手三重超螺旋大分子[1],由成纤维细胞合成,分子质量在300 kDa左右,根据能否形成纤维可以分为纤维胶原蛋白和非纤维胶原蛋白[2]。
明胶是胶原蛋白经过部分水解以后得到的产物,属于具有一定分子质量分布的多分散体系。胶原蛋白肽是由天然胶原蛋白或明胶水解而成的小分子生物活性肽(bioactive peptides,BAP),分子质量一般小于3 kDa,且普遍含有甘氨酸-脯氨酸-羟脯氨酸序列,因而展现出独特的理化性质和部分生物学活性,如较好的吸收性、降血压、降血糖、抗氧化、抗衰老以及促进伤口愈合等生理功能[3]。
胶原蛋白肽主要从陆生动物(如猪、牛)的皮肤和骨骼中分离提取。研究发现,家禽和鱼类加工废弃物中的皮肤、骨、鳍和鳞等也是获取有价值的胶原蛋白肽的重要来源[4]。除此以外,水母、牛蛙、海参等水产品中也可以获取有特定生理活性的胶原蛋白肽。
我国水产品资源丰富,常以活水产品、鲜水产品以及水产加工品(主要包括腌制品和干制品等)进行销售和食用,大量的加工废弃物被用作饲料或者直接当作废弃物处理,造成了资源的浪费,使得环境和经济面临巨大的威胁。鱼类加工副产品及其主要成分如图1所示[5],其中包含大量的蛋白质、矿物质以及不饱和脂肪酸等有益成分。
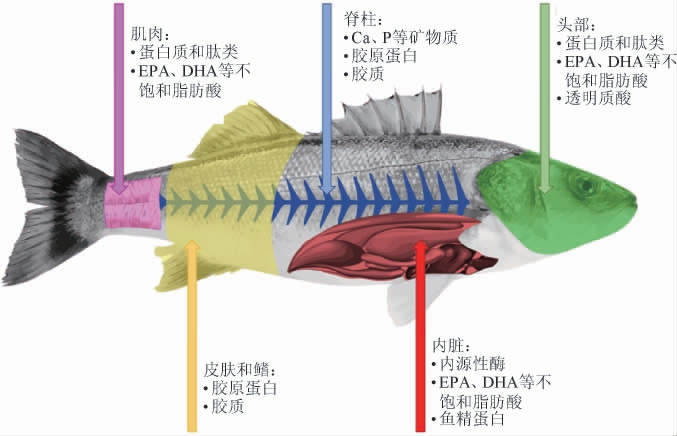
图1 鱼类加工副产品及其主要成分
Fig.1 Fish processing by-products and their main components
因此,探索更多水产加工下脚料综合利用的方法以及提高废弃物的附加值成为了当前水产养殖业的研究热点。近年来,随着家畜中传染性疾病的爆发,以及卫生和社会文化的影响,消费者对于以陆生动物生产的胶原蛋白制品的安全性缺乏信心[6]。相较于陆生动物源胶原蛋白,鱼源胶原蛋白的免疫原性和炎症反应都较弱,更适合于人体代谢,可作为胶原蛋白肽的新资源加以开发和利用。该文概述了微生物发酵法生产水产胶原蛋白肽的研究现状,并对其原理、发酵条件的确定、肽的分离纯化方法以及生理功能的研究进行了详细的总结,对比分析了不同生产胶原蛋白肽技术的优势和不足,旨在为微生物发酵法制备具有高生理活性的水产胶原蛋白肽提供理论依据。
1 水产胶原蛋白肽的制备
生物活性肽的获得需要经过以非活性形式从亲本蛋白中释放出来的过程[7]。选择不同的生产方法,所得到的胶原肽的种类和特性也会有所区别。
1.1 化学降解法
胶原蛋白在较高温度下,经酸、碱的作用,可以水解为氨基酸和少量二肽,实现蛋白质的彻底降解。但是该方法易腐蚀设备、造成环境污染,同时氨基酸结构也会被不同程度的破坏,并且产物含盐量高[8]。
1.2 蛋白酶解法
酶解法是最常应用于制备水产胶原蛋白肽的方法。胶原蛋白经过酸或碱浸泡的预处理后,体积膨胀且连接胶原蛋白三条多肽链之间的氢键被打开,使得原本由三条α-链缠绕形成的三螺旋结构变得疏松[9],采用不同的限制性内切酶降解,得到不同功能的肽段。相较于化学法,其对环境相对友好、氨基酸结构保存完整、产物纯度高。当用单一酶进行酶解时,酶解效果往往不理想。复合蛋白酶中含有多种蛋白酶切位点,可以最大化地将大分子胶原蛋白切割成较小分子的多肽,各种蛋白酶优先切割位点如表1所示[10]。但普通蛋白酶不仅价格昂贵,目标产物通常还具有苦肽味,得率较低且所制得的胶原蛋白肽保水性和乳化性较差。
表1 不同蛋白酶的优先切割位点
Table 1 Preferential cleavage sites of different proteases

注:表1中的相关数据均来自于酶综合信息系统(http://www.brendaenzymes.org/)。
近年来,也有人采用体外模拟胃肠道消化的方式来生产水产胶原蛋白肽。LIN Y H等[11]利用复合蛋白酶模拟胃肠道消化的过程,体外水解军曹鱼,得到对血管紧张素转化酶(angiotensin converting enzyme,ACE)的半抑制浓度为0.221 mg/mL的酶解物PX-5,酶解液中包含的肽段分别为色氨酸-丙氨酸-丙氨酸(Trp-Ala-Ala)、丙氨酸-色氨酸-色氨酸(Ala-Trp-Trp)、异亮氨酸-色氨酸-色氨酸(Ile-Trp-Trp)和色氨酸-亮氨酸(Trp-Leu),PX-5已被证明在体内有明显的抗高血压活性。IGD是一种独特的过程,采用体外模拟肠道蛋白质消化,可用于生产新的活性肽。然而,对于应用此方式生产水产胶原肽的研究仍然很少。因此,后续对于蛋白质水解物的顺序消化应进行更深入的研究。
1.3 人工合成法
合成法主要包括化学合成法、酶促合成法和基因重组表达法。化学合成以固相合成法为主,产物可能含有有毒有害物质,且成本较高。酶促合成法适用于短链的合成,对反应条件要求严格,副产物较多,且得率较低。基因重组表达法可用于合成长肽链,利用微生物发酵可以获得大量目标肽[12],该方法制备的生物活性肽容易被微生物自身的胞内酶降解,使得肽类物质得率降低。由于鱼源性胶原蛋白肽大多为未鉴定组成结构的肽段,因此利用人工合成的方式生产水产胶原蛋白肽的应用还有待进一步探索。
1.4 胶原蛋白肽制备的新兴技术
1.4.1 溶剂萃取法
溶剂萃取法也是海洋多肽常用的提取技术之一[13]。根据目标肽极性和溶解度的不同,可以采用多种溶剂或溶剂组合的方式提取胶原蛋白肽。近年来对于溶剂的选择更倾向于绿色、可持续性溶剂,如深层共晶溶剂(氯化胆碱-草酸)就常应用于海洋生物活性肽的提取[14]。深共晶溶剂(deep eutectic solvent,DES)是由两种或两种以上可以作为氢键供体(hydrogen bonddonor,HBD)或氢键受体(hydrogen bond accepter,HBA)的化合物按照一定的摩尔比混合并通过氢键连接形成的共熔物,其熔点低于DES所含的任何单一组分。基于DES与目标化合物之间相互作用的原理,BAI C等[15]利用其提取鳕鱼皮胶原蛋白肽,使得其提取率和回收率都大幅度提高。随着技术的进步,超声辅助萃取、超临界流体萃取、加压溶剂萃取、微波辅助萃取、脉冲电场辅助萃取和酶辅助萃取都可用于改进多肽的溶剂萃取。
1.4.2 亚临界水解法
亚临界水解法(subcritical water hydrolysis,SBW)也可应用于水产胶原肽的提取。该方法使用压力高于饱和值但低于临界值且温度控制在100~274 ℃的水,在上述条件下,水的介电常数会随温度的升高而降低,使其由中等极性溶剂变为非极性溶剂。此外,水的离子积会随温度的升高而增加,溶液中氢离子和氢氧根离子的比例增加,通过形成水合氢离子和氢氧化物并使其在亚临界状态下充当催化剂,进而催化胶原蛋白的水解[16]。该方法虽极大程度的节约了时间,不污染环境,但是成本过高,不适合大规模生产。
1.5 微生物发酵法
通过微生物发酵制备活性肽的过程[10]如下。有些微生物可以以胶原蛋白为底物,利用内源性蛋白水解酶,发酵生产胶原蛋白肽,且微生物代谢产生的丰富酶系还可以将原料中少量存在的脂类和杂蛋白降解为营养物质供自身生长发育。水产品中的腥味物质也可以被微生物降解为各种有机酸类,赋予产品特有的香味,发酵过程中产生的一些活性因子可以增加产品的营养价值[17]。该方法将原料中杂蛋白和脂肪的去除以及胶原蛋白的提取和酶解通过微生物发酵一次性完成,简化了生产工艺,节约了成本,同时减少了环境污染。除此以外,微生物发酵还具有条件温和,氨基酸保存完整,水解产物种类丰富且生理活性较高的特点[18]。虽然目前微生物发酵的工艺和技术尚不成熟,制备的肽的活性和功能还需要进一步研究,但基于上述优点,微生物发酵法生产水产胶原蛋白肽前景广阔。
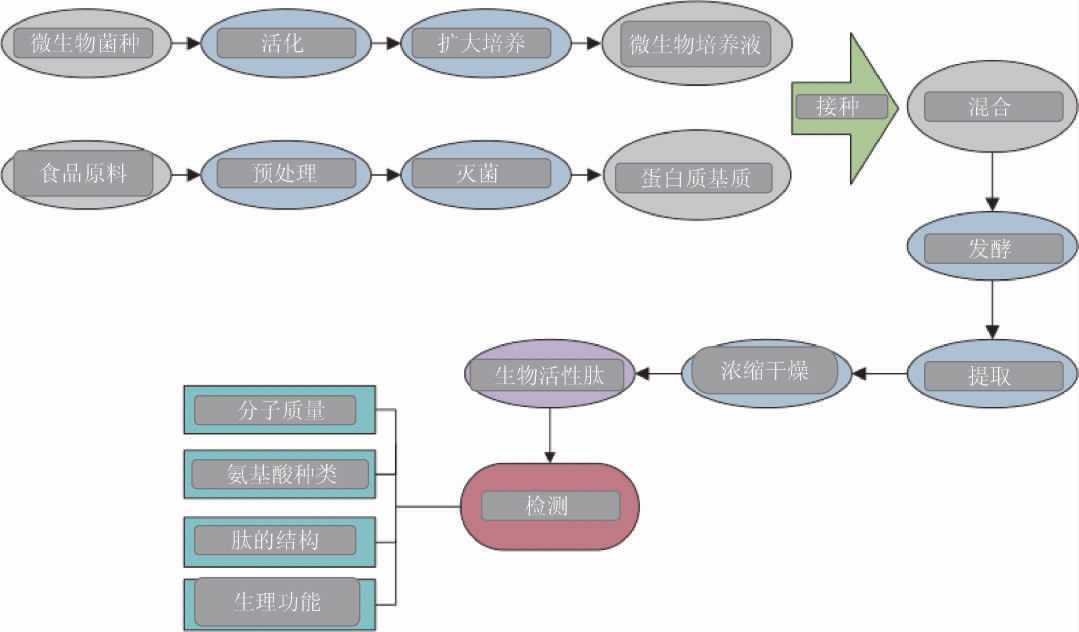
图2 活性肽的微生物发酵制备过程及检测指标
Fig.2 Microbial fermentation preparation process and detection indexes of active peptide
2 水产胶原蛋白肽的发酵工艺
现代发酵技术可以产生具有众多生理功能的活性肽,利用发酵来生产水产胶原蛋白肽也逐渐成为一个趋势。发酵法制备胶原蛋白肽的研究主要集中在发酵菌种、发酵原料的选择以及发酵工艺的优化这三个方面。
2.1 发酵原料的选择
在水产加工过程中会产生大量加工下脚料,如鱼骨、鱼皮、内脏等,大部分会被直接丢弃,少部分会被粗加工成饲料、作物肥料或其他低值产品,造成了资源的浪费。其中鱼皮是鱼类加工废弃物的重要组成部分,富含生物活性胶原蛋白,最适合作为水产胶原蛋白肽的提取原料,其次还有鱼骨、鱼鳍等。目前,通过不同的生产工艺,从鳕鱼皮、鲨鱼皮、罗非鱼皮、鲤鱼皮、草鱼皮和鲢鱼皮等鱼类组织中均生产出具有不同生物活性的胶原蛋白肽。除了鱼类胶原蛋白以外,许多其他来自不同类群的海洋生物也可作为胶原蛋白的重要来源,如无脊椎动物源的胶原蛋白以及海洋哺乳动物源的胶原蛋白。目前已有研究从海绵动物、水母、海葵、珊瑚、鱿鱼以及棘皮类动物的组织中提取胶原蛋白并用于生产胶原蛋白肽[19]。
2.2 发酵菌种的筛选
菌种的筛选是微生物生物转化水产加工下脚料的基础和关键。在微生物发酵的过程中,肽的产生是由发酵菌株分泌的蛋白水解酶催化的。可以通过定性、定量分析的手段特异性的筛选高效的胶原分解微生物,具有胶原降解活性的部分菌株如图3所示[20]。
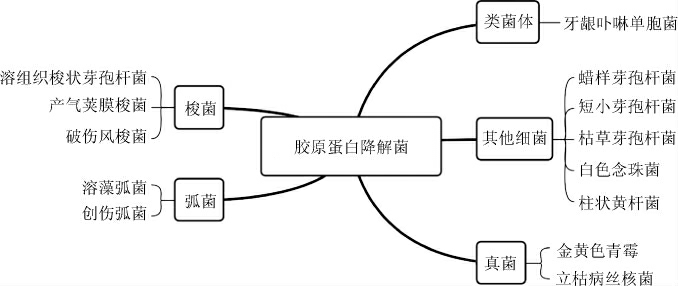
图3 具有胶原降解活性的部分菌株
Fig.3 Part of strains with collagen-degrading activity
目前常用的发酵水产品及其加工下脚料的菌种主要有枯草芽孢杆菌、乳双歧杆菌、酵母菌、植物乳杆菌和霉菌等,它们大多筛选自土壤、水产下脚料、海鲜市场以及污水处理厂。利用明胶水解实验,通过三氯乙酸沉淀大分子蛋白质锐化水解区域的大小,可以定性分析得到具有胶原降解活性的菌株。将适当浓度的底物与酶一起孵育,通过测量由于酶的作用而释放的游离氨基酸的含量来进一步计算酶活的大小[21],可以定量分析菌株降解胶原蛋白的能力。
纳豆芽孢杆菌(Bacillus natto)作为我国发酵传统大豆食品的主要微生物,可以产生丰富的胞外蛋白酶,且发酵周期较短。姚雨杉[22]利用纳豆芽孢杆菌发酵鱿鱼加工副产物,得到冻干品血管紧张素转化酶(ACE)抑制率为82.22%、多肽含量为208.18 mg/g的产品。SONG Y等[23]也利用纳豆芽孢杆菌发酵菲律宾蛤仔,制备得到具有高ACE抑制活性的肽,体内研究证明了该活性肽可显著降低自发性高血压大鼠的收缩压和舒张压,同时还可以通过降低厚壁菌门和拟杆菌门的比例以及增加某些属的相对丰度来改善肠道微生物群。Bacillus subtilis、Bacillus sp.H3以及Stenotrophomonas maltophilia YQ-1均被证实可以降解胶原蛋白,利用这些菌株发酵罗非鱼皮可以产生理化性质优良的胶原肽,除此以外,枯草芽孢杆菌还被应用于制备全细胞生物催化剂,发酵鱼皮制备胶原肽粉[24]。近年来,在发酵食品中使用的一般认为安全(generally recognized as safe,GRAS)的微生物也逐渐被人们应用于胶原蛋白肽的制备[25]。在发酵制备胶原蛋白肽的过程中,应该关注酶和活性成分的生产水平,提高通过发酵法生产水产生物活性肽的安全性和功能性。
2.3 发酵工艺的优化
在微生物发酵的过程中,发酵条件的变化对产酶的合成效率影响很大,因此应该在正式发酵之前对培养条件进行优化。影响发酵过程的因素主要有接种量、pH值、底物浓度、发酵时间和温度。除此以外,不同的发酵形式也会对胶原蛋白酶及胶原蛋白肽的产量产生影响。在微生物发酵系统中,最为常见的发酵形式是深层发酵和固态发酵[26]。深层发酵需要将待发酵的原料制备成液体,更适合于具有高水位活性的微生物的发酵,如细菌。而固态发酵需要将待发酵原料制备成固态基质,往往适合于对水分要求不高的微生物的发酵,如真菌、部分细菌等。
对于发酵效果的评价指标为可溶性多肽的含量以及水解度的大小。除此以外,一些理化指标(溶解性、黏度和凝固性等)以及感官评价的指标(颜色、气味、滋味等)也可以应用于对肽的品质进行初步判断。若目标产物是具有特殊生理活性的胶原蛋白肽,则可以通过发酵产物生理活性的指标来综合评价发酵效果。除了单一地采用微生物发酵手段生产活性胶原蛋白肽以外,随着现代加工技术的逐渐成熟,还可以通过非热加工技术,如超声波、超高压以及脉冲电场等来提高微生物的发酵效率[27]。
3 胶原蛋白肽的分离、纯化与鉴定
3.1 肽粗品的分离
蛋白质和多肽常用盐析法进行粗提,由于其含有亲水性基团如-NH2、-OH、-COOH,在正常情况下可以与水结合形成水化层从而增加其在水中的溶解度。当向发酵液中加入大量中性盐如硫酸铵等,会破坏亲水胶体,使得蛋白质和多肽聚集沉淀,但该法不易沉淀分子质量较小的多肽且产物肽含盐量较高。醇沉法也常应用于对肽进行分离,发酵液离心除杂后,将上清液进行真空旋转蒸发浓缩,浓缩后的上清液加入乙醇溶解小分子肽,进而得到胶原蛋白肽粗品。醇沉法虽较为简便,但乙醇的沉淀面广,专属性差,且消耗量较多,因此应该探索更高效的粗肽的提取方法。
3.2 肽粗品的纯化与鉴定
膜分离技术是指在压力差驱动下,样品在膜系统中渗透和保留的过程[28],具有高效性、能耗小且选择性高的特点,可用于粗肽的分离纯化。该方法可以分为微滤、超滤、纳滤、反渗透和多级耦联膜。其中,纳滤和反渗透主要截留分子质量为200~1 000 Da的物质,可用于更小分子质量肽的分级分离[29]。除此以外,色谱法、层析法和毛细管法也常用于肽的分离纯化。在上述方法中,膜过滤法节约了时间和成本,但其也存在一些挑战。如半透膜易与疏水性多肽作用、膜易污染堵塞、选择性和分辨率较差且不适合大量肽的分离纯化等[30]。色谱法可以很好的解决上述问题,但是会消耗大量的时间和成本。为了达到更好的分离纯化效果,可以采用不同技术相结合的方式对粗肽制品进行分离。如将膜过滤技术与电渗析等其他技术相结合,或者采用多步膜循环反应器等技术分离纯化具有高生理活性的水产胶原蛋白多肽。
对于活性肽纯化后序列的测定,最常用的方法是液相色谱-质谱联用技术[31]。除此以外,串联质谱、基质辅助激光解吸/电离飞行时间质谱、表面增强激光解吸/电离飞行时间质谱等都可以用来检测所分离肽的纯度以及对肽序列进行高效、准确的测定。以上方法都各有其优缺点,应该根据待分离组分的理化性质选择合理的分离鉴定方法。胶原蛋白肽的制备、分离纯化和表征常用的技术手段,以及胶原蛋白肽可以应用的技术领域见图4。可以依据待分离胶原蛋白肽的自身特点,采用不同的分离和纯化鉴定的手段对其进行分离和功能研究。
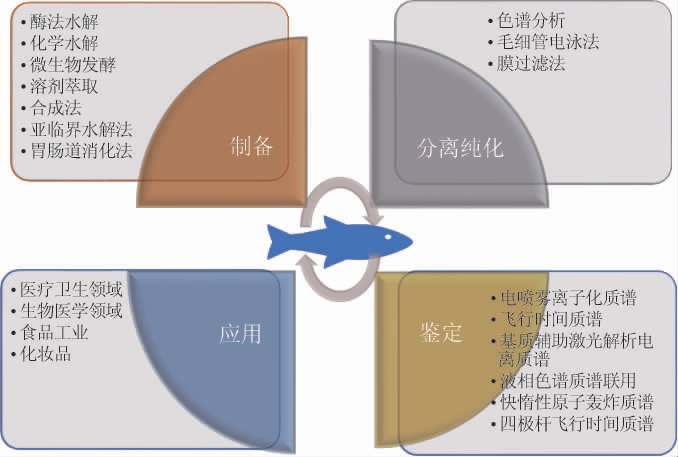
图4 胶原蛋白的制备、分离纯化、鉴定及应用
Fig.4 Preparation,isolation and purification,identification and application of collagen peptides
4 发酵法生产水产胶原肽的生理活性
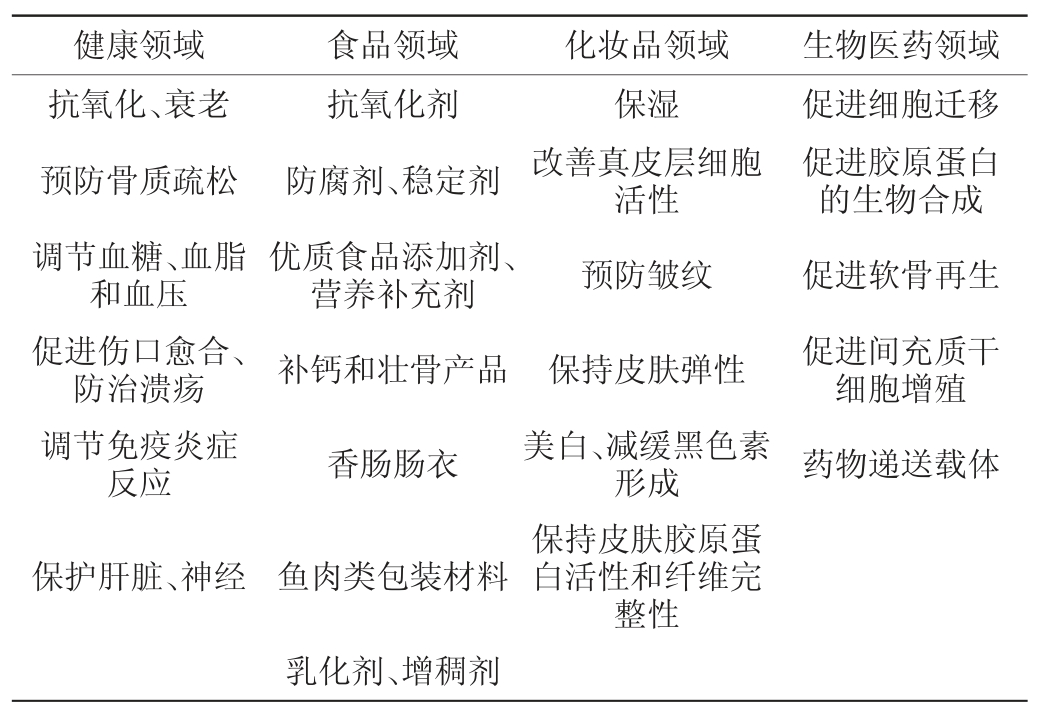
生物活性肽的功能会受到氨基酸的组成和排列顺序以及生产方式等的影响。通过从发酵食品中提取的生物活性肽的数据库可知,利用发酵的方式可以生产出不同功能的活性肽。其中,具有ACE抑制作用的活性肽占大部分,除此以外还有抗高血压肽以及抗氧化肽等[32]。我国水产胶原蛋白肽研究起步较晚,针对胶原蛋白肽的生理功能的研究还有待进一步深入,目前制备得到的水产胶原蛋白肽在不同领域的应用见表2。在生物医学中,由于其低致敏性、优良细胞耐受性以及亲和性,使其可作为药物递送载体以及医用敷料。在美容美妆领域,由于其性能温和、安全性高等特点而常应用于护肤类化妆品中,起到保湿、预防皱纹、延缓皮肤衰老的作用。在医疗健康领域,可作为功能性添加成分补充蛋白质营养和促进皮肤、骨骼等部位的健康。在食品工业中,还可应用于澄清剂、乳化剂以及肠衣等的制备。此外,在造纸、皮革、饲料等行业,胶原蛋白肽均有一定的应用。
表2 水产胶原蛋白肽在不同领域的应用
Table 2 Application of aquatic collagen peptides in different fields
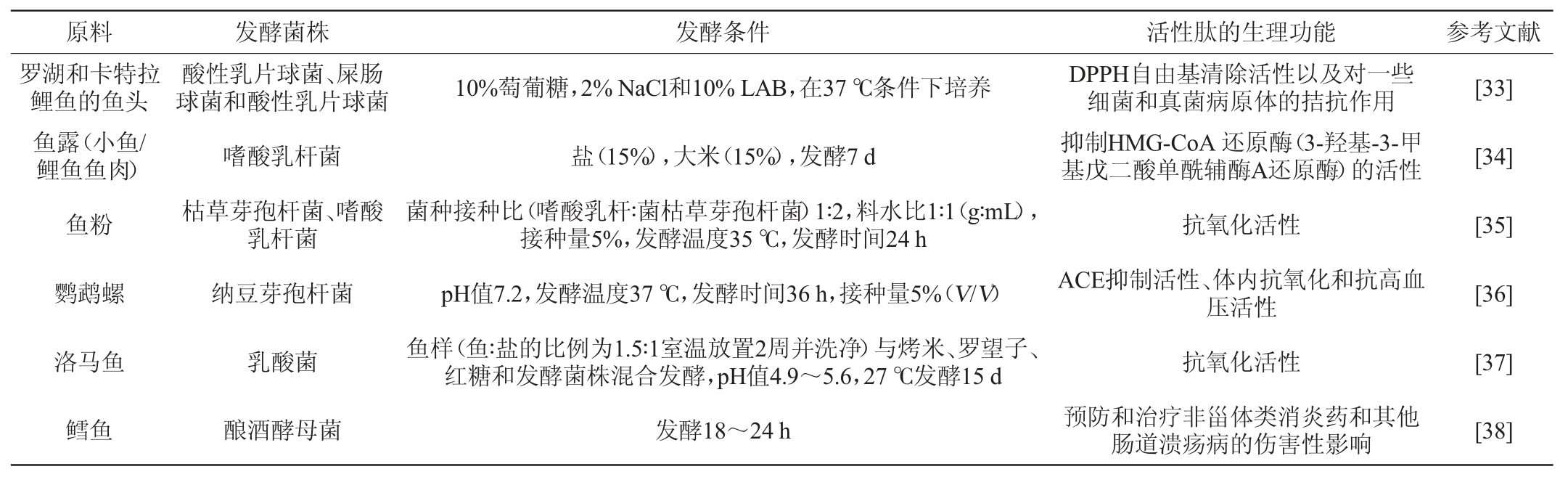
发酵在鱼类及其加工副产物(鱼露、内脏、肉渣等)中已有较为广泛的应用,一些通过发酵的方式制备的水产生物活性肽见表3。
表3 发酵法生产水产生物活性肽
Table 3 Production of aquatic bioactive peptides by fermentation method
对于发酵法生产的胶原多肽生理活性的研究,尤其是在抗肿瘤、抗疲劳、促进骨形成等方面还不全面。鱿鱼加工副产物中必需氨基酸与非必需氨基酸的比值较高,且富含鲜味及疏水性氨基酸,具备制备抗高血压肽的潜力。张京楼等[39]对发酵后鳕鱼皮胶原蛋白多肽抗氧化活性进行了分析,发现其抗氧化能力优于维生素。韩玮[40]将酸法、碱法和发酵法制备的胶原蛋白进行对比,发现发酵法所得胶原蛋白的乳化性最强。FANG B等[41]利用米曲霉发酵废弃的大菱鲆皮,得到具有抗氧化活性的鱼皮胶原蛋白肽。除了抗氧化、抗高血压等生理功能,发酵法制备的水产胶原多肽在医疗卫生、化工、美容和食品等领域均有深入研究的潜力。
5 发酵技术制备水产胶原蛋白肽的优缺点
微生物发酵技术具有其他生物活性肽的生产方法不具备的某些优势。由于微生物自身具有丰富多样的酶系,可以使底物中的胶原蛋白实现更彻底的降解,更容易产生具有高生理活性的肽段。除此以外,有越来越多的GRAS微生物被应用于发酵水产加工下脚料,这使得通过发酵释放出来的肽具有更高的生物安全性和更好的营养价值。微生物发酵还可以增加底物的利用效率,无有毒物质的残留,是一种环境友好的胶原蛋白肽制备技术[42]。
虽然发酵法生产水产胶原蛋白肽有很大的开发前景,但是也有一些亟待解决的问题,这也给进一步应用微生物发酵法提供了一些思路。微生物发酵过程是一个十分复杂的体系,发酵上清液中除了水解后的多肽以外,还有一些胞外多糖,活菌或者死菌的细胞,未水解的大分子以及细胞色素类物质等,它们大多也具有生物学活性。因此,在研究胶原蛋白肽的生理功能时,应尽可能除去这些影响因素,这些物质的存在同时也增加了胶原蛋白肽的分离纯化难度。除此以外,有些细菌自身还会产生细菌素,细菌素本身也是具有生物学活性的多肽,可以抑制或者杀死某些微生物或者癌细胞。当需要确定分离出的胶原蛋白肽是否具有抑菌活性时,应首先确定其不是细菌素。另外,由于微生物产酶对释放生物活性肽至关重要,在发酵培养基制备时,培养基组分如碳源的种类、溶氧率、pH值、温度等都会影响发酵过程,这就需要在发酵前对发酵参数进行确定。最后,微生物发酵法作为一种生物技术,容易出现不同批次间重复性较差的问题,提示在进行工业化生产目标肽的过程中,应对发酵条件进行实时监控和调整[43]。
6 总结与展望
我国作为一个水产资源大国,废弃原料如何高效利用的问题近年来受到人们的广泛关注。水产加工下脚料是高质量胶原蛋白肽的一个有效来源,而我国水产胶原肽产业起步较晚,企业对胶原蛋白肽产品提取手段的开发和功能性研究相对不足。用发酵法制取胶原蛋白肽,可以给予水产加工下脚料二次生命,具有其他方法不可比拟的优势。目前,发酵菌种及原料的选择都还比较局限,应该加深对菌种和原料的探索。由于发酵体系相对复杂导致产物肽的提取难度大,可以通过分子生物学的手段生产微生物胶原蛋白酶,并用该酶水解胶原蛋白。除此以外,对于产物肽的结构、功效肽段的鉴定、生理功能的开发以及动物和临床试验仍然存在较大的研究潜力,需要在后续的研究中深入探索。
[1]RICARD-BLUM S.The collagen family[J].Cold Spring Harbor Perspect Biol,2011,3(1):a004978.
[2]KIRKNESS M W H,LEHMANN K,FORDE N R.Mechanics and structural stability of the collagen triple helix[J].Curr Opin Chem Biol,2019,53:98-105.
[3]ZHOU J,CHEN M,WU S,et al.A review on mushroom-derived bioactive peptides:Preparation and biological activities[J].Food Res Int,2020,134:109230.
[4]SUBHAN F,HUSSAIN Z,TAUSEEF I,et al.A review on recent advances and applications of fish collagen[J].Crit Rev Food Sci Nutr,2021,61(6):1 027-1 037.
[5] MARTI-QUIJAL F J,REMIZE F,MECA G,et al.Fermentation in fish and by-products processing: An overview of current research and future prospects[J].Curr Opin Food Sci,2020,31:9-16.
[6] ATEF M,OJAGH S M,LATIFI A M,et al.Biochemical and structural characterization of sturgeon fish skin collagen(Huso huso)[J].J Food Biochem,2020,44(8):1-10.
[7] BOUGLÉ D,BOUHALLAB S N.Dietary bioactive peptides: Human studies[J].Crit Rev Food Sci Nutr,2015:335-343.
[8] WANG X,YU H,XING R,et al.Characterization,preparation,and purification of marine bioactive peptides[J].BioMed Res Int,2017,2017:9746720.
[9]COTTENDE N,WONG F.Development and validation of a new method for measuring friction between skin and nonwoven materials[J].J Eng Medicine,2008,222(5):791-803.
[10]YANG F J,CHEN X,HUANG M C,et al.Molecular characteristics and structure-activity relationships of food-derived bioactive peptides[J].J Int Agr,2021,20(9):2313-2332.
[11]LIN Y H,CHEN C A,TSAI J S,et al.Preparation and identification of novel antihypertensive peptides from the in vitro gastrointestinal digestion of marine cobia skin hydrolysates[J].Nutrients,2019,11(6):1351.
[12]杨贵兰,秦松,李文军,等.海洋生物活性肽的功能,制备技术与作用机制研究进展[J].海洋科学,2021,45(10):10.
[13] SABLE R,PARAJULI P,JOIS S.Peptides,peptidomimetics,and polypeptides from marine sources:a wealth of natural sources for pharmaceutical applications[J].Marine Drugs,2017,15(4):124.
[14]SRIDHAR K,INBARAJ B S,CHEN B H.Recent developments on production,purification and biological activity of marine peptides[J].Food Res Int,2021,147:0963-9969.
[15] BAI C,WEI Q,REN X J.Selective extraction of collagen peptides with high purity from cod skins by deep eutectic solvents(DESs)[J].Acs Sustain Chem Eng,2017,5(8):7220-7227.
[16]SIMES P J F.Subcritical water extraction and hydrolysis of cod(Gadus morhua) frames to produce bioactive protein extracts[J].Foods,2022,10(6):1222.
[17]DI Y U,CHI C F,WANG B,et al.Characterization of acid-and pepsinsoluble collagens from spines and skulls of skipjack tuna (Katsuwonus pelamis)[J].Chinese Journal of Natural Medicines,2014,12(9):712-720.
[18]CHEN S,CHEN H,XIE Q,et al.Rapid isolation of high purity pepsinsoluble type I collagen from scales of red drum fish(Sciaenops ocellatus)[J].Food Hydrocolloid,2016,52:468-477.
[19]FCA B,PR C,GO A,et al.Aquaculture as a circular bio-economy model with Galicia as a study case: How to transform waste into revalorized by-products[J].Trend Food Sci Technol,2022,119:23-35.
[20]WANDERLEY M,NETO J M W D,FILHO J,et al.Collagenolytic enzymes produced by fungi: A systematic review[J].Brazil J Microbiol,2017,48(1):13-24.
[21]BHAGWAT P K,DANDGE P B J B,BIOTECHNOLOGY A.Collagen and collagenolytic proteases: A review[J].Biocatal Agr Biotechnol,2018(15):43-55.
[22]姚雨杉.鱿鱼加工副产物酶解、发酵工艺的优化和抗高血压肽的制备[D].广州:华南理工大学,2020.
[23]SONG Y,YU J,SONG J,et al.The antihypertensive effect and mechanisms of bioactive peptides from Ruditapes philippinarum fermented with Bacillus natto in spontaneously hypertensive rats[J].J Funct Food,2021,79(4):104411.
[24]赖圆圆.枯草芽孢杆菌水解动物皮制备胶原肽技术[D].广州:华南农业大学,2017.
[25] MELINI F,MELINI V,LUZIATELLI F,et al.Health-promoting components in fermented foods:An up-to-date systematic review[J].Nutrients,2019,11(5):1189.
[26]CHAI K F,VOO A,CHEN W N.Bioactive peptides from food fermentation: A comprehensive review of their sources,bioactivities,applications,and future development[J].Compr Rev Food Science,2020,19(6):3825-3885.
[27] SHOKRI S,TEREFE N S,MANZARI M.Advances in food fermentation:potential application of novel processing technologies for enhancing fermentation kinetics and product yield[J].Inn Food Process Technol,2021,13:135-156.
[28]ONDRˇEJ D,NATÁLIA V.Electrodialysis with ultrafiltration membranes for peptide separation[J].Chem Paper,2018,72(2):261-271.
[29]YANG X,WANG K,LIU Q,et al.Discovery of monoamine oxidase A inhibitory peptides from hairtail (Trichiurus japonicus) using in vitro simulated gastrointestinal digestion and in silico studies[J].Bioorgan Chem,2020,101:104032.
[30]DOYEN A,ROBLET C,BEAULIEU L,et al.Impact of water splitting phenomenon during electrodialysis with ultrafiltration membranes on peptide selectivity and migration[J].J Membr Sci,2013,428:349-356.
[31]LAFARGA T,ACIEN-FERNANDE Z,GARCIA-VAQUERO M.Bioactive peptides and carbohydrates from seaweed for food applications:Natural occurrence,isolation,purification,and identification[J].Algal Res,2020,48:101909.
[32]张中杰,蒋华.我国水产胶原蛋白肽领域专利分析[J].情报工程,2018,4(5):96-104.
[33] RUTHU,MURTHY P S,RAI A.Fermentative recovery of lipids and proteins from freshwater fish head waste with reference to antimicrobial and antioxidant properties of protein hydrolysate[J].Food Sci Technol,2014,51(9):1884-1892.
[34] RINTO N,HERPANDI R,OKTAVIANI S,et al.Fractionation of anticholesterol bioactive compounds from Bekasam (Indonesian fermented fish product)[J].Pertan J Trop Agr Sci,2017,40(3):399-406.
[35]林俊宏.生物转化鱼粉的研发及替代血浆蛋白粉在仔猪饲料中的应用[D].广州:华南农业大学,2017.
[36]CHEN Y Y,GAO X,WEI Y X,et al.Isolation,purification and anti-hypertensive effect of a novel angiotensin I-converting enzyme (ACE) inhibitory peptide from Ruditapes philippinarum fermented with Bacillus natto[J].Food Funct,2018,9(10):DOI:10.1039/c8fo01146j.
[37]GHRIBI A M,SILA A,PRZYBYLSKI R,et al.Fractionation and identification of novel antioxidant peptides from fermented fish (pekasam)[J].J Food Measure Character,2015,12:516-525.
[38]FITZGERALD R J,CERMEO M,KHALESI M,et al.Application of in silico approaches for the generation of milk protein-derived bioactive peptides[J].J Funct Food,2019,64:103636.
[39]张京楼,梁丽琨,马丽杰,等.复合微生物发酵制备鳕鱼皮多肽的工艺探索[J].农产品加工(学刊),2012(3):42-45,50.
[40]韩玮.微生物发酵法制备胶原蛋白及其性质和应用研究[D].上海:上海海洋大学,2019.
[41]FANG B,SUN J,DONG P,et al.Conversion of turbot skin wastes into valuable functional substances with an eco-friendly fermentation technology[J].J Clean Product,2017,156(10):367-377.
[42]SIDDIKI S,MOFIJUR M,KUMAR P S,et al.Microalgae biomass as a sustainable source for biofuel,biochemical and biobased value-added products:An integrated biorefinery concept[J].Fuel,2022,307:121782.
[43]WU H,CHEN J,LI J,et al.Recent advances on bioactive ingredients of Morchella esculenta[J].Appl Biochem Biotechnol,2021,193(12):4197-4213.