纳豆激酶(nattokianse,NK)是由纳豆芽孢杆菌(Bacillus natto)产生的一种具有纤溶活性的丝氨酸蛋白酶[1],由日本学者须见洋行对传统发酵食品纳豆及其提取物作研究时发现的[2]。纳豆激酶是目前最具有潜力的口服溶栓药物[3],体内溶栓试验表明,纳豆激酶能减缓血栓的形成时间,明显提高血栓的再通率和减少肺内血栓的形成[4],且溶栓效果显著高于同等剂量的尿激酶[5]。体外溶栓试验表明,纳豆激酶能使纤溶酶原激活物抑制剂(plasminogen adivator inhibitor,PAI)失活,从而将血纤维蛋白溶酶原转化为血纤维蛋白溶酶,通过蛋白水解作用直接溶解纤维蛋白凝块[6],没有任何毒副作用,这一点不同于市面常用药物组织型纤溶酶原激活剂、尿激酶、链激酶[7]。纳豆激酶因具有高效的溶纤活性、安全性好[8]、生产成本低[9]、无毒副作用[10]、半衰期长[11]、在胃肠的稳定性好等优点[12],而被广泛关注。
传统上,纳豆激酶均是经过固态发酵获得;目前,商业化应用的固态发酵工艺的纳豆激酶活性一般能达到20~100 FU/g[13]。由于这种方法的产率低、劳动强度大,已经很少使用。现在普遍采用的是液体发酵法。纳豆芽孢杆菌的发酵过程较为复杂,优化其培养条件对纳豆激酶工艺开发、性能改善和工业化应用发挥至关重要的作用[14]。熊晓辉等[15]对纳豆激酶的深层液体发酵条件进行了优化,得到的发酵液酶活为700 IU/mL;董明盛等[16]筛选出菌株NK-5,对其进行了培养条件的优化,发酵液酶活力达683.3 U/mL;田秀媛等[17]利用Plackett-Burman试验设计对纳豆芽孢杆菌的培养条件进行优化,得到的最佳种龄为8.5 h;KWON E Y等[18-19]都对纳豆芽孢杆菌的液态发酵产酶条件进行了优化,而且酶活力也有较大提高。虽然纳豆芽孢杆菌的产酶活力提高了很多,但纳豆激酶总体产率较低、成本较高限制了其广泛使用。
大量试验表明,响应面分析方法在优化培养基[20]、优化培养条件方面是非常高效的工具[21-22],响应面分析方法能用较少的试验次数针对影响试验目的的主要因素建立数学回归模型[23],并对模型进行方差、显著性分析,确定各因素之间的交互关系,找出响应值最高对应研究因素的最佳取值。本研究以实验室分离的一株高产纳豆激酶的纳豆芽孢杆菌为研究对象,在前期培养基优化基础上。先利用单因素试验优化纳豆芽孢杆菌产纳豆激酶培养条件,再利用响应面试验对培养条件进行优化,以进一步提高纳豆激酶活力,为纳豆激酶产品的成本降低、广泛使用提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
纳豆芽孢杆菌(Bacillus natto):本实验室筛选保藏。
1.1.2 试剂
胰蛋白胨、牛肉膏、氯化钠、甘油、无水氯化钙、七水硫酸镁、十二水磷酸氢二钠、无水磷酸二氢钾、L-甲硫氨酸:国药集团化学试剂有限公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
种子培养基[24]:蛋白胨10 g/L,牛肉膏5 g/L,氯化钠5 g/L,pH 7.2~7.4。121 ℃高压蒸汽灭菌20 min。
发酵培养基:甘油43 g/L,豆粕粉24 g/L,无水氯化钙0.14 g/L,七水硫酸镁0.80 g/L,十二水磷酸氢二钠3.00 g/L,无水磷酸二氢钾1.00 g/L,L-甲硫氨酸0.20 g/L,pH 7.2。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
BX-240H电子天平:日本岛津公司;PHS-3C型精密pH计:上海雷磁仪器厂;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-1D型超净工作台:苏州苏净净化有限公司;HZQ-X100型振荡培养箱:哈尔滨市东联电子技术开发有限公司;HC-2518R高速冷冻离心机:科大创新有限公司中佳分公司。
1.3 方法
1.3.1 纳豆芽孢杆菌种子液及发酵液的制备
种子液的制备:挑取1环纳豆芽孢杆菌菌株的新鲜斜面接种于装液量为100 mL/500 mL的种子培养基中,37 ℃、180 r/min条件下振荡培养24 h(OD600nm值=1.5~1.6)。
发酵液的制备:将菌龄为24 h的种子液,按接种量5%(V/V)接种于装液量为100 mL/500 mL的发酵培养基中,37 ℃、180 r/min条件下振荡培养96 h后,得到发酵液。
1.3.2 纳豆激酶活力的测定
发酵液10 000 r/min离心10 min后,取上清液,采用紫外分光光度法[25]测定纳豆激酶活力。
纳豆激酶酶活力的定义:每分钟波长275 nm 处吸光度值增加0.01 所需要的酶量定义为1个酶活力单位(FU/mL)。
1.3.3 纳豆芽孢杆菌产纳豆激酶培养条件优化
(1)单因素试验
采用单因素轮换法依次考察培养温度(27 ℃、30 ℃、33 ℃、36 ℃、39 ℃)、初始pH(6.0、6.5、7.0、7.5、8.0)、接种量(1%、3%、5%、7%、9%)、培养时间(72 h、84 h、96 h、108 h、120 h)及菌龄(12 h、18 h、24 h、30 h、36 h)对纳豆激酶活力的影响。
(2)响应面试验
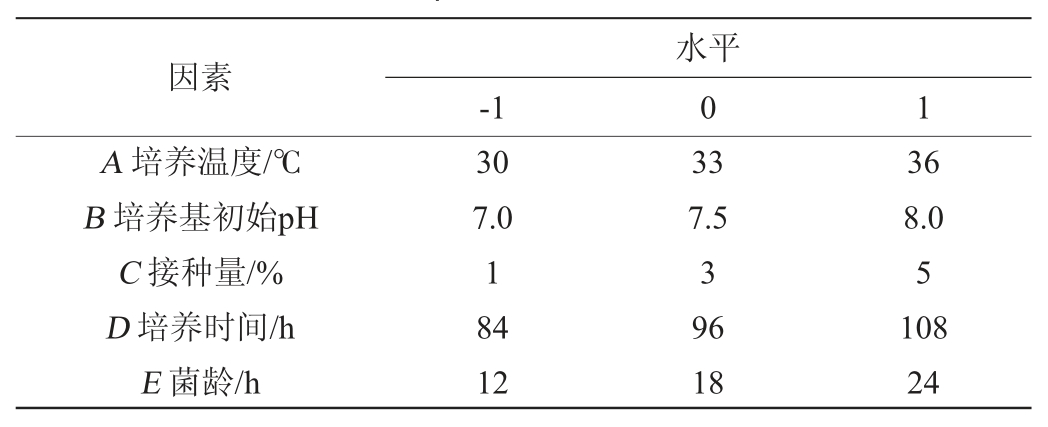
在单因素试验的基础上,进行响应面优化试验。根据Box-Behnken设计原理,以培养温度(A)、培养基初始pH(B)、接种量(C)、培养时间(D)、菌龄(E)为自变量,纳豆激酶活力(Y)为响应值,采用Design-Expert 8.0.6软件进行5因素3水平的响应面分析试验,共分46个试验单元。其中40个为析因子,6个为中心重复试验以估计误差。Box-Behnken试验设计因素与水平见表1。
表1 培养条件优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for culture conditions optimization
2 结果与分析
2.1 培养条件优化单因素试验
2.1.1 培养温度的选择
不同培养温度对纳豆芽孢杆菌产纳豆激酶活力的影响见图1。由图1可知,当培养温度为27~33 ℃时,纳豆激酶活力随温度升高而增大;当培养温度为33 ℃时,纳豆激酶活力最高,为4 531 FU/mL;当培养温度为33~39 ℃时,纳豆激酶活力有所下降。培养温度由27 ℃升到33 ℃,纳豆激酶活力逐渐升高,可见适温可提高菌体的活性;培养温度由33 ℃升到39 ℃,纳豆激酶活力逐渐降低,可能高温促进了菌体的衰亡,影响了纳豆激酶的产量。因此,最适培养温度为33 ℃。
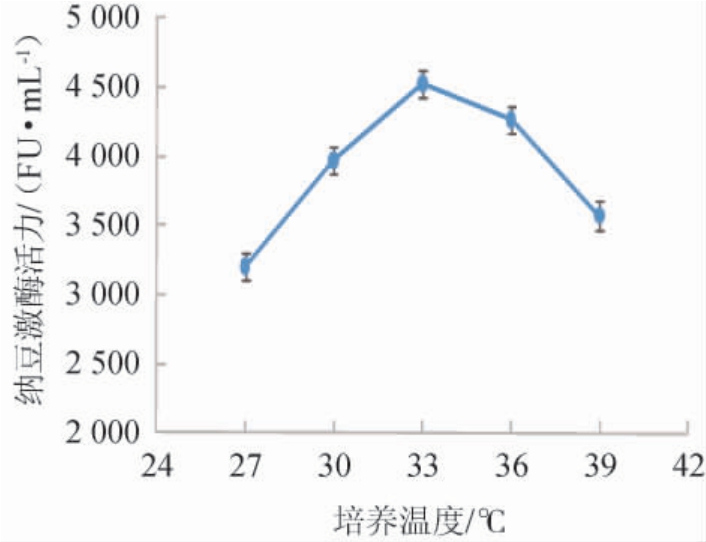
图1 不同培养温度对纳豆激酶活力的影响
Fig.1 Effect of different culture temperature on nattokinase activity
2.1.2 培养基初始pH的选择
不同培养基初始pH值对纳豆芽孢杆菌产纳豆激酶活力的影响见图2。
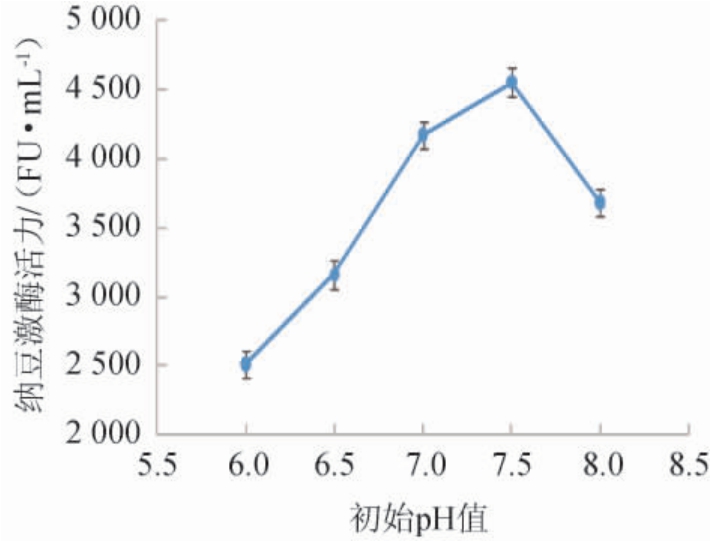
图2 不同培养基初始pH对纳豆激酶活力的影响
Fig.2 Effect of different medium initial pH on nattokinase activity
由图2可知,当培养基初始pH为6.0~7.5时,纳豆激酶活力随培养基初始pH升高而增大;当培养基初始pH为7.5时,纳豆激酶活力最高,为4 556 FU/mL;当培养基初始pH为7.5~8.0时,纳豆激酶活力有所下降。pH偏低或偏高都不利于纳豆激酶的合成。因此,最适培养基初始pH值为7.5。
2.1.3 接种量的选择
不同接种量对纳豆芽孢杆菌产纳豆激酶活力的影响见图3。
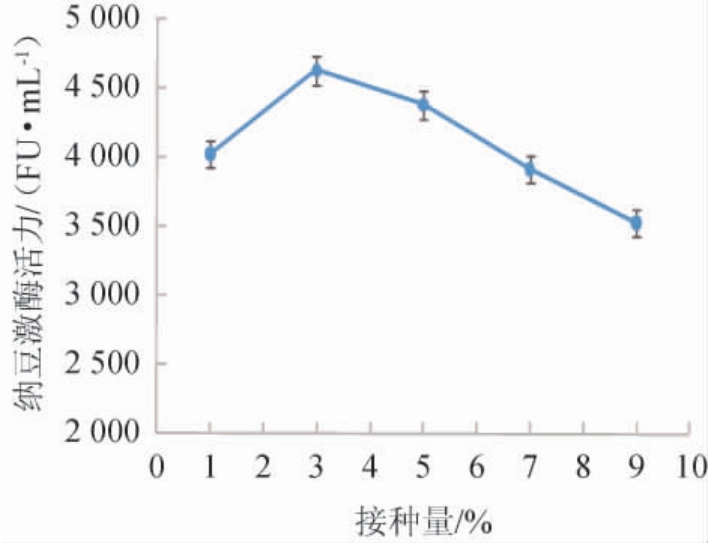
图3 不同接种量对纳豆激酶活力的影响
Fig.3 Effect of different inoculum on nattokinase activity
由图3可知,当接种量为1%~3%时,纳豆激酶活力随接种量升高而增大;当接种量为3%时,纳豆激酶活力最高,为4 627 FU/mL;当接种量为3%~9%时,纳豆激酶活力有所下降。接种量偏小影响菌体的生长、接种量偏大影响物质的过快消耗,都阻碍了纳豆激酶的产生。因此,最适接种量为3%。
2.1.4 培养时间的选择
不同培养时间对纳豆芽孢杆菌产纳豆激酶活力的影响见图4。
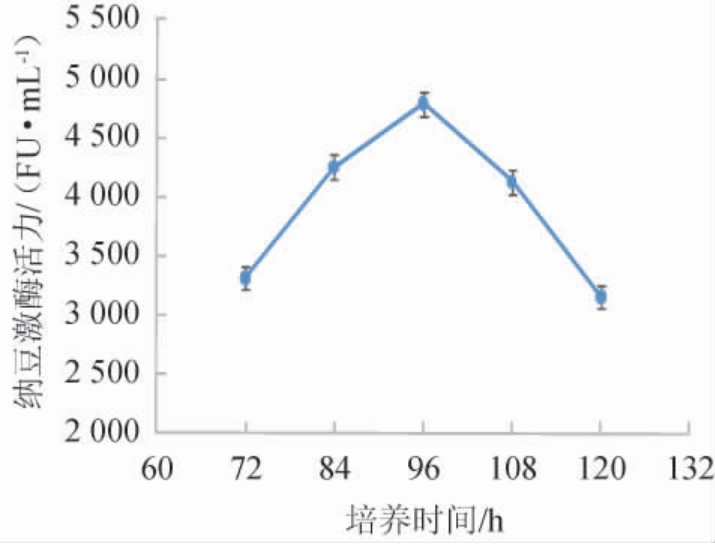
图4 不同培养时间对纳豆激酶活力的影响
Fig.4 Effect of different culture time on nattokinase activity
由图4可知,当培养时间为72~96 h时,纳豆激酶活力随培养时间延长而增大;当培养时间为96 h时,纳豆激酶活力最高,为4 792 FU/mL;当培养时间为96~120 h时,纳豆激酶活力有所下降。发酵时间过短有部分产物还没有分泌完全,发酵时长偏长又可能导致纳豆激酶作为营养被菌体利用,都达不到生产的最大效益化。因此,最适培养时间为96 h。
2.1.5 菌龄的选择
不同菌龄对纳豆芽孢杆菌产纳豆激酶活力的影响见图5。
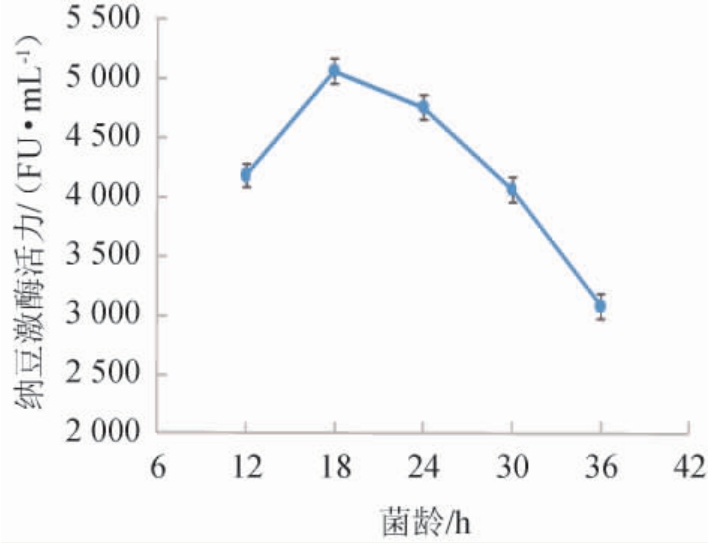
图5 不同菌龄对纳豆激酶活力的影响
Fig.5 Effect of different cell age on nattokinase activity
由图5可知,当菌龄为12~18 h时,纳豆激酶活力随菌龄升高而增大;当菌龄为18 h时,纳豆激酶活力最高为5 069 FU/mL,种子液在对数期转接发酵瓶,菌种活力最强,迟缓期和衰亡期转种都不能使菌种的生理代谢最活跃;当菌龄为18~36 h时,纳豆激酶活力有所下降。因此,最适菌龄为18 h。
2.2 培养条件优化响应面试验
2.2.1 Box-Benhnken试验结果与分析
Box-Benhnken试验设计及结果见表2,方差分析结果见表3。
表2 培养条件优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for culture conditions optimization
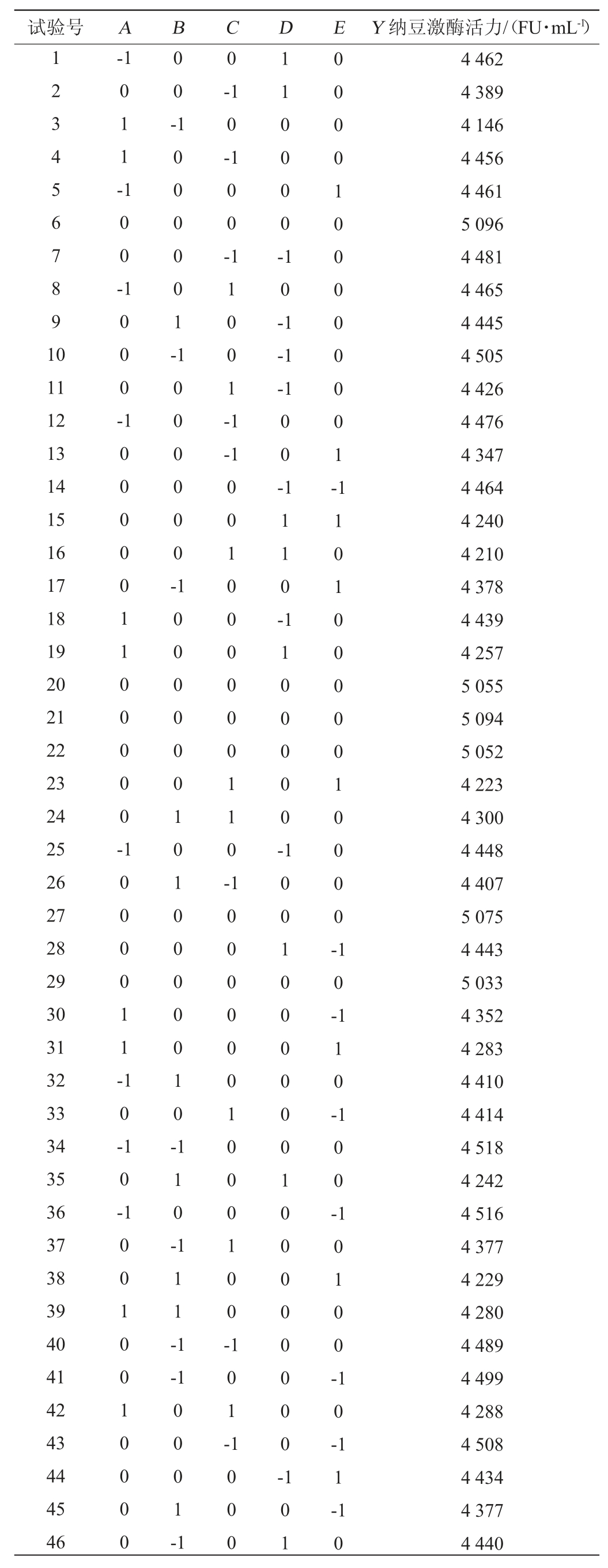
表3 回归模型方差分析
Table 3 Variance analysis of regression model

注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。
利用Design-Expert 8.0.6 软件对Box-Benhnken试验结果进行响应面分析,得到纳豆激酶活力(Y)对培养温度(A)、培养基初始pH(B)、接种量(C)、培养时间(D)、菌龄(E)的多元二次回归方程如下:

由表3可知,模型P值<0.000 1,模型极显著,失拟项P值0.054 1>0.05,失拟项不显著,表明模型拟合性良好。模型决定系数R2=0.979 1,调整决定系数R2Adj=0.962 4,说明有97.91%的数据都可用该方程进行解释,具有较高相关性,模型试验误差合理。由P值可知,一次项A、B、C、D、E,二次项A2、B2、C2、D2、E2对结果影响极显著(P<0.01),交互项AB对结果影响显著(P<0.05),其他交互项对结果影响不显著(P>0.05)。由F值可知,5个因素对纳豆激酶活力影响由大到小顺序为:培养温度(A)>菌龄(E)>培养时间(D)>接种量(C)>培养基初始pH(B)。
利用Design-Expert 8.0.6软件根据多元二次回归方程绘制培养温度(A)和培养基初始pH(B)间交互作用的三维响应面及等高线,结果见图6。
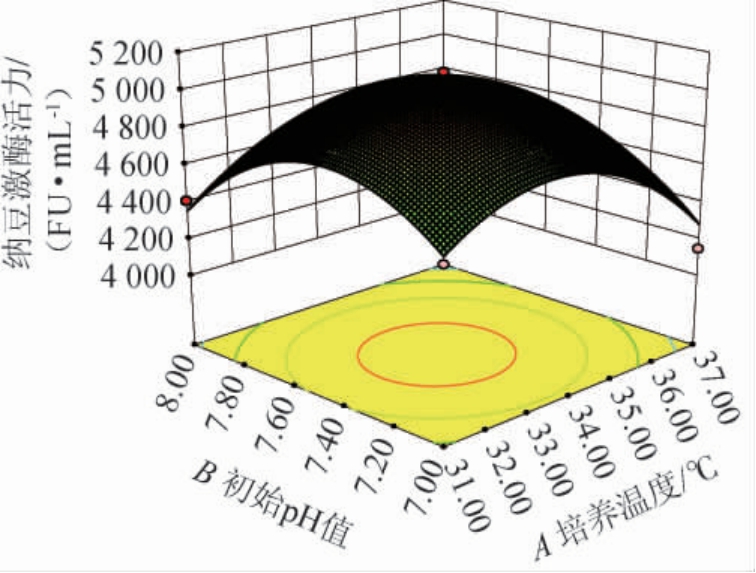
图6 培养温度与培养基初始pH间交互作用对纳豆激酶活力影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between culture temperature and culture medium initial pH on nattokinase activity
由图6可知,纳豆激酶活力随着培养温度(A)和培养基初始pH(B)两者均呈现先增加后减少的趋势,A、B间交互作用响应面较为陡峭,等高线椭圆程度较为明显,表明二者间交互作用对纳豆激酶活力的影响显著(P<0.05)。
2.2.2 模型验证
根据二次回归方程得到纳豆激酶优化后的培养条件为:培养温度33.66 ℃、培养基初始pH 7.47、接种量2.86%、培养时间95.15 h、菌龄17.51 h。在此条件下,纳豆激酶活力预测值为5 079 FU/mL。为了方便实际操作,将培养条件修正为:培养温度34 ℃、培养基初始pH 7.5、接种量3%、培养时间95 h、菌龄17.5 h。在此条件下进行3次平行验证试验,纳豆激酶活力分别为5 092 FU/mL、5 083 FU/mL、5 087 FU/mL,平均实际值为5 087 FU/mL,与预测值基本一致,纳豆激酶活力较优化前提高了18.83%。
3 结论
本研究取影响纳豆激酶活力的5个重要条件因子,在单因素试验的基础上,根据Box-Behnken设计原理,设计5因素3水平的响应面试验,得出纳豆激酶的最佳培养条件为:培养温度34 ℃、发酵培养基初始pH值7.5、接种量3%、培养时间95 h、菌龄17.50 h。在此最佳培养条件下,纳豆激酶活力达到5 087 FU/mL,较优化前提高18.83%。
[1]CHEN H J,MCGOWAN E M,REN N N,et al.Nattokinase:a promising alternative in prevention and treatment of cardiovascular diseases[J].Biomark Insights,2018,13:1177271918785130.
[2]JU S Y,CAO Z L,WONG C,et al.Isolation and optimal fermentation condition of the Bacillus subtilis subsp.natto strain WTC016 for nattokinase production[J].Fermentation,2019,5(4):92.
[3]朱俊丰,刘帅,赵鹏燕,等.纳豆枯草芽孢杆菌LNUB236 所产纳豆激酶的溶栓活性[J].食品科学,2020,41(13):148-159.
[4]VIANNEY Y M,TJOA S E E,ADITAMA R,et al.Designing a less immunogenic nattokinase from Bacillus subtilis subsp.natto:a computationalmutagenesis[J].J Mol Mode,2019,25(11):1-12.
[5]ZHANG B,CHAI J,HE L M,et al.Nattokinase produced by natto fermentation with Bacillus subtilis inhibits breast cancer growth[J].Int J C Exp Med,2019,12(12):13380-13387.
[6]刘璐.纳豆菌液态发酵荞麦产纳豆激酶及其代谢特性分析[J].化工管理,2020,29(20):43-44.
[7]满丽莉,向殿军.传统发酵豆制品中纳豆激酶产生菌的筛选及发酵培养基的优化[J].中国调味品,2019,44(6):44-49,55.
[8]张海粟,王家林,于江淼.纳豆激酶的研究及展望[J].食品与发酵科技,2019,55(4):92-95,111.
[9]YOO H J,KIM M,KIM M,et al.The effects of nattokinase supplementation on collagen-epinephrine closure time,prothrombin time and activated partial thromboplastin time in nondiabetic and hypercholesterolemic subjects[J].Food Funct,2019,10(5):2888-2893.
[10]薛莹莹,林福兴,别小妹,等.ARTP 诱变联合抗生素抗性选育纳豆激酶高产菌株[J].食品工业科技,2019,40(23):93-97.
[11]BHATT P C,PATHAK S,KUMAR V,et al.Attenuation of neurobehavioral and neurochemical abnormalities in animal model of cognitive deficits of Alzheimer′s disease by fermented soybean nanonutraceutical[J].Inflammopharmacology,2018,26(1):105-118.
[12]MAN L L,XIANG D J,ZHANG C L.Strain screening from traditional fermented soybean foods and induction of nattokinase production in Bacillus subtilis MX-6[J].Probiotics Antimicro,2019,11(1):283-294.
[13]TAKANO A,HIRATA A,OGASAWARA K,et al.Posterior vitreous detachment induced by nattokinase(subtilisin NAT):a novel enzyme for pharmacologic vitreolysis[J].Invest Ophthalmol Vis Sci,2006,47(5):2075-2079.
[14]王艳艳,邓启华.纳豆激酶液体发酵条件优化的研究[J].中国酿造,2013,32(12):83-87.
[15]熊晓辉,梁剑关,熊强.纳豆激酶液体发酵条件的优化[J].食品与发酵工业,2004,30(1):62-66.
[16]董明盛,江晓,江汉湖,等.溶栓纳豆菌的筛选鉴定及其发酵特性研究[J].南京农业大学学报,2001,24(1):95-98.
[17]田秀媛,孙智杰.产纳豆激酶枯草芽孢杆菌种子液培养条件的优化[J].微生物杂志,2006,26(1):54-56.
[18]KWON E Y,KIM K M,KIM M K,et al.Production of nattokinase by high cell density fed-batch culture of Bacillus subtilis[J].Bioprocess Biosyst Eng,2011,34(7):789-793.
[19]UNREAN P,NGUYEN N H A.Metabolic pathway analysis and kinetic studies for production of nattokinase in Bacillus subtilis[J].Bioprocess Biosyst Eng,2013,36(1):45-56.
[20]刘开放,席志文,黄琳娜,等.布拉酵母高密度发酵培养基及发酵工艺优化[J].食品科学,2019,40(8):56-62.
[21]叶广彬,陈源红,王长丽,等.柠檬明串珠菌TD1产胞外多糖条件的响应面法优化及其抗氧化性研究[J].中国酿造,2018,37(11):70-75.
[22]王正齐,张薄博,陈磊,等.响应面法优化樟芝胞外多糖的发酵条件[J].食品工业科技,2018,39(11):99-107.
[23]刘刚,梁琪,宋雪梅,等.Plackett-Burman和Box-Behnken 试验优化嗜热链球菌Q4F8产胞外多糖工艺[J].食品科学,2019,40(20):136-143.
[24]余江淼.黑纳豆的发酵工艺及其纳豆激酶微囊稳定性的研究[D].青岛:青岛科技大学,2020.
[25]高泽鑫.高产纳豆激酶菌株的筛选及其酶学稳定性的研究[D].贵阳:贵州大学,2018.