糖尿病(diabetes mellitus,DM)是一种由胰岛素代谢障碍或分泌不足引起的以血糖浓度偏高为特征的代谢性疾病[1]。我国是全球糖尿病患者人数最多的国家,患病人群已超过2亿[2],近年来糖尿病患病率不断攀升,已高达10.9%[3]。目前,市面上的多种降血糖药物虽然治疗效果明显,但存在着引起腹胀腹泻、皮肤过敏等不良反应和市场价格较高等问题[4]。因此,从天然植物中制备出安全、有效且价格低廉的活性物质用于代替药物治疗和预防糖尿病是当前研究和探索的热点。
玉米须是玉蜀黍(Zea mays)的花柱和花头,形如发丝状,呈棕黄色[5],在我国属于传统中药材。玉米须富含黄酮及其苷类、甾醇类、糖类、多酚类、有机酸等化学成分,具有降血糖、抗氧化、抗疲劳、抑菌抗炎等作用[6-9],通常被用于防治肿瘤[10]和治疗肥胖、糖尿病等代谢综合征[11]。党婷等[12]研究发现,玉米须水提取物具有降低链脲佐菌素(streptozotocin,STZ)所致Ⅱ型糖尿病小鼠血糖的作用;宋烨等[13]研究发现,玉米须水煎液能缓解Ⅰ型糖尿病小鼠的高血糖症状,降低Ⅱ型糖尿病小鼠的血糖值;李敏等[14]研究发现,乳酸杆菌(Lactobacillus)玉米须发酵液对糖尿病小鼠具有良好的体内外降血糖作用并可调节其血脂异常。在我国玉米产量较大,大田玉米采用机器收割,玉米须无法单独回收而被废弃。近年来,随着鲜食玉米的市场份额增加,其嫩青玉米须被很好的保留了下来。但嫩青玉米须需晾晒、干燥后才能储存,并且干燥玉米须储存占地空间较大,导致人力、物力资源的极大浪费。因此,如何将丰富的玉米须资源充分、合理的高值化利用,已成为值得探讨和研究的重点问题。
类干酪乳杆菌(Lactobacillus paracasei)属于乳酸杆菌属,具有促进糖、蛋白质和脂肪的分解代谢,促进营养物质的吸收,调节肠道菌群平衡及调节免疫等作用[15]。酿酒酵母(Saccharomyces cerevisiae)属于酵母菌属,酵母菌的存在对乳酸菌生长代谢具有促进作用,并且能够提高乳酸菌的稳定性,另外,酵母菌的参与还可抑制有害菌的生长,对人体产生潜在的益生作用[16]。本研究利用多菌种发酵的方法,以玉米须发酵液的α-葡萄糖苷酶抑制率为评价指标,采用单因素及正交试验探究最佳发酵工艺条件和发酵液的稳定性,以期为开发具有降血糖功能性的产品提供重要参考。
1 材料与方法
1.1 材料与试剂
玉米须:市售;类干酪乳杆菌(Lactobacillus paracasei)和酿酒酵母(Saccharomyces cerevisiae):上海沪峥生物科技有限公司;α-葡萄糖苷酶(酶活50 U/mg)、4-硝基苯-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucoside,PNPG):美国Sigma公司;磷酸盐缓冲液(phosphate buffered saline,PBS):北京酷来搏科技有限公司;MRS肉汤培养基、酵母膏麦芽汁琼脂培养基:北京奥博星生物技术有限责任公司;人工胃液、人工小肠液:上海樊克生物科技有限公司;所有试剂均为分析纯或生化试剂。
1.2 仪器与设备
GRP-9080隔水式恒温培养箱、DRP-9082电热恒温培养箱、SHP-250F生化培养箱、DR-M2阿贝斯折光仪、TNZ5-WS低速多管架自动平衡离心机:湖南湘仪实验室仪器开发有限公司;PA紫外可见分光光度计:北京普析通用仪器有限责任公司;SW-CG-2 FD洁净工作台:苏州安泰空气技术有限公司;YXQ-100G立式压力蒸汽灭菌器:上海博迅医疗生物仪器股份有限公司。
1.3 试验方法
1.3.1 玉米须前处理条件优化
玉米须经清水漂洗2次,45 ℃烘干4 h,粉碎,分别将不过筛、过40目筛和过60目筛的玉米须用蒸馏水以料液比1∶10(g∶mL)进行提取,提取条件为80 ℃、90 ℃、100 ℃各回流提取2 h和浸泡提取12 h、24 h。提取液冷却后过滤2次,滤液4 000 r/min离心20 min,取上清液并抽滤。抽滤液121 ℃灭菌15 min后冷却至室温。用阿贝斯折光仪检测无菌抽提液中固形物含量[17]。
1.3.2 菌种筛选
分别以类干酪乳杆菌单菌、酿酒酵母单菌、复合菌种(酿酒酵母∶类干酪乳杆菌=1∶3)为玉米须水提液发酵剂,根据1.3.1方法,在料液比1∶15(g∶mL)、菌种接种量8%、各菌种在最适发酵时间和温度条件下进行玉米须水提液发酵,对照组用玉米须水提液代替发酵样品。以α-葡萄糖苷酶的抑制率为评价指标,筛选最佳发酵菌种。
1.3.3 玉米须发酵工艺优化单因素试验
选取上述最佳菌种进行发酵,分别考察料液比(1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL))、复合菌种接种量(4%、6%、8%、10%、12%)、发酵时间(24 h、48 h、72 h、96 h、120 h)、发酵温度(28 ℃、30 ℃、32 ℃、34 ℃、36 ℃)对α-葡萄糖苷酶抑制率的影响,筛选最佳发酵条件。
1.3.4 玉米须发酵工艺优化正交试验
在单因素试验的基础上,选定最佳发酵条件范围,设计4因素3水平L9(34)正交试验进一步优化发酵工艺条件,正交试验设计因素与水平见表1。
表1 玉米须发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for corn stigma fermentation process optimization

1.3.5 玉米须发酵液的稳定性分析
热稳定性:发酵液分别在20℃、40℃、60℃、80℃、100℃、120 ℃加热30 min后冷却至室温,以未加热样品作为对照组,测定其α-葡萄糖苷酶抑制率,并表示为相对于对照组的活性。
pH稳定性:用1 mol/L HCl 或NaOH 调节发酵液的pH分别为2、4、6、8、10、12、14,在室温条件下孵育30 min后调节样品溶液pH至7.0,以未处理样品作为对照组,测定其α-葡萄糖苷酶抑制率,并表示为相对于对照组的活性。
体外模拟胃肠道消化稳定性:参考文献[18],取200 mL人工胃液加入20 mL发酵液在37 ℃条件下恒温振荡2 h。取100 mL人工小肠液加入经胃部消化过的发酵液在37 ℃条件下恒温继续振荡2 h。在体外消化过程中分别取消化0 h、0.5 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h、3.5 h、4.0 h消化液,将取得的消化液快速放入沸水浴中10 min,测定其α-葡萄糖苷酶抑制率,并表示为相对于对照组的活性。
1.3.6 测定方法
α-葡萄糖苷酶抑制率的测定:参照文献[19],略有改动:用0.1 mol/L pH 6.8的PBS将α-葡萄糖苷酶(50 U/mg)和PNPG分别配制成0.2 U/mL和10 mmol/L的溶液备用。取3 mL PBS、100 μL样品、0.5 mL PNPG于试管中混合并搅拌均匀,在37 ℃保温5 min后,加入0.5 mL α-葡萄糖苷酶并保温60 min后,加入5 mL 0.2 mol/L的碳酸钠溶液终止反应。阳性对照用阿卡波糖,调零组用蒸馏水,空白组用缓冲溶代替样品和α-葡萄糖苷酶,对照组用缓冲液代替样品。溶液在波长400 nm处测吸光度值,并记录数值。依据下式计算玉米须发酵液对α-葡萄糖苷酶的抑制率:
式中:A样品、A样品、A空白分别为对照组、样品组、空白组吸光度值。
相对活性的检测:根据1.3.6方法检测处理后样品α-葡萄糖苷酶抑制率,对照组用未经过处理的发酵液代替样品。依据下式计算处理后的发酵液α-葡萄糖苷酶抑制率相对活性:
1.3.7 数据处理
所有试验均重复3次,数据采用SPSS19.0和Origin2019进行分析和作图。
2 结果与分析
2.1 玉米须前处理条件优化
由图1可知,在同一提取条件下,玉米须水提液固形物含量随过筛目数增加而显著升高(P<0.05),其中过60目筛(粒径<300 μm)的玉米须水提液中固形物含量最高,其次是过40目筛(粒径<630 μm)的玉米须水提液,而未过筛的玉米须水提液最低。这说明玉米须粉碎后的粒度大小对于提取效率有显著的影响。对于不同的提取条件,回流提取的水提液中固形物含量显著高于浸泡提取(P<0.05)。在90 ℃和100 ℃回流提取2 h的过60目筛玉米须提取液中固形物含量最高,分别达到(3.69±0.05)%和(3.72±0.05)%,但两者无显著差异(P>0.05)。因此综合成本因素,玉米须前处理最优条件为玉米须粉碎、过60目筛,于90 ℃回流提取2 h。

图1 不同前处理条件对玉米须水提液固形物含量的影响
Fig.1 Effect of different pretreatment conditions on solid content of water extract of corn stigma
同一条件下不同小写字母表示差异显著(P<0.05)。下同。
2.2 菌种筛选
由图2可知,玉米须水提液的α-葡萄糖苷酶抑制率为(42.00±2.11)%。发酵后,其发酵液的α-葡萄糖苷酶抑制率显著增加(P<0.05)。3种菌种按玉米须发酵液的α-葡萄糖苷酶抑制率大小排序为复合菌种[(62.13±2.10)%]>类干酪乳杆菌[(53.87±1.91)%]>酿酒酵母[(47.97±2.03)%]。玉米须复合菌种发酵液对α-葡萄糖苷酶的抑制率表现出较大差异。类干酪乳杆菌和酿酒酵母存在着互利共生的关系[20],两种菌混合培养过程中富集了大量的肽,提高了培养液中的活菌数,促进乳酸的产生。混合培养过程中酿酒酵母可以不断中和代谢物中的乳酸,从而降低乳酸对类干酪乳杆菌生长的抑制,使得产物不断富集。因此,选择复合菌种(酿酒酵母∶类干酪乳杆菌=1∶3)作为玉米须液态发酵的最适菌株。

图2 不同菌种玉米须发酵液对α-葡萄糖苷酶抑制率的影响
Fig.2 Effect of different strains on α-glucosidase inhibition rate of corn stigma fermentation broth
不同小写字母表示差异显著(P<0.05)。下同。
2.3 单因素试验结果
2.3.1 料液比对玉米须发酵液α-葡萄糖苷酶抑制率的影响
料液比对玉米须发酵液的α-葡萄糖苷酶抑制率的影响见图3。

图3 料液比对玉米须发酵液α-葡萄糖苷酶抑制率的影响
Fig.3 Effect of material to liquid ratio on α-glucosidase inhibition rate of corn stigma fermentation broth
由图3可知,α-葡萄糖苷酶抑制率在料液比为1∶10(g∶mL)到1∶15(g∶mL)区间内呈现上升趋势,溶剂的增多能有效加快玉米须内部物质的扩散速度,增加溶出度;在料液比为1∶15(g∶mL)时,α-葡萄糖苷酶抑制率达到峰值(42.13±1.10)%,可能是因为液料比达到了平衡[21];在1∶15(g∶mL)到1∶30(g∶mL)区间内呈现下降趋势,可能是在达到平衡后溶剂的增多使溶液被稀释,从而使α-葡萄糖苷酶抑制率下降。综上考虑,确定玉米须发酵液最佳的料液比为1∶15(g∶mL)。
2.3.2 复合菌种接种量对玉米须发酵液α-葡萄糖苷酶抑制率的影响
复合菌种接种量对玉米须发酵液α-葡萄糖苷酶抑制率的影响如图4所示,当复合菌种接种量在低于8%范围内,α-葡萄糖苷酶抑制率随复合菌种接种量增加呈现上升趋势。其原因可能是随复合菌种接种量增加,使底物与复合菌种结合的概率增大,复合菌种在单位时间内发酵能力增加致反应充分[22];当复合菌种接种量为8%时,α-葡萄糖苷酶抑制率达到最大值,为(47.94±1.11)%;当复合菌种接种量高于8%,随复合菌种接种量增加,α-葡萄糖苷酶抑制率呈下降趋势。其原因可能是,接种量过大则导致在有限的营养物质下菌种生长受到限制,致使后续进行发酵的动力不足,也可能由于菌种的不断产生并不断积累一些抑制产物,从而限制了发酵过程中菌种的正常生长[23]。综上考虑,确定玉米须发酵液最佳的复合菌种接种量为8%。

图4 复合菌种接种量对玉米须发酵液α-葡萄糖苷酶抑制率的影响
Fig.4 Effect of compound strains inoculum on α-glucosidase inhibition rate of corn stigma fermentation broth
2.3.3 发酵温度对玉米须发酵液α-葡萄糖苷酶抑制率的影响
发酵温度对玉米须多菌种发酵液α-葡萄糖苷酶抑制率的影响结果如图5所示,当发酵温度在28~34 ℃范围内,随发酵温度升高α-葡萄糖苷酶抑制率呈上升的趋势,其原因可能是随温度升高,类干酪乳杆菌生长速度和代谢能力增加,类干酪乳杆菌内部活动加剧,有利于抑制α-葡萄糖苷酶的活性物质积累[24];当发酵温度为34 ℃时,α-葡萄糖苷酶抑制率达到最大值,为(50.64±1.12)%;当发酵温度高于34 ℃时,α-葡萄糖苷酶抑制率随发酵温度升高呈下降趋势。其原因可能是发酵温度过高,酿酒酵母生长繁殖能力受到限制,使发酵副产物积累过多影响复合菌种的发酵能力和α-葡萄糖苷酶的抑制率[25]。综上考虑,确定玉米须多菌种发酵液最佳的发酵温度为34 ℃。

图5 发酵温度对玉米须发酵液α-葡萄糖苷酶抑制率的影响
Fig.5 Effect of fermentation temperature on α-glucosidase inhibition rate of corn stigma fermentation broth
2.3.4 发酵时间对玉米须发酵液α-葡萄糖苷酶抑制率的影响
发酵时间对玉米须多菌种发酵液α-葡萄糖苷酶抑制率的影响如图6所示,当发酵时间在24~72 h范围内,α-葡萄糖苷酶抑制率呈上升趋势,其原因可能是在发酵初期,发酵液中能源物质充足,可以提供足够的物质使复合菌种进行发酵;当发酵时间为72 h时,α-葡萄糖苷酶抑制率达到最大值,为(55.61±1.12)%;当发酵时间高于72 h时,随发酵时间延长α-葡萄糖苷酶抑制率呈下降趋势。其原因可能是随发酵时间延长菌种进入衰亡期,致使后续进行发酵的动力不足,发酵副产物积累过多,pH下降,从而具有α-葡萄糖苷酶抑制功能的活性物质受到影响。综上考虑,确定玉米须发酵液最佳的发酵时间为72 h。

图6 发酵时间对玉米须发酵液α-葡萄糖苷酶抑制率的影响
Fig.6 Effect of fermentation time on α-glucosidase inhibition rate of corn stigma fermentation broth
2.4 正交试验结果
正交试验结果与分析见表2,方差分析见表3。
表2 玉米须发酵工艺条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for corn stigma fermentation process optimization

表3 正交试验结果的方差分析
Table 3 Variance analysis of orthogonal test results

注:“**”表示对结果影响极显著(P<0.01)。
由表2可知,通过方差分析各因素对发酵液影响大小依次为料液比>接种量>发酵时间>发酵温度;通过极差分析发现最优组合为A2B2C2D3。当玉米须发酵液工艺参数料液比为1∶15(g∶mL),复合菌种接种量为8%;发酵温度为34 ℃,发酵时间为96 h。该条件下玉米须发酵液对α-葡萄糖苷酶抑制率最高,为(62.13±2.10)%,具有良好的降低血糖作用。由表3可知,接种量、料液比和发酵时间对发酵液α-葡萄糖苷酶抑制率具有显著性影响(P<0.01)。
2.5 玉米须发酵液的稳定性
2.5.1 热稳定性
由图7可知,发酵液经过不同温度处理后,对α-葡萄糖苷酶抑制率相对活性影响不显著(P>0.05),仍保持较高的抑制活性。结果表明,发酵液具有较好的热稳定性,可以应用到热处理食品中。
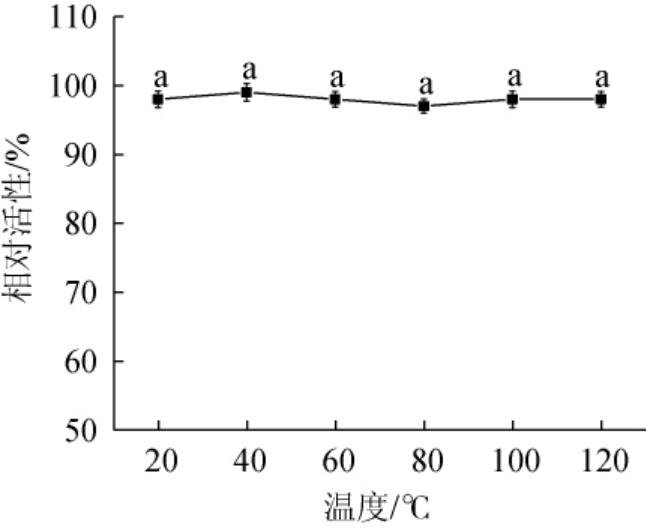
图7 玉米须发酵液热稳定性
Fig.7 Thermal stability of corn stigma fermentation broth
2.5.2 pH稳定性
由图8可知,当pH<6或者pH>8时,处理后的发酵液对α-葡萄糖苷酶抑制活性略有损失。这可能是由于发酵液中的活性物质在酸性或碱性过强的条件下降解成非活性片段[26]。表明发酵液可以应用到宽pH范围的食品体系中,其生物活性不易受pH值影响。

图8 玉米须发酵液pH稳定性
Fig.8 pH stability of corn stigma fermentation broth
2.5.3 体外模拟胃肠道消化稳定性
为了发酵液中的活性物质在体内发挥其活性,要满足的要求之一就是能抵抗胃肠道消化和降解的能力。体外模拟胃肠道消化可用于研究玉米须发酵液在体内的生物利用度。
由图9可知,在胃环境中消化2 h,玉米须发酵液α-葡萄糖苷酶抑制率相对活性由(98±1.02)%降低至(89±1.20)%,在十二指肠环境中α-葡萄糖苷酶抑制活性趋于稳定。这可能是因为胃部的酸性环境导致发酵液中的活性物质发生降解[27-28]。小肠的环境近中性对α-葡萄糖苷酶抑制率的影响较小。

图9 玉米须发酵液体外模拟胃肠道消化稳定性
Fig.9 Simulated gastrointestinal digestive stability in vitro of corn stigma fermentation broth
3 结论
玉米须水提液中含有多糖、生物碱、黄酮、皂苷等多种生物活性物质,通过多菌种复合发酵技术处理后,多糖、皂苷和黄酮等活性物质的分子质量、化学结构发生变化,提高了生物活性。其α-葡萄糖苷酶抑制活性一定温度和pH范围内保持稳定,且在模拟胃肠道系统中,消化后的α-葡萄糖苷酶抑制活性有所下降,但还是保留了较高的活性。本研究获得的玉米须发酵液表现出较好的α-葡萄糖苷酶抑制活性,具有降糖作用。为人体降血糖功能膳食的开发利用提供了基础。此发酵液制备方法不添加任何化学试剂,制作成本低廉,解决了玉米须资源浪费问题,也为玉米副产物深加工提供了新途径。
[1]Expert Group of Metformin in Clinical Practice.Chinese expert consensus statement on metformin in clinical practice[J].Chinese Med J,2020,133:1445-1447.
[2]武安琪,衣春敏,赵学旭,等.具有α-葡萄糖苷酶抑制活性的苦杏仁醇溶蛋白酶解物制备及稳定性表征[J].现代食品科技,2022,38(4):1-10.
[3]赵博,张意,王淼,等.中医药治疗2型糖尿病胰岛素抵抗研究进展[J].现代中西医结合杂志,2021,38(4):2162-2166.
[4]朱作艺,张玉,王君虹,等.蜂王浆蛋白肽的制备及其降血糖和抗氧化活性研究[J].食品工业科技,2020,41(17):45-50,57.
[5]WANG G Q,XU T,BU X M,et al.Anti-inflammation effects of corn silk in a rat model of carrageenin-induced pleurisy[J].Inflammation,2012,35(3):822-827.
[6]张培丽,庄岩,霍金海,等.玉米须有效化学成分及药理作用的研究概况[J].黑龙江中医药,2017(1):74-75.
[7]刘杰,郭江涛,徐剑,等.黔产玉米须不同萃取部位抗氧化作用研究[J].食品工业,2019,40(1):179-183.
[8]陈珠,夏道宗,陈梦雅,等.玉米须、马齿苋提取物对小鼠抗疲劳作用及配伍协同研究[J].云南中医学院学报,2015,38(2):15-17.
[9]鞠健,乔宇,周文星,等.玉米须总黄酮的闪式提取及提取物抑菌作用的研究[J].食品科技,2016,41(3):208-212.
[10]吴先闯,杜钢军,郝海军,等.玉米须多糖对H22 荷瘤小鼠的肿瘤抑制作用及其对小鼠免疫功能的影响[J].华西药学杂志,2015,30(1):26-29.
[11]尚浩南,陈珺明,阮君,等.玉米须防治代谢综合征的药理研究进展[J].中药新药与临床药理,2019,30(10):1273-1276.
[12]党婷,曹燕,李雯,等.玉米须水提取物对2型糖尿病小鼠的降血糖作用研究[J].卫生职业教育,2018,24(11):2627-2630.
[13]宋烨,王明彦,宋成武,等.玉米须水煎液对1型、2型糖尿病小鼠降血糖活性的研究[J].时珍国医国药,2013,36(9):112-113.
[14]李敏,刘畅.不同益生菌发酵玉米须产物对体内外降糖作用的影响[J].安徽农学通报,2021,27(2):16-23.
[15]赵红霞,詹勇,许梓荣.乳酸菌的研究及其应用[J].江西饲料,2003(1):1-2.
[16]闫彬,贺银凤.酸马奶中乳酸菌与酵母菌的共生发酵特性[J].食品科学,2012,33(7):131-137.
[17]张伟清,林媚,徐程楠,等.柑橘可溶性固形物和总酸含量测定方法比较[J].浙江农业科学,2019,60(11):2094-2095,2099.
[18]王洁,陈思佳,高哲,等.具α-葡萄糖苷酶抑制作用的蚕豆蛋白酶解物的制备[J].中国油脂,2021,9(18):28-32.
[19]汪磊.刺梨多糖的分离纯化、降血糖作用及其对肠道微生态的影响[D].广州:华南理工大学,2019.
[20]刘敏敏.酸马奶中乳酸菌和酵母菌潜在共生菌筛选及发酵特性研究[D].呼和浩特:内蒙古农业大学,2011.
[21]叶兆伟,叶润,赫丁轩,等.息半夏多糖提取工艺优化及其抗氧化活性研究[J].中国食品添加剂,2022,33(1):90-98.
[22]谢晓阳,范毅,王伟,等.响应面法优化刺梨果多糖发酵工艺研究[J].中国酿造,2021,40(4):177-181.
[23]薛燕,李丽,刘光荣,等.铁皮石斛多糖液态发酵工艺及其抗氧化活性研究[J].食品工业科技,2017,38(9):155-159.
[24]刘彩婷,周鸿翔.不同发酵工艺对蓝莓果酒品质的影响[J].食品与发酵工业,2020,46(4):172-179.
[25]李安,刘小雨,张惟广.发酵及贮藏条件对蓝莓果酒花色苷稳定性的影响及其抗氧化性研究[J].中国酿造,2020,39(2):146-151.
[26]李利华.花椰菜多糖的提取工艺优化及稳定性研究[J].粮食与油脂,2021,34(8):74-77,84.
[27]HU J L,NIE S P,MIN F F,et al.Artificial simulated saliva,gastric and intestinal digestion of polysaccharide from the seeds of Plantago asiatica L.[J].Carbohyd Polym,2013,92(2):1143-1150.
[28]FU Y,YOUNG J F,DALSGAARD T K,et al.Separation of angiotensin I-converting enzyme inhibitory peptides from bovine connective tissue and their stability towards temperature,pH and digestive enzymes[J].Int J Food Sci Tech,2015,50:1234-1243.