中国白酒品种繁多,不同白酒酿造工艺中采用的酒曲也不尽相同。根据酒曲所用的原料和形状的不同可分为大曲、小曲和麸曲[1]。大曲常以小麦为主要原料(大麦、豌豆等为辅料),采用生料制曲、自然接种,自然发酵而成[2],主要用于酿造酱香型、浓香型和清香型等白酒。根据大曲品温的不同,可分为高温大曲(60~70 ℃)、中温大曲(45~50 ℃)及低温大曲(40~45 ℃)[3]。中温大曲是浓香型白酒发酵中使用的糖化发酵剂,因此也称浓香型大曲[4]。
大曲含有丰富的微生物酶系,淀粉酶是水解谷物原料的重要酶类[5-7],其酶活力的高低是影响原料利用率和出酒率的重要因素之一[8]。大曲中产淀粉酶微生物的种类繁多,芽孢杆菌属(Bacillus sp.)细菌和曲霉属(Aspergillus sp.)真菌是大曲中淀粉酶的主要产生菌,其中,枯草芽孢杆菌(Bacillus subtilis)是白酒酿造中常见的功能菌,具有很强的分泌降解酶的能力,其分泌的淀粉酶能快速将原料中的淀粉水解为还原糖,进而发酵为醇、酯和各种有机酸,不仅能提高淀粉质原料的利用率还能增加白酒的香气[9-10]。而来源于芽孢杆菌属微生物所产淀粉酶最为常见,如贝莱斯芽孢杆菌(Bacillus velesi),地衣芽孢杆菌(Bacillus licheniformis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、蜡样芽孢杆菌(Bacillus cereus)、枯草芽孢杆菌(Bacillus subtilis)、巨大芽孢杆菌(Bacillus megaterium)等芽孢杆菌[11-14]。王屈祎等[12]从高温大曲中筛选得到一株产淀粉酶贝菜斯芽孢杆菌LT-2,经优化后酶活达到972.88 U/mL,鲁珍等[15]从高温大曲获得产淀粉酶假蕈状芽孢杆菌(Bacillus pseudomycoides)GX05,优化后酶活达到180.12 U/g,毛祥等[16]从酱香型大曲中获得产淀粉酶枯草芽孢杆菌1#,优化后酶活为8 667.79 U/mL。中温大曲作为浓香型白酒酿造的重要组成部分,筛选产淀粉酶功能微生物,优化其发酵条件后并应用到浓香型白酒酿造中,对白酒出酒率和品质的提升具有非常重要的意义。较之于放线菌、霉菌等产淀粉酶微生物,芽孢杆菌具有产酶量高、发酵周期短、成本低和易于规模化生产等优势,其更有发展前景[12]。
本研究利用淀粉水解圈法初筛、摇瓶发酵法复筛从中温大曲中筛选获得产淀粉酶芽孢杆菌,结合菌落形态观察、革兰氏染色和16S rRNA同源序列分析,对其进行菌种鉴定,通过单因素试验、Plackett-Burman试验、最陡爬坡试验和Box-Behnken试验优化其产淀粉酶的培养条件,以期提高中温大曲的液化力和糖化力,丰富产淀粉酶功能微生物资源库,为提升白酒出酒率和品质提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
中温大曲:取自河南某酒企。
蛋白胨、牛肉粉、酵母粉(均为生化试剂):北京奥博星生物技术责任有限公司;可溶性淀粉(生化试剂)、Na2PHO4、MgSO4、葡萄糖(均为分析纯):天津市凯通化学试剂有限公司;琼脂粉(生化试剂)、NaCl(分析纯):生工生物工程(上海)股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):上海麦克林生化科技有限公司;土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒FastDNA SPIN kit for Soil:美国MP biomedicals公司;其余试剂均为国产分析纯。
SPIN kit for Soil:美国MP biomedicals公司;其余试剂均为国产分析纯。
1.1.2 培养基
筛选培养基:蛋白胨10 g/L,牛肉粉5 g/L,NaCl 5 g/L,可溶性淀粉10 g/L,琼脂粉20 g/L,pH值7.0。
种子培养基:蛋白胨10 g/L,牛肉粉5 g/L,NaCl 5 g/L,pH值7.0。
发酵培养基:蛋白胨20 g/L,可溶性淀粉20 g/L,Na2PHO4 5 g/L,MgSO4 0.1 g/L,NaCl 0.1 g/L,pH值7.0。
以上培养基均于121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
LDZX-50KBS型蒸汽灭菌器:上海中安医疗器械厂;SW-CJ-1型超净工作台:苏州净化设备有限公司;ZWY-100H型恒温摇床:上海智城分析仪器有限公司;DH-400型恒温培养箱:上海鸿都电子科技有限公司;HH-S型水浴锅:金坛市医疗仪器厂;TGL-20M型离心机:上海卢湘仪离心机仪器有限公司;721S型分光光度计:上海元析仪器有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪:郑州利研仪器设备有限公司。
1.3 方法
1.3.1 产淀粉酶菌株的分离与初筛
取10 g大曲样品加入90 mL无菌水,180 r/min振荡混匀20 min;进行10倍梯度稀释,将10-3、10-4、10-5梯度的稀释液涂布于筛选培养基上,37 ℃恒温培养24 h;在培养基中滴加0.05%的卢戈式碘液,测定菌落透明圈直径(D)和菌落直径(d)的比值(D/d),进行初筛,取D/d值较大的菌株进行纯化,用于后续复筛试验[17]。
1.3.2 产淀粉酶菌株复筛
将初筛的D/d>2.5的菌株接种至100 mL种子培养基中,于37 ℃、150 r/min振荡培养24 h进行活化,至OD600nm值达到1.0左右,以5%(V/V)接种量接种到装液量为100 mL/250 mL的发酵培养基中,于37 ℃、150 r/min振荡培养48 h后,收集发酵液于5 000 r/min离心5 min,取上清液(粗酶液)测定淀粉酶活力,进行复筛。
1.3.3 高产淀粉酶菌株的鉴定
形态学观察:参照《伯杰细菌鉴定手册》[18]对菌株的菌落及细胞形态进行观察,细胞经革兰氏染色后镜检观察。
分子生物学鉴定:复筛后淀粉酶活最高的菌株按照FastDNA SPIN kit for Soil试剂盒说明书提取DNA,以其为模板,采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3)和1492R(5′-TACGACTTAACCCCAATCGC-3′)为上、下游引物,对其16S rRNA基因片段进行PCR扩增,具体参照刘延波等[19]的方法。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库与已知序列进行比对,通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行比对搜索,选择与待测物种序列相似性最大的同源序列,使用MEGA7.0软件通过邻接法(neighbor-joining,NJ)构建系统发育树,对菌株进行鉴定。
SPIN kit for Soil试剂盒说明书提取DNA,以其为模板,采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3)和1492R(5′-TACGACTTAACCCCAATCGC-3′)为上、下游引物,对其16S rRNA基因片段进行PCR扩增,具体参照刘延波等[19]的方法。将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库与已知序列进行比对,通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行比对搜索,选择与待测物种序列相似性最大的同源序列,使用MEGA7.0软件通过邻接法(neighbor-joining,NJ)构建系统发育树,对菌株进行鉴定。
1.3.4 高产淀粉酶菌株生长曲线和产酶曲线的绘制
将高产淀粉酶菌株的种子液按5%(V/V)的接种量接种到发酵培养基,初始pH值7.0,装液量100 mL/250 mL,37 ℃、150 r/min培养,每6 h取样一次,24 h以后每隔1 d取样一次,测定菌液在波长600 nm处的吸光度值,并取发酵液于5 000 r/min离心5 min,测定上清液的淀粉酶活力,分析该菌株的生长规律及产淀粉酶特点。
1.3.5 高产淀粉酶菌株培养条件优化单因素试验
固定基本培养基成分的碳源为20 g/L可溶性淀粉,氮源为20 g/L蛋白胨,基本培养条件为发酵温度37 ℃,转速150 r/min,初始pH值7,装液量100 mL/250 mL,接种量5%,发酵时间8 d。单因素试验中只改变其中一个因素,其他8个因素固定不变。分别考察碳源种类(可溶性淀粉、葡萄糖、麦芽糖、蔗糖、小麦、高粱、糯米)及其质量浓度(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L)、氮源种类(蛋白胨、牛肉粉、酵母粉、尿素、硫酸铵、硝酸钠)及其质量浓度(10 g/L、20 g/L、30 g/L、40 g/L、50 g/L、60 g/L、70 g/L)、发酵温度(31 ℃、33 ℃、35 ℃、37 ℃、39 ℃、41 ℃)、转速(120 r/min、150 r/min、180 r/min、210 r/min、240 r/min、270 r/min)、初始pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0)、装液量(25 mL/250 mL、50mL/250mL、75mL/250mL、100mL/250mL、125mL/250mL、150 mL/250 mL)及接种量(1%、3%、5%、7%、9%、11%、13%)9个因素对菌株产淀粉酶酶活力的影响。
1.3.6 高产淀粉酶菌株培养条件优化Plackett-Burman试验
在单因素试验的基础上,选取碳源质量浓度(X1)、氮源质量浓度(X2)、初始pH值(X3)、接种量(X4)、转速(X5)、发酵温度(X6)、装液量(X7)7个因素,进行Plackett-Burman试验设计,每个因素选取高低2个水平,以-1和+1编码各值,利用Design Expert10.0.8软件对其进行Plackett-Burman试验设计,以淀粉酶活(Y)为响应值,筛选对菌株产淀粉酶具有显著影响的因子,试验因素与水平见表1。1.3.7 高产淀粉酶菌株培养条件优化最陡爬坡试验
表1 培养条件优化Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman tests design for culture conditions optimization
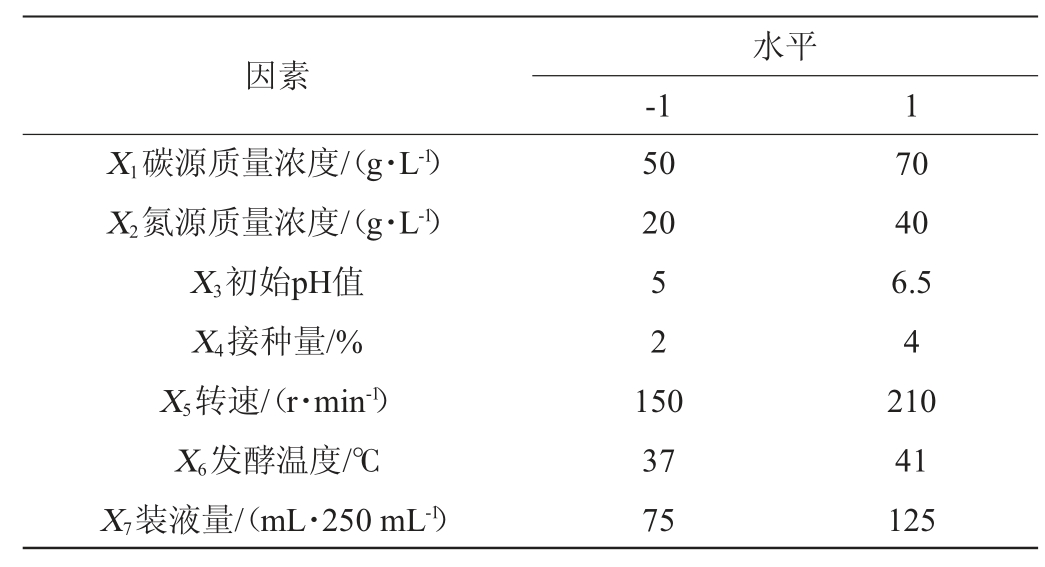
根据上述试验结果,从7个因素中选取对淀粉酶活影响较大的3个显著因素,采用最陡爬坡试验进一步确定各因素水平、爬坡方向和步长,确定用于Box-Behnken试验的中心点。
1.3.8 高产淀粉酶菌株培养条件优化Box-Behnken试验设计
根据最陡爬坡试验结果,选取影响淀粉酶活力最大的因素氮源质量浓度(X2)、转速(X5)、装液量(X7)进行优化,以淀粉酶活力(Y)为响应值,采用Box-Behnken试验设计进行优化,其因素与水平见表2。
表2 培养条件优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design for culture conditions optimization

1.3.9 淀粉酶活力的测定[20]
取粗酶液1 mL,于65 ℃水浴预热5 min,加1 mL淀粉含量为1%的磷酸柠檬酸缓冲液(pH值6.0),65 ℃恒温水浴保温30 min,加入2 mL DNS试剂终止反应,沸水浴加热5 min,立即在冰水中冷却,加水定容至10 mL,在波长540 nm处测定吸光度值。对照组为在1 mL粗酶液中先加2 mL DNS,之后加入1 mL淀粉含量为1%的磷酸柠檬酸缓冲液,其他步骤相同,由实验组吸光度值减去对照组吸光度值,计算淀粉酶活力。空白组为2 mL蒸馏水加2 mL DNS试剂,其他步骤相同,定容至10 mL,在波长540 nm处调节零点。
淀粉酶酶活定义:在65 ℃、pH值6条件下,每分钟产生1 μg葡萄糖所需酶量定义为一个酶活力单位(U/mL)。
2 结果与分析
2.1 产淀粉酶菌株的分离及筛选
经筛选培养基对产淀粉酶菌株进行稀释涂布分离,从中温大曲样品中共分离纯化得到70株不同形态的产淀粉酶菌株,经卢戈式碘液染色,测量D/d值进行初筛,并通过测定其产淀粉酶活力进行复筛,结果见表3。由表3可知,得到D/d值>2.5的菌株共6株,分别编号为菌株BM-34、SHBQ-36、DQ47、SHAM-7、SHAM-8及SHAM-28。经复筛获得菌株DQ47产淀粉酶能力较强,D/d值与淀粉酶活力均为最高值,分别为2.98、552.78 U/mL。因此,对该菌株进行进一步鉴定。
表3 高产淀粉酶菌株的初筛及复筛结果
Table 3 Results of preliminarily screening and second screening of high yield amylase strains
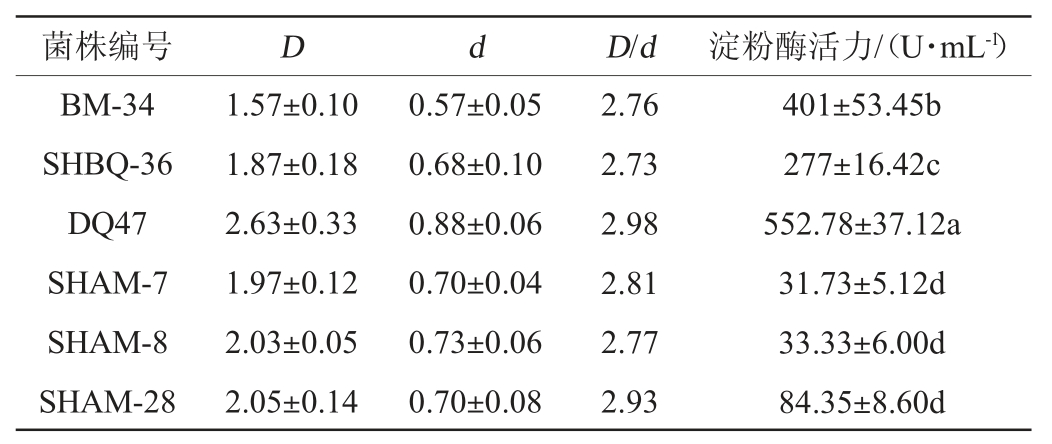
注:同列不同小写字母表示差异显著(P<0.05)。
2.2 菌株DQ47的鉴定
2.2.1 菌株DQ47的形态学观察
对菌株DQ47进行划线培养及革兰氏染色,其菌落形态与细胞形态见图1。
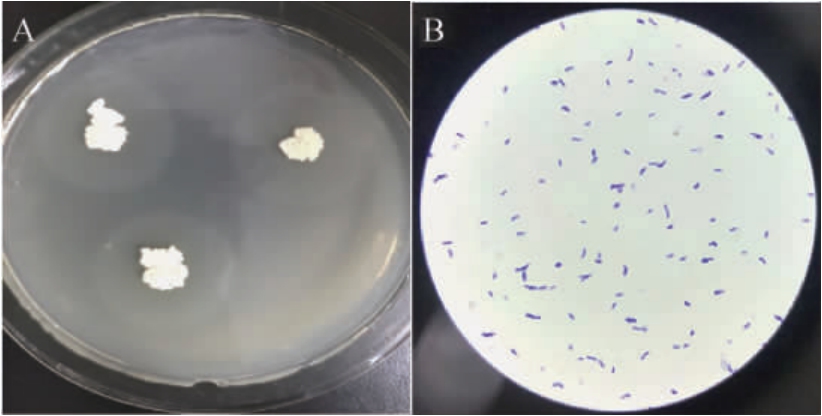
图1 菌株DQ47的菌落形态(A)及细胞形态(B)
Fig.1 Colony morphology (A) and cell morphology (B) of strain DQ47
由图1A可知,菌株DQ47的菌落较大且不规则,表面粗糙有褶皱,颜色为灰白色;由图1B可知,菌株DQ47经革兰氏染色后呈紫色,为革兰氏阳性菌,菌体为杆状,根据《伯杰细菌鉴定手册》初步鉴定菌株DQ47为芽孢杆菌属(Bacillus sp.)。
2.2.2 菌株DQ47的分子生物学鉴定
使用MEGA7.0软件基于16S rRNA基因序列构建菌株DQ47的系统发育树,结果见图2。

图2 基于16S rRNA基因序列菌株DQ47的系统发育树
Fig.2 Phylogenetic tree of strain DQ47 based on 16S rRNA gene sequences
由图2可知,菌株DQ47与枯草芽孢杆菌(Bacillus subtilis)IAM12118亲缘关系相近,结合菌落形态、细胞形态和分子生物学鉴定结果,菌株DQ47被鉴定为枯草芽孢杆菌(Bacillus subtilis)。
2.3 菌株DQ47的生长曲线及产淀粉酶酶活曲线的测定
由图3可知,菌株DQ47的生长趋势和产淀粉酶活力变化不完全同步。菌株DQ47的迟滞期为0~6 h,生长对数期为6~24 h,1~6 d进入稳定期,6~8 d进入衰亡期。发酵时间在0~8 d范围内增加,淀粉酶活力逐渐增加,在第8天达到最大值(2 723 U/mL),发酵时间>8 d之后,淀粉酶活力下降。淀粉酶合成受到底物淀粉的诱导,在菌株生长达到稳定期后,依旧延续合成淀粉酶,据此,推断菌株DQ47所产淀粉酶酶生物合成模式为延续合成型,选择酶活力达到最大时终止发酵,即发酵周期为8 d。在目前研究中,从大曲中筛选得到的产淀粉酶细菌发酵周期多在36~96 h范围内[14-15,18]。
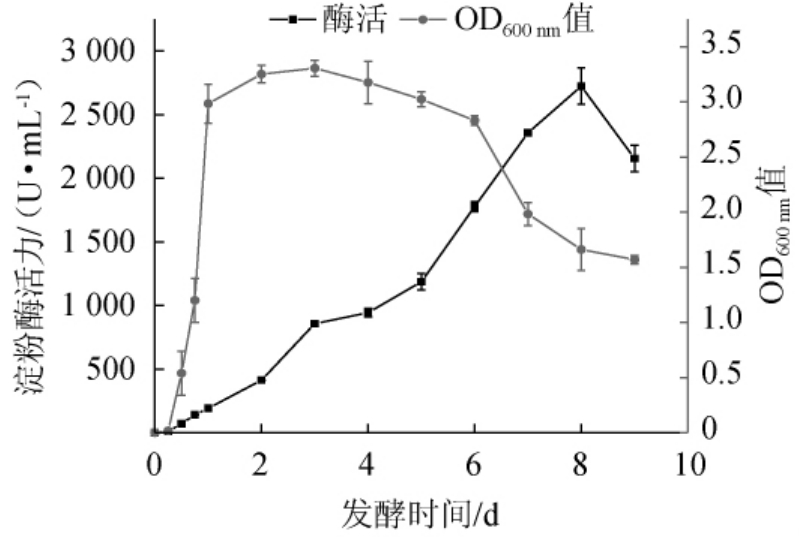
图3 菌株DQ47的生长曲线及产淀粉酶曲线
Fig.3 Growth curve and amylase production curve of strain DQ47
2.4 培养条件优化
2.4.1 培养条件优化单因素试验结果
由图4A可知,以可溶性淀粉为碳源时,淀粉酶活力最高为3 231.35 U/mL,与胡红伟等[21]的研究结果一致,这可能是由于淀粉易于被微生物直接利用,其提供的营养物质促使菌体量不断增加,进而提高淀粉酶产量[22],因此,确定最佳碳源为可溶性淀粉。由图4B可知,酵母粉作为氮源时淀粉酶活力(5 170.56 U/mL)显著高于其他氮源种类(P<0.05),相比于无机氮源,有机氮源更能促进菌株产淀粉酶,因为有机氮源含有丰富的氨基酸、维生素及生长因子等营养物质,有利于菌体生长[23],而酵母粉分子比其他有机氮源分子小,更有利于菌体吸收,促进菌体生长和产酶。因此,确定最佳氮源为酵母粉。
由图4C可知,随可溶性淀粉质量浓度在10~60 g/L范围内的升高,淀粉酶活力不断提高;可溶性淀粉质量浓度为60 g/L时,淀粉酶活力最高达到7 022.69 U/mL;可溶性淀粉质量浓度>60 g/L,淀粉酶活力开始降低。因此,确定可溶性淀粉最佳质量浓度为60 g/L。由图4D可知,当酵母粉质量浓度在10~30g/L范围内的升高,淀粉酶活力不断提高;当酵母粉质量浓度为30 g/L时,酶活力达到最大值(7 119.82 U/mL);当酵母粉质量浓度>30 g/L之后,淀粉酶活力开始降低。在微生物生长过程中,碳源和氮源的浓度起着十分重要的作用,浓度过低,微生物生长所需的营养物质不足,浓度过高,又会出现底物反馈抑制,进而影响微生物的产酶[24]。因此,确定最佳酵母粉质量浓度为30 g/L。
发酵温度可直接影响微生物的生长和淀粉酶的产生,温度过高或过低都会抑制酶的表达[25]。由图4E可知,随着发酵温度在31~39 ℃范围内的升高,淀粉酶酶活力显著升高;当发酵温度增加至39 ℃时,淀粉酶活力达到最大值,4 175.83 U/mL;发酵温度>39 ℃之后,淀粉酶活力下降。因此,确定最佳发酵温度为39 ℃。

图4 不同培养条件对淀粉酶酶活力的影响
Fig.4 Effects of different culture conditions on amylase activity
不同小写字母表示差异显著(P<0.05)。
由图4F可知,当转速在120~180 r/min范围内增加,淀粉酶活力提高;当转速为180 r/min时,淀粉酶活力提高达到最大值4 120.38 U/mL;当转速>180 r/min之后,淀粉酶活力下降。因此,确定最佳转速为180 r/min。由图4G可知,装液量在25 mL/250 mL~100 mL/250 mL范围内增加,淀粉酶活逐渐增加;当装液量为100 mL/250 mL时,淀粉酶活达到最大值,为3 267.72 U/mL;当装液量>100 mL/250 mL之后,淀粉酶活下降。由于枯草芽孢杆菌是兼性厌氧菌,当氧气供应不足时会进入厌氧发酵途径,进而影响产酶效率;当氧气供应过量时,会存在一定的氧毒性,从而抑制细胞生长和酶的表达[26]。因此,确定最佳装液量为100 mL/250 mL。
由图4H可知,当初始pH值在4~6范围内增加,淀粉酶活逐渐增加;当初始pH值为6时,达到最大值,为4 708.36U/mL;当初始pH值>6之后,淀粉酶活逐渐下降,其原因可能是在白酒发酵过程中,原料中的淀粉和蛋白质等营养物质的分解会产生有机酸,使得整个发酵环境偏酸性从而抑制微生物的活性[27],与毛祥等[16]的研究结果一致。因此,确定最佳初始pH值为6。
由图4I可知,当接种量在1%~3%范围内增加,淀粉酶活逐渐增加;当接种量为3%时,淀粉酶活力达到最大值,为3 214.60 U/mL;接种量>3%之后,淀粉酶活力有所下降。因此,确定最佳接种量为3%。
2.4.2 培养条件优化Plackett-Burman试验结果
Plackett-Burman试验设计及结果见表4,方差分析见表5。
表4 Plackett-Burman试验设计及结果
Table 4 Design and results of Plackett-Burman tests
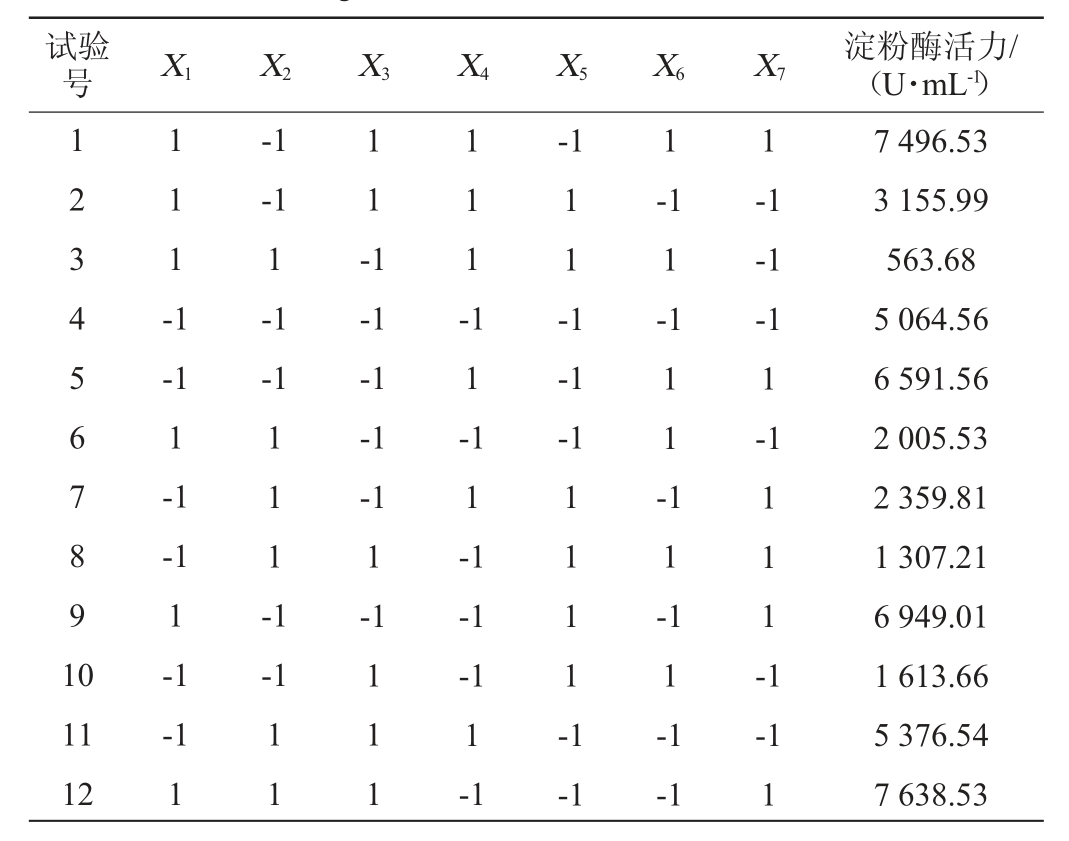
由表5可知,7个因素中对响应值影响的重要性顺序为转速>装液量>氮源质量浓度>发酵温度>碳源质量浓度>初始pH值>接种量,其中,氮源质量浓度、转速、装液量是对淀粉酶酶活力影响显著的因素(P<0.05),该模型的P值为0.039,影响显著,决定系数R2为0.925 1,表明该方程的拟合度较好,因此选择氮源质量浓度(X2)、转速(X5)、装液量(X7)做进一步优化试验。
表5 Plackett-Burman试验方差分析结果
Table 5 Variance analysis results of Plackett-Burman tests
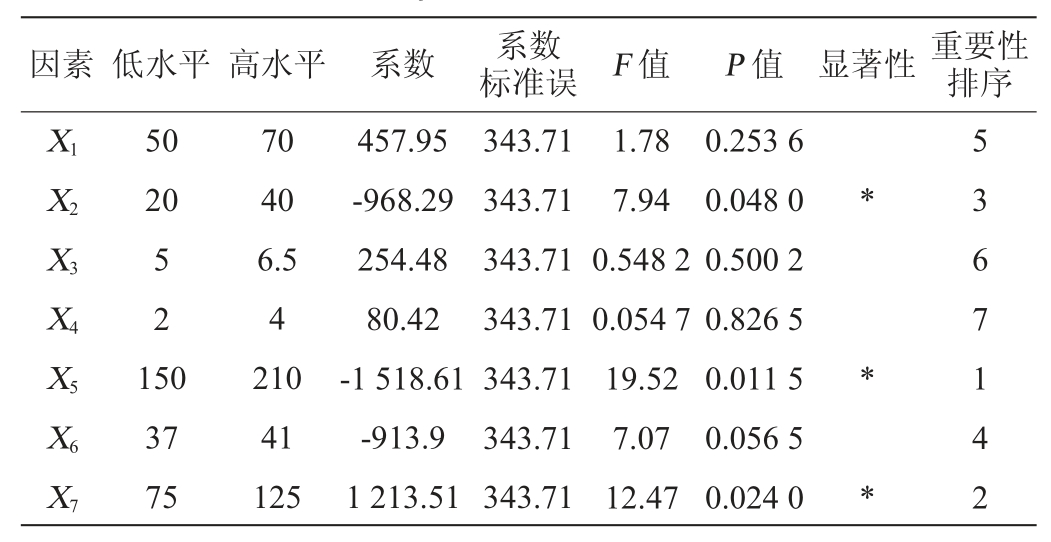
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
2.4.3 培养条件优化最陡爬坡试验
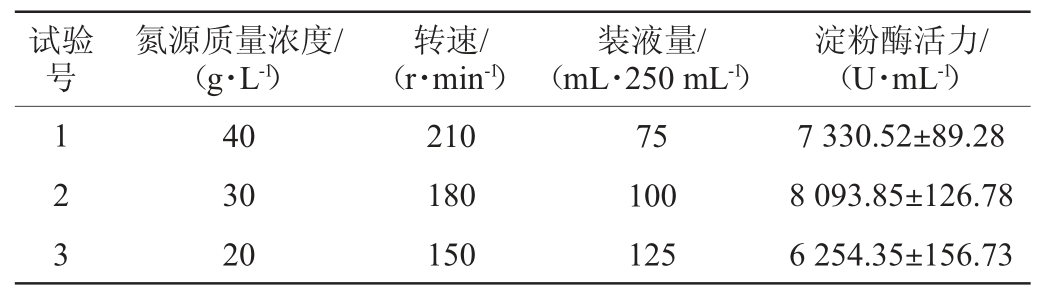
为逼近响应面中心点,提高淀粉酶活,选取氮源质量浓度、转速、装液量这3个显著影响因素进行最陡爬坡试验设计,确定最佳水平范围,最陡爬坡试验设计及结果见表6。由表6可知,在试验组2的培养条件下,淀粉酶活力最高,为8 093.85 U/mL。因此,选择试验组2的培养条件作为响应面中心点,进行Box-Behnken试验设计。
表6 最陡爬坡试验设计及结果
Table 6 Design and results of the steepest climbing tests
2.4.4 培养条件优化Box-Behnken试验设及结果
在上述试验的基础上,以淀粉酶活力(Y)为响应值,以氮源质量浓度(X2)、转速(X5)、装液量(X7)为自变量,利用Design Expert10.0.8软件进行3因素3水平响应面试验,试验设计及结果见表7,方差分析结果见表8。
表7 培养条件优化Box-Behnken试验设计及结果
Table 7 Design and results of Box-Behnken tests for culture conditions optimization
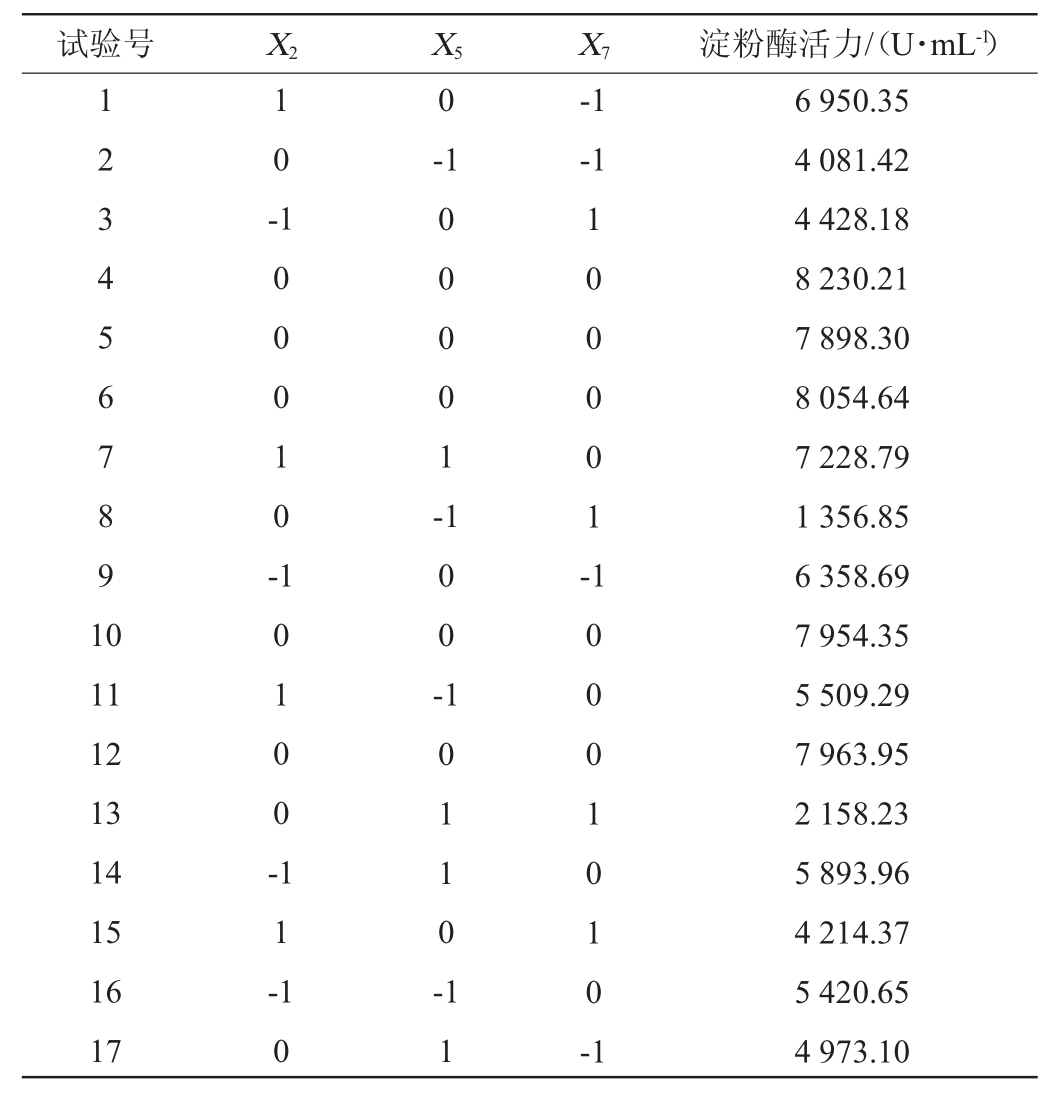
表8 回归模型方差分析
Table 8 Variance analysis of regression model
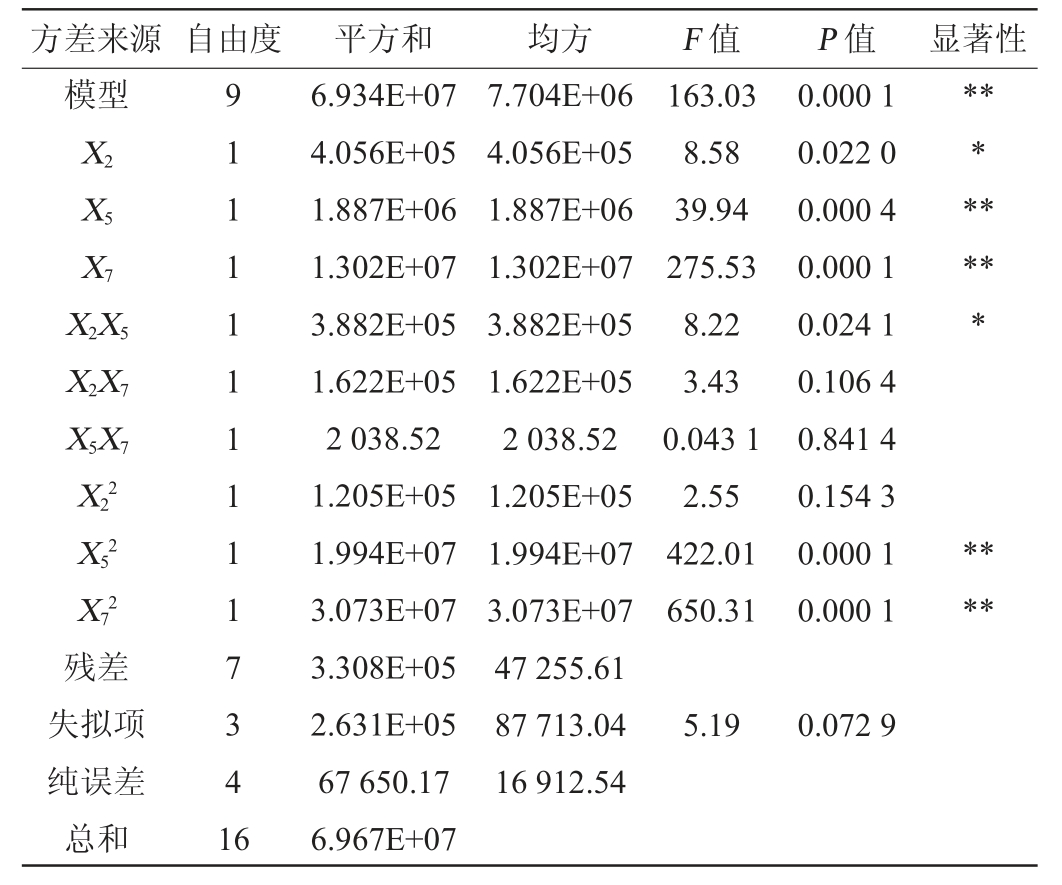
采用Design-Expert10.0.8软件对表7的试验结果进行多项拟合回归,获得淀粉酶酶活力(Y)对氮源质量浓度(X2)、转速(X5)、装液量(X7)的二次多项回归方程:Y=8 020.29+225.17X2+485.73X5-1 275.74X7+311.55X2X5-2 01.37X2X7-22.57X5X7+169.19X22-2 176.31X52-2 701.58X72。
由表8可知,该回归模型极显著(P=0.000 1<0.01),说明拟合回归方程有意义,模型达到极显著水平;且失拟项不显著(P=0.072 9>0.05),回归模型决定系数R2=0.995 3,说明试验数据误差较小,试验精度高,能够较好描述试验结果且用于预测考察因素与淀粉酶活力之间的关系。由P值可知,一次项X5、X7,二次项X52、X72对结果影响极显著(P<0.01);一次项X2,交互项X2X5对结果影响显著(P<0.05);其他项对结果影响不显著(P>0.05)。由F值可知,影响淀粉酶活的因素主次顺序为X7>X5>X2,即装液量>转速>氮源质量浓度。各因素间交互作用对淀粉酶活力影响的响应曲面及等高线见图5。

图5 各因素间交互作用对淀粉酶活力影响的响应曲面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on amylase activities
由图5可知,氮源质量浓度(X2)与转速(X5)间交互作用曲面较陡,等高线较密集,说明其交互作用对淀粉酶活力影响显著(P<0.05),而装液量(X7)与氮源质量浓度(X2)、转速(X5)与装液量(X7)有一定交互作用,但交互作用对淀粉酶活力影响不显著(P>0.05),这与方差分析结果一致。
根据Design-Expert10.0.8软件分析得到的最优培养条件为氮源质量浓度36.84 g/L,转速175.25 r/min,装液量85.98 mL/250 mL。在此条件下,淀粉酶活力的预测值为8 285.45 U/mL。为方便实际操作,将培养条件修正为氮源质量浓度37 g/L,转速175 r/min,装液量85 mL/250 mL。以此最佳培养条件进行3次平行验证试验,获得淀粉酶活力的实际值为8 158.23 U/mL,与预测值接近,说明该模型可行。
3 结论
本研究从中温大曲中筛选出一株淀粉酶活力较高的菌株DQ47,通过形态观察与16S rRNA同源序列分析,被鉴定为枯草芽孢杆菌(Bacillus subtilis)。通过测定菌株DQ47生长曲线和产淀粉酶酶活曲线,确定其发酵产淀粉酶的周期为8 d,且其酶合成模式为延续合成型,这种持续生长、持续产酶的发酵特性可使其在白酒酿造具有较高的应用价值。采用单因素试验及响应面试验确定其最优培养条件为:可溶性淀粉60 g/L、酵母粉37 g/L、发酵温度39 ℃、装液量85 mL/250 mL、转速175 r/min、初始pH值6、接种量3%,在此最佳培养条件下,淀粉酶活力达到8 158.23 U/mL,是优化前的14.75倍。在后续研究工作中,将进一步考察菌株DQ47对浓香型白酒出酒率的影响,以期为产淀粉酶功能微生物在浓香型白酒生产中的应用提供参考。
[1]周晨曦,郑福平,李贺贺,等.白酒大曲风味物质研究进展[J].中国酿造,2019,38(5):6-12.
[2]ZHENG X W,TABRIZI M R,NOUT M,et al.Daqu:A fermentation starter for Chinese liquor fermentation[J].J I Brewing,2011,117(1):82-90.
[3]周天慈,孙佳,朱雨婕,等.中高温大曲制作过程中火圈真菌菌群演替规律及其风味功能[J].微生物学通报,2021,48(11):4178-4189.
[4]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110955.
[5]LI Z M,BA I Z H,WANG D L,et al.Cultivable bacterial diversity and amylase production in three typical Daqus of Chinese spirits[J].Int J Food Sci Technol,2014,49(3):776-786.
[6]罗晶,祝水兰,王丽,等.浓香型白酒酿造微生物与风味物质组成的研究进展[J].中国酿造,2020,39(4):1-6.
[7]申孟林,张超,王玉霞,等.白酒大曲微生物酶系研究进展[J].中国酿造,2018,37(4):7-11.
[8]GUPTA R,GUPTA N,RATHI P J A M,et al.Bacterial lipases:an overview of production,purification and biochemical properties[J].Appl Microbiol Biol,2004,64(6):763-781.
[9]HE G Q,HUANG J,ZHOU R Q,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:doi.org/10.3389/fmicb.2019.00056.
[10]蒋倩儿,陈文浩,孙金沅,等.酱香型白酒大曲微生物研究进展[J].中国酿造,2021,40(12):1-5.
[11]DIBYANGANA R,TANIA B,SUCHITA M,et al.Production and partial purification of alpha amylase from Bacillus subtilis(MTCC 121) using solid state fermentation[J].Bio Res Int,2014,2014:568141.
[12]王屈祎,钟倩,闫如玉,等.淀粉酶产生菌的筛选、鉴定及其发酵条件优化[J].微生物学通报,2022,49(1):173-188.
[13]王志山,李苗,陈文浩,等.一株芝麻香型白酒高温大曲细菌Q2B1的鉴定及其产酶活性研究[J].中国酿造,2020,39(2):51-55.
[14]周平,罗惠波,黄丹,等.中高温大曲中一株耐热地衣芽孢杆菌耐受性及产酶特性的初步研究[J].食品科技,2016,41(11):14-20.
[15]鲁珍,魏姜勉,谌馥佳,等.高温大曲中高产α-淀粉酶菌株分离鉴定及其产酶性能研究[J].农业研究与应用,2016(2):5-11.
[16]毛祥,黄丹,沈才萍,等.酱香型大曲中产淀粉酶菌的分离鉴定及发酵特性研究[J].中国酿造,2015,34(12):24-27.
[17]马晓梅,赵辉.淀粉酶产生菌MSP13筛选及其产酶条件初步优化[J].食品科学,2015,36(11):177-181.
[18]布坎南R E.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984:729-732.
[19]刘延波,张世凯,赵志军,等.高产淀粉酶细菌的分离鉴定及产酶条件优化[J].食品与机械,2020,36(1):65-71.
[20]唐丽江,王振华,王迪.高产淀粉酶芽孢杆菌菌株的筛选[J].安徽农业科学,2009,37(12):5362-5363,5371.
[21]胡红伟,段明房,闫凌鹏,等.一株枯草芽孢杆菌的鉴定及液体发酵工艺优化[J].中国饲料,2017(5):13-19.
[22]张晓瑞,刘晓晖,付博,等.烟草中淀粉降解菌的筛选、鉴定及发酵工艺优化[J].食品与机械,2021,37(2):34-41.
[23]杜丽红,郝亚男,陈宁,等.有机氮源及其在微生物发酵中的应用[J].发酵科技通讯,2019,48(1):1-4.
[24]孙思佳,翟磊,白秀彬,等.一株高产淀粉酶扣囊复膜孢酵母的产酶条件优化及酶学性质研究[J].食品与发酵工业,2019,45(21):31-37.
[25]FAR B E,DILMAGHANI A,KHOSROUSHAHI A Y.In silico study and optimization of Bacillus megaterium alpha-amylases production obtained from honey sources[J].Curr Microbiol,2020,77(10):1-9.
[26]安玉亭,刘彬,薛丹丹,等.城市污泥与稻草混合堆肥氧气消耗的通风量优化研究[J].中国土壤与肥料,2019(1):128-133.
[27]秦立芹,马景浩,李二浩,等.一株源于北派酱香白酒酿造环境中产淀粉酶细菌的筛选、鉴定及其特性研究[J].中国酿造,2021,40(11):154-160.