益生菌发酵是利用有益微生物自身代谢产生的多种酶类使蛋白质、多糖等大分子分解,生成新的小分子多肽、糖类等营养功效物质[1]。通过益生菌发酵不仅常可以提升食品风味、延长食品保质期,还能赋予或强化发酵制品的抗氧化、抗炎、抗菌、降血压等多种益生功能[2]。DU X P等[3]采用植物乳杆菌、酿酒酵母、巴氏醋酸菌发酵红毛藻,可有效降低藻腥味、提高接受度。MARTÍ-QUIJAL F J等[4]利用乳酸菌对鱼副产品进行发酵,获得了抗氧化活性产物,从而提升了食品加工副产品的价值。韩之皓等[5]的研究表明,复合益生菌乳饮料具有较强的抗氧化、抑菌及血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性。FAN J J等[6]研究发现,乳杆菌发酵人参制品可以通过调节肠道菌群,进而缓解酒精性肝损伤和肠道功能紊乱。目前,益生菌已广泛应用于发酵乳、米面、果蔬、肉类等食品的制作与加工[7-8],而应用于海洋贝类发酵的研究相对有限。为数不多的研究表明,贝类发酵制品也表现出多种生理活性,如GAO J等[9-10]分别利用纳豆芽孢杆菌发酵的扇贝裙边和菲律宾蛤仔,均有较好的ACE抑制活性。然而,以牡蛎为基料进行益生菌发酵目前还较为少见。
牡蛎在我国资源丰富且富含蛋白质,素有“海中牛奶”之称,具有开发为抗氧化功能食品的潜能[11-12]。刘文颖等[13]通过二步酶解法制备了具有良好抗氧化效果的牡蛎低聚肽。王力等[14]研究表明,牡蛎酶解多肽组分具有较好的抗氧化活性。庞忠莉等[15]对牡蛎干双酶解液的体外抗氧化活性进行了评价。
本研究以牡蛎为基料,参考《可用于食品的菌种名单》[16],选用4株典型的益生菌进行液态发酵后,对比相应牡蛎制品的总抗氧化能力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基、超氧阴离子自由基清除能力及总肽含量等指标,旨在为益生菌株选用和牡蛎基功能食品开发提供参考依据,为益生菌发酵海洋食药资源的产业应用提供基础数据。
1 材料与方法
1.1 材料与试剂
鼠李糖乳杆菌(Lactobacillus rhamnosus)、干酪乳杆菌(Lactobacillus casei)、肠膜明串珠菌(Leuconostoc mesenteroides)、布拉酵母菌(Saccharomyces boulardii):本实验室保存;牡蛎冻干粉:陕西东禾福生物科技有限公司;蔗糖(分析纯):国药集团化学试剂有限公司;MRS肉汤培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:北京索莱宝科技有限公司;总抗氧化能力检测试剂盒、DPPH自由基检测试剂盒、羟自由基检测试剂盒、超氧阴离子自由基检测试剂盒、总蛋白定量检测试剂盒:南京建成生物工程研究所;其他化学试剂(均为分析纯):西陇科学股份有限公司。
1.2 仪器与设备
GR88DR高压灭菌锅:致微(厦门)仪器有限公司;Anaerobox IV型厌氧培养箱:美国GeneScience公司;SKY-2102C恒温摇床:上海苏坤实业有限公司;UV-5100B紫外可见分光光度计:上海元析仪器有限公司;HWS-24水浴锅:上海一恒科技有限公司;FE28酸度计:梅特勒托利多科技(中国)有限公司;3K15冷冻台式离心机:德国SIGMA公司;Quintix5102电子天平:德国Sartorius公司;Vortex 3漩涡混匀器:德国IKA公司。
1.3 方法
1.3.1 益生菌的活化及种子菌悬液的制备
将鼠李糖乳杆菌、干酪乳杆菌、肠膜明串珠菌接种于MRS肉汤,37 ℃厌氧培养24~48 h;布拉酵母菌接种于YPD液体培养基,37 ℃、250 r/min培养24~48 h,使各菌活化后,再同上条件分别转接、培养至对数生长期,制成109 CFU/mL的种子菌悬液,备用。
1.3.2 益生菌液态发酵牡蛎制品的制备
称取4.0 g牡蛎冻干粉、0.4 g蔗糖,加100 mL蒸馏水混匀,配制成4 g/100 mL牡蛎培养基,pH调节至6.2~6.6后灭菌备用。
以10%接种量分别接入上述4种益生菌的种子菌悬液,同上条件发酵24 h后,8 000 r/min离心10 min收集上清,并利用0.22 μm微孔滤膜确保除菌,获得各益生菌液态发酵牡蛎制品。以未接种任何益生菌的4%牡蛎培养基为空白对照。
1.3.3 总抗氧化能力的测定
遵照总抗氧化能力检测试剂盒说明书的步骤,配制对应试剂,设置测定管及对照管,按照操作顺序加样、混匀、水浴、静置后,以双蒸水调零后测定吸光度值(波长520 nm、光径1 cm)后,完成计算。
1.3.4 DPPH自由基清除能力的测定
遵照DPPH自由基检测试剂盒说明书的步骤,配制对应试剂,设置空白管、对照管及测定管,按照操作顺序加样、混匀、避光静置,以无水乙醇调零后测定吸光度值(波长517 nm、光径1 cm)后,完成计算。
1.3.5 羟自由基清除能力的测定
遵照羟自由基测试试剂盒说明书的步骤,配制对应试剂,设置空白管、标准管、对照管及测定管,按照操作顺序加样、迅速混匀、精确计时水浴、显色,以双蒸水调零后测定吸光度值(波长550 nm,光径1 cm)后,完成计算。
1.3.6 超氧阴离子自由基清除能力的测定
遵照超氧阴离子自由基测定试剂盒说明书的步骤,配制对应试剂,设置对照管、标准管及测定管,按照操作顺序加样、混匀、水浴、显色,以双蒸水调零后测定吸光度值(波长550 nm,光径1 cm)后,完成计算。
1.3.7 总肽含量的测定
遵照总蛋白定量测定试剂盒说明书的步骤,配制对应试剂,设置空白管、标准管及对照管,按照操作顺序加样、混匀、孵育、终止,以双蒸水调零后测定吸光度值(波长562 nm、光径0.5 cm)后,完成计算。
1.3.8 数据处理
实验如无特别标注,平行测定3次。数据采用GraphPad Prism version 5.01进行分析及绘图,结果以“平均值±标准偏差”表示。
2 结果与分析
2.1 总抗氧化能力的测定
4株益生菌液态发酵牡蛎制品的总抗氧化能力见图1。由图1可知,与空白对照((0.73±0.02)U/mL)相比,4株益生菌液态发酵牡蛎制品的总抗氧化能力均显著提升(P<0.05);总抗氧化能力依次为鼠李糖乳杆菌组((4.04±0.05)U/mL)>干酪乳杆菌组((3.59±0.12)U/mL)>布拉酵母菌组((2.54±0.09)U/mL)>肠膜明串珠菌组((2.32±0.13)U/mL),且除了肠膜明串珠菌组与布拉酵母菌组之间无显著差异之外(P>0.05),其余各组间均存在显著差异(P<0.05)。因此,进一步评估各实验组的DPPH自由基、羟自由基、超氧阴离子自由基清除能力。
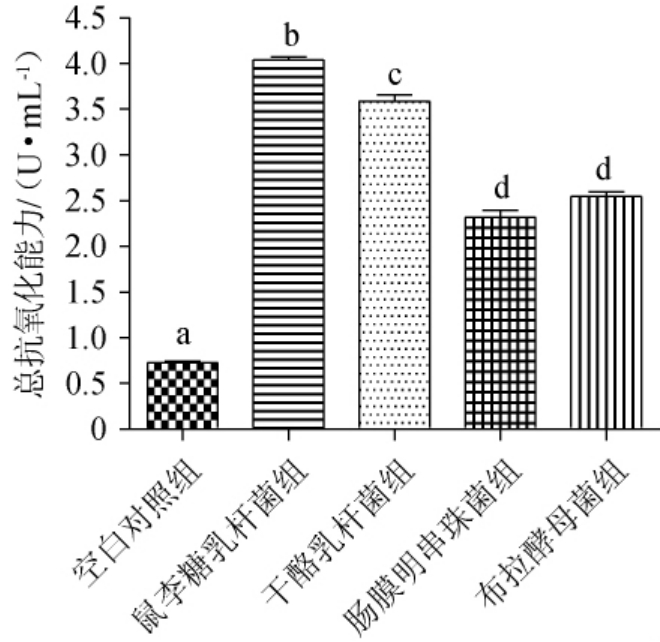
图1 4株益生菌液态发酵牡蛎制品的总抗氧化能力比较
Fig.1 Comparison of total antioxidant capacity of oyster products with liquid fermentation by 4 probiotics
不同小写字母表示差异显著(P<0.05)。下同。
2.2 DPPH自由基清除能力测定
4株益生菌液态发酵牡蛎制品的DPPH自由基清除能力见图2。由图2可知,鼠李糖乳杆菌组、干酪乳杆菌组、肠膜明串珠菌组、布拉酵母菌组的DPPH自由基清除能力分别为(47.62±0.63)μg Trolox/mL、(44.71±1.24)μg Trolox/mL、(39.34±1.88)μg Trolox/mL、(39.40±1.32)μg Trolox/mL,表明各组均有一定的DPPH自由基清除能力,其中鼠李糖乳杆菌与干酪乳杆菌两组显著高于肠膜明串珠菌与布拉酵母菌两组(P<0.05)。
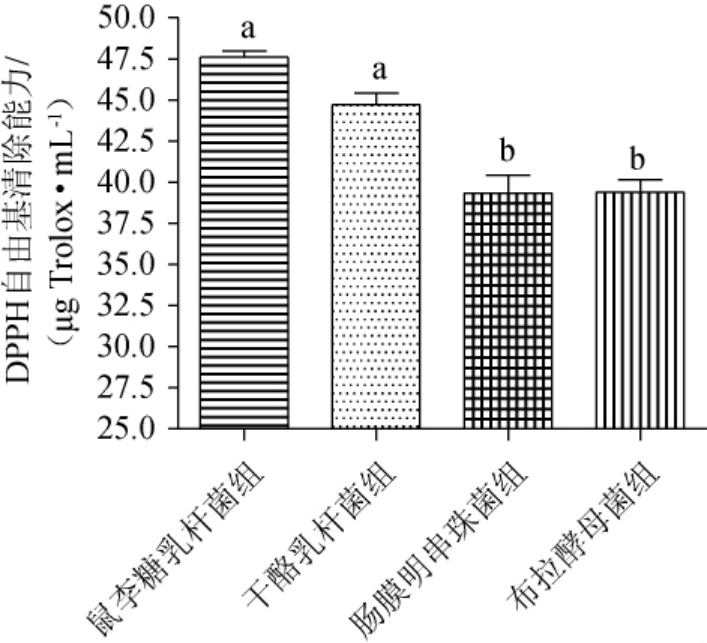
图2 4株益生菌液态发酵牡蛎制品的DPPH自由基清除能力比较
Fig.2 Comparison of DPPH free radical scavenging ability of oyster products with liquid fermentation by 4 probiotics
2.3 羟自由基清除能力测定
4株益生菌液态发酵牡蛎制品的羟自由基清除能力见图3。由图3可知,鼠李糖乳杆菌组、干酪乳杆菌组、肠膜明串珠菌组、布拉酵母菌组的羟自由基清除能力分别为(33.04±0.09)U/mL、(32.98±1.06)U/mL、(34.18±1.70)U/mL、(32.18±1.12)U/mL,表明各组均有一定的羟自由基清除能力,其中肠膜明串珠菌组稍高,但各组之间均无显著差异(P>0.05)。
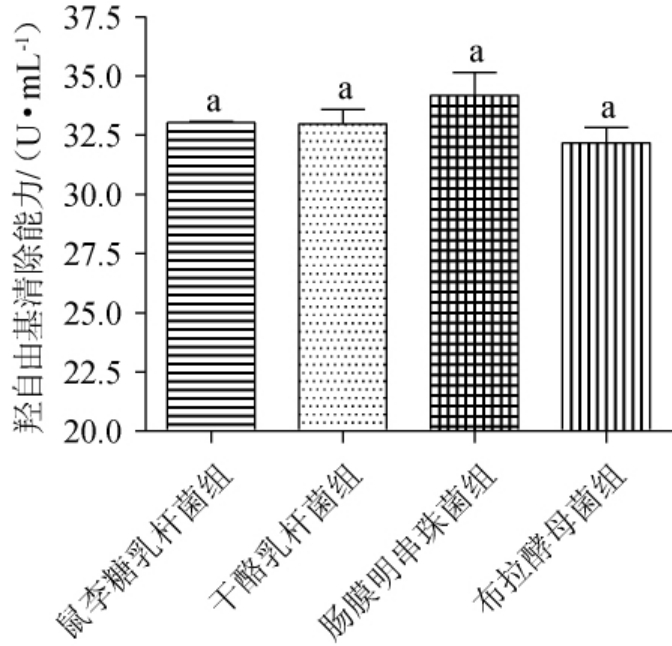
图3 4株益生菌液态发酵牡蛎制品的羟自由基清除能力比较
Fig.3 Comparison of hydroxyl radical scavenging capacity of oyster products with liquid fermentation by 4 probiotics
2.4 超氧阴离子自由基清除能力测定
4株益生菌液态发酵牡蛎制品的超氧阴离子自由基清除能力见图4。由图4可知,鼠李糖乳杆菌组、干酪乳杆菌组、肠膜明串珠菌组、布拉酵母菌组的超氧阴离子自由基清除能力分别为(21.85±0.46)U/L、(31.11±1.00)U/L、(35.45±1.76)U/L、(36.96±1.29)U/L,表明各组均有一定的超氧阴离子自由基清除能力,其中布拉酵母菌与肠膜明串珠菌两组显著高于干酪乳杆菌组(P<0.05),而干酪乳杆菌组又显著高于鼠李糖乳杆菌组(P<0.05)。
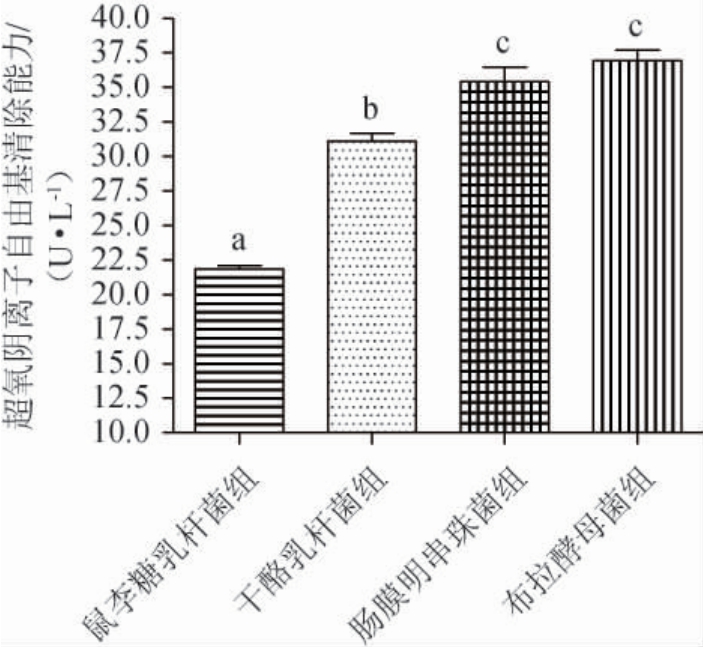
图4 4株益生菌液态发酵牡蛎制品的超氧阴离子自由基清除能力比较
Fig.4 Comparison of superoxide anion radical scavenging capacity of oyster products with liquid fermentation by 4 probiotics
2.5 总肽含量的测定
4株益生菌液态发酵牡蛎制品中总肽含量见图5。由图5可知,鼠李糖乳杆菌组、干酪乳杆菌组、肠膜明串珠菌组、布拉酵母菌组的总肽含量分别为(4.04±0.01)mg/mL、(4.30±0.07)mg/mL、(4.46±0.10)mg/mL、(3.77±0.11)mg/mL;其中肠膜明串珠菌与干酪乳杆菌组两组显著高于鼠李糖乳杆菌组(P<0.05),而鼠李糖乳杆菌组又显著高于布拉酵母菌组(P<0.05)。
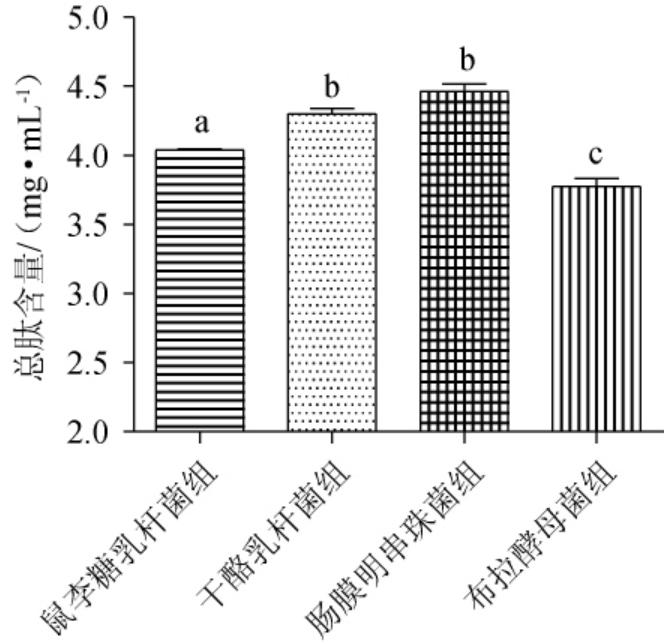
图5 4株益生菌液态发酵牡蛎制品的总肽含量比较
Fig.5 Comparison of total peptide contents of oyster products with liquid fermentation by 4 probiotics
3 讨论
微生物发酵食品因其口感丰富、功能显著,贴合现代社会人们的饮食需求,在行业内愈加受到关注[17]。食品发酵工业中所用微生物菌株以乳酸菌、酵母菌最为常见,二者均具有良好的食品安全性[18]。乳酸菌常具有优良的产酸能力和凝乳特性,还含有酚酸脱羧酶、β-葡萄糖苷酶、蛋白酶、超氧化物歧化酶、过氧化氢酶、乳酸脱氢酶等多种活性酶,可基于生物转化活性改变基质中的物质结构和类型[18-20]。酵母菌多具有产香能力,还富含蛋白酶、脂肪酶、α-淀粉酶、谷氨酸脱氢酶,表现出抗氧化、抑菌等多种益生特性[21-22]。刘梦培等[23]比较了酿酒酵母、植物乳杆菌单独或复合发酵杜仲雄花茶汁的抗氧化活性,发现采用植物乳杆菌发酵的品质指标和抗氧化活性均比较好。曹庆超等[24]研究发现,相比酿酒酵母,采用扣囊复膜酵母发酵的芍药籽饼粕的抗氧化活性更强。此外,有研究表明,不同的菌种由于所分泌的酶系存在差异,对蛋白质的降解效果也不相同,有必要针对性对比筛选[25-26]。因此,本研究基于牡蛎原料中蛋白质含量高的特点,采用鼠李糖乳杆菌、干酪乳杆菌、肠膜明串珠菌、布拉酵母菌4株典型的乳酸菌或酵母菌进行液态发酵,综合对比抗氧化活性和总肽含量指标,从而筛选较适用于牡蛎基料发酵的益生菌株。而研究结果也表明,牡蛎基料经各益生菌发酵后,其制品的总抗氧化能力均有明显提高;但不同菌株之间存在显著差异,其中以鼠李糖乳杆菌液态发酵牡蛎制品的总抗氧化能力最高。在自由基抑制清除能力上,鼠李糖乳杆菌组的DPPH自由基清除能力也最强。但其羟自由基清除能力与其他组相近,超氧阴离子自由基清除能力反而最低,这或与不同菌株存在的代谢转化途径差异有关[27]。
鼠李糖乳杆菌自分离鉴定以来,已成为全世界范围内食品工业乃至临床试验中应用研究最多的益生菌之一,不仅具有良好的耐酸、耐胆汁、粘附、增殖能力,还能发挥清除致病菌定植、预防感染、防治腹泻、增强免疫等益生作用[28]。由此鼠李糖乳杆菌也显示出良好的发酵增香增效性能,如鼠李糖乳杆菌在非洲被广泛应用于发酵牛乳、小米、果汁,其制品营养丰富,并被赋予一系列的增进健康特性[29]。值得关注的是,BEGUNOVA A V等[30]研究表明,鼠李糖乳杆菌具有独特的蛋白水解系统,虽然对牛乳酪蛋白的水解活性相较瑞士乳杆菌更弱,却能释放出多种特有的具有较好抗氧化和ACE抑制活性的肽。这与本研究结果较为一致,牡蛎经鼠李糖乳杆菌液态发酵后,虽然其制品中总肽含量并不是最高,但总抗氧化能力和DPPH自由基清除能力最强。因此,经综合对比,鼠李糖乳杆菌或是可用于发酵牡蛎制备生物活性肽的优良菌株,但肽的序列结构和种类尚待后续加以鉴定,其发酵条件也需系统优化[30-31]。
牡蛎是我国重要的经济贝类,产量持续排名世界第一,而研究所在地福建省的牡蛎产量在全国也是连年占据高比重,在我国各主要的沿海省级产区中,福建省牡蛎产业的综合比较优势第一、规模比较优势第二[32]。然而,在效率比较优势上,福建省在八个省级区域中仅排名第六[32]。一直以来,市场上牡蛎输出形式主要为鲜食、蚝干、蚝油等粗放型产品,附加值较低,因此,牡蛎功效成分的深度开发、综合利用日益受到关注[33]。如王力等[14]评估了牡蛎酶解多肽组分的抗氧化活性和抗衰老作用,认为其可作为相应的功能食品基料。XIAO M F等[34]研究表明,牡蛎多肽组分具有抗疲劳作用,并能调节小鼠肠道菌群的丰度,维持肠道微生态平衡。陈宏等[35]通过酶解牡蛎制备了二肽基肽酶-Ⅳ(dipeptidyl peptidase-Ⅳ,DPP-Ⅳ)抑制肽,为牡蛎基功能食品的开发奠定了理论基础。
4 结论
通过比较4株益生菌液态发酵牡蛎制品的体外抗氧化活性指标,结果表明,牡蛎制品经益生菌发酵后总抗氧化能力均得到明显提高,其中以鼠李糖乳杆菌组的总抗氧化能力和DPPH自由基清除能力效果最佳,可初步确定鼠李糖乳杆菌为适用于发酵牡蛎制备生物活性肽的优良菌株,验证了采用益生菌发酵牡蛎增效的技术可行性,对牡蛎等海洋药食资源的高值化利用具有借鉴意义,但发酵水解肽的序列结构、活性评估、增效机理尚待后续进一步分离、鉴定和验证。
[1]谢明勇,熊涛,关倩倩.益生菌发酵果蔬关键技术研究进展[J].中国食品学报,2014,14(10):1-9.
[2]S,ANLIER N,GÖKCEN B B,SEZGIN A C.Health benefits of fermented foods[J].Crit Rev Food Sci Nutr,2019,59(3):506-527.
[3]DU X P,XU Y X,JIANG Z D,et al.Removal of the fishy malodor from Bangia fusco-purpurea via fermentation of Saccharomyces cerevisiae,Acetobacter pasteurianus,and Lactobacillus plantarum[J].J Food Biochem,2021,45(5):e13728.
[4]MARTÍ-QUIJAL F J,TORNOS A,PRÍNCEP A,et al.Impact of fermentation on the recovery of antioxidant bioactive compounds from sea bass byproducts[J].Antioxidants,2020,9(3):239.
[5]韩之皓,郭帅,黄天,等.复合益生菌在乳酸菌饮料中的发酵特性和功能性质研究[J].中国食品学报,2020,20(11):129-138.
[6]FAN J J,WANG Y S,YOU Y,et al.Fermented ginseng improved alcohol liver injury in association with changes in the gut microbiota of mice[J].Food Funct,2019,10(9):5566-5573.
[7]阿热爱·巴合提,谭春明,李平兰.益生菌的分类及其多领域应用研究现状[J].生物加工过程,2022,20(1):88-94.
[8]朱寒剑,李雷兵,钟晓凌,等.富硒益生菌及其发酵食品的研究进展[J].中国酿造,2018,37(11):7-12.
[9]GAO J,LIU Q,ZHAO L,et al.Identification and antihypertension study of novel angiotensin I-converting enzyme inhibitory peptides from the skirt of Chlamys farreri fermented with Bacillus natto[J].J Agr Food Chem,2021,69(1):146-158.
[10]CHEN Y Y,GAO X,WEI Y X,et al.Isolation,purification and the antihypertensive effect of a novel angiotensin I-converting enzyme (ACE)inhibitory peptide from Ruditapes philippinarum fermented with Bacillus natto[J].Food Funct,2018,9(10):5230-5237.
[11]国家贝类产业技术体系.中国牡蛎产业发展报告[J].中国水产,2021(6):20-31.
[12]李旭东,彭吉星,吴海燕,等.牡蛎中营养、呈味及功能成分研究进展[J].水产科学,2022,41(4):682-694.
[13]刘文颖,冯晓文,李国明,等.牡蛎低聚肽的结构表征及体外抗氧化作用[J].中国食品学报,2021,21(12):261-269.
[14]王力,肖嵋方,陈弘培,等.牡蛎多肽组分OE-I抗氧化活性及其对秀丽隐杆线虫抗衰老作用[J].食品科学,2022,43(3):152-160.
[15]庞忠莉,郑建仙.双酶法制备牡蛎干酶解液及其体外抗氧化活性评价[J].食品与机械,2020,36(4):151-156.
[16]国家卫生健康委员会.解读关于《可用于食品的菌种名单》和《可用于婴幼儿食品的菌种名单》更新的公告(2022年第4号)[J].饮料工业,2022,25(5):3-4.
[17]李新,臧学丽.微生物发酵食品的保健功效[J].现代食品,2022,28(2):54-56.
[18]MATHUR H,BERESFORD T P,COTTER P D.Health benefits of lactic acid bacteria(LAB)fermentates[J].Nutrients,2020,12(6):1679.
[19]吴彩云,张晓荣,徐怀德,等.益生菌发酵果蔬汁生物活性成分及功能特性研究进展[J].中国食品学报,2021,21(12):323-334.
[20]段希宇,叶陵,刘成国,等.乳酸菌的抗氧化作用机制[J].微生物学杂志,2017,37(3):111-115.
[21]杨玉蓉,钟海雁,徐帅哲,等.产香酵母的分离鉴定及对不同原料酿造甜酒香气成分的影响[J].中国酿造,2021,40(7):77-82.
[22]牟志勇,杨昳津,等.酵母菌的益生功能及在食品中的应用[J].食品科学,2021,42(15):309-318.
[23]刘梦培,李佳,纵伟,等.乳酸菌和酵母菌发酵对杜仲雄花茶汁品质及抗氧化活性的影响[J].中国酿造,2020,39(5):71-76.
[24]曹庆超,李叶婷,金银哲,等.不同酵母发酵后芍药籽饼粕成分的液质联用分析及抗氧化活性[J].扬州大学学报(农业与生命科学版),2021,42(4):46-52.
[25]高艳,薛桥丽,田洋,等.不同菌种发酵对辣木叶蛋白降解的影响[J].中国酿造,2022,41(3):93-97.
[26]李杰,张姣锦,杨红玲,等.3种益生菌发酵豆粕的营养品质研究[J].饲料研究,2021,44(22):56-59.
[27]李思宁,唐善虎,任然.动物双歧杆菌、植物乳杆菌与传统发酵剂共培养对发酵乳抗氧化特性的影响[J].食品科学,2021,42(18):127-134.
[28]STAGE M,WICHMANN A,JØRGENSEN M,et al.Lactobacillus rhamnosus GG genomic and phenotypic stability in an industrial production process[J].Appl Environ Microbiol,2020,86(6):e02780-19.
[29]WESTERIK N,KORT R,SYBESMA W,et al.Lactobacillus rhamnosus probiotic food as a tool for empowerment across the value chain in Africa[J].Front Microbiol,2018,9:1501.
[30]BEGUNOVA A V,SAVINOVA O S,GLAZUNOVA O A,et al.Development of antioxidant and antihypertensive properties during growth of Lactobacillus helveticus, Lactobacillus rhamnosus and Lactobacillus reuteri on cow′s milk: fermentation and peptidomics study[J].Foods,2020,10(1):17.
[31]梁雪荣,路振康,毛晓英,等.鹰嘴豆抗氧化肽的分离纯化、鉴定及其抗氧化活性[J/OL].食品科学,2022:1-12[2022-04-27].http://kns.cnki.net/kcms/detail/11.2206.ts.20220224.1739.024.html.
[32]蒋如浩,慕永通.中国牡蛎养殖业集聚特征分析[J].中国渔业经济,2021,39(1):55-61.
[33]赵强,魏祥玲,孙建安,等.牡蛎资源的综合开发利用研究进展[J].中国食品添加剂,2021,32(7):150-159.
[34]XIAO M F,LIN L,CHEN H P,et al.Anti-fatigue property of the oyster polypeptide fraction and its effect on gut microbiota in mice[J].Food Funct,2020,11(10):8659-8669.
[35]陈宏,章骞,陈玉磊,等.利用牡蛎制备DPP-Ⅳ抑制肽及其活性分析[J].食品科学,2021,42(10):120-126.