细菌、真菌等微生物在食品发酵过程中通过多种代谢途径赋予发酵食品特殊的风味和保健功能,尤其与风味的形成密不可分[1]。随着新一代测序技术和多元统计分析技术的发展,国内外学者在阐明酿造酒[2-5]、酿造醋[6-8]以及发酵果蔬[9-10]等发酵食品的微生物多样性与风味形成相关性方面做了大量的研究,对明确发酵食品中微生物的风味代谢途径及其形成机理意义重大。
食用植物酵素作为发酵食品之一,是指以可用于食品加工的植物为主要原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分可供人来食用的酵素产品[11-12]。其不仅含有植物本身的多种维生素、酶和矿物质等营养物质[13],还通过微生物发酵产生了新的次生代谢物及活性成分,可满足人们对口感、风味、营养以及健康功能的需求[14-15]。食用酵素中乳酸菌、酵母菌、醋酸菌和霉菌等微生物对产品风味物质的形成至关重要,阴芳冉[16]研究发现,红树莓酵素自然发酵过程中优势微生物酵母属(Saccharomyces)、哈萨克斯坦酵母属(Kazachstania)和汉逊酵母属(Hanseiaspora)与其部分有机酸、氨基酸和其他活性物质有显著相关性(P<0.05);邸鹏月等[17]采用宏基因组分析了桑葚酵素的微生物多样性,发现乳杆菌在桑葚酵素风味形成中起重要作用;李希羽等[18]分析了3种水果酵素自然发酵过程中优势菌群和乳酸、柠檬酸、苹果酸和草酸等有机酸的变化规律,结果表明,植物乳杆菌(Lactobacillus plantarum)对有机酸的生成贡献率最大。苹果经微生物发酵可将大分子活性物质转化为小分子营养成分,有利于人体吸收,发酵后含有丰富的超氧化物歧化酶、蛋白酶、脂肪酶、淀粉酶等功效酶及较强的抗氧化能力[19]。目前,对苹果酵素的研究多集中在工艺优化[20-21]、代谢产物[22]及抗氧化性能的变化[23-24]等方面,康晓乐等[25]对苹果自然发酵酵素的微生物多样性进行分析发现,苹果酵素中的微生物菌群结构复杂多样,以乳杆菌属(Lactobacillus)、葡萄糖酸杆菌属(Gluconobacter)、乳酸乳球菌属(Lactococcus)、魏斯氏属(Weissella)、明串珠菌属(Leuconostoc)等为主,但对于苹果酵素微生物群落与风味物质相关性的研究报道较少。同时,LIU A P等[26]研究发现,自然发酵体系中多种菌群的协同作用可赋予产品丰富的香味和滋味,有利于天然微生物资源的挖掘、筛选和开发以及形成特殊的风味物质。
因此,本研究通过IlluminaMiSeq高通量测序技术对苹果酵素自然发酵过程中微生物多样性进行分析,同时采用高效液相色谱(high performance liquid chromatography,HPLC)和气相色谱-质谱联用(gas chromatography-mass spectrography,GC-MS)法对其发酵过程中风味成分的变化进行监测分析,并利用双向正交偏最小二乘法(bidirectional orthogonal partial least squares,O2PLS)拟合模型系统分析微生物菌群与风味物质之间的相关性,以期为挖掘相关功能微生物、探究风味形成机理和改进苹果酵素发酵工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
富士苹果(长富2号):采自甘肃省平凉市苹果试验基地;乳酸、乙酸、柠檬酸、琥珀酸、富马酸、丙酸、苹果酸、天冬氨酸、苏氨酸、络氨酸、谷氨酸、组氨酸、缬氨酸、苯丙氨酸、赖氨酸、丝氨酸、甘氨酸、精氨酸、酪氨酸、半胱氨酸、甲硫氨酸、异亮氨酸、亮氨酸、脯氨酸、γ-氨基丁酸、甲醇、3-辛醇、乙酸正戊酯等标准品(均为色谱纯):美国Sigma公司;无水乙醇(色谱纯):上海阿拉丁试剂有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)Markers:宝日医生物技术(北京)有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
GCMS-QP2020 SYSTEM气质联用仪:日本岛津公司;RIGOL L3000高效液相色谱仪:北京普源精电科技有限公司;Amethyst C18液相色谱柱(250 mm×4.6 mm,5 μm):美国赛分科技有限公司;LRH-70型恒温培养箱:上海一恒科学仪器有限公司;YXQ-LS-75G型立式压力蒸汽灭菌锅:上海博迅实业有限公司医疗设备厂;ABI GeneAmp 9700聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;DYCP-32B琼脂糖水平电泳仪:北京六一仪器厂;ChemiDoc XRS+凝胶成像系统:美国伯乐公司。
9700聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;DYCP-32B琼脂糖水平电泳仪:北京六一仪器厂;ChemiDoc XRS+凝胶成像系统:美国伯乐公司。
1.3 方法
1.3.1 苹果酵素样品的制备
新鲜苹果用纯净水冲洗干净,沥干水分后去核并切分成3~5 mm的片,冰糖破碎后用紫外灯辐照处理30 min,将苹果片与纯净水按料液比200∶1(g∶L)加入无菌酵素发酵罐中,加入冰糖调节糖度至15.0°Bx,置于阴凉干燥的发酵车间,在常温(20~26 ℃)条件下自然发酵30 d后,滤去果肉,继续发酵至90 d,发酵第一个月隔天搅拌通气,之后密封发酵,发酵过程中每15 d无菌取样,样品编号分别为:j0、j15、j30、j45、j60、j75、j90,每个样品5个重复,-80 ℃保存待检测。
1.3.2 DNA提取及PCR扩增[27]
DNA提取方法参照试剂盒说明书,提取完成后用1%琼脂糖凝胶测定DNA纯度。以其为模板,采用带有条形码的特异性引物341F(5'-CCTACGGGNGGCWCAG-3')和805R(5'-GACTACHVGGGTATCTAATCC-3')、ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')分别扩增细菌16S rRNA基因的V3-V4高变区和真菌ITS区基因序列。PCR扩增体系:5×FastPfu缓冲液4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTPs)2 μL,5 μmol/L上下游引物各0.8 μL,FastPfu聚合酶0.4 μL,DNA模板10 ng。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共循环27次;72 ℃再延伸10 min。
1.3.3 文库构建和Illumina MiSeq高通量测序
委托南京集思慧远生物科技有限公司完成,使用试剂盒完成文库的构建后,利用Qubit进行定量检测以保证所建文库的质量合格,然后在Illumina MiSeq2500平台对细菌16S rRNA基因和真菌ITS rRNA基因文库进行测序,并基于有效数据以97%的相似性进行操作分类单元(operational taxonomic units,OTUs)聚类和物种分类分析,同时对OTUs进行Alpha多样性分析;通过主成分分析(principal component analysis,PCA)和线性判别分析效应值(linear discriminant analysis effect size,LEfSe)统计分析方法探究组间群落结构的差异。
1.3.4 风味物质分析
有机酸:取2 mL样品,10 000 r/min离心5 min后取上清液,经0.45 μm滤膜过滤,采用HPLC法测定有机酸含量[28]。HPLC条件:进样量为10 μL;Waters Atlantis C18色谱柱(250 mm×4.5 mm,5 μm),柱温30 ℃,流动相0.05 mmol/L H3PO4∶甲醇=95∶5(V/V),流速0.8 mL/min,检测波长210 nm。
氨基酸:取1 mL样品,用100 g/L的三氯乙酸等体积稀释后静置1 h,双层滤纸过滤后10 000 r/min/离心10 min,取上清液采用HPLC法测定氨基酸含量[28]。HPLC条件:流动相A为27.6 mmo/L醋酸钠-三乙胺-四氢呋喃(500∶0.11∶2.5,V/V)(pH=7.2),流动相B为80.9 mmo/L醋酸钠-甲醇-乙腈(1∶2∶2,V/V)(pH=7.2),AgilentHypersilODS(4.0 mm×250mm,5 μm)色谱柱,梯度洗脱程序为0 min,8%B;17 min,50%B;20.1 min,100%B;24.0 min,0%B。流速为1.0 mL/min,柱温40 ℃,检测波长338 nm,脯氨酸检测波长为262 nm。
挥发性风味成分:取1 mL上清液,加入1 mL甲醇、50 μL 3-辛醇内标(630.8mg/L),100μL乙酸正戊酯内标(438.7mg/L),漩涡混匀,采用GC-MS检测挥发性风味成分[28]。GC条件:TB-WAX(30 m×0.25 mm×0.25 μm)毛细管色谱柱,升温程序为40 ℃恒温2 min,以5 ℃/min升温至180 ℃,再以15 ℃/min升温至250 ℃,保持5 min。载气为高纯氦气(He),流速1.2 mL/min,进样量1 μL,不分流进样。MS条件:电子电离(electron ionization,EI)源,电子能量70 eV,离子源温度200 ℃,接口温度250 ℃,扫描范围33.00~350.00 amu。
1.3.5 数据处理及分析
采用PRINSEQV0.20.4、PandaseqV2.11、VsearchV2.15.0、QIIME、LefSe、Orange软件进行统计学分析,结果用“平均值±标准差”表示。采用Simca14.1软件考察微生物群落与风味物质的相关性,利用Cytoscape可视化微生物群落群落与风味物质之间的相互作用网络。
2 结果与分析
2.1 苹果酵素发酵过程中微生物多样性分析
2.1.1 IlluminaMiSeq高通量测序结果及微生物α-多样性分析
采用Illumina Miseq测序分析苹果酵素发酵过程中微生物的多样性,测序结果及α-多样性指数见表1。由表1可知,在35个样品中,质控后共获得1700535条高质量的16SrRNA基因序列,平均每个样本有48 587条,共获得4 307个OTUs,平均每个样品得到123个OTUs;共获得1 348 741条高质量的ITS rRNA基因序列,平均每个样本有38 535条,共得到3 567个OTUs,平均每个样品得到102个OTUs;每个样品的覆盖率均>99%,说明测序深度覆盖到样品中所有的物种,且数据质量可靠。根据Chao1和Shannon指数可知,随着发酵时间的延长,发酵液中细菌和真菌菌群的丰度和多样性均逐渐升高,细菌菌群在发酵90 d时达到最高,真菌菌群在发酵75 d时达到最高,说明发酵有利于提高食用苹果酵素中菌群的数量及种类。
表1 Illumina MiSeq高通量测序结果及α-多样性分析结果
Table 1 Results of Illumina MiSeq high-throughput sequencing and Alpha diversity analysis

2.1.2 微生物群落组成及动态变化
在门和属水平上对苹果酵素中的微生物群落进行分类以考察其发酵过程中的演替规律,结果见图1。苹果酵素发酵过程中共鉴定出366个细菌门和489个真菌门,由图1A可知,细菌群落中厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)占绝对优势地位,二者的相对丰度>96%,其中,变形菌门在发酵0~15 d和75~90 d处于主导地位,随着发酵时间的延长,其相对丰度从发酵0 d的99.58%逐渐降低至45 d时的41.38%,随后逐渐升高,发酵90 d时上升至75.40%;厚壁菌门的相对丰度先升高后降低,发酵60 d时最高为57.34%,随后逐渐降低至90 d时的21.55%。真菌群落中子囊菌门(Ascomycota)在整个发酵过程中占绝对优势地位,相对丰度达87.93%~99.74%,其相对丰度先降低后升高,发酵75 d时降至最低为87.93%,发酵90 d时又上升至93.18%;其次为担子菌门(Basidiomycota),相对丰度为0.07%~4.11%,其相对丰度随着发酵时间的延长先升高后降低,发酵75 d时最高为4.11%,随后逐渐降低至90 d时的1.75%。

图1 基于门(A)和属(B)水平苹果酵素发酵过程中微生物的群落结构
Fig.1 Microbial community structure of apple Jiaosu during fermentation process based on phylum (A) and genus (B) levels
Other:未知微生物。
苹果酵素发酵过程中共鉴定出218个细菌属和114个真菌属,由图1B可知,在发酵0~15 d,泛菌属(Pantoea)、肠杆菌属(Enterobacter)和葡萄糖酸杆菌属(Gluconobac ter)占优势地位,其相对丰度之和为60.83%~97.86%,它们可能来源于原料和环境,并于发酵15 d后迅速减少。同时,酒球菌属(Oenococcus)和醋酸杆菌属(Acetobacter)的相对丰度从发酵15 d后逐渐升高,成为优势细菌群,随着发酵的进行,发酵75~90 d的优势细菌群以假单胞菌属(Pseudomonas)为主,发酵90 d时达到最高,相对丰度为51.23%,同时,束毛球菌属(Trichococcus)、链球菌属(Streptococcus)和微小杆菌属(Exiguobacterium)等的相对丰度从发酵15 d后逐渐升高。真菌菌群在发酵45 d前主要以梨孢菌属(Magnaporthe)为主,其相对丰度为87.80%~97.87%,发酵45 d后的优势真菌菌群有梨孢菌属(Magnaporthe)和柱隔孢属(Ramularia),二者相对丰度之和为76.77%~97.79%,曲霉属(Aspergillus)、假丝酵母属(Candida)、有孢圆酵母属(Torulaspora)、青霉属(Penicillium)、枝孢霉属(Cladospo rium)、酵母属(Saccharomyces)以及威克汉姆酵母属(Wickerhamomyces)等的相对丰度随着发酵的进行逐渐升高,它们虽然占比较小,但可能为苹果酵素风味的形成做出了重要的贡献[29],威克汉姆酵母菌作为非酿酒酵母,在高酸度条件下生长良好,生成大量酯类,并且保证生成的酯类不被降解[30]。
2.2 苹果酵素发酵过程中微生物菌群组成的比较
为了进一步了解苹果酵素发酵过程中的微生物菌群结构,采用PCA和LEfSe对其发酵过程中的微生物菌群在属水平的组成进行比较,结果分别见图2和图3。
由图2可知,根据细菌群落结构苹果酵素发酵过程分为3个阶段:0~15 d为发酵前期,30~60 d为发酵中期,75~90 d为发酵后期;根据真菌群落结构苹果酵素发酵过程分为可分为2个阶段:0~45 d为发酵前期,60~90 d为发酵后期。
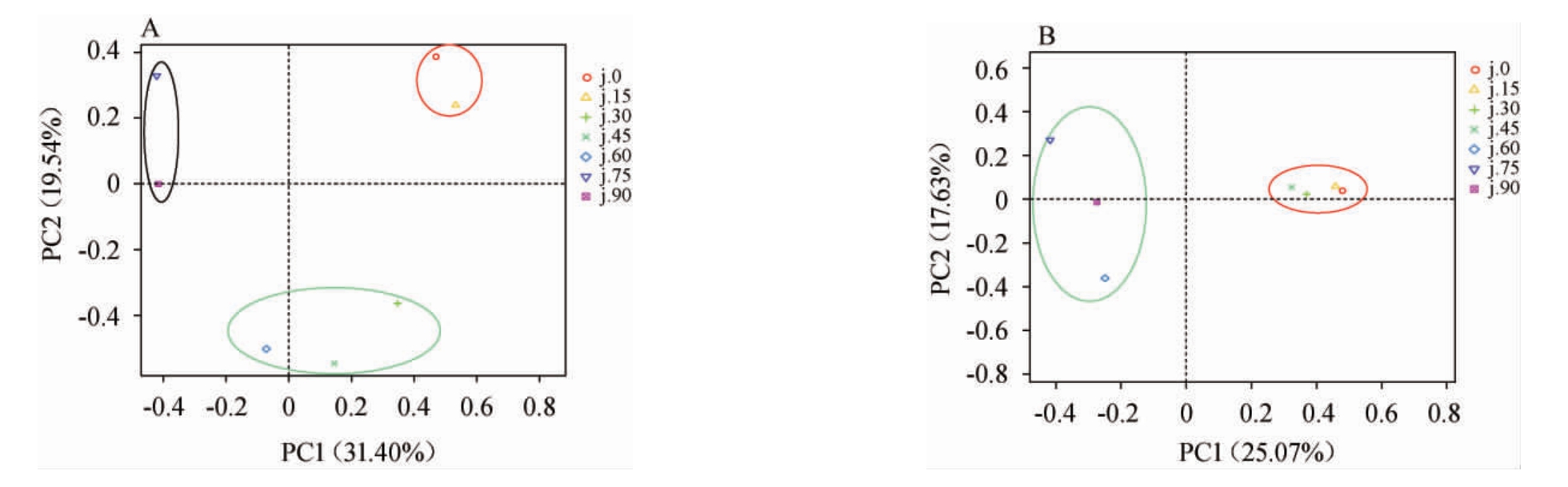
图2 基于属水平苹果酵素发酵过程中细菌(A)和真菌(B)群落的主成分分析结果
Fig.2 Principal component analysis results of bacterial (A) and fungal (B) communities of apple Jiaosu during fermentation process based on genus level
由图3可知,发酵前期(0~15 d)与其他两个阶段的差异细菌属有4个,分别为泛菌属(Pantoea)、肠杆菌属(Enterobacter)、葡萄糖酸杆菌属(Gluconobacter)和Ferruginibacter,其中随原材料进入的环境物种Pantoea和Enterobacter为此阶段的主要差异细菌属,Gluconobacter和Ferruginibac ter相对丰度增长,且Gluconobacter贯穿发酵始终,该菌含有多种酶类,可以产生多种重要化合物,这些化合物不仅在发酵中起着重要作用,还可能影响发酵过程中抗氧化性能的变化,酵素中酶活力的强弱可能与葡萄糖酸杆菌中富含酶有关[31];由酒球菌属(Oenococcus)、醋酸杆菌属(Ace tobacter)和拟杆菌属(Bacteroides)组成的细菌菌群在发酵中期(30~60 d)表现出明显的属间差异,此时,发酵体系中的氧气含量逐渐下降,pH逐渐降低,抗炎因子的产生,使得杂菌及有害菌逐渐死亡,醋酸杆菌属、酒球菌属等有益菌的相对丰度增加,逐步占领泛菌属和肠杆菌属的空间与资源,这些益生菌及整个发酵环境的改变使得杂菌相对丰度逐步下降[32],酒球菌属是完成苹果酸乳酸发酵的重要微生物[33],醋酸杆菌属在发酵30 d后可能因为进入乳酸发酵而逐渐降低;发酵后期(75~90 d)的差异菌种显著增多,其中假单胞菌属(Pseudomonas)和链球菌属(Streptococcus)为优势菌细菌属,微小杆菌属(Exiguobacterium)、乳杆菌属(Lactobacillus)、琥珀酸菌属(Succiniclasticum)等可能是影响苹果酵素风味物质形成的主要菌群。真菌在发酵前期(0~45 d)的主要差异真菌属为酵母菌属(Saccharomyces);毕赤酵母属(Pichia)、曲霉属(Aspergillus)、篮状菌属(Talaromyces)、有孢圆酵母属(Torulaspora)、假丝酵母属(Candida)等是发酵后期(60~90 d)的差异真菌属。总体而言,每个发酵阶段都有标志性的差异物种,在不同的发酵阶段起着重要作用,对于不同发酵阶段微生物在发酵过程中的作用及机制需要进一步的研究。

图3 基于属水平苹果酵素发酵过程中细菌(A)和真菌(B)群落的LEfSe结果
Fig.3 LEfSe results of bacterial (A) and fungal (B) communities of apple Jiaosu during fermentation process based on genus level
2.3 苹果酵素发酵过程中风味物质的变化
2.3.1 有机酸和氨基酸的变化
有机酸和氨基酸是发酵产品中主要的滋味物质[33]。苹果酵素发酵过程中有机酸和氨基酸的变化见图4。
由图4A可知,从苹果酵素发酵过程中共检测出7种有机酸,分别为苹果酸、乙酸、乳酸、柠檬酸、琥珀酸、富马酸和丙酸。发酵初期(0~15 d)检测到的主要有机酸为苹果酸,其含量>20 mg/100 mL,分析原因可能是由于苹果酸是苹果原料中的主要有机酸[34];发酵中期(30~60 d),乙酸和乳酸的含量迅速升高,分析原因可能是在乳酸菌的作用下,苹果酸被分解成乳酸及二氧化碳,与此同时产生带有黄油风味的丁二酮等风味物质[34],在糖源充足的情况下,醋酸菌可直接利用葡萄糖生成乙酸[35],或将酵母菌代谢产生的乙醇在醋酸菌的作用下转化为乙酸[36];发酵后期(75~90 d)的有机酸主要为乙酸和乳酸,占7种有机酸总量的90.25%,乙酸含量高于乳酸,这可能是因为厌氧条件下部分乳酸氧化转化为乙酸,柠檬酸参与三羧酸代谢循环,在发酵过程中不易累积[37],发酵结束时含量仅为9.12 mg/100 mL;琥珀酸是三羧酸循环的中间产物,同时也是厌氧代谢的发酵产物之一[38],发酵90 d时达到127.4 mg/100 mL;富马酸和丙酸随着发酵进程逐渐升高,但含量较低。
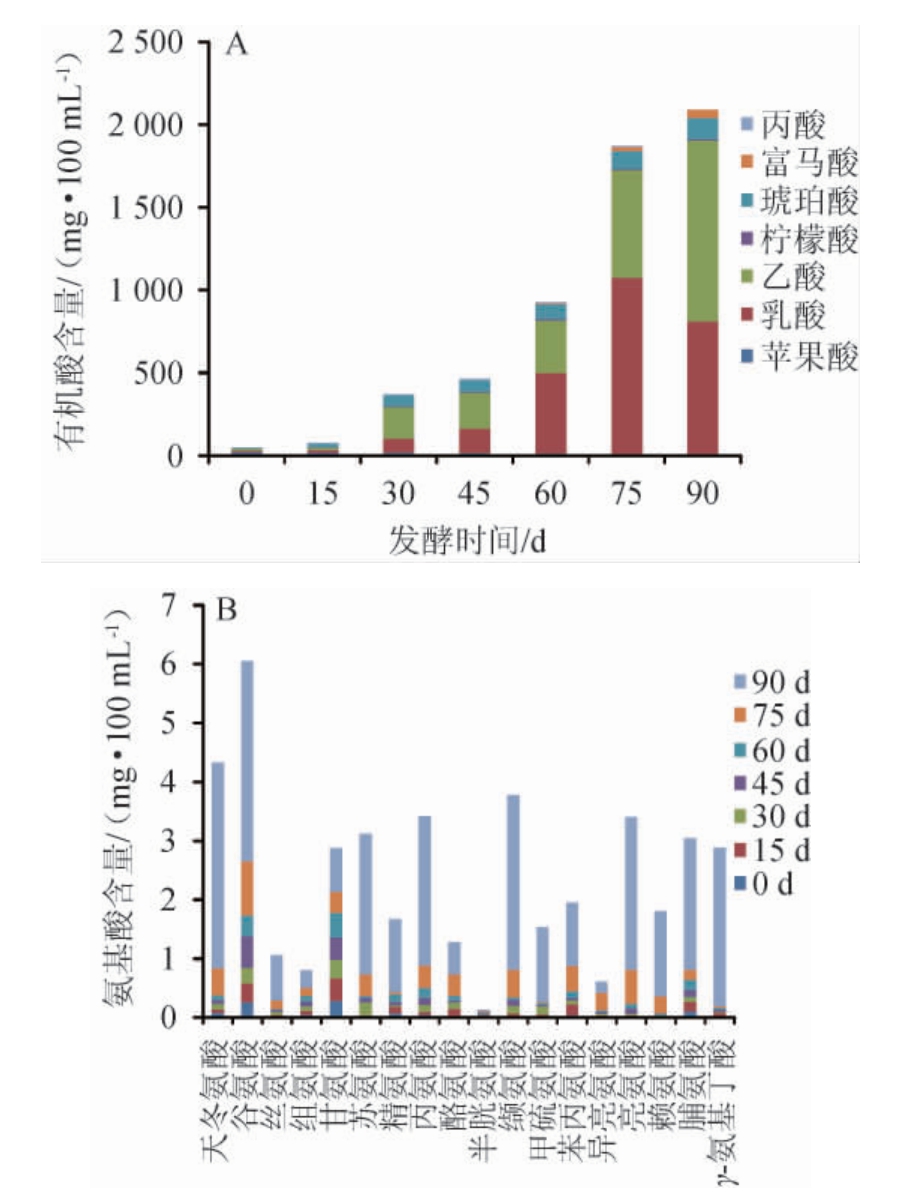
图4 苹果酵素发酵过程中有机酸(A)和氨基酸(B)含量的变化
Fig.4 Changes of organic acids (A) and amino acids (B) contents in apple Jiaosu during fermentation process
γ-氨基丁酸(γ-aminobutyric acid,GABA)具有降血压、改善脑机能和调节睡眠等功能,游离氨基酸主要影响食品的酸、甜、苦、鲜等风味,其中谷氨酸(glutamic acid,Glu)和天冬氨酸(aspartic acid,Asp)呈鲜味,苯丙氨酸(phenylalanine,Phe)、亮氨酸(leucine,Leu)、异亮氨酸(isoleucin,Ile)和缬氨酸(valine,Val)呈苦味,甘氨酸(glycine,Gly)、脯氨酸(proline,Pro)、丝氨酸(serine,Ser)、丙氨酸(alanine,Ala)、苏氨酸(threonine,Thr)和赖氨酸(lysine,Lys)呈甜味[39]。由图4B可知,苹果酵素发酵过程中均含有17种游离氨基酸和γ-氨基丁酸,其中包括苏氨酸、缬氨酸、甲硫氨酸(methionine,Met)、苯丙氨酸、亮氨酸、赖氨酸等6种必需氨基酸(essential amino acid,EAA),必需氨基酸是评价食品营养的指标之一,发酵结束时必需氨基酸含量为11.71 mg/100 mL,总氨基酸(total amino acid,TAA)含量为23.84 mg/100 mL,EAA/TAA为49.12%,与世界卫生组织(World Health Organization,WHO)和联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)提出的理想蛋白质模式的氨基酸组成EAA/TAA 40%接近[39],说明苹果酵素必需氨基酸含量丰富,达到优质蛋白质的要求。苹果酵素发酵过程中氨基酸含量普遍升高,这与金哲宁等[40]在沙棘酵素中的研究结果一致,发酵后期(75~90 d)氨基酸含量升高较快,这可能与微生物细胞中的氨基酸溶出有关[41],含量较高的呈味氨基酸有天冬氨酸、谷氨酸、苏氨酸、丙氨酸、缬氨酸、亮氨酸、脯氨酸,7种氨基酸总含量占总氨基酸含量的82.05%,共同赋予苹果酵素产品鲜香、甜美的特征。
2.3.2 挥发性风味物质的变化
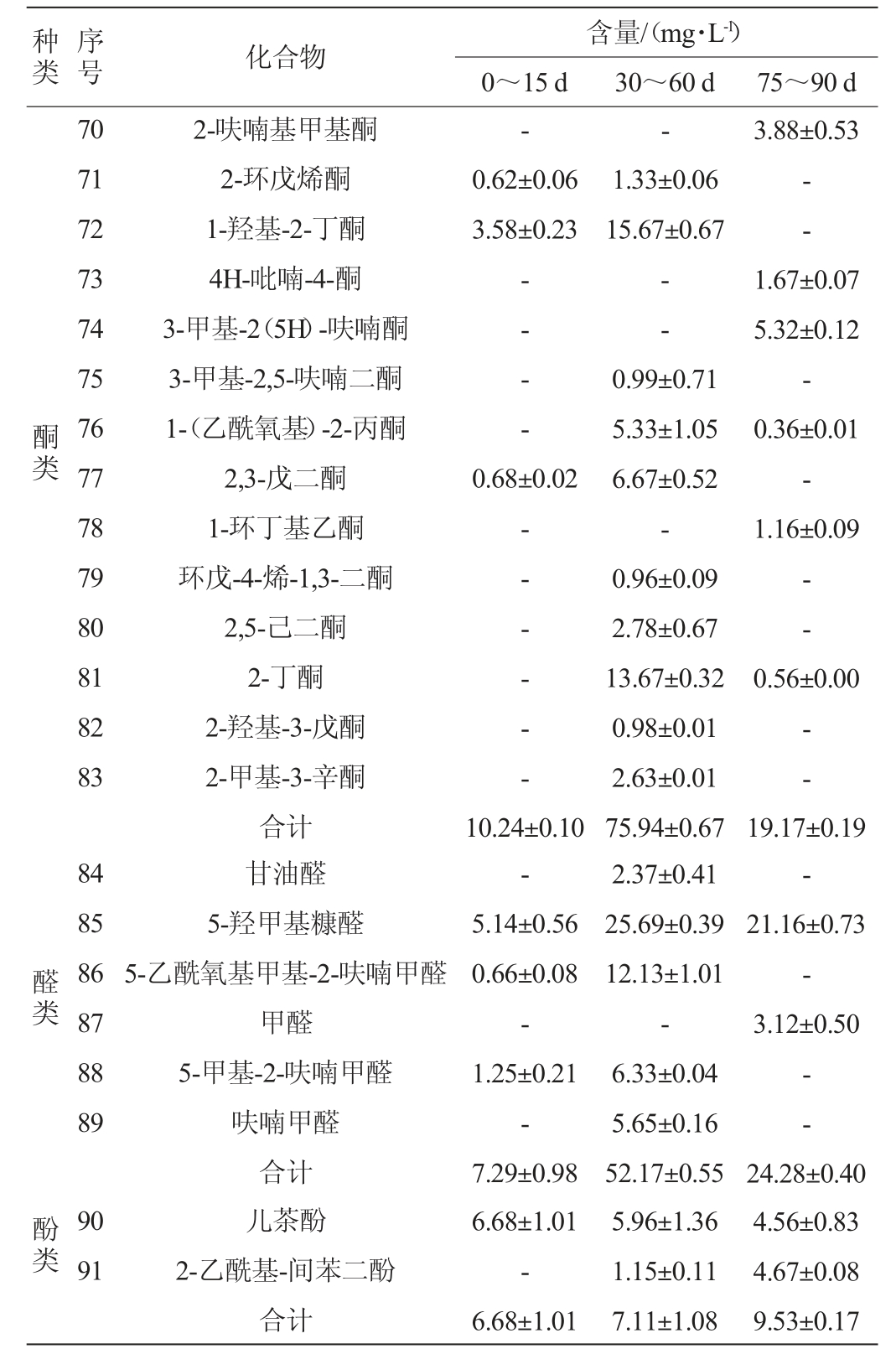
食用酵素不仅含有原料本身的风味物质,而且通过微生物发酵产生了新的成分,挥发性风味物质的构成与含量客观地反映了产品风味特点[13]。苹果酵素发酵过程中挥发性风味物质的变化见表2。
表2 苹果酵素发酵过程中挥发性风味物质GC-MS测定结果
Table 2 Determination results of volatile flavor compounds in apple Jiaosu during fermentation process analyzed by GC-MS

续表

续表
注:“-”表示未检出。
由表2可知,苹果酵素发酵过程中共检出91种主要挥发性风味物质,包括酯类31种、醇类16种、酸类18种、酮类18种、醛类6种、酚类2种,王印壮等[42]在葡萄酵素中检测出21种香气成分,范昊安等[43]在苹果梨酵素中检测出40种香气成分,说明自然发酵的苹果酵素的挥发性风味物质较为丰富。发酵前期有13种酯类,总含量为46.00 mg/L,10种醇类,总含量为57.83 mg/L,9种酸类,总含量为33.05 mg/L,6种酮类,总含量为10.24 mg/L,3种醛类,总含量为7.29 mg/L,1种酚类,含量为6.68 mg/L;发酵中期有26种酯类,总含量为388.39 mg/L,14种醇类,总含量为281.01 mg/L,14种酸类,总含量为331.88 mg/L,13种酮类,总含量为75.94 mg/L,5种醛类,总含量为52.17 mg/L,2种酚类,总含量为7.11 mg/L;发酵后期有30种酯类,总含量为933.17 mg/L,11种醇类,总含量为173.81 mg/L,17种酸类,总含量为488.21 mg/L,7种酮类,总含量为19.17 mg/L,2种醛类,总含量为24.28 mg/L,2种酚类,总含量为9.53 mg/L。其中2-羟基-γ-丁内酯、对羟基苯乙酸乙酯、异丁酸异戊酯、羟基乙酸乙酯、苯乙醇、异山梨醇、乙酸、乳酸、苯甲酸和儿茶酚等挥发性风味物质在发酵后期含量较高,这可能与发酵后期微生物的代谢有关[4],需要进一步进行相关性分析。
由表2亦可知,苹果酵素发酵过程中挥发性风味物质的种类和含量差异较大,酯类物质的种类和含量随着发酵时间的延长逐渐增加,同时因其阈值低、气味活度值高,故而在苹果酵素的风味形成中贡献较大,乙酸乙酯、甲酸乙酯、戊酸乙酯等长链脂肪酸乙酯具有水果香味,增加了产品的醇厚风味[44]。醇类物质主要在酵母菌发酵阶段产生,发酵45 d后含量和种类均逐渐降低,这可能是与酸类物质发生酯化反应生成酯类物质,使得酯类物质在发酵后期迅速升高。酸类物质使苹果酵素的香气更为浓郁,酮类物质和醛类物质的含量呈先升高后降低的趋势,这可能与其在发酵过程中易被氧化还原为酸或醇类物质有关[42]。综合来看,苹果酵素中挥发性风味物质主要以酯类物质、酸类物质、醇类物质为主,路翔等[45]提出对苹果芳香起主要作用的物质为酯类、醇类、酸类、醛类、酮类等,这与本研究的结果基本一致。
2.4 微生物菌群与风味物质的相关性分析
采用微生物菌属(218个细菌属、114个真菌属)与风味物质(91种挥发性物质、18种氨基酸、7种有机酸)两个数据集建立O2PLS模型[47],根据模型的解释能力R2(细菌1、真菌1)和预测能力Q2(细菌0.936、真菌0.934)可知,O2PLS模型适合于微生物与风味物质相关性的分析和预测,同时基于变量投影重要性(variable importance in projection,VIP)值>1且P<0.05筛选出对风味物质影响较大的22个细菌属和14个真菌属,进行微生物菌群与风味物质的Spearman相关性分析[46],结果见图5。
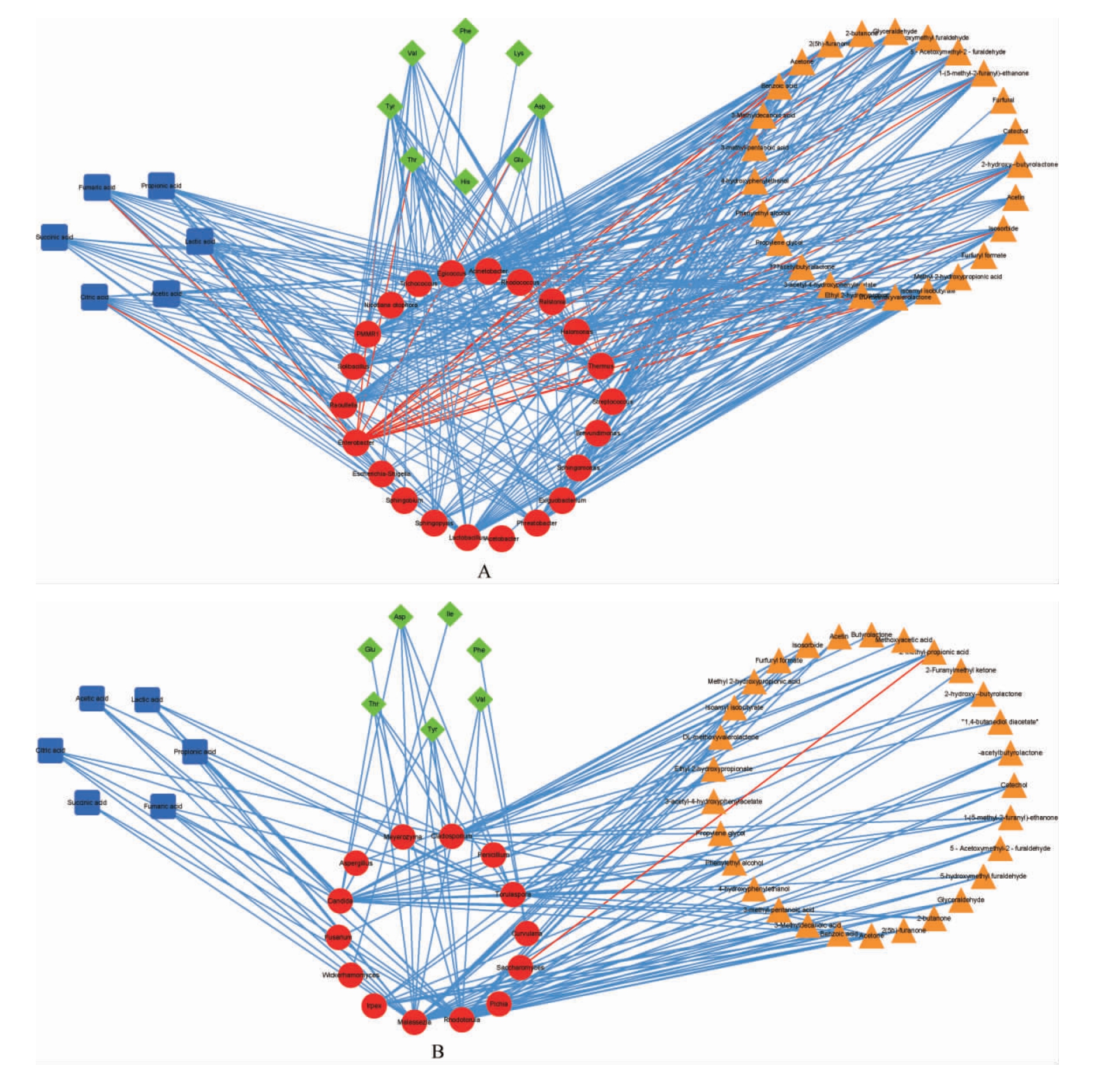
图5 苹果酵素发酵过程中细菌菌群(A)和真菌菌群(B)与风味物质的相关性网络图
Fig.5 Correlation network diagram of bacterial flora (A) and fungal flora (B) with flavor substances during fermentation process of apple Jiaosu
由图5A可知,除肠杆菌属(Enterobacter)与3种有机酸、3种氨基酸和15种挥发性风味物质呈负相关关系外,其他21个细菌属均与风味物质呈正相关关系,其中与醋杆菌属(Acetobacter)、乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)呈正相关关系的风味物质较多,包括6种有机酸(乳酸、乙酸、柠檬酸、琥珀酸、富马酸、丙酸)和6种氨基酸(天冬氨酸、苏氨酸、络氨酸、谷氨酸、组氨酸、缬氨酸)以及23种挥发性风味物质(2-羟基丙酸乙酯、乙酸甘油酯、乙酸异山梨醇酯、甲酸糠酯、2-羟基丙酸甲酯、DL-甲羟戊酸内酯、2-羟基丙酸乙酯、3-乙酰基-4-羟基苯乙酸酯、α-乙酰丁内酯、异山梨醇、丙二醇、苯乙醇、4-羟基苯乙醇、3-甲基癸酸、苯甲酸、2(5H)-呋喃酮、2-丁酮、甘油醛、5-羟甲基糠醛、5-乙酰氧基甲基-2-呋喃甲醛、5-甲基-2-呋喃甲醛、儿茶酚)。
由图5B可知,共有14种真菌属与6种有机酸、7种氨基酸和29种挥发性风味物质有相关性,除酵母菌属(Saccha romyces)与2-甲基-丙酸呈负相关关系外,其他13个真菌属均与风味物质呈正相关关系。假丝酵母属(Candida)、有孢圆酵母属(Torulaspora)、枝孢属(Cladosporium)、马拉色菌属(Malassezia)和红酵母属(Rhodotorula)是影响有机酸合成代谢的主要真菌属微生物,均与乳酸和柠檬酸呈正相关关系;共有8个真菌属对氨基酸的合成代谢产生贡献,假丝酵母属、有孢圆酵母属、枝孢属、马拉色菌属和红酵母属5个属与天冬氨酸、苏氨酸、络氨酸呈正相关关系,马拉色菌属、弯孢属(Curvularia)、红酵母属3个属与缬氨酸呈正相关关系,Meyerozyma和威克汉姆酵母属(Wickerhamomyces)分别与谷氨酸和异亮氨酸呈正相关关系;假丝酵母属、有孢圆酵母属、枝孢属、马拉色菌属、红酵母属、耙菌属(Irpex)、曲霉属(Aspergillus)、青霉属(Penicillium)、酵母菌属(Saccharomyces)、镰刀菌属(Fusarium)、毕赤酵母属(Pichia)11个真菌参与到29种挥发性风味物质的代谢中,假丝酵母属和有孢圆酵母属与2-羟基-γ-丁内酯、异丁酸异戊酯、3-乙酰基-4-羟基苯乙酸酯、异山梨醇、苯乙醇、4-羟基苯乙醇、3-甲基-戊酸、3-甲基癸酸、2-甲基-丙酸、2-丁酮、5-甲基-2-呋喃甲醛、5-羟甲基糠醛和儿茶酚等14种挥发性风味物质呈正相关关系。
综上所述,醋杆菌属、乳杆菌属、链球菌属、假丝酵母属和有孢圆酵母属是与苹果酵素中风味物质物质关联最强的微生物菌群。醋杆菌属、乳杆菌属和链球菌属是重要的产酸菌,均与乙酸和乳酸呈高度相关,它们在提供酸味的同时,还可与醇、醛、酮等物质相互作用产生新的风味物质[47],而且一直以来被认为是病原菌的假丝酵母属,在苹果酵素风味物质的形成中发挥着重要作用[48],这与XIAO Y S等[29]的研究结果一致,有孢圆酵母属是常见的非酿酒酵母属之一[49],其发酵能力强,可以增加甘油、萜烯和果味脂肪酸酯类等的含量,同时低产乙醇、挥发酸和乙醛[50]。因此,微生物和风味物质关联性研究有利于科学评价微生物群落在苹果酵素发酵中的作用,解决苹果酵素中功能性微生物的筛选以及风味物质的调控难题,并为建立具有科学性的发酵工艺,为生产风味和营养价值更高的酵素产品提供参考。
3 结论
本研究采用高通量测序技术对苹果酵素发酵过程中微生物多样性进行动态分析,通过PCA和LEfSe分析了苹果酵素不同发酵阶段的标志微生物演替图谱,并结合高效液相色谱和气相色谱-质谱联用技术监测风味物质的变化。结果显示,发酵过程中共鉴定出366个细菌门、218个细菌属,489个真菌门、114个真菌属。门水平上,厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和子囊菌门(Ascomycota)是整个发酵过程中主要微生物。属水平上,首先由环境微生物泛菌属(Pantoea)、肠杆菌属(Enterobacter)、梨孢菌属(Magnaporthe)启动发酵,随后酒球菌属(Oenococcus)、醋酸杆菌属(Acetobacter)、柱隔孢属(Ramularia)的相对丰度逐渐升高,发酵结束时假单胞菌属(Pseudomonas)和柱隔孢属(Ramularia)的相对丰度较大。PCA和LEfSe分析结果表明,苹果酵素不同发酵阶段的微生物群落差异显著,且随着发酵时间的延长,发酵液中的差异菌属逐渐增加。苹果酵素发酵过程中共检测出7种有机酸(苹果酸、乙酸、乳酸、柠檬酸、琥珀酸、富马酸和丙酸)、18种氨基酸(天冬氨酸、谷氨酸、丝氨酸、组氨酸、甘氨酸、苏氨酸、精氨酸、丙氨酸、酪氨酸、半胱氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、异亮氨酸、赖氨酸、亮氨酸、脯氨酸和γ-氨基丁酸)以及91种挥发性风味物质(酯类、醇类、酸类、酮类、醛类、酚类)。采用双向正交偏最小二乘法(O2PLS)对微生物菌群与风味物质进行相关性分析,结果表明,醋杆菌属、乳杆菌属、链球菌属、假丝酵母属和有孢圆酵母属与苹果酵素中风味物质物质的风味形成高度相关,研究结果为筛选产生特征风味和功能物质的菌株提供了有力的理论指导,但这并不意味着这些微生物一定会产生风味物质,具体代谢途径还需通过宏基因组学或宏转录组学进一步深入研究。
[1]陈倩,李永杰,扈莹莹,等.传统发酵食品中微生物多样性与风味形成之间关系及机制的研究进展[J].食品工业科技,2021,42(9):412-419.
[2]姜丽.黑糯米酒发酵过程中微生物多样性及风味品质研究[D].贵阳:贵州大学,2020.
[3]马冰涛,范恩帝,李泽霞,等.老白干香型白酒制曲过程中微生物多样性及其与风味成分的关系[J].食品与发酵工业,2020,46(16):7-16.
[4] ZOU W,ZHAO C Q,LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Front Microbiol,2018,9:671.
[5] WANG S L,WU Q,NIE Y,et al.Construction of synthetic microbiota for reproducible flavor metabolism in Chinese light aroma type liquor produced by solid-state fermentation[J].Appl Environ Microbiol,2019,85(10):e03090-18.
[6]孙娜.三种发酵方式柑橘果醋品质及细菌微生物多样性的研究[D].延边朝鲜族自治州:延边大学,2020.
[7]黄静,严唯玮,刘书亮,等.食醋大曲功能微生物菌群与品质解析研究进展[J].食品科学,2020,41(7):322-328.
[8] JIANG Y J,LV X C,ZHANG C,et al.Microbial dynamics and flavor formation during the traditional brewing of Monascus vinegar[J]. Food Res Int,2019,125(6):108531.
[9]HE Z,CHEN H Y,WANG X Y,et al.Effects of different temperatures on bacterial diversity and volatile flavor compounds during the fermentation of Suancai,a traditional fermented vegetable food from northeastern China[J].LWT-Food Sci Technol,2020,118:108773.
[10]XU X X,WU B B,ZHO W T,et al.Correlation between autochthonous microbial communities and key odorants during the fermentation of red pepper(Capsicum annuum L.)[J].Food Microbiol,2020,91:103510.
[11]中华人民共和国工业和信息化部.QB/T5323—2018 植物酵素[S].北京:中国标准出版社,2018.
[12]高庆超,常应九,马蓉,等.微生物酵素的研究进展[J].食品研究与开发,2020,41(2):190-195.
[13]DAI J,SHA R Y,WANG Z Z,et al.Edible plant Jiaosu:manufacturing,bioactive compounds,potential health benefits,and safety aspects[J].Sci Food Agr,2020,100(15):5313-5323.
[14]陈小伟,程勇杰,范昊安,等.草莓酵素发酵过程中氨基酸成分分析和蛋白质营养评价[J].食品工业科技,2018,39(17):64-70,78.
[15]张海燕,康三江,袁晶,等.苹果酵素自然发酵过程中生物活性物质的变化[J].中国酿造,2021,40(3):111-114.
[16]阴芳冉.红树莓自然发酵过程中生物活性研究与微生物多样性分析[D].保定:河北农业大学,2019.
[17]邸鹏月,彭宇,李晨,等.基于宏基因组分析桑葚酵素的微生物多样性[J].中国食品学报,2020,20(5):251-257.
[18]李希羽,高洁,李云姣,等.水果酵素自然发酵过程中优势菌群与有机酸变化规律分析[J].食品科学,2020,41(24):61-68.
[19]张海燕,康三江,张芳,等.发酵条件对苹果酵素品质及生物活性的影响[J].食品工业,2021,42(6):163-168.
[20]鲁云风,王博文,张四普,等.苹果酵素生产工艺优化研究[J].酿酒,2021,48(3):104-107.
[21]张海燕,康三江,袁晶,等.苹果酵素自然发酵工艺优化及品质分析[J].中国酿造,2020,39(10):145-151.
[22]杨小幸,周家春,陈启明,等.苹果酵素天然发酵过程中代谢产物的变化规律[J].食品科学,2017,38(24):15-19.
[23]张海燕.自然发酵苹果酵素理化指标和抗氧化活性动态分析[J].甘肃农业科技,2020(11):37-41.
[24]李飞,王凤舞,潘越,等.苹果酵素抗氧化活性初步研究[J].青岛农业大学学报(自然科学版),2016,33(1):40-44.
[25]康晓乐,李东霓,李晨,等.苹果自然发酵酵素微生物多样性分析[J].中国食品学报,2021,21(1):283-290.
[26]LIU A P,LI X Y,PU B,et al.Use of psychrotolerant lactic acid bacteria(Lactobacillus spp.and Leuconostoc spp.) isolated from Chinese traditional Paocai for the quality improvement of Paocai products[J]. J Agr Food Chem,2017,65(12):2580-2587.
[27]XIAO Y S,HUANG T,HUANG C L,et al.The microbial communities and flavour compounds of Jiangxi Yancai,Sichuan Paocai and Dongbei Suancai:Three major types of traditional Chinese fermented vegetables[J].LWT-Food Sci Technol,2020,121:108865.
[28]RAO Y,TAO Y F,CHEN X,et al.The characteristics and correlation of the microbial communities and flavors in traditionally pickled radishes[J].LWT-Food Sci Technol,2020,118:108804.
[29] XIAO Y S,XIONG T,PENG Z,et al.Correlation between microbiota and flavours in fermentation of Chinese Sichuan Paocai[J]. Food Res Int,2018,114:123-132.
[30]GUAN Q Q,XIONG T,XIE M Y.Influence of probiotic fermented fruit and vegetables on human health and the related industrial development trend[J].Engineering,2021,7(2):212-218.
[31]MA D,HE Q W,DING J,et al.Bacterial microbiota composition of fermented fruit and vegetable juices(Jiaosu) analyzed by single-molecule,real-time(SMRT)sequencing[J].CyTA-J Food,2018,16(1):950-956.
[32]HUANG X N,YU S Z,HAN B Z,et al.Bacterial community succession and metabolite changes during sufu fermentation[J]. LWT-Food Sci Technol,2018,97:537-545.
[33]彭潇,邹文静,邵清清,等.石榴酒发酵过程中真菌种群演替及风味物质代谢规律解析[J].食品科学,2021,42(6):157-163.
[34]郭志君,杨磊,骆红霞,等.苹果酸-乳酸发酵对刺梨酒香气的影响[J].食品与机械,2022,38(3):197-204,233.
[35] ZHOU P P,YAO R M,ZHANG H S,et al.Unique glucose oxidation catalysis of Gluconobacter oxydans constitutes an efficient cellulosic gluconic acid fermentation free of inhibitory compounds disturbance[J].Biotechnol Bioeng,2019,116(9):2191-2199.
[36]LYNCH K M,ZANNINI E,WILKINSON S,et al.Physiology of acetic acid bacteria and their role in vinegar and fermented beverages[J].Compr Rev Food Sci Food Saf,2019,18(3):587-625.
[37]刘心澄.柑橘磷酸烯醇式丙酮酸羧激酶与柠檬酸降解[D].杭州:浙江大学,2021.
[38]唐文秀.高产琥珀酸大肠杆菌的构建与发酵研究[D].无锡:江南大学,2021.
[39]高熳熳,张旭普,白俊岩,等.不同发酵工艺糙米酵素中游离氨基酸、γ-氨基丁酸及挥发性香气成分分析[J].食品工业科技,2019,40(23):36-41.
[40]金哲宁,方晟,沙如意,等.沙棘酵素功能成分及其体外抗氧化性能研究[J].食品研究与开发,2020,41(17):20-28.
[41]赵敏,王瑜,李立郎,等.天麻酵素化过程中风味物质及抗氧化活性动态变化[J].食品与发酵工业,2021,47(22):92-98.
[42]王印壮,段定定,丁玉峰,等.葡萄酵素发酵过程中代谢产物的动态变化[J].食品科学,2022,43(18):98-104.
[43]范昊安,沙如意,杜柠,等.苹果梨酵素发酵过程中香气成分的变化[J].食品科学,2021,42(2):177-184.
[44]李维妮,郭春锋,张宇翔,等.气相色谱-质谱法分析乳酸菌发酵苹果汁香气成分[J].食品科学,2017,38(4):146-154.
[45]路翔,高源,王昆,等.苹果栽培品种不同族系香气特征分析[J].中国农业科学,2022,55(3):543-557.
[46]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities: a metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[47]万国福,郝涤非,李西腾,等.微生物检验技术[M].北京:化学工业出版社,2018:160-165.
[48] ENGLEZOS V,TORCHIO F,CRAVERO F,et al.Aroma profile and composition of Barbera wines obtained by mixed fermentations of Starmerella bacillaris(synonym Candida zemplinina)and Saccharomyces cerevisiae[J].LWT-Food Sci Technol,2016,73:567-575.
[49]BENITO S.The impact of Torulaspora delbrueckii yeast in winemaking[J].Appl Microbiol Biotechnol,2018,102:3081-3094.
[50]战吉宬,曹梦竹,游义琳,等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学,2020,53(19):4057-4069.