桂皮是我国日常调味品中一种常见的原料,由樟科樟属植物树皮经过晾晒或烘烤干燥后制得[1],因为其含有挥发油、丁香酚、香豆素等易挥发性物质,具有芳香气味,因而常被用于复合调味料的制作或在烹饪中直接使用。其中,所含有的香豆素具有抗炎镇痛的功效[2-3],同时还在抗肿瘤药物的开发领域得到广泛的关注[4]。近年来,也有研究表明,香豆素的合成衍生物和仿生香豆素类似物对乳腺癌细胞有一定的抑制作用[5-7]。然而,也有相关研究表明,香豆素的代谢产物具有一定的毒性,可影响肝脏功能[8-9]。2017年世界卫生组织国际癌症研究机构也将香豆素列为3类致癌物。由于香豆素香味独特,常被作为增味剂添加到食品中,容易出现违法添加及用量超标的情况。因此,建立桂皮中香豆素的检测方法具有重要的现实意义,将有助于企业规避贸易壁垒的风险。
目前,国标GB 5009.284—2021《食品安全国家标准食品中香兰素、甲基香兰素、乙基香兰素和香豆素的测定》建立了婴幼儿配方食品、糕点、饮料、乳制品以及小麦粉中香兰素及香豆素的相关测定方法,但天然香辛料中香豆素的测定相关标准及法律法规尚未建立,检测方法的相关报道也较少。2021年11月30日,印度食品安全标准局(food safety standards authority of India,FSSAI)发布公告对进口肉桂中的香豆素展开检验,要求所有进口肉桂均需检验香豆素含量,且香豆素含量不得超过0.3%。我国年均出口贸易数量逐年增加,都在215万t以上。由于印度是香料消费大国,有不少企业从我国进口桂皮。
目前,已报道的香豆素及其同系物的测定方法主要集中在高效液相色谱法(high performance liquid chromatography,HPLC)[10-13]、高效液相色谱-质谱法(high performance liquid chromatography-mass spectrometry,HPLC-MS)[14-17]和气相色谱-质谱法(gas chromatography-mass spectrometer,GC-MS)[18-22],而桂皮中香豆素的相关测定方法报道较少。对于大部分的化合物测定,高效液相色谱法选择性较低,前处理净化步骤复杂,且仪器检出限较高[23]。高效液相色谱-串联质谱法和气相色谱-质谱法对目标物的选择性较高,但受基质干扰明显,可能会存在假阳性的情况[24]。因此,本研究通过响应面设计优化桂皮中香豆素的提取条件,建立超高效液相色谱-四极杆飞行时间质谱法(ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-Q-TOF/MS)测定桂皮中香豆素的含量,并进行方法学考察,以期为桂皮中香豆素及其同系物的测定提供技术支持。
1 材料与方法
1.1 材料与试剂
桂皮:市售;香豆素和香豆素-d4(纯度均≥98.5%):天津阿尔塔科技有限公司;甲酸、乙腈、乙酸乙酯、甲醇(均为色谱级):美国Thermo Fisher Scientific公司;其他试剂均为国产分析纯。
1.2 仪器与设备
API5600+质谱仪:美国AB SCIEX公司;LC-30AD液相色谱仪:日本岛津公司;Milli-Q Advantage A10超纯水设备:法国默克密理博公司;1-14K高速冷冻离心机:德国希格玛公司;MultiReax涡旋振荡器:德国Heidolph公司;KQ-800DB超声波清洗仪:昆山超声仪器有限公司。
1.3 方法
1.3.1 样品前处理
称取0.5 g桂皮样品(打粉后过3号筛,50目)于50 mL离心管中,加入25 mL甲醇,涡旋混匀,于50 ℃水浴超声提取25 min(超声仪工作参数为功率480 W,频率40 kHz)。然后置于离心机中以10 000 r/min离心5 min,转移上清液于50 mL比色管中。残渣用25 mL甲醇重复提取一次,10 000 r/min离心5 min,合并上清液,采用甲醇定容至50 mL。取上清液过0.22 μm有机滤膜,移取0.9 mL滤液加入0.1 mL的5 mg/L香豆素-d4(内标)溶液,混匀,采用UPLC-Q-TOF/MS测定香豆素含量。
1.3.2 UPLC-Q-TOF/MS分析条件
色谱条件:Waters BEH C18色谱柱(2.1 mm×100 mm,3.0 μm);流动相以乙腈为A相,0.1%甲酸水溶液为B相,流速0.4 mL/min;进样体积5 μL;柱温35 ℃;梯度洗脱程序:0~5 min,20~90%A;5~7 min,90%A;5~7 min,90%A;7~7.5 min,90%~20%A;7.5~10 min:20%A。
质谱条件:采用电喷雾电离和大气压化学电离复合源,以正离子模式进行扫描;一级飞行时间质谱(time of flight mass spectrometry,TOF-MS)扫描质量范围为50~1 000 m/z;二级信息依赖型质谱(information dependent acquisition mass spectrometry,IDA-MS)扫描准确质量范围为50~1 000 m/z;校正液流速0.5 mL/min;气帘气为氮气(N2),流速35 psi;离子源雾化气N2流速50 psi;离子源加热辅助气N2流速50 psi;离子源温度450 ℃;离子源电压5 500 V;去簇电压DP为90 V;碰撞能量为(30±10)eV;监测模式:飞行时间结合信息依赖型扫描(TOF-IDA-MS);每10个样品自动校正1次。
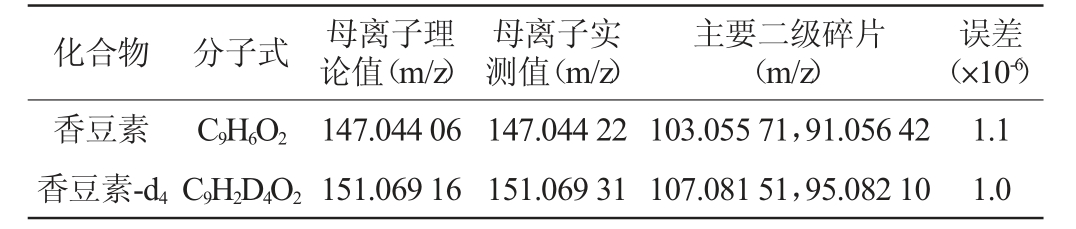
定性、定量:以母离子的精确质量数及出峰时间进行定性,另外两对响应较高的子离子的精确质量数辅助定性。采用内标法定量。香豆素及香豆素-d4的具体离子参数见表1。
表1 香豆素及香豆素-d4的质谱分析参数
Table 1 Parameters of coumarin and coumarin-d4 analyzed by mass spectrometry
1.3.3 桂皮中香豆素提取条件优化
单因素试验:以甲醇用量20 mL、超声20 min、提取温度30 ℃、重复提取2次为初始提取条件,依次考察提取溶剂(50%甲醇-水、甲醇、乙腈、乙酸乙酯、水)、提取溶剂体积(10 mL、15 mL、20 mL、25 mL、30 mL)(合并两次提取液后,定容至100 mL)、提取温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)及提取时间(10 min、15 min、20 min、25 min、30 min)对香豆素响应强度的影响。
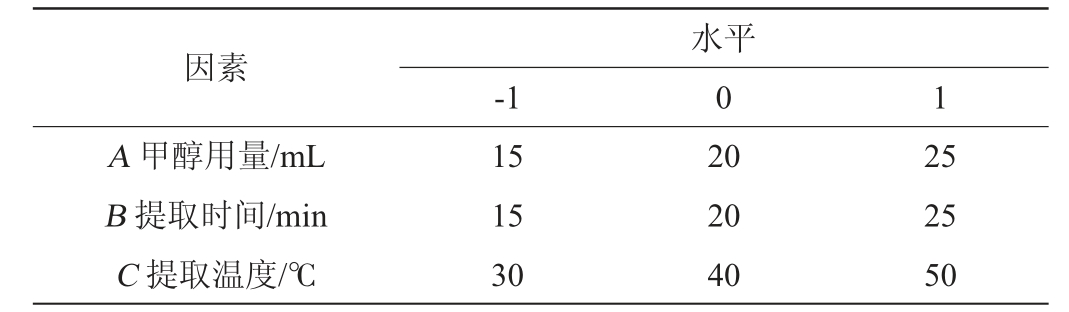
响应面试验:在单因素试验的基础上,以香豆素响应强度为评价指标,甲醇用量(A)、提取时间(B)及提取温度(C)为考察因素,采用Design Expert 8.0.6设计响应面试验,试验设计因素与水平见表2[23,25]。
表2 桂皮中香豆素提取条件优化响应面试验设计因素与水平
Table 2 Factors and levels of response surface tests for optimization of extraction conditions of coumarin in cinnamon
1.3.4 方法学验证
按照桂皮样品本底值附近的1、2、5倍水平,在样品中添加不同质量浓度的香豆素标准溶液,经前处理方法处理后,供仪器测定分析。通过平行试验测定回收率和计算相对标准偏差(relative standard deviation,RSD)。另外,以信噪比3倍和10倍为基准,通过稀释样品液的方法测定方法检出限(limit of detection,LOD)和方法定量限(limit of quantitation,LOQ)[26-29]。
1.3.5 实际样品的检测
使用优化后的前处理参数和仪器参数对市售的10个随机桂皮样品进行处理和测定,每个样品重复6次平行试验。
1.3.6 数据处理
采用Excel 2016软件绘图;化合物的碎片信息使用Analyst TF 1.6软件采集;采用Design Expert 8.0.6设计响应曲面试验,并进行数据处理和显著性分析。
2 结果与分析
2.1 香豆素提取条件优化单因素试验
2.1.1 提取溶剂的选择
由于实验前处理方式为直接提取,且一般桂皮中所含的香豆素本底含量较大,因此前处理条件的优化,以香豆素的响应强度代替回收率为指标进行考察。不同提取溶剂对香豆素响应强度的影响见图1。
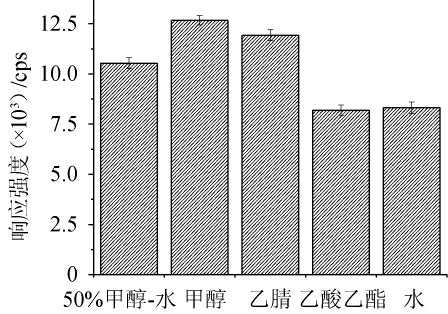
图1 不同提取溶剂对香豆素响应强度的影响
Fig.1 Effect of different extraction solvents on the response strength of coumarin
由图1可知,甲醇提取的香豆素响应强度最高,其次是50%甲醇-水和乙腈,而乙酸乙酯和水较低,可能是因为乙酸乙酯极性较低,在提取香豆素的同时,提取了较多杂质,造成了一定的基质效应,而水则可能因为极性较大,香豆素在水中溶解度相对其他溶剂较低[28]。最终选择甲醇作为提取溶剂。
2.1.2 甲醇用量的确定
甲醇用量对香豆素响应强度的影响见图2。由图2可知,香豆素的响应强度随甲醇用量的增大呈先升高后稳定的趋势。分析原因可能是,当甲醇用量<20 mL之前,由于甲醇较少,提取不充分,因此响应强度较低;当甲醇用量达到20 mL时,香豆素的响应强度基本达到最佳值,用量继续增加时,响应强度增加不明显。由于考虑到使用25 mL以上提取液提取两次,需要定容至100 mL,不但溶剂消耗大,而且会降低方法整体灵敏度。综合定容体积、使用溶剂量及方法检出限考虑,最终选择甲醇用量为20 mL。
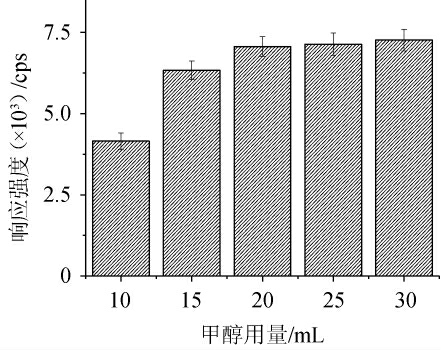
图2 甲醇用量对香豆素响应强度的影响
Fig.2 Effect of methanol dosage on the response strength of coumarin
2.1.3 提取时间的确定
虽然香豆素性质相对稳定,不会因为超声时间过长而造成分解,但时间过长会严重影响实验效率,增加检验成本,因此,考察提取时间对香豆素响应强度的影响,结果见图3。

图3 提取时间对香豆素响应强度的影响
Fig.3 Effect of extraction time on the response strength of coumarin
由图3可知,随着提取时间的延长,香豆素的响应强度呈先升高后趋于稳定的趋势。当提取时间较短时,提取不充分,响应强度低。但当超声时间>20 min之后,响应强度变化不明显,说明在超声20 min,提取率基本能达到要求,最终选择超声时间为20 min。
2.1.4 提取温度的确定
由于香豆素在加热条件下不易挥发,因此可以通过加热,加快提取速度,并且提高提取率。提取温度对香豆素响应强度的影响见图4。由图4可知,随着提取温度的升高,香豆素的响应强度呈先升高后降低的趋势,分析原因可能是随着温度的升高,提取速率增大,但温度高于50 ℃之后,香豆素遭到一定的破坏,从而造成提取量损失,影响提取率。由于提取温度为40 ℃和50 ℃时,香豆素的响应强度差异不大,因此,选择提取温度为40 ℃。
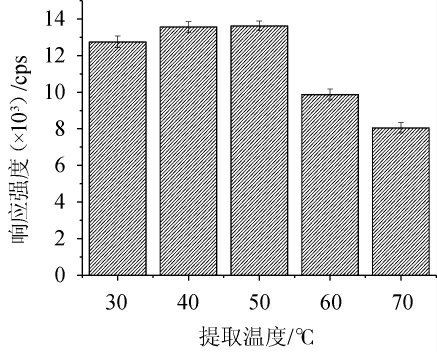
图4 提取温度对香豆素响应强度的影响
Fig.4 Effect of extraction temperature on the response strength of coumarin
2.2 香豆素提取条件优化响应面试验
根据单因素试验结果,以香豆素响应强度(Y)为评价指标,选择甲醇用量(A)、提取时间(B)和提取温度(C)为考察因素进行3因素3水平的响应面试验,结果与分析见表3,方差分析结果见表4。
采用Design Expert 8.0.6软件对表3的数据进行多元二次回归拟合,得到回归方程:Y=12 822+75.25A+475.25B+1 775.5C+778.5AB-297AC+414.5BC+435.5A2-1 001.5B2+338C2。由表4可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明该模型中,香豆素响应强度与其他变量之间对应关系良好。决定系数R2为0.911 0,调整决定系数R2Adj为0.796 5,说明79.65%的试验与该模型符合,适用于大多数情况。由表4亦可知,一次项C对结果影响极显著(P<0.01),二次项B2对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
表3 响应面试验设计及结果
Table 3 Design and results of response surface tests
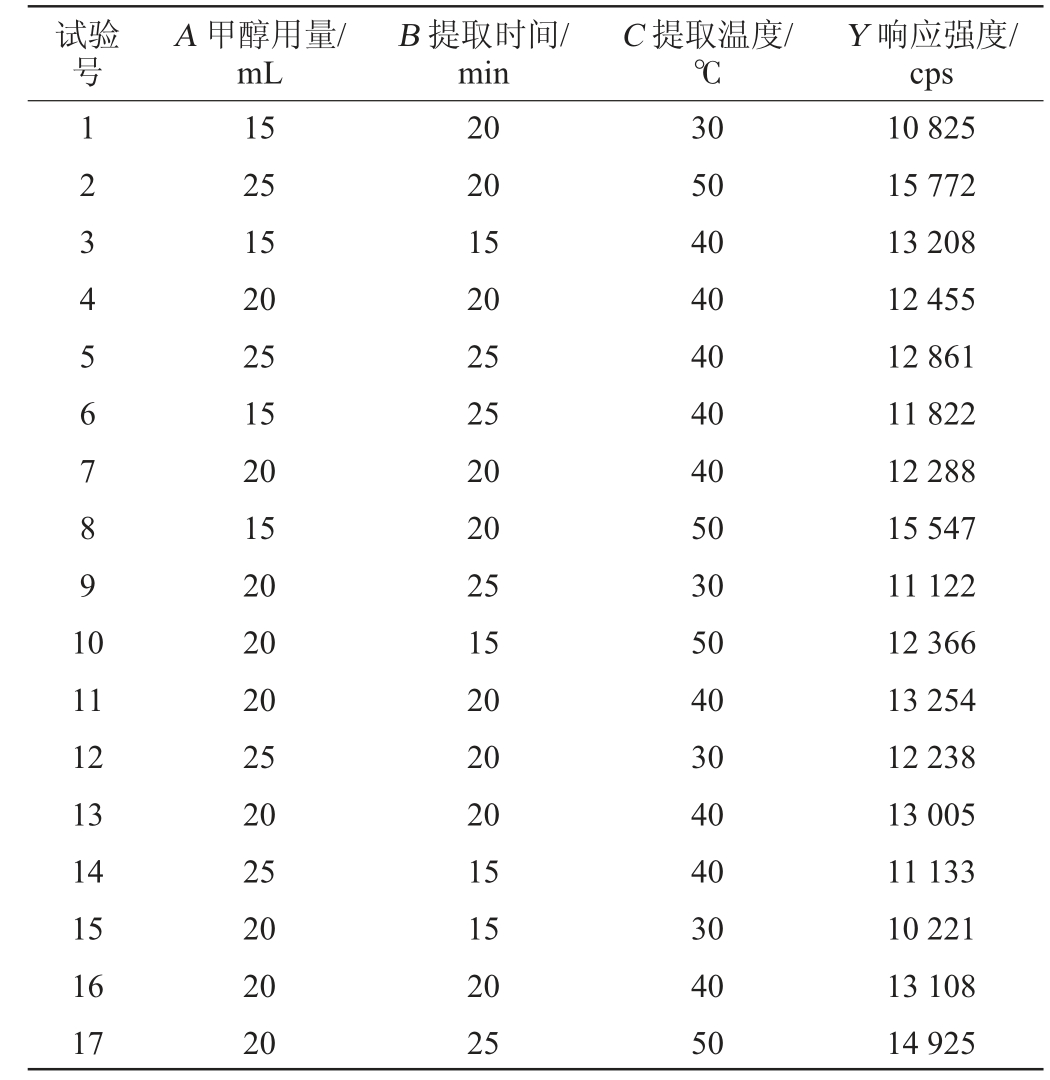
表4 回归模型方差分析
Table 4 Variance analysis of regression model
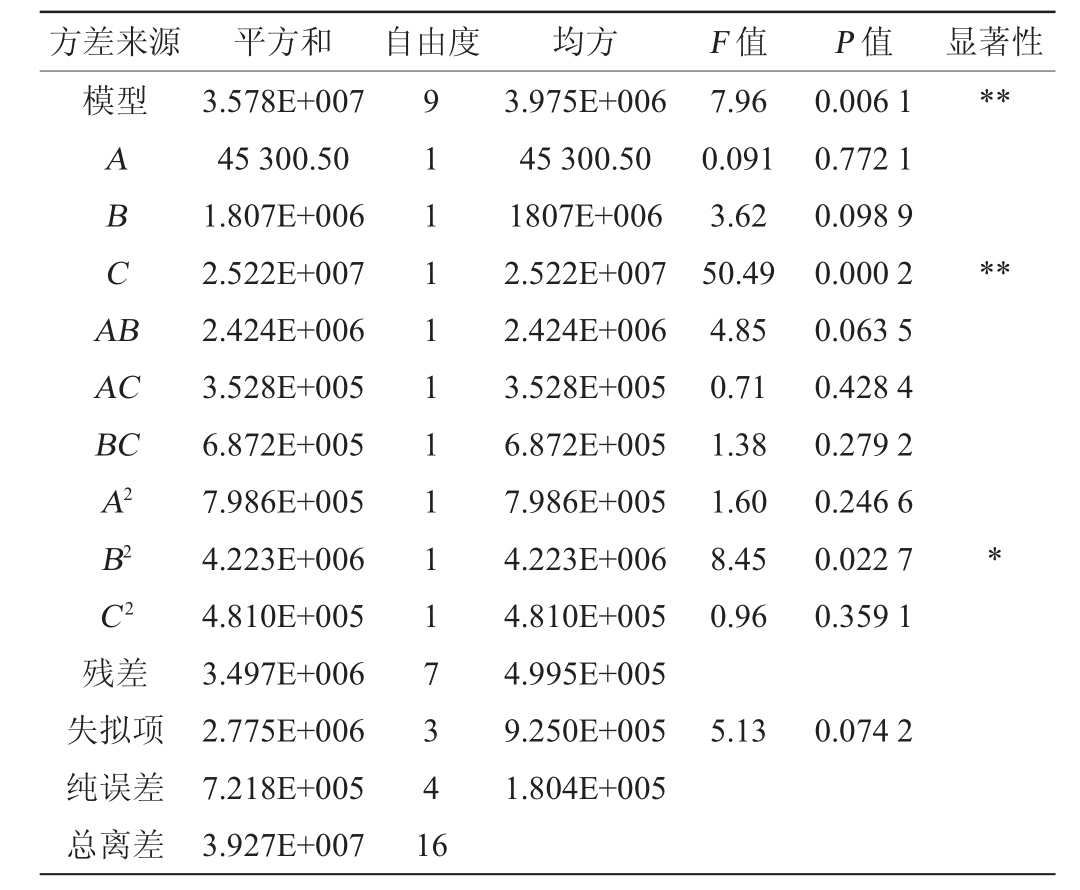
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
采用Design Expert 8.0.6软件对模型进行求解,得到香豆素的最优提取条件为甲醇用量24.8 mL、提取时间23.9 min和提取温度49.9℃,该模型预测的最大响应强度为15813.7cps。为了方便实际操作,将提取条件修正为甲醇用量25 mL,提取时间25 min,提取温度50 ℃。在此条件下进行3次平行验证试验,香豆素的响应强度实际值为15 774.4 cps,与预测值差异不大。最终确定香豆素的最优提取条件为甲醇用量25 mL,提取时间25 min,提取温度50 ℃。
2.3 基质效应
由于试验采用纯甲醇提取的前处理方式,且没有经过净化,因此提取液中可能会含有较多的杂质,从而使结果受到基质效应(matrix effect,ME)的影响。采用UPLC-QTOF/MS对多个桂皮样品进行测定,选择香豆素含量相对较低的桂皮的提取液配制香豆素,绘制香豆素基质曲线,回归方程为Y=861.46X+52 551;采用甲醇配制香豆素,绘制香豆素标准曲线,回归方程为Y=1 051.59X+85 240,将此基质曲线的斜率K1与纯甲醇配制的外标曲线斜率K2作对比,以其比值作为ME,结果发现,香豆素的ME值为81.9%,说明基质效应明显,抑制效果超过10%。因此,定量计算时,需要用基质曲线或内标进行校正,但由于桂皮中不存在香豆素阴性样品,因此同一基质曲线对不同样品进行计算,结果可能会有一定的偏差,操作也较繁琐,因此最终使用内标法进行定量。
2.4 方法学考察
2.4.1 线性关系及灵敏度
以香豆素外标(香豆素)质量浓度和内标(香豆素-d4)质量浓度比值(X)为横坐标,外标响应强度和内标响应强度比值(Y)为纵坐标,进行一次回归方程拟合,所得线性方程为Y=2.237 8X-0.007 9,作为内标曲线(内标法)进行定量,相关系数R2为0.999 3,说明曲线线性关系良好,能准确定量。同时,按照仪器的3倍信噪比和10倍信噪比得到测定方法的检出限(LOD)为0.3 mg/kg,定量限(LOQ)为1.0 mg/kg,说明本方法整体的灵敏度能满足一般样品香豆素含量的测定要求。
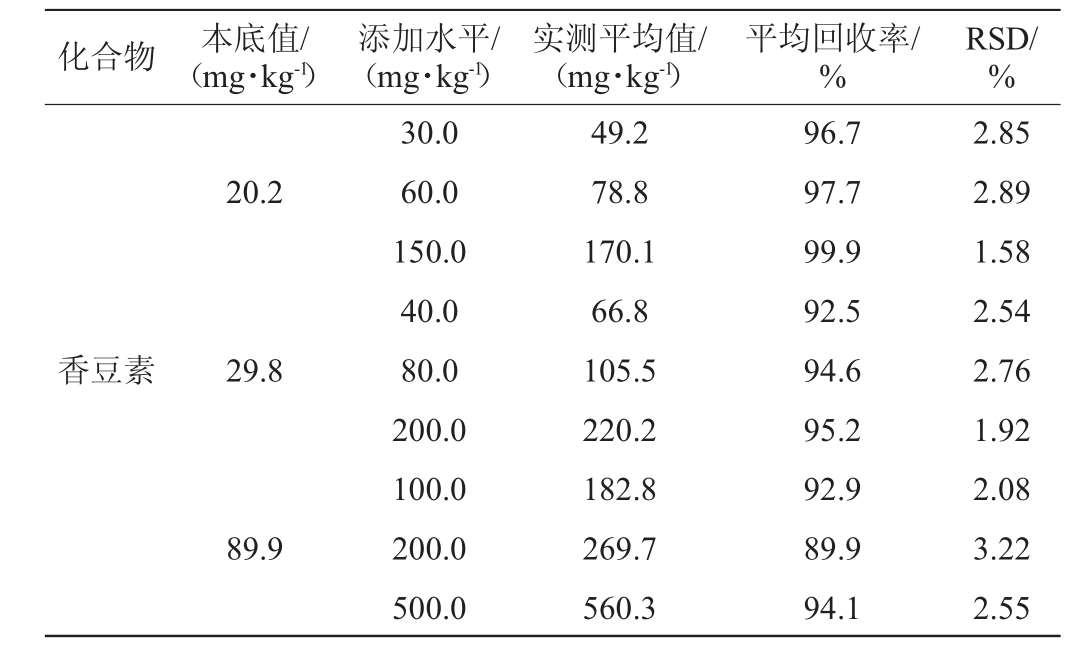
2.4.2 方法的回收率及精密度
方法的回收率及精密度试验结果的RSD见表5。由表5可知,平均回收率为89.9%~99.9%,精密度试验结果的相对标准偏差为1.58%~3.22%。根据最终试验结果可知,回收率及相对标准偏差均能满足一般样品的检测要求。
表5 回收率及精密度试验结果
Table 5 Results of recovery rate and precision tests
2.5 桂皮样品中香豆素的检测
随机选择市售的10个桂皮样品,采用最优方法处理并测定其香豆素含量,结果见表6。由表6可知,桂皮样品中的香豆素含量为20.2~661.0 mg/kg,对于不同含量的样品,相对标准偏差均<10%,说明本方法可准确测定桂皮中香豆素含量。
表6 桂皮样品中香豆素含量的测定结果
Table 6 Determination result of cinnamon content in cinnamon samples

3 结论
本研究采用甲醇对桂皮中的香豆素进行超声提取,通过单因素试验及响应面试验得到桂皮中香豆素的最优提取条件为甲醇用量25 mL、提取时间20 min、提取温度50 ℃,重复提取两次,合并提取液;采用稳定同位素稀释结合UPLC-Q-TOF/MS测定香豆素,使用香豆素-d4为内标物进行基质效应的校正,香豆素质量浓度在0.01~2.0 mg/L范围内,线性关系良好,相关系数R2为0.999 3,平均回收率为89.9%~99.9%,精密度试验结果的相对标准偏差(RSD)为1.58%~3.22%,方法检出限(LOD)为0.3 mg/kg,定量限(LOQ)为1.0 mg/kg,说明该方法操作简便、灵敏度高,回收率及精密度较好,可应用于桂皮中香豆素含量的测定。
[1]冯杨,胡涛,单义琴,等.广西不同产地桂皮铅含量对比及降低铅含量的方法研究[J].食品安全导刊,2021(31):56-58.
[2]王蕊,刘军,杨大宇,等.白芷化学成分与药理作用研究进展[J].中医药信息,2020,37(2):123-128.
[3]王梦月,贾敏如,马逾英,等.白芷中四种线型呋喃香豆素类成分药理作用研究[J].天然产物研究与开发,2010,22(3):485-489.
[4]EMAMI S,DADASHPOUR S.Current developments of coumarin-based anti-cancer agents in medicinal chemistry[J].Eur J Med Chem,2015,102:611-630.
[5]AHMED E Y,LATIF N A A,EL-MANSY M F,et al.VEGFR-2 inhibiting effect and molecular modeling of newly synthesized coumarin derivatives as anti-breast cancer agents[J].Bioorgan Med Chem,2020,28(5):115328.
[6] GKIONIS L,KAVETSOU E,KALOSPYROS A,et al.Investigation of the cytotoxicity of bioinspired coumarin analogues towards human breast cancer cells[J].Mol Divers,2021,25(1):307-321.
[7] LIN C L,HUNG T W,YING T H,et al.Praeruptorin B mitigates the metastatic ability of human Renal carcinoma cells through targeting CTSC and CTSV expression[J].Int J Mol Sci,2020,21(8):2919-2923.
[8] POUDEL S,LEE Y.Gustatory receptors required for avoiding the toxic compound coumarin in Drosophila melanogaster[J].Mol Cells,2016,39(4):310-315.
[9]NI Y N,ZHANG G W,KOKOT S.Simultaneous spectrophotometric determination of maltol,ethyl maltol,vanillin and ethyl vanillin in foods by multivariate calibration and artificial neural networks[J].Food Chem,2005,89(3):465-473.
[10]GOUVEA M M,FERREIRA-MACHADO S C,DA SILVA T M,et al.Decontamination of Mikania glomerata leaves by gamma irradiation:coumarin determination by HPLC-DAD,microbiological control and genotoxicological studies[J].Planta Med,2018,84(1):65-72.
[11] SCHAFFRATH M,WEIDMANN V,MAISON W.Enantioselective high performance liquid chromatography and supercritical fluid chromate graphy separation of spirocyclic terpenoid flavor compounds[J].J Chromatogr A,2014,1363:270-277.
[12]SPROLL C,RUGE W,ANDLAUER C,et al.HPLC analysis and safety assessment of coumarin in foods[J].Food Chem,2008,109(2):462-469.
[13] LAVINE B K,CORONA D T,PERERA U D N T.Analysis of vanilla extract by reversed phase liquid chromatography using water rich mobile phases[J].Microchem J,2012,103:49-61.
[14]许博舟,许秀丽,国伟,等.高效液相色谱-串联质谱法同时测定饮料中8种香豆素类化合物[J].食品安全质量检测学报,2021,12(19):7578-7584.
[15]REN Z Q,NIE B,LIU T,et al.Simultaneous determination of coumarin and its derivatives in tobacco products by liquid chromatography-tandem mass spectrometry[J].Molecules,2016,21(11):1511-1525.
[16]DE JAGER L S,PERFETTI G A,DIACHENKO G W.Determination of coumarin,vanillin,and ethyl vanillin in vanilla extract products:Liquid chromatography mass spectrometry method development and validation studies[J].J Chromatogr A,2007,1145(1-2):83-88.
[17]SHEN Y,HAN C,LIU B,et al.Determination of vanillin,ethyl vanillin,and coumarin in infant formula by liquid chromatography-quadrupolelinear ion trap mass spectrometry[J].J Dairy Sci,2014,97(2):679-686.
[18] FALASCA A,CAPRARI C,DE FELICE V,et al.GC-MS analysis of the essential oils of Juniperus communis L.berries growing wild in the Molise region: Seasonal variability and in vitro,antifungal activity[J].Biochem Syst Ecol,2016,69:166-175.
[19]林伟斌,谭丽容,程敏,等.气相串联质谱法测定薄荷香精中二氢香豆素[J].广州化工,2020,48(5):98-100.
[20]赵锦花,崔龙吉,金玉善,等.气流吹扫-微注射器萃取-气相色谱/质谱法同时快速检测香烟中香豆素和黄樟素[J].分析科学学报,2019,35(2):165-169.
[21]谭丽容,程敏,林伟斌.气相色谱-质谱法检测薄荷香精中的限用物质反-2-己烯醛、α-己基肉桂醛、香豆素的研究[J].食品安全质量检测学报,2018,9(15):4119-4124.
[22]周静,彭亚锋,胡守江.同位素稀释-气相色谱-质谱法同时测定婴儿配方乳粉中的4种香料[J].食品安全质量检测学报,2018,9(14):3643-3649.
[23]区硕俊,岑建斌,梁俊发,等.酰胺化衍生-高效液相色谱-四极杆-高分辨飞行时间质谱法测定食品接触塑料材料中7种烷基胺[J].分析化学,2020,48(3):413-422.
[24]邓颖,林森煜,何敏恒,等.超高效液相色谱-四极杆飞行时间质谱法测定保健食品中的缓泻剂[J].现代食品,2021(19):207-211.
[25]丁博,王志元,陈文锐,等.LC-Q-TOF-MS高分辨质谱法测定保健食品中24种抗炎、镇静安神类违禁药物[J].中国食品学报,2019,19(10):251-258.
[26]孙卓然,田金凤,尚远宏.UPLC-MS/MS法测定金沙江水域鱼体中卡巴氧及喹乙醇代谢物[J].中国酿造,2020,39(11):179-182.
[27]区硕俊,罗展远,曾广丰,等.UPLC-Q-TOF-MS法测定小鼠大脑中4种单胺类神经递质的含量[J].分析测试学报,2016,35(12):1569-1574.
[28]冯婉莹,刘结容,郑学殷,等.UPLC-Q-TOF/MS法测定液态乳中的糠氨酸[J].中国乳品工业,2019,47(6):48-50.
[29]马启明,梁小敏,曾广丰.增强型基质去除净化-UPLC-Q-TOF/MS法快速测定奶粉中的香兰素类化合物[J].中国乳品工业,2021,49(10):54-58.