灵芝(Ganoderma lucidum)别名灵芝草、神芝、芝草、仙草、瑞草。灵芝在我国作为药材使用已有2000多年的历史。现代药理研究表明,灵芝多糖在抗肿瘤、抗氧化、抗衰老、免疫调节、调节肠道健康[1-4]等方面,均具有良好的生理功能。玉竹(Polygonatum odoratum Mill)别名铃铛菜,地管子,尾参。为百合科黄精属的植物,常以根茎入药,具有滋阴润燥、生津止渴等功效,是我国常见中药材,主要有效成分为甾体皂苷类,黄酮类,多糖类及挥发油类[5]。研究表明,玉竹多糖具有降血糖、免疫调节、抗肿瘤、抗氧化、抗疲劳、延缓皮肤衰老等药理作用[6-8]。
以具有活性成分的各种中药材作为基质成分,使用药用真菌发酵中草药,该基质既提供真菌生长所需的营养,又因真菌的分解(合成)而产生新的成分,从而使整个发酵作用具有双向性[9]。近年来灵芝菌双向发酵取得了一定的进展。辛燕花等[10-11]利用灵芝菌发酵何首乌和银杏,发现其活性物质和抗氧化性均有不同程度的提高。裴智鹏等[12]利用灵芝菌发酵黄芪,发现黄芪促进了灵芝菌多糖的分泌,使灵芝多糖的免疫活性和抗肿瘤活性增强。胡永乐等[13]利用灵芝菌发酵泽泻,发现南韩灵芝发酵对菌质中粗多糖和黄酮提取,具有明显促进作用。玉竹含有大量纤维素和淀粉,灵芝菌生长时能分泌大量纤维素酶和淀粉酶[14-15],因此,该研究以灵芝菌株作为出发菌株以玉竹的作为基质,探究二者液体发酵水溶性多糖变化及其抗氧化活性。为其功能性产品的开发与其工业发酵提供一定参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
紫芝(Ganoderma sanensee):受赠于遵义医科大学冯昆教授;玉竹(Polygonatum odoratum Mill)采摘于湖南省娄底市;豆粕:市售,烘干粉碎,过80目网筛,备用;硫酸、苯酚、KH2PO4、MgSO4·7H2O:国药集团化学试剂有限公司。试验所用试剂均为分析纯。
1.1.2 培养基
种子培养基(g/100 mL):玉米粉2、麦麸1、酵母粉0.5、KH2PO4 0.2、MgSO4·7H2O 0.1、维生素B1 0.005,115 ℃灭菌30 min。
斜面培养基(g/100 mL):马铃薯20、葡萄糖2、KH2PO4 0.2、MgSO4·7H2O 0.1、琼脂2,115 ℃灭菌30 min。
基础发酵培养基(g/100 mL):玉竹5、酵母粉0.5、KH2PO4 0.2、MgSO4·7H2O 0.1、维生素B1 0.005,115 ℃灭菌30 min。
1.2 仪器与设备
UV1802G紫外分光光度计:天津冠泽科技有限公司;TYSP-400高速多功能粉碎机:浙江省永康市红太阳机电有限公司;PL303电子分析天平:梅特勒-托利多仪器有限公司;TGL18W台式高速离心机:长沙英泰仪器有限公司;ZQLY-180N恒温振荡培养箱:上海知楚仪器有限公司。
1.3 试验方法
1.3.1 菌种活化及培养条件
菌种活化:无菌条件下用接种针从保存紫芝菌种的斜面培养基上划取三块0.5 cm2的菌块接种于种子培养基中。30 ℃、170 r/min培养5 d活化。备用。
种子液制备:接种5%(V/V)活化的菌种至种子培养基中。30 ℃、170 r/min培养4 d。备用。
发酵培养:接种5%(V/V)的种子液至基础发酵培养基中。30 ℃、170 r/min培养4 d。
1.3.2 灵芝菌发酵玉竹工艺优化单因素试验
设定不同有机氮源种类(胰蛋白胨、豆粕、牛肉膏、酵母粉)、氮源添加量(0.5%、1.0%、1.5%、2.0%、2.5%)、玉竹添加量(3%、4%、5%、6%、7%)、KH2PO4添加量(0.05%、0.10%、0.15%、0.20%、0.25%)、MgSO4·7H2O添加量(0.05%、0.10%、0.15%、0.20%、0.25%),接种量5%,发酵温度30 ℃、170 r/min培养4 d,以发酵液多糖提高率为评价指标,分别考察发酵培养基成分对发酵后多糖提高率影响。设定玉竹添加量6%,豆粕添加量2%,KH2PO4添加量0.15%,MgSO4·7H2O添加量0.15%,不同接种量(2%、4%、6%、8%、10%)、发酵时间(1 d、2 d、3 d、4 d、5 d、6 d、7 d)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃),以发酵液多糖提高率为评价指标,分别考察发酵条件对发酵后多糖提高率影响。
1.3.3 响应面试验
(1)Packett-Burman试验设计
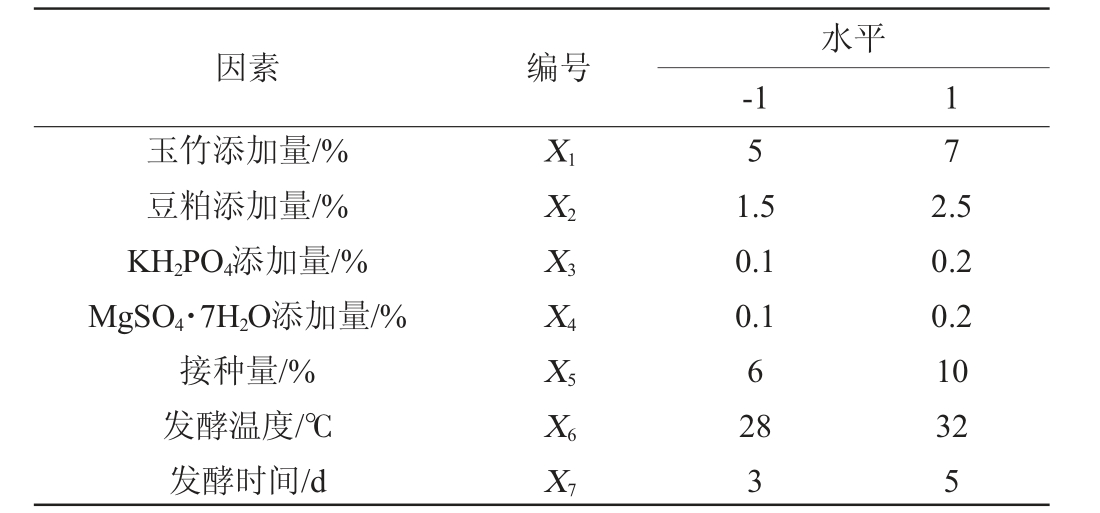
据单因素试验的结果,对基础发酵培养基的玉竹添加量(X1)、豆粕添加量(X2)、KH2PO4添加量(X3)、MgSO4·7H2O添加量(X4)、接种量(X5)、培养时间(X6)、发酵温度(X7)进行Packett-Burman试验,筛选出对多糖提高率影响显著的因子。利用Minitab 17.0软件进行试验设计和数据分析。Plackett-Burman试验设计因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design
(2)最陡爬坡试验
根据Packett-Burman试验筛选对多糖提高率影响显著的因子,参考Packett-Burman试验显著因子的正负效应和单因素试验效应来设计最陡爬坡试验步长,设计出最陡爬坡试验最佳路径。
(3)Box-Behnken试验设计
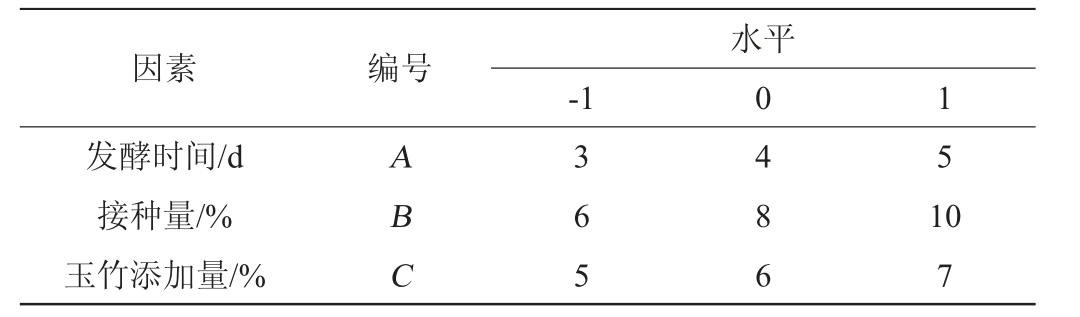
在Packett-Burman试验结果确定的因素基础上,在最陡爬坡试验所确定的区域内,以多糖提高率(Y)为响应值设计响应面试验。利用Design-Expert 12.0软件进行Box-Behnken试验设计和数据分析。响应面试验设计因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design
1.3.4 分析检测
(1)发酵后水溶性多糖测定
将发酵液10 000 r/min离心10 min,取上清液5 mL,加入3倍体积的体积分数95%乙醇,摇匀,4 ℃冰箱静置过夜。将溶液10 000 r/min离心10 min,弃上清液,用热水溶解沉淀,定容到100 mL容量瓶中,备用。按硫酸-苯酚法测定多糖含量,并计算多糖提高率[16]。
(2)生物量测定和多糖提取物制备
将摇瓶中的发酵液10 000 r/min离心10 min,收集沉淀过60目网筛。60 ℃烘干至质量恒定,称质量得生物量。
根据工艺进行发酵,分别将没有接种的对照组与接种发酵的试验组离心(10 000 r/min、10 min)收集上清液,减压浓缩至200 mL,以4∶1的体积比加入Sevage(氯仿∶正丁醇=4∶1)试剂,振荡30 min,离心(4 000 r/min、10 min),收集上清液,重复5次至没有白色沉淀析出。脱蛋白后的多糖溶液加入经预处理的AB-8大孔树脂进行脱色处理,振荡2 h,抽滤,收集样液。样液浓缩至150 mL后加入3倍无水乙醇,放于4 ℃冰箱过夜,离心(10 000 r/min、10 min),沉淀用热水溶解。使用截留分子质量8 000~14 000 Da透析袋透析48 h,12 h换水一次。将对照组和试验组透析液冷冻干燥得未发酵多糖(polysaccharides before fermentation,PBF)、发酵后多糖(polysaccharide after fermentation,PAF)含量。
(3)抗氧化能力测定
用自由基的清除率表征多糖的抗氧化能力,羟基自由基(OH·)清除率的测定参考文献[17],DPPH自由基清除率的测定参考文献[18],ABTS自由基清除率的测定参考文献[19]。
1.3.5 数据分析
上述试验均设置3次重复,试验结果利用SPSS25.0软件进行分析,测定结果均以“平均值±标准差”表示,统计学显著性差异P<0.05。利用GraphPad Prism 8进行绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 氮源种类的确定
灵芝菌对无机氮源利用率较低[20],故选用常见的有机氮源进行优化,结果见图1。由图1可看出,当牛肉膏和酵母粉作氮源时,多糖提高率较低,其中酵母粉作氮源有利于生物量的积累。当豆粕作为氮源时发酵后多糖提高率最高达(30.1±2.02)%,当蛋白胨作氮源时发酵后多糖提高率达(24.8±3.25)%,但两种氮源的多糖提高率没有显著性差异(P>0.05),因此从经济效应考虑,选择豆粕作为发酵培养基的氮源。
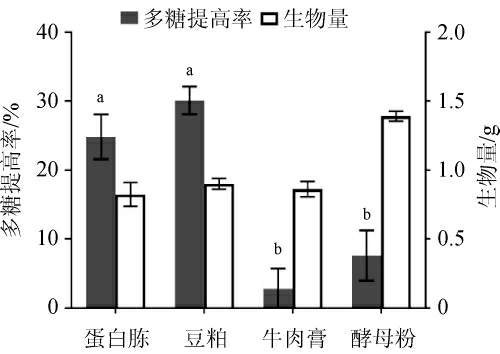
图1 不同氮源对多糖提高率的影响
Fig.1 Effect of different nitrogen sources on the increase rate of polysaccharide
2.1.2 豆粕添加量的确定
选定豆粕作为发酵培养基的氮源后,改变发酵培养基豆粕的添加量,考察不同的豆粕添加量对多糖提高率及生物量的影响,结果见图2。由图2可知,生物量随豆粕添加量的增大而增大,添加量达到2.0%后趋于平稳。当豆粕添加量为2.0%时,发酵后的多糖提高率最大,为(32.80±1.69)%。故选择发酵培养基豆粕添加量为2.0%。
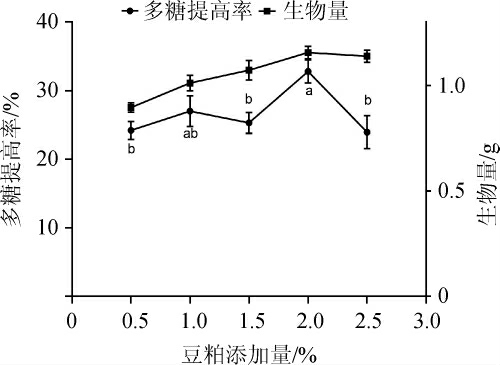
图2 豆粕添加量对多糖提高率的影响
Fig.2 Effect of soybean meal addition on the increase rate of polysaccharide
2.1.3 玉竹添加量的确定
改变基础发酵培养基的玉竹添加量,考察不同玉竹添加量对发酵后多糖提高率及生物量的影响,结果见图3。由图3可知,当玉竹添加量为3%~6%时,多糖提高率和生物量随玉竹添加量的增大而增大,添加量为6%时,发酵后的多糖提高率和生物量均最大,其中多糖提高率为(42.95±0.96)%。当玉竹添加量超过6%时,多糖提高率和生物量均显著下降,其原因可能是玉竹添加量过高,黄酮类、生物碱等生物活性物质含量增高,减缓和抑制灵芝菌生长[11],导致灵芝菌不足以酶解更多的淀粉和纤维素。故选择发酵培养基的玉竹添加量为6%。
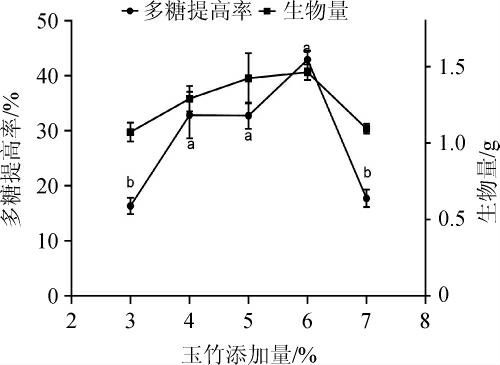
图3 玉竹添加量对多糖提高率的影响
Fig.3 Effect of Polygonatum odoratum addition on the increase rate of polysaccharide
2.1.4 KH2PO4添加量的确定
KH2PO4中的K+是果糖激酶、磷酸丙酮酸转磷酸酶等酶的辅因子;磷酸根主要作用是维持电位差、渗透压平衡及缓冲pH值[21]。改变基础培养基的KH2PO4的添加量,考察不同KH2PO4添加量对发酵后多糖提高率及生物量的影响,结果见图4。由图4可知,随着KH2PO4添加量的增加,生物量的变化不大,当添加量为0.15%时多糖提高率达到最大为(45.52±3.34)%。说明当KH2PO4添加量达到0.15%后,灵芝菌就不能再利用多余的KH2PO4,因此选择KH2PO4的添加量为0.15%。

图4 KH2PO4添加量对多糖提高率影响
Fig.4 Effect of KH2PO4 addition on the increase rate of polysaccharide
2.1.5 MgSO4·7H2O添加量的确定
Mg2+是糖酵解途径、三羧酸循环途径的重要激活剂,存在于细胞膜和细胞壁中,参与菌体生长,含量太少会影响碳源的氧化[22]。改变基础培养基的MgSO4·7H2O的添加量,考察不同MgSO4·7H2O添加量对发酵后多糖提高率及生物量的影响,结果见图5。由图5可知,随着MgSO4·7H2O添加量的增多,多糖提高率和生物量呈先上升后下降的趋势。说明一定浓度的硫酸镁能促进灵芝菌的生长和产多糖,添加量0.15%时多糖提高率最大,为(42.07±2.48)%,此时生物量也最大。因此选择MgSO4·7H2O添加量为0.15%。
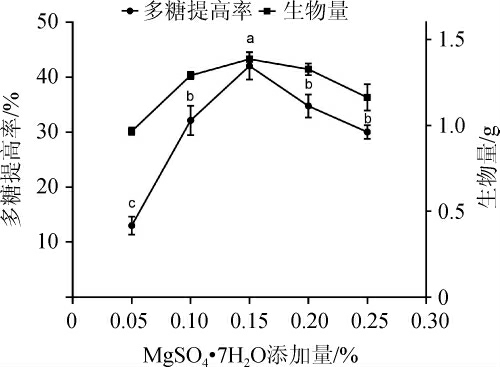
图5 MgSO4·7H2O添加量对多糖提高率影响
Fig.5 Effect of MgSO4·7H2O addition on the increase rate of polysaccharide
2.1.6 接种量的确定
改变基础培养基不同接种量,考察不同接种量对发酵后多糖提高率及生物量的影响,结果见图6。由图6可知,多糖提高率和生物量都随接种量的增大而先升高后降低。其原因可能和菌丝球大小和数目有关。接种量小时菌丝球较大,菌丝球菌球直径小,数量多,更易产生丝状体,有利于胞外多糖的形成[23]。其后多糖提高率降低其原因可能是接种量过大培养基消耗加快,菌体快速进入稳定和衰亡期[24]。其中,生物量在接种量4%时最大,继续增加接种量,生物量稍有下降但是不明显,多糖提高率在接种量8%时最大为(70.75±2.53)%。以多糖提高率为主要评价指标,选择最佳接种量为8%。
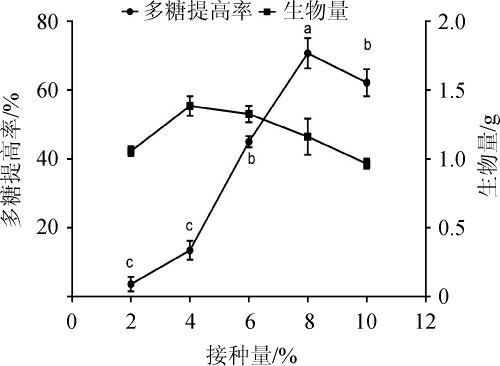
图6 接种量对多糖提高率的影响
Fig.6 Effect of inoculum on the increase rate of polysaccharide
2.1.7 发酵时间的确定
一般来说,菌体的生长包括延滞期、对数期、稳定期及衰老期四个阶段。改变发酵时间,考察不同发酵时间对发酵后多糖提高率及生物量的影响,结果见图7。由图7可知,随着发酵时间的增长,多糖提高率和生物量先升高后降低。生物量和多糖提高率在第4天达到最大,说明菌体在对数期结束时产糖最高,后开始逐步降低。发酵到第4天时多糖提高率最大达(64.56±2.25)%,之后开始逐步降低,其原因可能为前4天菌体产生的多糖大于菌体生长所消耗的多糖;4 d后,多糖消耗速率大于生产速率,多糖提高率开始逐步降低,因此选择发酵时间为4 d。
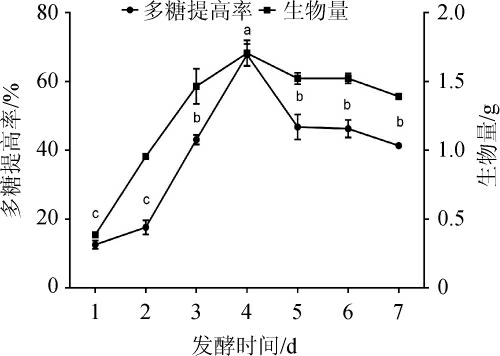
图7 发酵时间对多糖提高率的影响
Fig.7 Effect of fermentation time on the increase rate of polysaccharide
2.1.8 发酵温度的确定
适合的发酵温度是保证灵芝菌的生长活性和产酶的必要条件。发酵温度过高或过低都会抑制灵芝菌的生长活性和产酶,设置不同发酵温度,考察不同发酵温度对发酵后多糖提高率及生物量的影响,结果见图8。由图8可知,灵芝菌适合生长发酵温度是28~30 ℃,在此温度范围内多糖提高率逐渐升高,生物量趋于平缓,超过30 ℃后灵芝菌生物量和多糖增长率显著降低[25]。且在30 ℃时灵芝菌多糖提高率最高达(64.56±2.55)%,故选择30 ℃作为发酵温度。
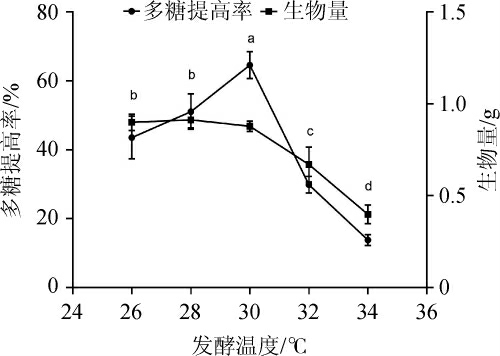
图8 发酵温度对多糖提高率的影响
Fig.8 Effect of fermentation temperature on the increase rate of polysaccharide
2.2 Packett-Burman试验结果
该试验考虑到用多糖提高率做指标能更好的反应灵芝菌利用玉竹释放多糖的效果,故PB试验以多糖提高率为指标进行试验,试验设计与结果见表3,对PB试验结果进行方差分析,结果见表4。
表3 Plackett-Burman试验设计与结果
Table 3 Design and results of Plackett-Burman experiments
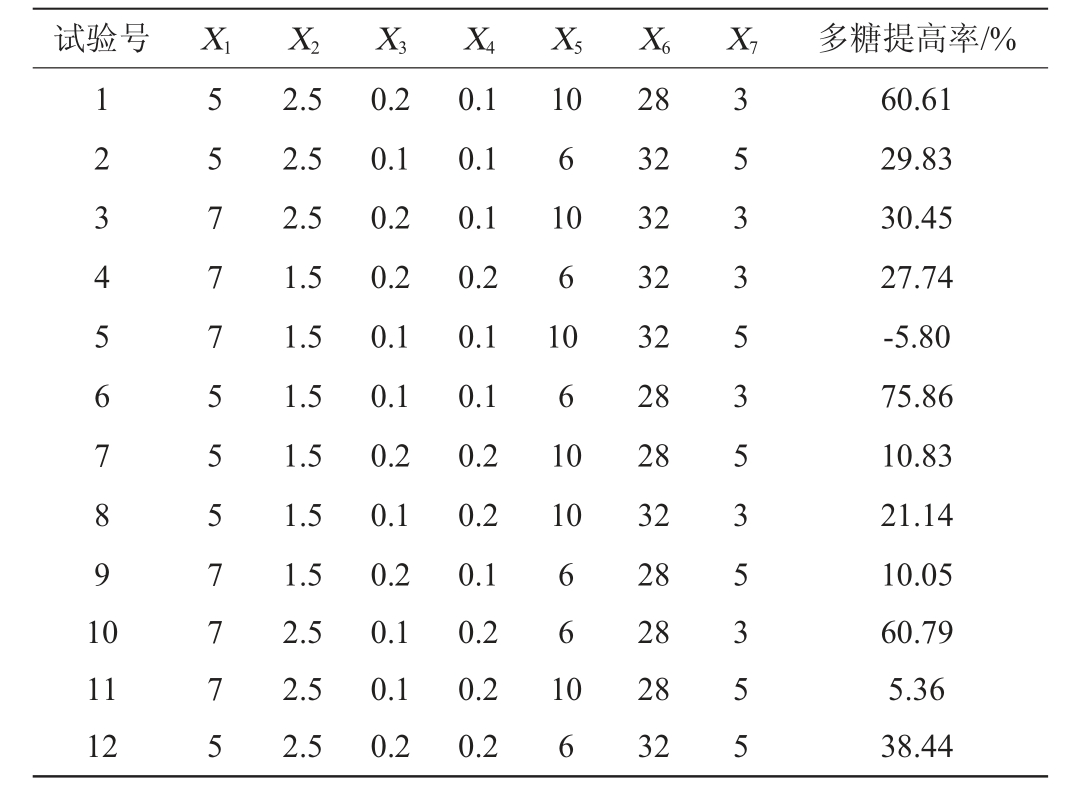
表4 Plackett-Burman试验结果显著性分析
Table 4 Significance analysis of Plackett-Burman experiment results
注:“*”表示差异显著(P<0.05),“**”表示差异较显著(P<0.001),“***”表示差异极显著(P<0.000 1)。
根据表4所列的显著性分析结果可知,7个影响因子的显著性排序为X7(发酵时间)>X5(接种量)>X1(玉竹添加量)>X2(豆粕添加量)>X6(发酵温度)>X3(KH2PO4添加量)>X4(MgSO4·7H2O添加量)。且X7(发酵时间)、X1(玉竹添加量)、X5(接种量)3个因子在7个因子中对多糖提高率影响显著(P<0.05)。因此确定接种量、玉竹添加量、发酵时间这3个因子进行下一步的最陡爬坡试验。
2.3 最陡爬坡试验设计及结果
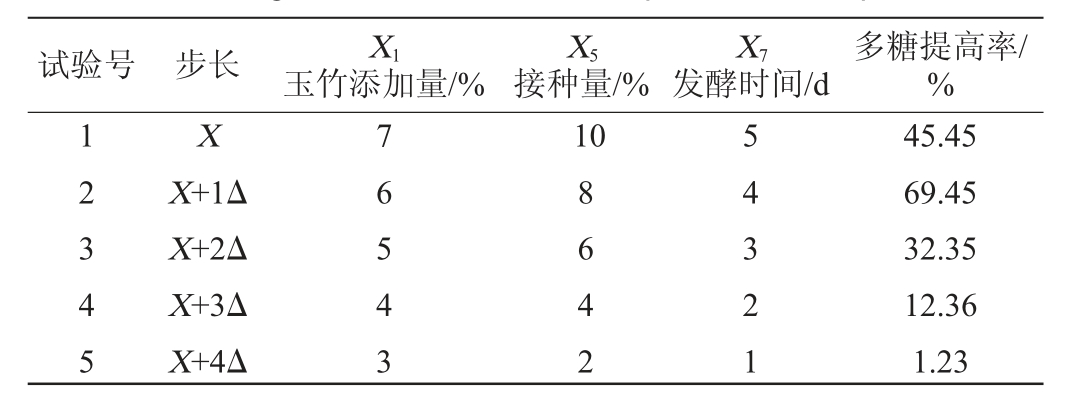
据表4的Packett-Burman试验结果筛选得出接种量、发酵时间、玉竹添加量为3个对多糖提高率影响显著的因子,参考表4的3个因子的效应值可知,3个因素的效应均为负值。因此在最陡爬坡试验中3个因素都从1水平开始逐步降低。其余4个影响不显著的因素根据单因素试验结果进行设置。最陡爬坡试验结果如表5所示,试验2多糖提高率最高,即接种量为8%、玉竹添加量为6%、发酵时间为4 d,因此选择第2组试验作为Box-Behnken试验的中心点,进行Box-Behnken试验设计。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest ascent experiment
2.4 响应面试验结果
2.4.1 Box-Behnken中心组合试验结果
在Packett-Burman试验结果基础上,在最陡爬坡试验所确定的区域内,以多糖提高率为响应值设计响应面试验,Box-Behnken试验设计和方差分析,结果如表6、表7所示。
运用Design-Expert 12.0软件对表6各因素进行二次多项式回归拟合后,得到响应面试验回归模拟方程:Y=77.73-4.62A+2.74B-8.86C-17.28AB-2.69AC-10.18BC-36.56A2-14.99B2-23.90C 2。
表6 发酵产多糖条件优化Box-Behnken试验设计及结果
Table 6 Design and results of Box-Behnken experiments for fermentation conditions optimization of polysaccharide production
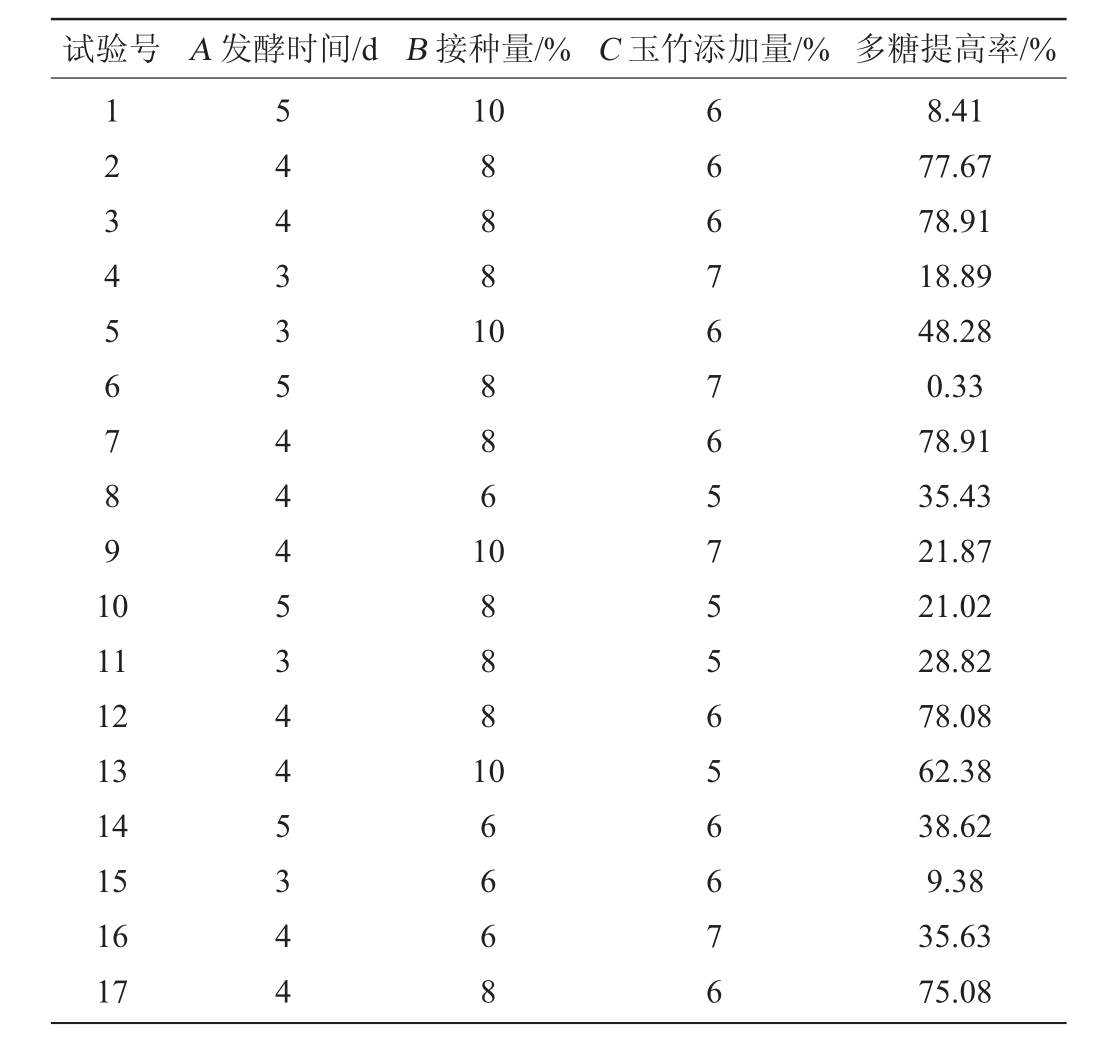
由表7方差分析结果可知,模型P<0.000 1,说明模型差异性极显著,其中,C、AB、A2、B2、C2对响应值的影响极显著(P<0.000 1),BC对响应值的影响较显著(P<0.01),A、B对响应值的影响显著(P<0.05),其余因素均不显著(P>0.05)模型的决定系数R2=0.995 6,说明模型与实际试验拟合较好;校正决定系数R2adj=0.989 8,说明该模型能解释98.98%响应值的变化。模型失拟项P=0.056 9>0.05,不显著,表明模型符合实际情况,综合以上结果表明可以用此模型对多糖提高率进行分析和预测。
表7 回归模型方差分析结果
Table 7 Variance analysis results of regression model
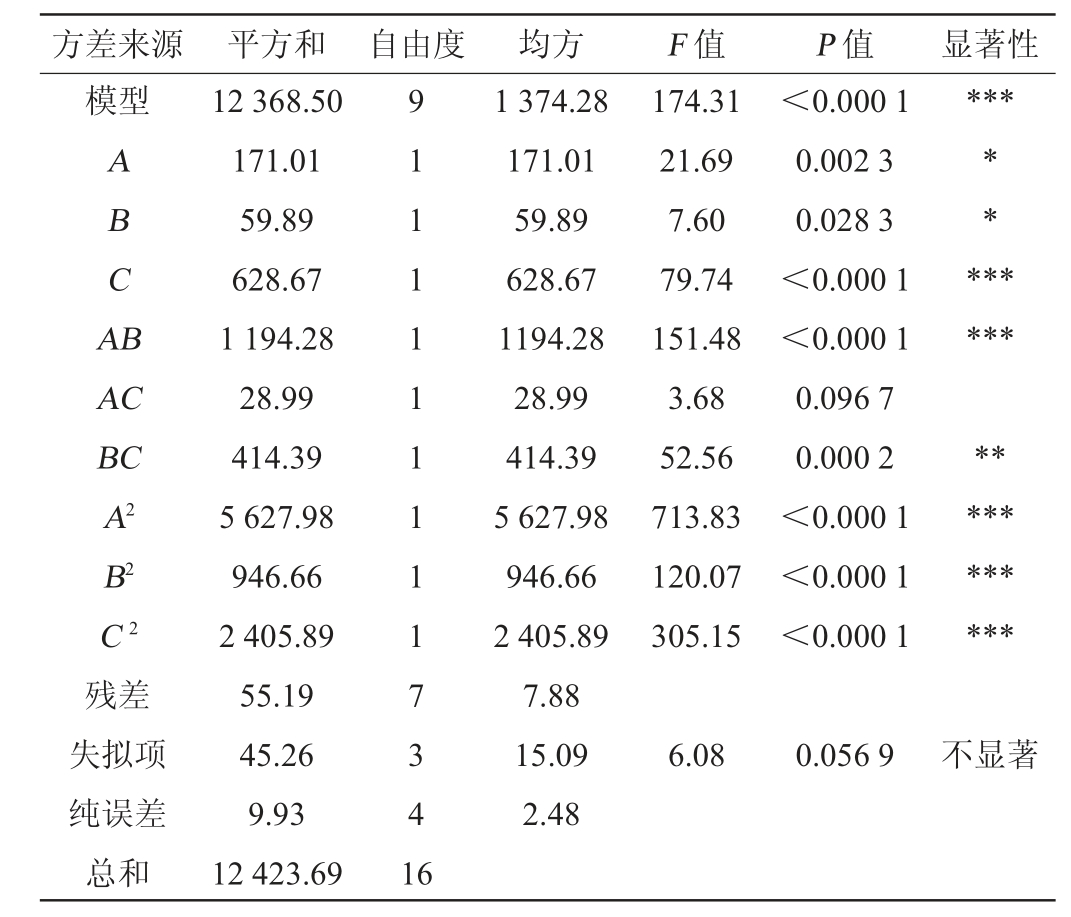
注:“*”表示影响显著(P<0.05),“**”表示影响较显著(P<0.01),“***”表示差异极显著(P<0.000 1)。
2.4.2 各因素之间的交互作用结果分析
通过Design-Expert 12软件得到接种量、发酵时间和玉竹添加量3个因子之间的模型响应曲面图如图9所示。由图9可知,所有响应面图形坡面陡峭,方程的抛物线图形开口向下,说明存在最大值,响应面覆盖最大值所在区域。玉竹添加量,接种量,发酵时间交互作用强弱的顺序为AB>BC>AC。
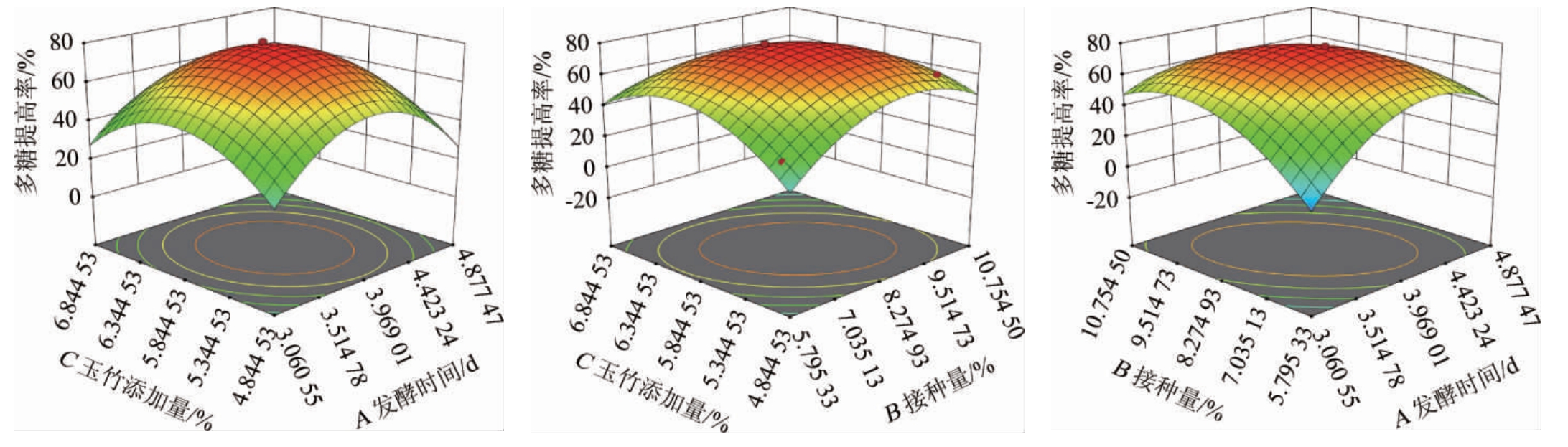
图9 各因素交互作用对多糖提高率影响的响应曲面图
Fig.9 Response surface plots and contour lines of effects of interaction between each factor on the increase rate of polysaccharide
2.4.3 响应面试验结果优化及模型验证
回归模型预测的最佳结果为:玉竹添加量5.884%,接种量8.7%,发酵时间4.261 d,此条件下多糖提高率理论值为72.5%。为方便实际操作对发酵工艺参数进行修正,修改发酵工艺为:玉竹添加量6%,接种量8.7%,发酵时间4 d。重复3次试验,取平均值,此条件下多糖提高率实际值为73.48%。实际值与理论值无显著性差异,表明该模型可靠有良好的准确性。
2.5 灵芝菌发酵玉竹液的体外抗氧化能力
测定DPPH自由基,羟基自由基和ABTS自由基的清除率,以VC为阳性对照,表征发酵前后多糖的抗氧化能力,结果见图10。从图10可以看出,清除DPPH自由基、羟基自由基和ABTS自由基能力均随着多糖含量的增加而增加。当多糖质量浓度为4 mg/mL时,对自由基的清除率最大。其中VC的自由基清除率最强。PBF对ABTS自由基、DPPH自由基和羟基自由基和清除率分别为(25.97±0.93)%、(45.21±1.13)%、(77.39±1.93)%,PAF对ABTS自由基、DPPH自由基和羟基自由基的清除率分别为(34.13±0.88)%、(52.77±3.14)%、(89.40±0.52)%,PAF对DPPH和羟基自由基的半抑制浓度(IC50)为分别为2.77 mg/mL,0.54 mg/mL,PBF对DPPH和羟基自由基的半抑制浓度(IC50)为分别为7.94 mg/mL,1.57 mg/mL其结果表明PAF的抗氧化能力显著强于PBF,其原因可能是,玉竹中的玉竹多糖经灵芝菌发酵可能形成了多种分子质量较小的多糖。

图10 发酵前后多糖的体外抗氧化活性
Fig.10 Antioxidant activities in vitro of polysaccharide before and after fermentation
3 结论
本研究通过单因素试验响应面试验对灵芝菌发酵玉竹产多糖的发酵条件进行优化。得到最佳工艺为:玉竹6%,豆粕2%,KH2PO4 0.15%,MgSO4·7H2O 0.15%,接种量8.7%,发酵时间4 d,发酵温度30 ℃。在此条件下,多糖含量达到5.91 mg/mL,较未发酵的培养基3.41 mg/mL提高了73.48%。抗氧化试验表明,在相同浓度下,发酵后多糖的ABTS+·、DPPH·、OH·清除率均有所提高。该研究为玉竹功能性产品的开发与其工业发酵提供一定参考。
[1]MA H T,HSIEH J F,CHEN S T.Anti-diabetic effects of Ganoderma lucidum[J].Phytochemistry,2015,114:109-113.
[2]WANG J,CAO B,ZHAO H P,et al.Emerging roles of Ganoderma lucidum in anti-aging[J].Aging Dis,2017,8(6):691-707.
[3]CHANG C J,LIN C S,LU C C,et,al.Ganoderma lucidum reduces obesity in mice bymodulatingthe composition ofthe gut microbiota[J].Nat Commun,2015,6(1):1-19.
[4] LI J,GU F F,CAI C,et al.Purification,structural characterization,and immunomodulatory activity of the polysaccharides from Ganoderma lucidum[J].Int J Biol Macromol,2020,143(80):806-813.
[5]张娇,王元忠,杨维泽,等.黄精属植物化学成分及药理活性研究进展[J].中国中药杂志,2019,44(10):1989-2008.
[6]WANG Y,FEI Y Q,LIU L R,et al. Polygonatum odoratum polysaccharides modulate gut microbiota and mitigate experimentally induced obesity in rats[J].Int J Mol Sci,2018,19(11):3587.
[7]ZHOU X L,ZHANG Y P,ZHAO H D,et al.Antioxidant homoisoflavonoids from Polygonatum odoratum[J].Food Chem,2015,186:63-68.
[8]TAI Y,SUN Y M,ZOU X,et al.Effect of Polygonatum odoratum extract on human breast cancer MDA-MB-231 cell proliferation and apoptosis[J].Experim Therap Med,2016,12(4):2681-2687.
[9]庄毅,潘扬,谢小梅,等.药用真菌“双向发酵”的起源、发展及其优势与潜力[J].中国食用菌,2007(2):3-6.
[10]辛燕花,张铁丹,张建华,等.灵芝-何首乌双向液体发酵菌质抗氧化活性研究[J].食用菌学报,2018,25(3):63-71.
[11]辛燕花,梁彬,王颖霞,等.灵芝-银杏双向液体发酵条件优化及抗氧化的研究[J].菌物学报,2017,36(10):1427-1435.
[12]裴智鹏,郑雪艳,何冰芳,等.灵芝-黄芪双向发酵菌质多糖的分离纯化及生物活性研究[J].生物加工过程,2019,17(5):521-529.
[13]胡永乐,尤永芳,黄薇,等.灵芝-泽泻双向发酵前后菌质活性成分分析[J].新乡学院学报,2020,37(6):10-3,20.
[14]陈志杰,顾振新,解春艳.灵芝发酵过程中营养物质及相关酶活性变化研究[J].中国酿造,2008,27(1):26-29.
[15]蒋盛岩,阳亚男,李艺琪,等.灵芝菌液态发酵富硒大豆过程中酶活性的研究[J].邵阳学院学报(自然科学版),2011,8(4):48-51.
[16]郎久义,齐旭阳,侯英雪,等.冬虫夏草液体发酵产胞外多糖的实验条件[J].大连工业大学学报,2009,28(2):107-10.
[17]宗鑫妍,徐德昌,聂少平,等.玉竹多糖分离纯化、理化性质及抗氧化功能[J].南昌大学学报(理科版),2019,43(1):70-5.
[18]LIANG X X,GAO Y Y,FEI W B,et al.Chemical characterization and antioxidant activities of polysaccharides isolated from the stems of Parthenocissus tricuspidata[J].Int J Biol Macromol,2018,119:70-78.
[19]柴美灵,李娜,乔宏萍,等.Box-Behnken法优化甘草多糖提取工艺及其体外抗氧化活性分析[J].食品工业科技,2021,42(23):192-200.
[20]冯杰,冯娜,贾薇,等.氮源对灵芝菌丝体液态深层发酵合成灵芝三萜的影响[J].菌物学报,2016,35(6):722-733.
[21]尹守亮,张玉秀,张琪,等.无机磷酸盐对链霉菌合成次级代谢产物的影响[J].中国生物工程杂志,2015,35(9):105-113.
[22]张蕊多,刘焕焕,郭枫,等.不同诱导因子对灵芝菌液体发酵的影响研究进展[J].中国酿造,2017,36(11):9-15.
[23]杨静静,丁重阳,顾正华,等.玉米粉对灵芝菌体形态及胞外多糖的影响[J].食品与生物技术学报,2017,36(4):383-388.
[24]梅玉立,黄先智,丁晓雯.响应面法优化发酵对桑叶生物碱、黄酮和多糖含量的影响[J].食品安全质量检测学报,2022,13(6):1764-1772.
[25]刘超,陈俊荣,于春涛.响应面法优化黄芪固体发酵工艺[J].食品研究与开发,2019,40(7):184-188.