β-葡聚糖是具有重要生物活性的天然多糖,主要来源于酵母等[1]。据中国食品工业协会发布数据[2],2020年我国啤酒废酵母产量3.41~5.17万t[3],废酵母主要作为饲料发展畜牧业[4]。近年来,随着营养学的发展,人们对酵母β-葡聚糖的功能如抗肿瘤[5]、益生元效用[6]、抑制和预防糖尿病[7]等越来越重视,因而,被广泛应用于食品、医药等行业。美国食品药品监督管理局(food and drug administration,FDA)推荐每日摄入量3 g以上[8],我国批准酵母β-葡聚糖为新食品原料[9]。酵母β-葡聚糖水溶性较差,如何从酵母中高效提取成为制约β-葡聚糖进一步应用的关键步骤。
酵母β-葡聚糖提取的方法主要有酶碱法、超声波辅助酸或碱法、酸碱法等[10],这些提取方法的共同特点是酸碱用量大,工艺过程复杂、提取时间较长和污染环境等缺陷[11]。三相萃取法是近年来发展起来的一种新型萃取分离技术,它是基于3个共存液相物化性质和亲疏水性的差别,不同目标物在三相体系中的分配不同,实现复杂溶液中多目标的同时萃取分离和纯化[12]。文沛瑶等[13]研究了三相萃取法纯化枸杞多糖关键参数,YAN J K等[14]使用三相萃取法研究分离提纯河蚬多糖的影响因素等。至今为止,三相萃取法己在天然产物、工业废水、医药生产等许多复杂溶液的处理上表现出良好的应用的前景[15-17],但在啤酒废酵母β-葡聚糖分离提纯的研究鲜见报道。基于三相萃取法高效、环保的特点,研究分离提纯酵母β-葡聚糖的关键因素,为开发啤酒废酵母资源化、产业化应用具有重要意义。
本试验以啤酒生产废酵母为原料,采用独创的二级提取纯化法:超声耦合蛋白酶处理啤酒废酵母(酸酶法)→三相萃取法分离提纯β-葡聚糖,探索酵母β-葡聚糖的分离提纯规律,测定β-葡聚糖的抗氧化性,以期为降低酵母β-葡聚糖生产成本、拓展应用领域提供理论依据。
1 材料与方法
1.1 材料与试剂
啤酒酵母泥:由化工食品学院精酿啤酒工厂提供;酒石酸、无水葡萄糖、苯酚、浓硫酸、无水乙醇、硫酸铵(分析纯):天津市科密欧化学试剂有限公司;木瓜蛋白酶(300 IU/g)、叔丁醇、1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(98%)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(diammonium 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonate),ABTS)(≥98.0%)、过二硫酸钾(分析纯):上海麦克林生化科技有限公司。
1.2 仪器与设备
A1124分析天平、723PC型可见光分光光度计:上海舜宇恒平科学仪器有限公司;TG16-WS台式高速离心机:湖南湘仪实验室仪器开发有限公司;80~100目分样筛:上虞市五四仪器筛具厂;KQ5200E超声波清洗器:昆山市超声仪器有限公司;HWS-12电热恒温水浴锅:上海一恒科学仪器有限公司;HC-3018R型高速冷冻离心机:安徽中科中佳科学仪器有限公司;IRTracer-100傅立叶变换红外光谱仪、ZH-13型压片机:岛津(中国)公司。
1.3 试验方法
1.3.1 酵母β-葡聚糖提取液制备
啤酒酵母泥预处理:参照衣海龙等[18]的方法稍作修改。取适量酵母泥,3倍体积蒸馏水进行清洗,搅拌均匀,用80目筛除去80%可见杂质,用100目筛除去全部可见杂质。过筛后的样液2 000 r/min离心处理5 min。去沉淀加入5%的酒石酸溶液(酵母泥与酒石酸溶液体积比1∶5),静置40~60 min。酒石酸处理后的样液再次2 000 r/min离心5 min,将上清液倒出,得到预处理后的酵母悬液。
蛋白酶耦合超声提取酵母β-葡聚糖:参照石豪磊等[19]方法稍作修改。首先将酵母泥加入2倍体积蒸馏水进行稀释,木瓜蛋白酶添加量为0.3%,在摇床中40 ℃酶解15 h,溶液pH值为5;酶解进行到14.5 h时,将反应体系放入超声处理仪中,设置超声频率为40 kHz,30 ℃超声处理30 min。将超声处理后的悬液于3 500 r/min离心10 min,收取上清液,即得酵母β-葡聚糖粗提液。
1.3.2 三相萃取法萃取纯化酵母β-葡聚糖条件优化单因素试验
取10 mL酵母β-葡聚糖粗提液,加入(NH4)2SO4使其含量分别为10%、20%、30%、40%、50%,再分别加入5 mL、10 mL、15 mL、20 mL、25 mL叔丁醇溶液,制配三相萃取体系。调节pH至5.5,磁力搅拌10 min使三相混合均匀后于5 000 r/min离心10 min加速三相的萃取剂分离。将离心后的三相体系分别放置于20 ℃、25 ℃、30 ℃、35 ℃、40 ℃条件下静置萃取60 min,使其完全分离后,弃去上、中层,保留下层溶液,并测定多糖含量及萃取率。
1.3.3 三相萃取法萃取纯化酵母β-葡聚糖条件优化响应面试验
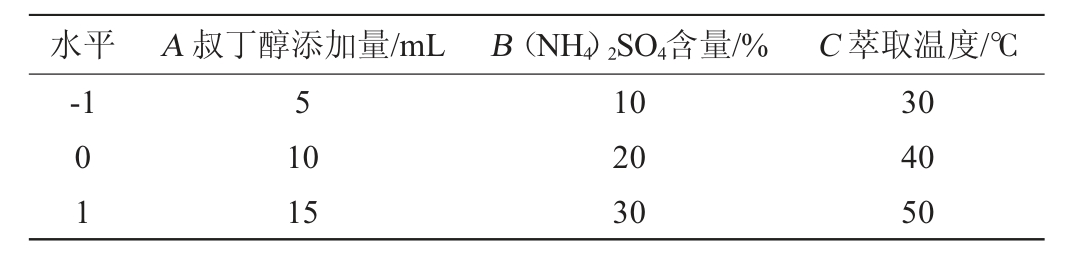
在单因素试验的基础上,选取叔丁醇添加量(A)、(NH4)2SO4含量(B)、萃取温度(C)为3个自变量,以啤酒酵母β-葡聚糖萃取率(P)为响应值,运用3因素3水平的响应面设计,选择Design Expert 8.0.6软件对试验结果所得数据进行回归分析。单因素变量分别以-1、0、1进行编码,响应面试验因素及水平见表1。
表1 三相萃取法萃取纯化酵母β-葡聚糖条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for extraction and purification of yeast β-glucan by three-phase extraction
1.3.4 酵母β-葡聚糖含量测定
采用苯酚-硫酸法测定样品中的酵母β-葡聚糖含量[20],得到标准曲线的回归方程:Y=0.2966X-0.00187(R2=0.9992)。
酵母β-葡聚糖提取率按式计算:
式中:M1为粗多糖质量,g;M2为啤酒废酵母质量,g。
1.3.5 酵母β-葡聚糖抗氧化活性测定
DPPH自由基清除能力:参照马吉锋等[4]的试验方法,稍作修改。
ABTS自由基清除能力:参照魏晨业等[21]的试验方法,稍作修改。
清除率计算公式为:
式中:A0为不加样品时的吸光度值;A为加入样品后的吸光度值。
2 结果与分析
2.1 三相萃取法萃取纯化酵母β-葡聚糖条件优化单因素试验分析
2.1.1 叔丁醇添加量对酵母β-葡聚糖萃取率的影响
由图1可知,随着叔丁醇添加量的增加,啤酒酵母β-葡聚糖萃取率呈先上升后下降的趋势。当叔丁醇添加量为10 mL时,啤酒酵母β-葡聚糖萃取率达到最大值为85.3%。当叔丁醇添加量继续增加,萃取率反而减小,导致这一现象的原因可能是由于叔丁醇的含量过高不利于三相体系的稳定或叔丁醇与(NH4)2SO4溶液发生作用[14]。因此,三相萃取液最适叔丁醇添加量为10 mL。
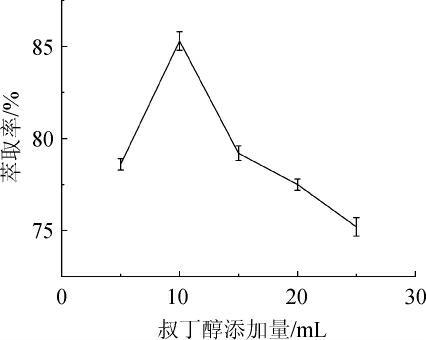
图1 叔丁醇添加量对酵母β-葡聚糖萃取率的影响
Fig.1 Effect of tert-butanol addition on extraction rate of β-glucan from yeast
2.1.2 (NH4)2SO4含量对酵母β-葡聚糖提取率的影响
由图2可知,当(NH4)2SO4含量从10%增至20%时,啤酒β-葡聚糖提取率缓慢升高,当(NH4)2SO4含量为20%时提取率最高,为84.3%。β-葡聚糖萃取率随着(NH4)2SO4含量的增加逐渐升高,可能是因为NH4+、SO42-可以稳定溶液体系中的大分子相互作用,从而使得溶液体系更加稳定。(NH4)2SO4含量超过20%以后,β-葡聚糖萃取率开始下降,可能是由于无机盐浓度过高导致多糖与水分子之间的作用力减弱,萃取率随之降低[22]。因此,根据β-葡聚糖萃取率变化,确定最适(NH4)2SO4含量为20%。
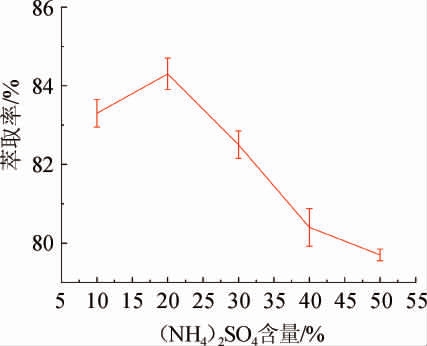
图2 (NH4)2SO4含量对酵母β-葡聚糖萃取率的影响
Fig.2 Effect on (NH4)2SO4 contents on extraction rate of β-glucan from yeast
2.1.3 萃取温度对酵母β-葡聚糖提取率的影响
由图3可知,萃取体系的温度从20 ℃上升至40 ℃时,酵母β-葡聚糖萃取率从73.6%增大至85.1%。在萃取体系中,随着温度的升高,暴露出来的更多羟基的有利于氢键形成,使得三相体系更加稳定,含多羟基的多糖亲水性增强[23],更多的β-葡聚糖从粗提掖中进入到萃取溶液下层,进而萃取率增加。当萃取温度高于40 ℃并持续升高时,萃取率开始下降。因此,根据β-葡聚糖萃取率变化,选择萃取温度40 ℃为最佳。
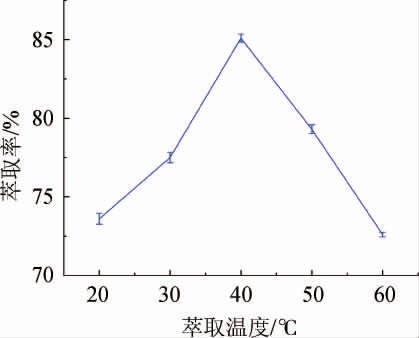
图3 萃取温度对酵母β-葡聚糖萃取率的影响
Fig.3 Effect of extraction temperature on extraction rate of β-glucan from yeast
2.2 三相萃取法萃取纯化酵母β-葡聚糖条件优化响应面试验结果及其分析
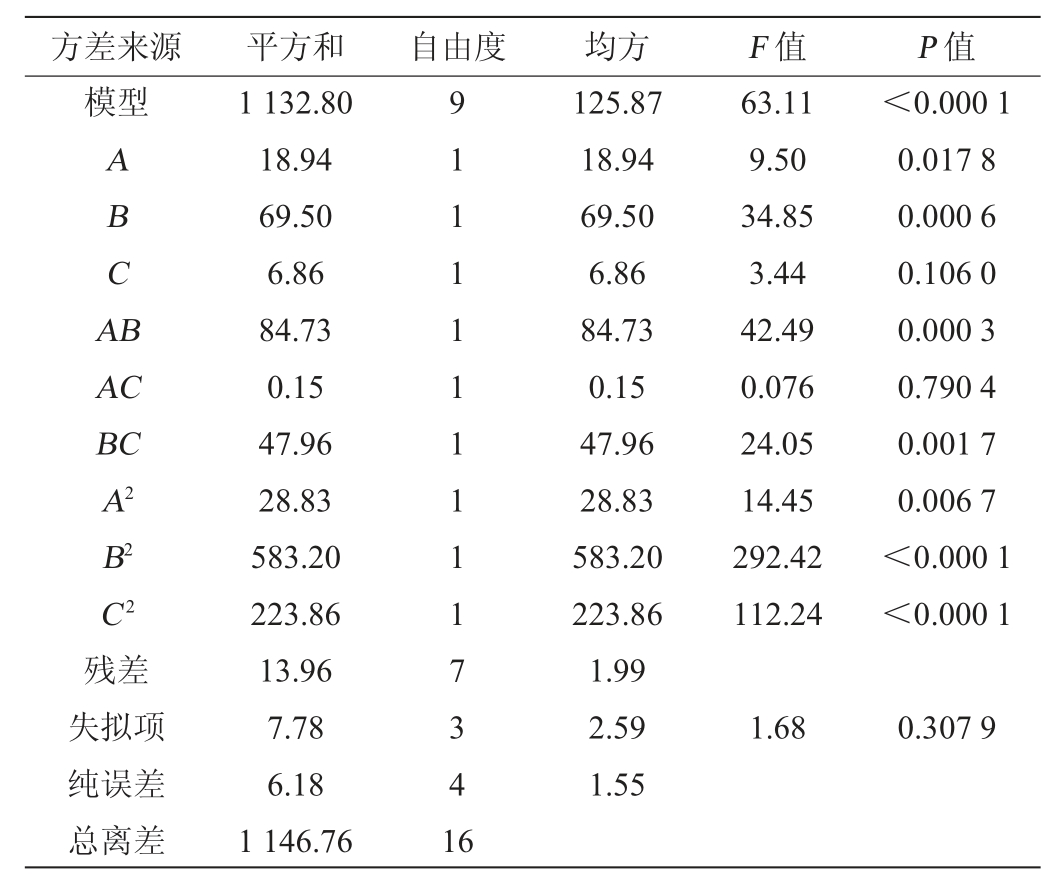
三相萃取法萃取纯化酵母β-葡聚糖条件优化响应面试验设计及结果见表2,方差分析见表3。
表2 三相萃取法萃取纯化酵母β-葡聚糖条件优化响应面试验设计及结果
Table 2 Design and results of response surface experiments for extraction and purification of yeast β-glucan by three-phase extraction

利用Design Expert 8.0.6软件对表2数据结果进行分析,获得叔丁醇添加量(A)、(NH4)2SO4含量(B)和萃取温度(C)的多元二次回归方程,确定以酵母β-葡聚糖萃取率(P)为目标函数的二次多项回归方程为:
由表3可知,二次多项式拟合模型极显著(P<0.000 1),表明此模型极为显著,即各因素与响应值之间相关性显著。模型失拟项P=0.307 9>0.05,表明模型的失拟项不显著。显著性结果分析表明,一次项A对酵母β-葡聚糖萃取率的影响显著(P<0.05),一次项B、二次项A2、B2、C2及交互项AB、BC对酵母β-葡聚糖萃取率的影响极显著(P<0.01)。各个因素对酵母β-葡聚糖萃取率影响的大小顺序依次为:(NH4)2SO4含量>叔丁醇添加量>萃取温度。
表3 响应面试验结果方差分析
Table 3 Variance analysis of response surface tests results
根据回归方程作响应曲面图,根据拟合的响应曲面形状,探讨叔丁醇添加量、(NH4)2SO4含量以及萃取温度对酵母β-葡聚糖萃取率的影响。分别将叔丁醇添加量、(NH4)2SO4含量以及萃取温度的其中一个因素固定在0水平,得到另2个因素交互的影响结果,二次回归方程的响应面及等高线见图4。
从图4根据曲面弯曲的程度可知,影响酵母β-葡聚糖萃取率最显著的因素为(NH4)2SO4含量,极值靠近等高线圆心处,表现为响应面变化幅度较大,叔丁醇添加量也较为显著,萃取温度响应面幅度变化平缓,说明其对结果影响较小。

图4 叔丁醇添加量、(NH4)2SO4含量及萃取温度交互作用对酵母β-葡聚糖萃取率影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between each factor on effect on extraction rate of β-glucan from yeast
利用Design Expert 8.0.6软件分析,得到最佳提取条件为叔丁醇添加量为9.4 mL,(NH4)2SO4含量为27.4%,温度为35.7 ℃,酵母β-葡聚糖萃取率理论值可达94.25%。
为了验证响应面分析法的可靠性,选取条件叔丁醇添加量为9.4 mL,(NH4)2SO4含量为27.4%,温度为35.7 ℃,实际测得酵母β-葡聚糖得率90.13%,比回归模型预测理论值低4.12%。该试验结果比张桂香等[24]研究得率高,主要原因是本试验采用的是在超声耦合蛋白酶提取基础之上的再次提纯,响应面法相当于纯化成品。因此,采用响应面法优化得到提取酵母β-葡聚糖最佳条件的数据可靠,具有使用价值。
2.3 酵母β-葡聚糖抗氧化活性
由图5可知,酵母β-葡聚糖对DPPH、ABTS自由基的清除能力随质量浓度增加而逐渐升高,当酵母β-葡聚糖质量浓度为8mg/mL时,对DPPH、ABTS自由基的清除率为60.5%、50.5%。相同质量浓度条件下,酵母β-葡聚糖对DPPH、ABTS自由基的清除能力均低于维生素C。多糖的自由基清除能力与单糖结构、分子大小、类别和构象有关[25]。酵母β-葡聚糖中的葡萄糖是还原剂,可以提供H+,H+可以与DPPH自由基结合,形成稳定的DPPH-H终止自由基反应[26]。
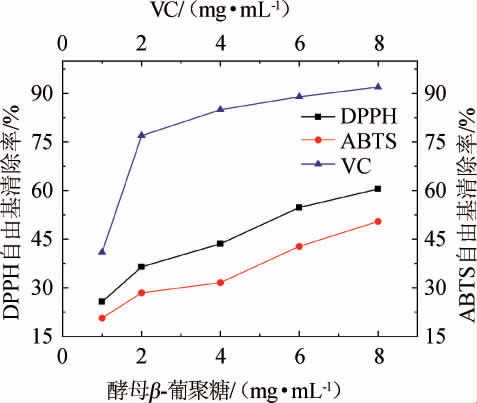
图5 酵母β-葡聚糖对DPPH和ABTS的清除率
Fig.5 Scavenging rate of DPPH and ABTS by β-glucan from yeast
表明酵母β-葡聚糖对于DPPH、ABTS自由基具有一定的清除作用,可作为天然抗氧化剂进一步研究,在多糖提取分离纯化优化的前提下,其抗氧化活性可能会有一定程度上的增强。
3 结论
本研究采用超声波耦合木瓜蛋白酶提取废酵母中粗多糖,再使用单因素试验和响应面优化三相萃取法萃取酵母β-葡聚糖提纯工艺,利用软件建立回归模型预测提纯的最佳提取工艺条件,结果表明,最佳提取条件为叔丁醇添加量为9.4 mL,(NH4)2SO4含量为27.4%,萃取温度为35.7 ℃,在此条件下,酵母β-葡聚糖萃取率为90.13%。通过体外抗氧化试验表明,试验所得酵母β-葡聚糖对DPPH、ABTS自由基均有一定清除作用,且清除能力的强弱与酵母β-葡聚糖样品浓度存在量效关系,当酵母β-葡聚糖质量浓度为8 mg/mL,清除率分别为60.5%、50.5%,表现出较好体外抗氧化活性。
本研究的其创新之处在于使用超声波耦合木瓜蛋白酶提取废酵母中粗多糖,得到的粗多糖经过三相萃取一步完成纯化。结合响应面优化三相萃取的最佳提取条件,完成酵母β-葡聚糖纯化,提取效率高,不使用大量的酸、碱,对环境友好。
[1]MURPHY E J,MASTERSON C,REZOAGLI E,et al.β-Glucan extracts from the same edible shiitake mushroom Lentinus edodes produce differential in vitro immunomodulatory and pulmonary cytoprotective effects:implications for coronavirus disease(COVID-19)immunotherapies[J].Sci Total Environ,2020,732:139330.
[2]中国食品工业协会.2020年中国各省市啤酒产量明细表[EB/OL].http://www.cnfia.cn/archives/18966.
[3]孙伟峰,周素梅,王强.废啤酒酵母综合利用研究进展[J].化工进展,2008,27(7):990-1000.
[4]马吉锋,赵东琪,张建勇,等.酵母细胞壁多糖对滩羊生长性能、免疫及抗氧化指标的影响[J].饲料工业,2021,42(13):17-23.
[5] GELLER A,SHRESTHA R,YAN J.Yeast-derived β-Glucan in cancer:novel uses of a traditional therapeutic[J].Int J Mol Sci,2019,20(15):3618.
[6] GIBSON G R,HUTKINS R,SANDERS M E,et al.Expert consensus document: the international scientific association for probiotics and prebiotics(ISAPP)consensus statement on the definition and scope of prebiotics[J].Nat Rev Gastroenterol Hepatol,2020,17:687-701.
[7] MAKELAINEN H,ANTTILA H,SIHVONEN J,et al.The effect of β-glucan on the glycemic and insulin index[J].Eur J Clin Nutr,2007,61(6):779-785.
[8]REGULATIONS E C O F.Food and drugs[EB/OL].https://ecfr.federal-register.gov/referer.
[9]中华人民共和国卫生部.中华人民共和国卫生部公告2010年第9号——关于批准金花茶、显脉旋覆花(小黑药)等5种物品为新资源食品的公告[R].北京,2010.
[10]王宜磊,刘燕,王文爽.啤酒酵母细胞壁β-(1,3)-D-葡聚糖提取工艺研究进展[J].安徽农业科学,2013,41(30):12153-12154.
[11]刘亚娜,周喆麒,王芳,等.酵母细胞壁多糖提取纯化鉴定技术及其应用研究进展[J].中国畜牧兽医,2019,46(12):3607-3616.
[12]于品华,常志东,金声超,等.液-液萃取及新型液-液-液三相萃取机理研究进展[J].化工进展,2009,28(9):1507-1512.
[13]文沛瑶,杜梦扬,吉文丽.三相萃取法纯化枸杞多糖[J].食品工业科技,2019,40(8):131-135.
[14]YAN J K,WANG Y Y,QIU W Y,et al.Three-phase partitioning for efficient extraction and separation of polysaccharides from Corbicula fluminea[J].Carbohydr Polym,2017,163:10-19.
[15]林洁媛.液-液-液三相萃取体系的相分离动态与成相机理研究[D].北京:中国科学院大学(中国科学院过程工程研究所),2018.
[16]张喜峰,程雯慧,张春梅.三相萃取黄参蛋白质及其抗氧化性分析[J].中国酿造,2019,38(8):157-162.
[17]王雪莹.三相萃取法在藻蓝蛋白分离纯化中的应用[D].哈尔滨:哈尔滨工业大学,2021.
[18]衣海龙.利用超声波法破碎啤酒酵母细胞壁的工艺研究[J].酿酒,2015,42(4):83-85.
[19]石豪磊,赵国正,孔祥君,等.碱法破壁-酶法提取葡萄酒废酵母细胞壁多糖的工艺研究[J].中国酿造,2018,37(12):82-86.
[20]王彦平,娄芳慧,陈月英,等.苯酚-硫酸法测定紫山药多糖含量的条件优化[J].食品研究与开发,2021,42(4):170-174.
[21]魏晨业,包晓玮,王娟,等.沙棘多糖分离纯化及抗氧化活性[J].食品科学,2021,42(4):227-232.
[22]赵艳霞,王大红.三相萃取法提取白牛肝菌多糖的工艺研究[J].食品研究与开发,2019,40(21):158-163.
[23]范红梅,汪建明,刘力.响应曲面法优化酵母β-葡聚糖酶解工艺及产物分析[J].食品与发酵工业,2018,44(3):128-134.
[24]张桂香,王元秀,宋晓妍,等.响应面法优化啤酒酵母泥中β-1,3-葡聚糖提取工艺[J].食品科学,2012,33(6):92-95.
[25]KHAN A A,GANI A,MASOODI F A,et al.Structural,thermal,functional,antioxidant &antimicrobial properties of β-d-glucan extracted from baker's yeast(Saccharomyces cereviseae)-effect of γ-irradiation[J].Carbohydr Polym,2016,140:442-450.
[26]韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322.