桑葚(Fructus mori),又名桑椹子,为桑科植物桑树的成熟果穗,大多为红紫色或黑色椭圆型聚花果,甜酸清香,营养成分丰富[1]。桑葚富含粗纤维、游离酸、氨基酸以及人体所必需的矿物质和微量元素,此外,还含有维生素、酚类化合物、花青素、超氧化物歧化酶(superoxide dismutase,SOD)等多种生物活性物质,桑葚也是医疗保健价值较高的一种“药食同源”农产品[2-4]。中医认为,桑葚味甘酸、性寒,入肺、肝、肾、大肠经,具有补肝益肾、滋阴补血、降压消渴、美容养颜等功效[5]。现代医学研究也表明:桑葚中的脂肪酸具有分解脂肪、降低血脂,防止血管硬化等作用,桑葚中含有的抗氧化和生物活性成分,具有延缓衰老、增强免疫力、防癌抗癌、明目等功效[6]。
食用酵素是以新鲜的蔬菜、水果、药食同源中药等为原料,破碎、榨汁、萃取等一系列工艺处理后,经过微生物发酵所产生的含有丰富的营养成分以及生物活性物质的发酵液[7]。它不仅保留了原料中原有的多种维生素、氨基酸、酚类、多糖等功效成分,还通过微生物发酵过程中的代谢作用将不易被人体所吸收的大分子物质转化成更易于被人体所吸收和利用的小分子物质,此外,还产生新的生物活性成分,大大提高了酵素的营养价值[8-9]。近年来,国内外诸多学者对沙棘酵素[10]、苹果酵素[11]、枇杷酵素[12]、银耳蓝莓酵素[13]等发酵过程中理化性质及抗氧化活性进行了深入的研究,对相关酵素生产过程的控制起到重要的指导意义。
本实验以桑葚酵素为研究对象,通过桑葚酵素发酵过程中理化指标及生物活性物质的测定,研究了pH、总酸、总酚等含量的变化趋势,并测定了发酵过程中2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)ammonium salt,ABTS)自由基清除能力、超氧化物歧化酶(SOD)活性等抗氧化能力的变化情况。采用Pearson相关系数法进行相关性分析,初步探究了抗氧化活性与理化指标、活性物质等的相关性,为桑葚酵素的发酵过程中的精准控制提供相关数据理论支持,同时,也对桑葚酵素的保健功能机理的研究及其综合开发利用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜桑葚果实:采摘于安徽太和县桑葚果园;白砂糖(食品级):市售;酿酒酵母(Saccharomyces cerevisiae)、醋化醋杆菌(Acetobacter aceti)、嗜热链球菌(Streptococcus thermophilus):中国工业微生物菌种保藏管理中心。NaOH、双缩脲试剂(均为分析纯):广州和为医药科技有限公司;SOD活性检测试剂盒:北京索莱宝科技有限公司;葡萄糖、硫酸、苯酚、ABTS(均为分析纯):国药集团化学试剂有限公司;酸性氧化电位水、纯化水:安徽新天生物科技有限公司。
1.2 仪器与设备
YXQ-50SII立式压力蒸汽灭菌器:上海博迅医疗生物仪器股份有限公司;TG16G台式离心机:常州金坛良友仪器有限公司;752N紫外分光光度计:上海仪电分析仪器有限公司;2WAJ阿贝折射仪:上海光学仪器一厂;YP502N电子分析天平:上海舜宇恒平科学仪器有限公司;PHS-3C pH计:上海雷磁仪器有限公司;SCPJ-10锤式破碎输送机:靖江艾莉特食品机械有限公司;50 L发酵罐:安徽神健化工医药装备股份有限公司。
1.3 方法
1.3.1 桑葚酵素的制备
新鲜桑葚用酸性氧化电位水、纯化水冲洗后,自然沥干,打浆,将桑葚果浆与白砂糖按料液比10∶1(g∶mL)加入酵素发酵罐中,再加入1%调配好的菌液(酿酒酵母∶醋化醋杆菌∶嗜热链球菌体积比为0.2∶0.4∶0.4),搅拌均匀后,于20~25 ℃条件下避光发酵49 d。每隔7 d搅拌一次,每次搅拌10 min,搅拌结束后,取样,10 000 r/min离心5 min,弃沉淀,上清液即为桑葚酵素,放置在-20 ℃冰箱中保存。
1.3.2 分析检测
pH的测定:采用PHS-3C pH计;总酸含量的测定:参照国标GB/T 12456—2021《食品中总酸的测定》;可溶性固形物含量的测定:采用阿贝折射仪[14];蛋白质含量的测定:采用双缩脲试剂法[15];总糖含量的测定:采用苯酚-硫酸法[16];总酚含量的测定:采用Folin-Ciocalteus法[17-18];超氧化物歧化酶(SOD)活性的检测:SOD活性检测试剂盒[19-20]。
ABTS自由基清除能力的测定:参照张浩然等[10]的方法制备ABTS自由基稀释液,取7.5 μL样品,用5 mmol/L磷酸盐缓冲液(phosphate buffer solution,PBS)(pH7.4)补充至300 μL,加入5 mL ABTS自由基稀释液,30 ℃条件下反应1 h,在波长734 nm处测定吸光度值。计算ABTS自由基清除率,其计算公式如下[21]:
式中:A1是空白管的吸光度值,A2是为样品测定管的吸光度值,A3为对照管的吸光度值。
1.3.3 理化指标与抗氧化指标相关性分析
采用Pearson相关系数法利用SPSS 22.0软件进行理化指标与抗氧化指标的相关性分析。
1.3.4 数据处理
实验数据均以“平均值±标准差”(n≥3)表示,采用Origin 2017软件进行数据处理与分析。
2 结果与分析
2.1 桑葚酵素发酵过程中pH和总酸含量的变化
pH和总酸含量是判断发酵是否正常和衡量发酵液品质的主要理化指标[7]。桑葚酵素发酵过程中pH值和总酸含量的变化见图1。由图1可知,在整个发酵过程中,pH值和总酸含量的变化趋势是相反的,pH随着发酵时间的延长而不断降低,而总酸含量则不断升高,直至发酵结束,发酵液中pH值和总酸含量都趋于稳定,不再发生变化。在发酵前42 d,总酸含量呈现显著的增长,这主要是由于在该发酵阶段,醋化醋杆菌、嗜热链球菌等微生物快速繁殖,产生乳酸、醋酸等多种代谢产物导致pH持续降低,总酸含量的不断增长[22]。42 d至发酵结束,pH稳定在3.60,总酸含量稳定在6.65 mg/mL,随后总酸含量出现轻微下降,pH升高至3.65,这可能是由于在发酵后期,较低的pH影响到微生物的总酸代谢积累,且微生物降解了一部分有机酸,导致总酸含量略有下降。
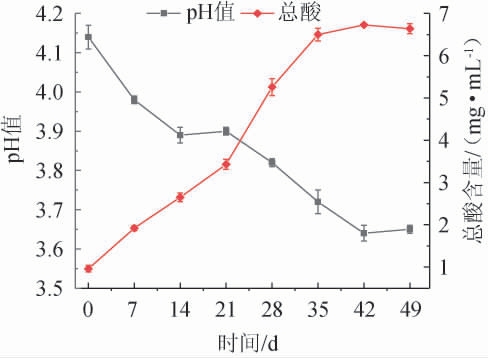
图1 桑葚酵素发酵过程中pH及总酸含量的变化
Fig.1 Changes of pH and total acid contents in the fermentation process of mulberry Jiaosu
2.2 桑葚酵素发酵过程中可溶性固形物和蛋白质含量的变化
桑葚酵素发酵过程中,可溶性固形物和蛋白质含量可较为直观反映发酵液品质,其含量随发酵时间的变化见图2[23]。
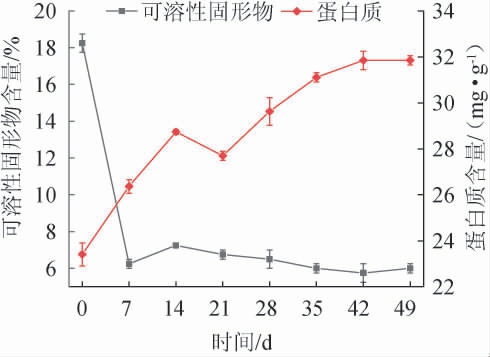
图2 桑葚酵素发酵过程中可溶性固形物及蛋白质含量的变化
Fig.2 Changes of soluble solids and protein contents in the fermentation process of mulberry Jiaosu
由图2可知,发酵前7 d可溶性固形物含量迅速下降,蛋白质含量呈现增长的趋势,该阶段营养成分充足,微生物迅速繁殖,大量的消耗利用糖类等可溶性的营养物质,产生代谢产物蛋白质和少量的酶类,使可溶性固形物含量迅速下降,7 d至发酵结束,可溶性固形物呈现先稍微上升随后下降并趋于稳定的趋势,而蛋白质含量呈现先下降后上升最终趋于稳定的趋势,这可能是微生物为维持生命活动,开始将桑葚发酵液中蛋白质等物质转化为可溶性碳水化合物并被逐渐利用,同时,不断代谢产生蛋白质、酶等代谢产物,使蛋白质含量呈现增长趋势,至发酵结束(49 d),蛋白质含量基本稳定在31.85mg/g,可溶性固形物含量稳定在6.00%。
2.3 桑葚酵素发酵过程中总糖含量的变化
糖作为微生物发酵过程中的主要碳源,其含量变化反映微生物的生长和代谢情况[24]。桑葚酵素发酵过程中总糖含量的变化见图3。
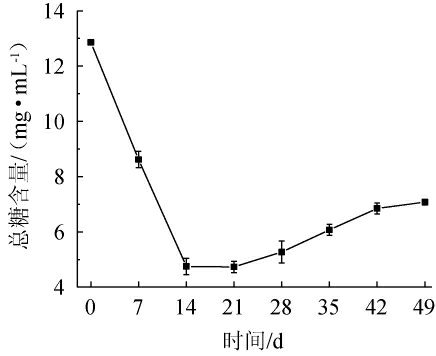
图3 桑葚酵素发酵过程中总糖含量的变化
Fig.3 Changes of total sugar contents in the fermentation process of mulberry Jiaosu
由图3可知,发酵前14 d,总糖含量出现显著下降的趋势,这可能是有由于此阶段微生物进入快速生长期,糖类物质主要被酿酒酵母、醋化醋杆菌、嗜热链球菌等微生物用于增殖和代谢,发酵至14 d,总糖含量达到4.73 mg/mL,发酵第14天至发酵结束,总糖含量有缓慢增加的趋势,并逐渐趋于稳定在6.85 mg/mL。这可能是由于微生物的大量生长和繁殖,分解了桑葚的营养物质,生成了糖类代谢产物,使发酵液的总糖含量升高,当微生物消耗的总糖与糖类代谢产物的产生量趋于平衡时,发酵液中的总糖含量基本处于稳定状态,发酵结束。
2.4 桑葚酵素发酵过程中总酚含量的变化
作为优良的天然抗氧化物质,酚类化合物具有抗氧化、延缓衰老、消炎等功能特性[25]。桑葚酵素发酵过程中总酚含量的变化见图4。由图4可知,发酵前7 d,总酚含量上升较慢,这可能是由于处于发酵前期的桑葚在高渗透压作用下多酚类物质的溶出所致。7~42 d总酚含量快速上升,在42 d时达到最大值1.61 mg/mL,这可能是由于微生物大量繁殖,代谢较为迅速,产生大量的酚类次生代谢产物;总酚含量的上升会对微生物的生长起到一定的抑制作用,此时,发酵液中的优势菌群为了维持自身的正常生命活动,一些多酚氧化酶被活化,促进酚类物质转化成其他代谢产物,从而导致在发酵后期桑葚酵素的总酚含量出现稍微下降的现象。
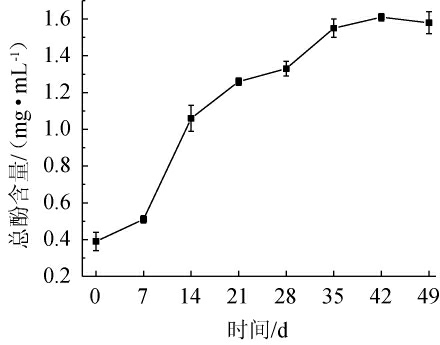
图4 桑葚酵素发酵过程中总酚含量的变化
Fig.4 Changes of total phenol contents in the fermentation process of mulberry Jiaosu
2.5 桑葚酵素发酵过程中ABTS自由基清除率的变化
ABTS自由基是一种稳定存在的自由基,其清除能力是评价亲水性和亲脂性物质的抗氧化能力的指标之一[26]。桑葚酵素发酵过程中ABTS自由基的清除率变化见图5。由图5可知,发酵过程中ABTS自由基清除率呈现先上升后趋于稳定的趋势,从发酵开始23.46%的清除率上升至42 d时的69.86%的清除率,随后,逐渐趋于稳定,整个发酵过程桑葚酵素的ABTS自由基清除率增长了约3倍。研究表明,酚类化合物、有机酸等化合物与ABTS自由基清除率存在着密切的关系,这也可能是使桑葚酵素发酵液的ABTS自由基清除率逐渐增高并最终趋于稳定的主要因素[27]。
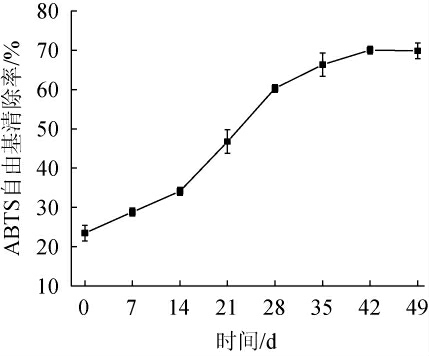
图5 桑葚酵素发酵过程中ABTS自由基清除能力的变化
Fig.5 Changes of ABTS free radical scavenging rates in the fermentation process of mulberry Jiaosu
2.6 桑葚酵素发酵过程中超氧化物歧化酶活性的变化
超氧化物歧化酶广泛分布在微生物体内,是生物体系中抗氧化酶系的重要组成部分,具有延缓皮肤衰老、免疫调节、抗氧化等功能[28]。桑葚酵素发酵过程中SOD活性的变化见图6。由图6可知,SOD活性随着发酵时间的延长呈逐渐增加趋势,发酵35 d后缓慢增加并趋于稳定,发酵结束时SOD活性从发酵初期的12.75 U/mL增至93.35 U/mL。说明桑葚经过微生物发酵所产生的代谢产物中含有超氧化物歧化酶或能提高超氧化物歧化酶活力的活性物质,这可能也是桑葚酵素具有较强自由基清除能力的重要原因之一。

图6 桑葚酵素发酵过程中超氧化物歧化酶活性的变化
Fig.6 Changes of superoxide dismutase activities in the fermentation process of mulberry Jiaosu
2.7 桑葚酵素发酵过程中各指标之间相关性分析
在不同的发酵过程中,桑葚酵素ABTS自由基清除率、SOD活性这两个抗氧化指标具有明显的差异性,这可能与桑葚酵素中的pH、可溶性固形物、总酸、总糖、总酚等有关,对发酵过程中上述参数与ABTS自由基清除率、SOD活性进行Pearson相关性分析,结果见表1。
表1 桑葚酵素发酵过程中各参数相关性分析结果
Table 1 Correlation analysis results of various parameters in the fermentation process of mulberry Jiaosu
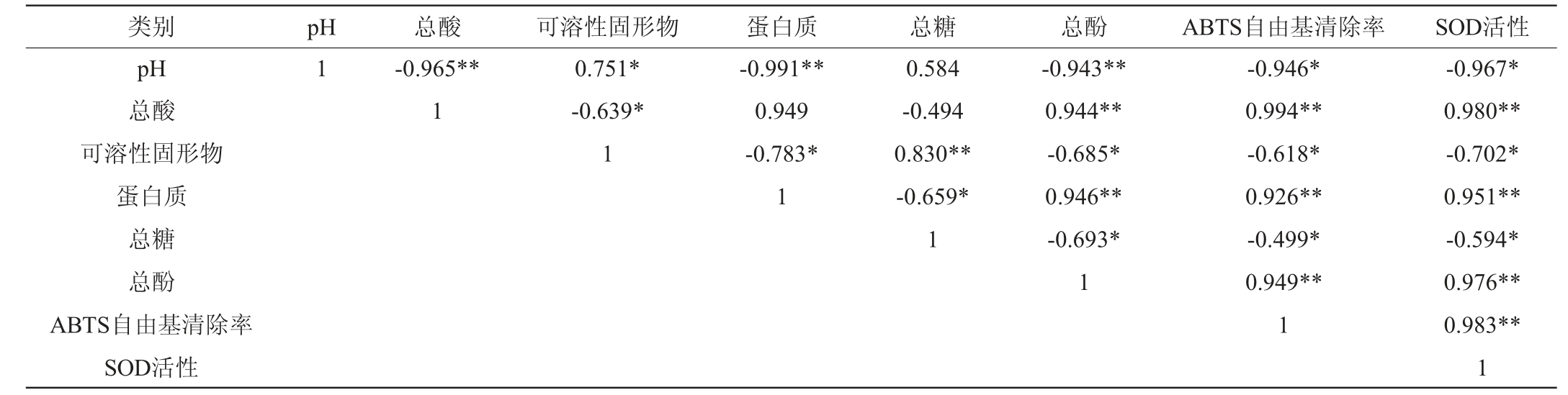
注:“*”表示显著相关(P<0.05);“**”表示极显著相关(P<0.01)。
由表1可知,ABTS自由基清除率和SOD活性这两个抗氧化指标之间存在极显著的正相关性(P<0.01),总酸、蛋白质和总酚与两个抗氧化指标之间呈现极显著的正相关(P<0.01),而pH、可溶性固形物、总糖与抗氧化指标之间呈现显著的负相关(P<0.05)。结果表明,在发酵过程中,微生物所产生的有机酸、酚类化合物、蛋白质等代谢产物具有一定的抗氧化作用,而糖类物质在微生物发酵过程中被消耗代谢产生有机酸、酚类化合物等活性物质,进而提高其抗氧化能力。
3 结论
本实验重点研究了桑葚酵素自然发酵过程中理化指标、代谢物含量及抗氧化活性的变化,并对各个指标之间的相关性进行了分析。结果表明,在整个发酵过程中,pH呈不断下降的趋势,至发酵结束时,pH在3.65左右趋于稳定,总酸含量的变化则与pH相反,发酵结束时总酸含量为6.65 mg/mL。总糖和可溶性固形物呈现相同的先快速下降后略有上升,最后趋于稳定的趋势。总酚含量、ABTS自由基清除率和SOD活性的变化趋势基本相同,呈现先上升后趋于稳定的趋势,这也说明了微生物发酵过程有生物活性成分的产生,提升了桑葚酵素的抗氧化能力。通过相关性分析,也进一步说明了抗氧化活性的提高与总酸、蛋白质和总酚含量的变化呈现极显著的相关性(P<0.01)。通过对桑葚酵素发酵过程中理化指标和代谢产物含量变化的研究,能较为直观的反映出发酵进程和生物活性物质的累积情况,为桑葚酵素的研究提供一定的数据支持,也为桑葚酵素系列产品的推广提供了一定的理论基础。
[1]程水明,曾霞,周国钰,等.桑葚复合酸奶的研制[J].中国酿造,2015,34(10):147-150.
[2]李冬香,陈清西.桑葚功能成份及其开发利用研究进展[J].中国农学通报,2009,25(24):293-297.
[3]BHATTACHARJYA D,SADAT A,DAM P,et al.Current concepts and prospects of mulberry fruits for nutraceutical and medicinal benefits[J].Curr Opin Food Sci,2021,40:121-135.
[4]JAN B,PARVEEN R,ZAHIRUDDIN S,et al.Nutritional constituents of mulberry and their potential applications in food and pharmaceuticals:A review[J].Saudi J Biol Sci,2021,28(7):3909-3921.
[5]郭伟峰,王红梅,邹晓桐,等.桑葚酵素饮料的发酵工艺研究及其质量评价[J].食品研究与开发,2019,40(5):88-93.
[6]刘功良,余洁瑜,姜弘佳,等.桑葚果酒的发酵工艺研究[J].中国酿造,2017,36(11):59-63.
[7]王帅,范影,胡超,等.蓝莓水果酵素复合饮料配方工艺的研究[J].饮料工业,2020,23(6):36-40.
[8]JING D,RUYI S,WANG Z Z,et al.Edible plant Jiaosu:manufacturing,bioactive compounds,potential health benefits,and safety aspectss[J].J Sci Food Agr,2020,100(15):5313-5323.
[9]王帅,王婷婷,范影,等.胶原蛋白酵素饮品配方的工艺[J].食品工业,2022,43(1):34-38.
[10]张浩然,范昊安,顾逸菲,等.沙棘酵素发酵过程中代谢产物及抗氧化活性研究[J].食品工业科技,2020,41(11):125-133.
[11]张海燕,康三江,袁晶,等.苹果酵素自然发酵过程中生物活性物质的变化[J].中国酿造,2021,40(3):111-114.
[12]付龙威,汤晓娟,林祥娜,等.枇杷酵素自然发酵过程中有机酸及其抗氧化活性的研究[J].食品研究与开发,2021,42(4):42-47.
[13]罗泽江,张永生,李琢伟,等.银耳蓝莓酵素发酵过程中体外抗氧化性能变化及品质的研究[J].食品研究与开发,2019,40(12):39-45.
[14]别智鑫,贺立虎,赵俊霞,等.几种生产因素对秦美猕猴桃单果重及品质的影响[J].西北农业学报,2007,16(5):199-202.
[15]LUBRAN M M.The measurement of total serum proteins by the biuret method[J].Ann Clin Lab Sci,1978,8(2):106-110.
[16]张媛媛,张彬.苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J].食品科学,2016,37(4):158-163.
[17]蒋增良,毛建卫,黄俊,等.蓝莓酵素在天然发酵过程中抗氧化性能的变化[J].食品工业科技,2013,34(2):194-197.
[18]LEDOUX M,LAMY F.Determination of proteins and sulfobetaine with the folin-phenol reagent[J].Anal Biochem,1986,157(1):28-31.
[19]MASSAYASU M,HIROSHI Y.A simplified assay method of superoxide dismutase activity for clinical use[J].Clin Chim Acta,1979,92(3):337-342.
[20]WANG Y N,LIANG C Z,MENG Z G,et al.Leveraging Atriplex hortensis choline monooxygenase to improve chilling tolerance in cotton[J].Environ Exp Bot,2019,162:364-373.
[21]方晟,陈犇,沙如意,等.百合酵素自然发酵过程中有机酸及其体外抗氧化活性的变化[J].食品与发酵工业,2019,45(22):39-46.
[22]陈小伟,程勇杰,蒋立新,等.草莓酵素发酵过程中代谢产物及抗氧化性的变化研究[J].中国食品学报,2020,20(5):157-165.
[23]王迪,王颖,张艳莉,等.芸豆酵素发酵过程中组分及抗氧化功能研究[J].食品工业科技,2021,42(18):18-24.
[24]张巧,陈春喜,陈振林,等.大果山楂酵素发酵过程中组分及抗氧化性研究[J].食品研究与开发,2018,39(22):15-19.
[25]陈彦林,遆慧慧,张名位,等.龙眼果肉的健康效应及主要活性物质研究进展[J].广东农业科学,2014,41(12):40-44.
[26]张雪春,刘江,吴鑫,等.响应面法优化提取文冠果壳中多酚类物质及其体外抗氧化能力分析[J].中国油脂,2018,43(5):117-122.
[27]范昊安,沙如意,方晟,等.苹果梨酵素发酵过程中的褐变与抗氧化活性[J].食品科学,2020,41(14):116-123.
[28]LYONS T J,GRALLA E B,VALENTINE J S.Biological chemistry of copper-zinc superoxide dismutase and its link to amyotrophic lateral sclerosis[J].Met Ions Biol Syst,1999,36:125-177.