大曲作为一种含微生物和酶的糖化发酵剂,对白酒的产量和风格具有重要影响[1]。依据制作时所达到的温度的不同,可将大曲分为高温大曲(60~65 ℃)、中高温大曲(55~60 ℃)、中温大曲(50~55 ℃)和低温大曲(40~50 ℃),其中,中高温大曲主要用于浓香型白酒的生产[2]。
大曲中的微生物是在开放式生产过程中自然富集的,含有包括细菌、霉菌和酵母菌等在内的多种微生物[3]。高通量测序技术的应用,为研究大曲微生物物种组成、群落结构及演替规律提供了有力的工具[4-5]。有研究表明,不同类型大曲微生物组成不同[6],同一类型不同地区大曲微生物多样性也存在差异[7]。在实际生产中往往要依据季节、原料、发酵特性等将不同大曲混合使用,以保证白酒的质量。如在清香型白酒中通常以红心曲、后火曲和清茬曲的混合曲用于生产[8]。红心曲可以提高芳香化合物的含量,后火曲可以调节苦味和酸味,清茬曲可以抑制含硫有机化合物的产生[9]。在酱香型白酒生产中,高温功能大曲与普通酱香型大曲以6∶4比例混合后可有效提高大曲质量,生产出典型的酱香风格白酒[10]。
实践中,多数情况下都是基于经验对不同大曲进行混合使用,缺乏进一步的理论支持。基于此,本研究以内蒙古河套酒业集团股份有限公司生产的3种中高温大曲为研究对象,通过理化检测和高通量测序技术分析其理化、微生物组成及多样性差异,并采用PICRUSt软件对微生物的功能进行预测,以期为生产中不同大曲的混合使用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
本研究所用大曲采自内蒙古河套酒业集团股份有限公司,分别采集实际生产中的3种不同大曲各3块,编号分别为Q1、Q2、Q3,每块用五点法取样后混合为一个样品。3种大曲均以小麦为原料制作而成,Q1、Q2和Q3大曲所用小麦分别产于河套、四川和山东地区,培曲顶火温度分别为60~63 ℃、58~60 ℃和58~62 ℃。
1.1.2 试剂
氢氧化钠、酚酞、磷酸氢二钠、柠檬酸、可溶性淀粉、三氯乙酸、硫酸(均为分析纯):国药集团化学试剂有限公司;碘、碘化钾、氯化钴、重铬酸钾、铬黑T、无水葡萄糖、硫酸铜、亚甲基蓝、酒石酸钾钠、亚铁氰化钾、乳酸、乳酸钠、硼砂(均为分析纯):天津永晟精细化工有限公司;福林试剂、酪氨酸(均为分析纯):北京酷来搏科技有限公司;Omega EZNATM土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega Bio-tek公司;AxyPrep DNA凝胶回收试剂盒:美国AXYGEN公司。
1.2 仪器与设备
FA2104N电子天平:上海箐海有限公司;XMTD-8222恒温水浴锅:上海精宏实验设备有限公司;T6紫外可见分光光度计:北京普析通用仪器有限责任公司;DHG-9053A电热鼓风干燥箱、GHP-9080恒温培养箱:上海一恒科学仪器有限公司;MiSeq PE250测序仪:美国Illumina公司;9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司。
1.3 方法
1.3.1 大曲理化指标的测定
参照《酿酒分析与检测》(第二版)[11]测定大曲的水分、酸度、淀粉酶活力(液化型)、糖化酶活力、蛋白酶活力和发酵力。
1.3.2 大曲样品微生物菌群多样性分析
称取样品7.0 g,经0.1 mol/L的磷酸盐缓冲液(phosphate buffered solution,PBS)洗涤,收集菌体,采用Omega EZNATM土壤基因组DNA提取试剂盒提取大曲微生物基因组[12]。以其为模板,使用引物338F/806R和ITS1F/ITS2R分别对细菌16S rRNA V3-V4区和真菌ITS1-ITS2区基因序列进行PCR扩增[13]。PCR扩增产物经2%琼脂糖凝胶电泳,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR扩增产物,将纯化后的PCR扩增产物委托上海凌恩生物科技有限公司进行高通量测序。
测序所得数据经FLASH(1.2.11)拼接后,使用Usearch(10)以97%相似度进行操作分类单元(operational taxonomic units,OTU)划分,与Silva(138.1)和Unite(8.2)数据库进行比对注释。
1.3.3 数据处理
使用上海凌恩生物科技有限公司云平台(http://www.cloud.biomicroclass.com/CloudPlatform/)和R语言(Vegan包)对高通量测序数据进行多样性分析,并在门水平和属水平上对各大曲样品的微生物组成进行分析。采用欧式距离算法计算3种大曲样本间的距离矩阵,通过主成分分析(principal component analysis,PCA)样品间差异,采用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)确定样品间的显著差异物种,采用PICRUSt软件对细菌和真菌进行功能预测,并参照蛋白质直系同源库(clusters of orthologousgroupsofproteins,COGs)注释。使用R语言(Psych包)计算斯皮尔曼(Spearman)相关系数,使用SPSS 24.0进行方差分析。
2 结果与分析
2.1 3种中高温大曲样品理化指标的分析
3种中高温大曲样品的理化指标见表1。由表1可知,3种中高温大曲的酸度、发酵力、淀粉酶活力和蛋白酶活力无显著差异(P>0.05),糖化酶活力差异显著(P<0.05),其中,样品Q1的糖化酶活力最高,为(158.67±16.44)U/g,样品Q3的糖化酶活力最低,为(69.33±8.22)U/g。样品Q1、Q3与Q2水分含量差异显著(P<0.05),其中,样品Q1水分含量最高,为(6.63±0.69)%。有研究表明,大曲糖化力和液化力与白酒的出酒率直接相关,糖化力高则出酒率高[14]。本研究中,大曲样品Q1的糖化酶活力最高,样品Q3的糖化酶活力最低,因此使用大曲样品Q1的出酒率高于样品Q3。
表1 3种中高温大曲样品的理化指标
Table 1 Physicochemical indexes of three kinds of medium-high temperature Daqu
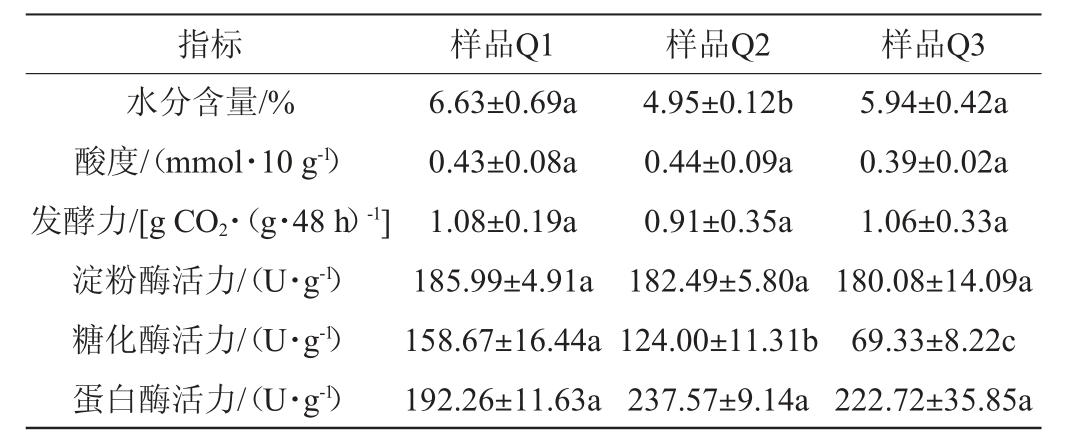
注:同行肩不同小写字母表示差异显著(P<0.05)。
2.2 3种中高温大曲样品微生物菌群多样性差异分析
对3种中高温大曲样品进行高通量测序,16S rRNA V3-V4区域测序共得到403 802条序列,ITS1区域测序共得到355 847条序列。以97%的相似性对测序所得序列聚类并进行OTU划分,细菌得到507个OTU,真菌得到90个OTU。对3种中高温大曲的微生物多样性进行分析,结果见图1。

图1 3种中高温大曲微生物多样性指数
Fig.1 Microbial diversity indexes of three kinds of medium-high temperature Daqu
由图1可知,样品Q3中细菌和真菌菌群的OTU数、Shannon和Chao1指数均最大,样品Q1中均最小,说明细菌和真菌群落多样性和物种总数在样品Q3中最高,在样品Q1中最低。为说明样本的测序数据量是否合理,基于OTU水平绘制3种中高温大曲细菌(a)及真菌(b)菌群的Shannon指数曲线,结果见图2。
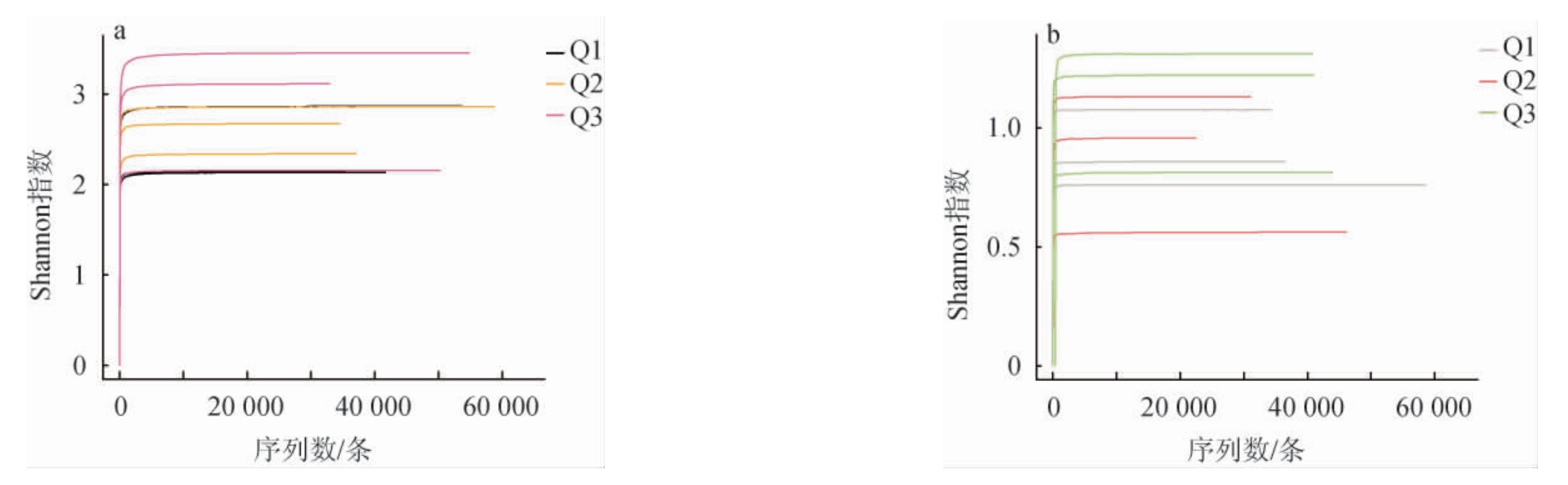
图2 3种中高温大曲细菌(a)及真菌(b)菌群Shannon指数曲线
Fig.2 Shannon index curve of bacterial (a) and fungal (b) community in three kinds of medium-high temperature Daqu
由图2可知,随着序列数的增加,测序结果的Shannon指数曲线达到了饱和状态,由图1也可知,细菌和真菌菌群的coverage指数均>0.99,并且在3种中高温大曲间无显著性差异(P>0.05),说明本次实验测序深度合适,能够反映样品中微生物菌群的真实情况。
2.3 3种中高温大曲样品微生物菌群结构差异分析
2.3.1 3种中高温大曲细菌菌群组成差异分析
为了解3种大曲的微生物菌群组成,将细菌菌群的OTU代表性序列与Silva数据库同源性比对注释,被划分为16个门和220个属,结果见图3。
由图3a可知,3种中高温大曲样品中的优势细菌门(相对丰度≥1%)有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和蓝细菌(Cyanobacteria),但其在不同样品中的相对丰度存在差异。Firmicutes、Proteobacteria和Actinobacteria的相对丰度在3种大曲中较高,其中,Firmicutes的平均相对丰度在样品Q3中最高,在样品Q1中最低,分别为63.52%和26.33%。Proteobacteria的平均相对丰度在样品Q2中最高,在样品Q1中最低,分别为43.52%和17.34%。Actinobacteria的平均相对丰度在样品Q1中最高,在样品Q2中最低,分别为48.35%和1.35%。
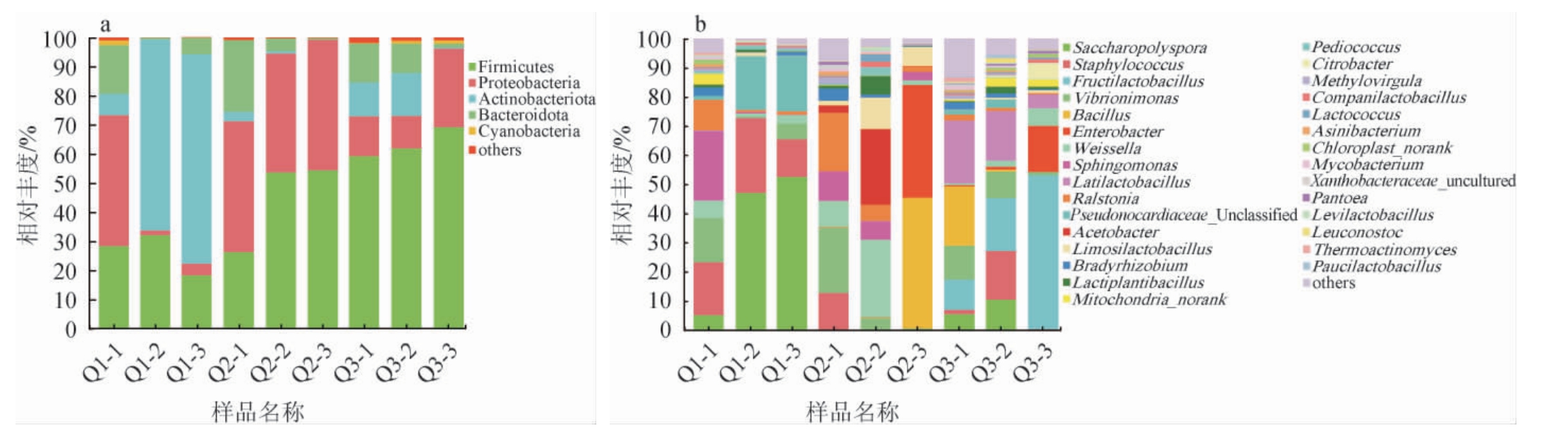
图3 基于门(a)和属(b)水平3种中高温大曲样品细菌菌群结构分析结果
Fig.3 Structural analysis results based on phylum (a) and genus (b) level of three kinds of medium-high temperature Daqu bacterial community
others:相对丰度<1%的其他菌门或菌属。下同。
由图3b可知,3种中高温大曲样品中的优势细菌属(相对丰度≥1%)共有30种,不同大曲中优势细菌属的种类及相对丰度存在差异。其中优势细菌属糖多孢菌属(Saccharopolyspora)和葡萄球菌属(Staphylococcus)的平均相对丰度在样品Q1中较高,分别为35.01%和18.92%。芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、魏斯氏菌属(Weissella)和粘液乳杆菌属(Limosilactobacillus)的平均相对丰度在样品Q2中较高,分别为15.02%、13.01%、12.35%和9.56%。果实乳杆菌属(Fructilactobacillus)和广布乳杆菌属(Latilactobacillus)的平均相对丰度在样品Q3中较高,分别为27.17%和14.42%。
研究表明,不同地区和不同生产方式生产的大曲微生物组成存在差异,且大曲中细菌主要来源于制曲原料[2]。此外,XIAO C等[15]研究表明,温度是影响中温大曲微生物菌群形成的内源性驱动力。因此,原料和培曲顶火温度的不同可能是造成3种大曲间细菌组成差异的原因。优势细菌属Saccharopolyspora在浓香型大曲中普遍存在,具有多种催化水解功能[16]。Staphylococcus存在于制曲环境、大曲以及酒醅中[17],具有2,3-丁二醇代谢潜力,并具有产脂肪酶能力,脂肪酶代谢产物可构成白酒风味物质或前体物质[18]。此外,Bacillus也具有分泌淀粉酶的能力[19],同时还可发酵产生吡嗪、芳香族类风味物质等[20]。本研究中样品Q1中Saccharopolyspora和Staphylococcus的平均相对丰度远高于样品Q2和Q3,Bacillus在样品Q2中的平均相对丰度较高,在样品Q1中的平均相对丰度<1%。因此样品Q1中Saccharopolyspora可提供水解功能,样品Q2和Q3中Bacillus可提供水解功能。本研究中,优势细菌中存在多种乳酸菌科(Lactobacillaceae)细菌,包括Fructilactobacillus、Latilactobacillus、Weissella、Limosilactobacillus、乳植杆菌属(Lactiplantibacillus)、片球菌属(Pediococcus)、伴生乳杆菌属(Companilactobacillus)、促生乳杆菌属(Levilactobacillus)、明串珠菌属(Leuconostoc)和寡食乳杆菌属(Paucilactobacil-lus)等。乳酸菌是大曲中的优势细菌[4],在白酒发酵过程具有促进美拉德反应、促进酿酒的发酵、维护与保持酿酒微生态环境等作用[21],是白酒风味物质演替的推动者之一[22]。研究显示,Fructilactobacillus sanfranciscensis作为异型发酵乳酸菌,在发酵中产生有机酸、风味物质和胞外多糖等[23],Latilactobacillus sakei同样具有产酸的能力[24]。Weisslla可通过磷酸己糖和磷酸酮酶途径异型发酵葡萄糖产乳酸,还可发酵麦芽糖、蔗糖等糖产酸以增加食品中的有机酸、短链脂肪酸、酯类等风味物质,同时起到防止腐败菌的作用[25]。此外,Enterobacter作为大曲的优势细菌属与酯类物质合成呈现正相关[26],Acetobacter在发酵中可产生乙酸,是浓香型白酒发酵前体物质产生菌中贡献最大的菌群[27]。本研究中,Fructilactobacillus和Latilactobacillus在样品Q3中的平均相对丰度高于样品Q1和Q2,Weissella、Limosilactobacillus、Enterobacter和醋酸菌属(Acetobacter)在样品Q2中的平均相对丰度较高。因此,样品Q2和Q3能提供多种产酸细菌。
2.3.2 3种中高温大曲真菌菌群组成差异分析
将真菌菌群的OTU代表性序列与Unite数据库同源性比对注释,被划分为4个门和52个属,结果见图4。
由图4可知,3种中高温大曲的真菌菌群组成在门和属水平上无较大差异,子囊菌门(Ascomycota)在3种大曲样品中的平均相对丰度较高,均>98%,此外,毛霉菌门(Mucoromycota)在样品Q3的平均相对丰度高于样品Q1和样品Q2。3种中高温大曲样品的优势真菌属共有8种,其中优势真菌属热子囊菌属(Thermoascus)的平均相对丰度在样品Q3中较高,为90.98%;嗜热真菌属(Thermomyces)的平均相对丰度在样品Q1中较高,为33.11%。有研究表明,Thermoascus和Thermomyces能够产生热稳定性和高活力纤维素酶、蛋白酶,有利于酿造过程中产酒生香[28];高温大曲中Thermomyces与糖化酶活力具有显著正相关[17]。在本研究中,3种大曲的糖化酶活力之间差异显著(P<0.05),活力最高的为样品Q1,最低的为样品Q3,且Thermomyces在样品Q3中的平均相对丰度较低,这可能是造成样品Q3糖化酶活力较低的原因。曲霉属(Aspergillus)在样品Q1中未检测出,在样品Q2中平均相对丰度较高。此外,覆膜孢酵母属(Saccharomycopsis)的相对丰度较其他优势真菌属较低,但在样品Q3中的平均相对丰度高于样品Q1和Q2,德巴利氏酵母属(Debaryomyces)、根毛霉属(Rhizomucor)、青霉菌属(Penicillium)和酵母菌属(Saccharomyces)的相对丰度较其他优势真菌属低,并在3种大曲间差异较小。有研究表明,大曲发酵力与酵母数量呈显著正相关[28],发酵力具有显著差异的大曲,其真菌属的相对丰度也具有差异[12,29]。本研究中3种大曲的发酵力无显著差异(P>0.05),可能与3种大曲中酿酒酵母及其他酵母的相对丰度较低,并且无显著差异有关。
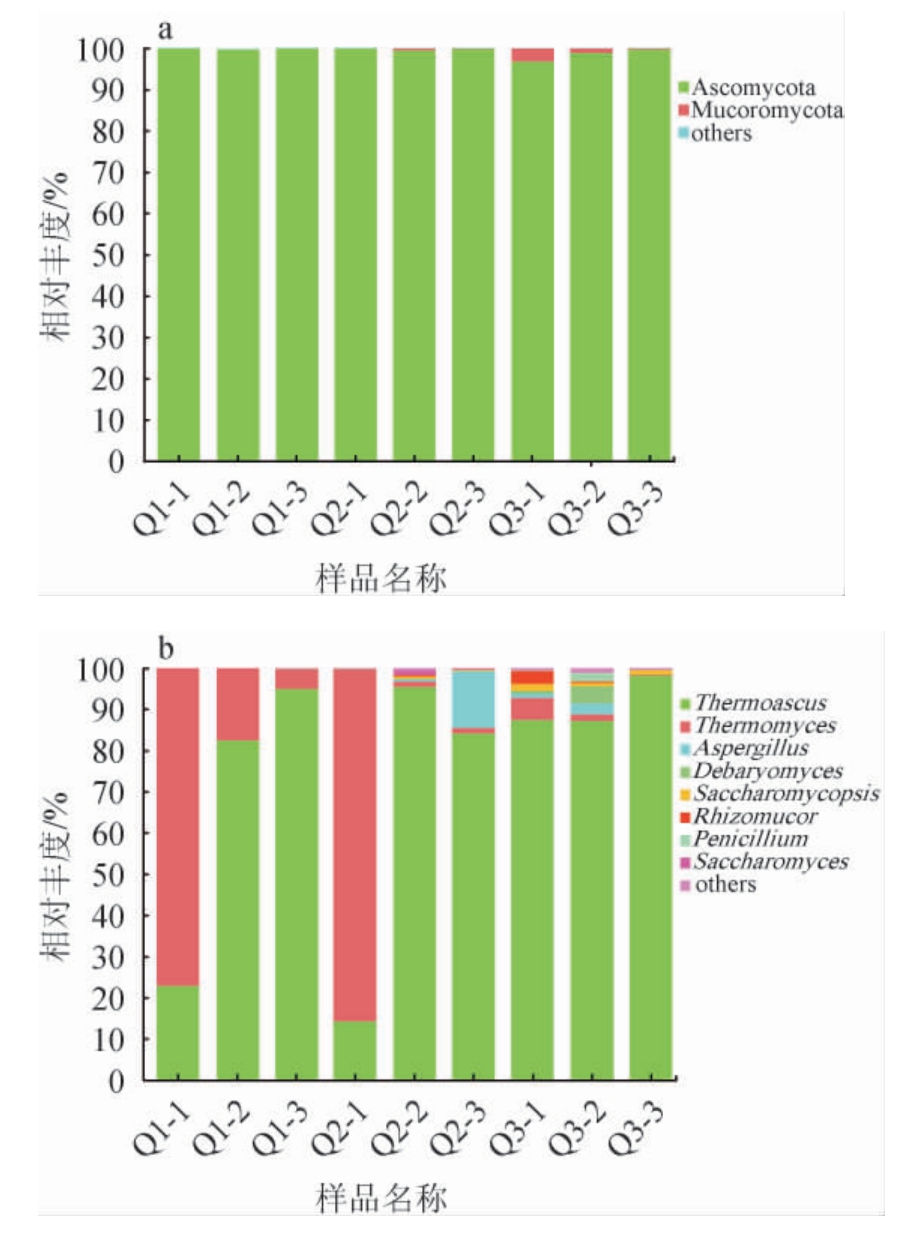
图4 基于门(a)及属(b)水平3种中高温大曲真菌菌群结构分析结果
Fig.4 Structural analysis results based on phylum (a) and genus (b)level of three kinds of medium-high temperature Daqu fungal community
2.4 3种中高温大曲微生物群落及物种差异分析
通过PCA对3种中高温大曲样品的细菌及真菌群落结构的差异进行分析,结果见图5。由图5a可知,第一主成分(principalcomponent1,PC1)的方差贡献率为35.37%,权重最大,PC2的方差贡献率为25.44%,累计方差贡献率为60.81%。在第一主成分轴和第二主成分轴上,样品Q1、Q2和Q3可明显划分为3组,但样品Q2和Q3组内差异较样品Q1组内差异大,说明3种中高温大曲样品细菌群落具有差异。由图5b可知,PC1的方差贡献率为96.6%,权重最大,PC2的贡献率为1.77%,累计方差贡献率为98.37%。在第一主成分轴上,3种大曲间距离接近,且第一主成分贡献率远大于第二主成分的方差贡献率,因此,在真菌水平上,3种中高温大曲真菌群落差异不明显。

图5 3种中高温大曲细菌(a)和真菌(b)菌群结构主成分分析结果
Fig.5 PCA results of bacterial (a) and fungal (b) community in three kinds of medium-high temperature Daqu
进一步通过LEfSe分析具有显著性差异的细菌属,结果发现样品Q1与样品Q2间无显著差异物种,而样品Q3与样品Q1、Q2间具有显著性差异的细菌属(P<0.05),结果见图6。由图6可知,样品Q3中的细菌属Fructilactobacillus、Citrobacter、Stenotrophomonas、Paucilactobacillus、Lentilactobacillus与样品Q1和Q2具有显著性差异(P<0.05)。在LEfSe分析中Fructilactobacillus的影响值最高,说明在3种大曲中Fructilactobacillus差异最大。
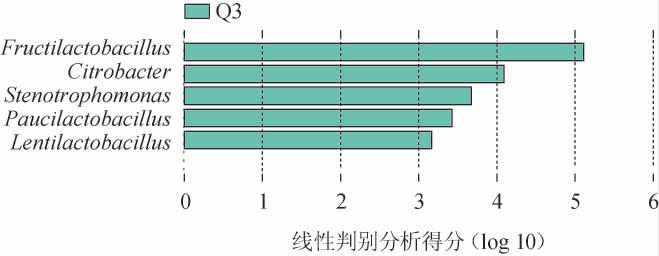
图6 3种中高温大曲细菌菌群的LEfSe分析结果
Fig.6 LEfSe analysis results of bacterial community in three kinds of medium-high temperature Daqu
2.5 差异细菌属与理化指标间相关性的预测
利用Spearman相关系数建立3种中高温大曲样品差异细菌属与理化指标的相关性,结果见图7。由图7可知,5个差异细菌属与糖化酶活力显著负相关(P<0.05),与其他理化性质无显著相关性(P>0.05)。此外,Fructilactobacillus仅与酸度和蛋白酶活力呈正相关,Citrobacter和Paucilactobacillus仅与蛋白酶活力呈正相关,Stenotrophomonas仅与水分呈正相关。Fructilactobacillus与酸度呈正相关,并且其平均相对丰度在样品Q3中较高,由此说明Fructilactobacillus是样品Q3中的主要产酸菌。

图7 3种中高温大曲差异细菌属与理化指标间的相关性分析结果
Fig.7 Correlation analysis results between differential bacterial genera and physicochemical indexes of three kinds of medium-high temperature Daqu
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
2.6 3种中高温大曲微生物群落功能差异分析
3种中高温大曲微生物群落功能的预测结果见图8。由图8可知,通过功能预测,3种中高温大曲样品中的细菌菌群共注释得到4 398个COGs,其中含有21个已知功能簇;真菌菌群共注释得到1 379个COGs,其中含有20个已知功能簇。细菌和真菌菌群功能预测结果均含有9种细胞过程和信号相关功能簇和8种代谢相关功能簇,但在信息存储与处理相关功能簇具有差异。除共有的3种信息存储与处理相关功能簇外,细菌菌群中还具有核糖核酸(ribonucleic acid,RNA)加工与修饰(A)相关功能簇。在众多功能簇中,代谢相关功能簇和其他功能簇相比丰度较高。

图8 3种中高温大曲细菌(a)和真菌(b)菌群COGs功能预测结果
Fig.8 COGs functional prediction results of bacterial(a) and fungal(b)community in three kinds of medium-high temperature Daqu
“*”表示样品Q1和Q3、Q2和Q3具有显著差异(P<0.05)。
在代谢相关功能簇中,真菌菌群的代谢相关功能簇丰度远小于细菌菌群代谢相关功能簇丰度,且样品Q1细菌的代谢相关功能簇丰度显著高于Q2和Q3(P<0.05)。对3种大曲微生物组成分析发现,Saccharopolyspora和Staphylococcus的平均相对丰度在样品Q1中较高,在样品Q2和Q3中较低,并且Saccharopolyspora具有多种催化水解功能[15]。由此说明,样品Q1中的代谢相关功能簇丰度显著高于样品Q2和Q3(P<0.05),可能是由于样品Q1中Saccharopolyspora和Staphylococcus的平均相对丰度较高。细菌菌群中参与代谢的相关功能簇中丰度最高的为氨基酸转运和代谢(E)相关功能簇,其次为碳水化合物转运和代谢(G)、辅酶转运代谢(H),次生代谢物的生物合成和转运和分解代谢(Q)相关功能簇丰度最低。真菌菌群中参与代谢的相关功能簇中丰度最高的为氨基酸转运和代谢(E)相关功能簇,其次为辅酶转运代谢(H)和能量产生和转换(C)相关功能簇,转运和分解代谢(Q)相关功能簇丰度最低。
3 结论
理化性质研究结果表明,北方浓香型白酒的3种中高温大曲(Q1、Q2和Q3)的酸度、发酵力、淀粉酶活力和蛋白酶活力无显著差异(P>0.05),糖化酶活力和水分含量具有显著差异(P<0.05),其中样品Q1的糖化酶活力和水分含量较高。微生物多样性分析结果表明,3种中高温大曲中优势细菌存在较大差异,其中糖多孢菌属(Saccharopolyspora)和葡萄球菌属(Staphylococcus)相对丰度在样品Q1中较高,芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)、魏斯氏菌属(Weisslla)和粘液乳杆菌属(Limosilactobacillus)相对丰度在样品Q2中较高,果实乳杆菌属(Fructilactobacillus)和广布乳杆菌属(Latilactobacillus)相对丰度在样品Q3中较高;优势真菌属的差异较小,其中嗜热子囊菌属(Thermoascus)的相对丰度较高。LEfSe分析及Spearman相关性分析得出,果实乳杆菌属(Fructilactobacillus)为样品Q3与样品Q1和Q2的主要差异微生物,且其与糖化酶活力呈显著负相关(P<0.05)。功能预测结果表明,3种中高温大曲样品中的微生物菌群的代谢相关功能簇丰度较高,并且样品Q1细菌菌群的代谢相关功能簇丰度显著高于样品Q2和Q3(P<0.05)。综上,3种大曲各具优势,样品Q1有较高的糖化酶活力,能够保证发酵的正常进行,样品Q2和Q3可提供更多产酸微生物,为合成酯类物质提供前体物质,有利于白酒风味物质的形成。因此,在实际生产中可将3种大曲以一定比例混合后使用,达到提高出酒率并获得具有良好风味的白酒的目的。本研究将为进一步优化混合用曲比例,提高北方浓香型大曲白酒质量提供理论依据。
[1]罗惠波,杨晓东,杨跃寰,等.浓香型大曲中可培养真菌的分离鉴定与系统发育学分析[J].现代食品科技,2013,29(9):2047-2052.
[2]周天慈,何宏魁,周庆伍,等.基于高通量扩增子测序技术解析中高温大曲微生物来源[J].食品与发酵工业,2021,47(16):66-71.
[3] ZOU W,ZHAO C Q,LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:a review[J].Front Microbiol,2018,9:671.
[4] ZHANG X,ZHAO J,DU X.Barcoded pyrosequencing analysis of the bacterial community of Daqu for light-flavour Chinese liquor[J].Lett Appl Microbiol,2014,58(6):549-555.
[5]LI P,LIN W F,LIU X,et al.Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J].Front Microbiol,2016,7:1237.
[6]李斌,闫志鹏,李慧星,等.基于高通量测序技术的浓香型和芝麻香型白酒酒曲细菌群落结构分析[J].中国酿造,2018,37(8):148-152.
[7]谭崇尧,徐军.高通量测序法对不同地域浓香型大曲微生物结构的分析[J].酿酒科技,2018(9):118-122.
[8]HU Y N,HUANG X N,YANG B,et al.Contrasting the microbial community and metabolic profile of three types of light-flavor Daqu[J].Food Biosci,2021,44(PA):101395.
[9] CAI W C,WANG Y R,NI H,et al.Diversity of microbiota,microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(PA):110734.
[10]陈宗校,林琳,韩莹,等.基于风味物质组成的高温功能大曲应用方法[J].中国酿造,2017,36(1):98-101.
[11]王福荣.酿酒分析与检测(第二版)[M].北京:化学工业出版社,2012:10-18.
[12]王雪山,杜海,徐岩.清香型白酒发酵过程中微生物种群空间分布[J].食品与发酵工业,2018,44(9):1-8.
[13]陈蒙恩,韩素,侯建光,等.陶融型大曲培养贮存过程生化指标变化规律及相关性研究[J].食品与发酵工业,2020,46(13):146-151.
[14]王晓丹,班世栋,胥思霞,等.浓香型大曲中酶系与白酒品质的关系研究[J].中国酿造,2014,33(1):44-47.
[15] XIAO C,LU Z M,ZHANG X J,et al.Bio-heat is a key environmental driver shaping microbial community of medium-temperature Daqu[J].Appl Environ Microbiol,2017,83(23):e01550-17.
[16]陈青柳.绍兴机械化黄酒风味形成途径和功能微生物的研究[D].无锡:江南大学,2018.
[17]袁再顺.“破堆移位”对酱香型白酒冬季堆积发酵的影响研究[D].贵阳:贵州大学,2019.
[18]肖蓓.酱香大曲中细菌类群关系研究与功能细菌筛选[D].贵阳:贵州大学,2015.
[19]SUN H Y,WANG L,LIU J W,et al.Improved production of raw starch degrading enzyme by Aspergillus oryzae F-30 using methyl glucoside sesqui-stearate[J].Appl Biochem Biotech,2009,159(1):78-84.
[20] WANG P,WU Q,JIANG X J,et al. Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250:59-67.
[21]梁晨,杜海,徐岩.大曲贮存过程中原核微生物群落结构及风味成分演替规律[J].微生物学通报,2017,44(2):384-393.
[22]王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.
[23] XU D,HU Y,WU F F,et al.Comparison of the functionality of exopolysaccharides produced by sourdough lactic acid bacteria in bread and steamed bread[J].J Agr Food Chem,2020,68(33):8907-8914.
[24]WINKELSTROTER L K,GOMES B C,THOMAZ M R S,et al.Lactobacillus sakei 1 and its bacteriocin influence adhesion of Listeria monocytogenes on stainless steel surface[J].Food Control,2011,22(8):1404-1407.
[25]李巧玉,方芳,堵国成,等.魏斯氏菌在发酵食品中的应用[J].食品与发酵工业,2017,43(10):241-247.
[26]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities:a metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[27]侯小歌,王俊英,李学思,等.浓香型白酒糟醅及窖泥产香功能菌的研究进展[J].微生物学通报,2013,40(7):1257-1265.
[28]夏玙,罗惠波,周平,等.不同处理方式的大曲真菌群落差异分析[J].食品科学,2018,39(22):166-172.
[29]向港兴,陈莹琪,沈毅,等.不同等级浓香型大曲的微生物群落结构与理化性质的比较分析[J/OL].食品科学:1-11[2022-06-17].http://kns.cnki.net/kcms/detail/11.2206.TS.20220107.1531.004.html.