酵素是指以一种或多种原料经过发酵而得到的具有某种生理功能的产品[1-2],常见的水果、蔬菜均可作为酵素发酵的原料。目前市场上大量的酵素食品被开发,如桑葚酵素、蔓越莓酵素、水果酵素、蔬菜酵素等[3-4],在民众关注此类产品各种功效时,也应关注此类产品的质量安全。据报道,桑葚、蔓越莓等易感染螨虫的农产品中被检测出有敌螨普残留,此外多种蔬菜中也存在敌螨普残留的风险[5-7]。敌螨普是一种允许在蔬菜、水果生长过程中使用的杀菌杀螨剂[8-9],但是具有一定的发育毒性,可致胎儿畸形,特别是近年来,滥用农药引发的植物源性食品质量安全事故引起消费者越来越多的关注[10]。在国标GB 2763—2021《食品安全国家标准食品中农药最大残留限量》中仅规定敌螨普在部分蔬菜、水果中有最大残留限量,但是缺少相对应的国标检测方法。针对以一种或者多种水果、蔬菜为主要原料制成的各类酵素产品,对敌螨普等相关农药残留的风险评估也很难开展[11-12],因此有必要开发一种快速、实用的检测其中敌螨普残留的方法。
目前,对于食品中敌螨普检测方法主要气相色谱法和液相色谱串联质谱法[13-15]。气相色谱法虽然稳定性较好,但是产品中含有发酵产生的酚类、有机酸等组分,高温气化后易对待测组分产生干扰,造成定量不准确;液相色谱串联质谱法灵敏度高、目标物的选择性较好,但是对仪器和人员有较高要求,检测成本较高。加压毛细管电色谱(pressurized capillary electrochromatography,pCEC)技术是一种结合毛细管电泳的高柱效性和高效液相色谱的高选择性两者优点的新型电动微分离技术[16-17],此方法的双重分离机理适用于复杂样品基质中目标物的分离检测。本试验通过优化加压毛细管电色谱的各项检测条件以及前处理过程,建立了一种快速、简便的pCEC法分析酵素中敌螨普含量,为快速检测酵素中敌螨普残留量提供技术参考。
1 材料与方法
1.1 材料与试剂
敌螨普(纯度98.5%):上海安谱实验科技股份有限公司;甲醇、乙腈(均为色谱纯):德国Merck公司;磷酸钾(分析纯):国药化学试剂有限公司。
1.2 仪器与设备
2100型加压毛细管电色谱系统:美国赛默飞公司;RV10旋转蒸发仪:德国IKA公司;亲水亲油平衡(hydrophilelipophile balance,HLB)小柱、石墨化炭黑(graphitized carbon black,GCB)小柱和多壁碳纳米管(multi walled carbon nanotubes,MWCNTS)小柱(3 mg):美国Waters公司。
1.3 实验方法
1.3.1 仪器条件
色谱柱为C18毛细管填充柱(100 μm×45 cm,3 μm);流速1.0 mL/min;进样量10 μL;柱温30 ℃;检测波长260 nm。
1.3.2 流动相体系的优化
流动相中有机相的种类、有机相的比例、盐溶液的浓度以及pH值等因素都会影响到目标物在加压毛细管电色谱中的分离效果[18-20]。本实验对流动相体系中不同的因素有机相的种类(甲醇、乙腈)、有机相的比例(10%、15%、20%)、磷酸钾缓冲盐溶液的浓度(10 mmol/L、15 mmol/L、20 mmol/L)及pH值(4.0、4.7、6.0、7.0)进行比较,分别考察以上不同因素对敌螨普保留时间和分离度的影响。
1.3.3 电压强度的选择
加压毛细管电色谱中施加电压强度的不同会直接改变电渗流作用力的大小及方向,导致目标物在加压毛细管电色谱中不同的分离效果。本实验分别施加-6 kV、-4 kV、-2 kV、0、+2 kV、+4 kV负向或正向电压,分别比较在以上不同电压下敌螨普在加压毛细管电色谱中的分离能力和分离速度。
1.3.4 前处理方式的选择
酵素基质中干扰物较多,为了提高检测的灵敏度和准确度,分别对试验中提取液的种类、固相萃取柱类型进行选择优化[21-23]。其中提取液分别比较了20%乙腈水溶液、20%乙醇水溶液、20%乙腈水溶液(含0.1%甲酸)、20%乙腈水溶液(含0.1%氨水)和0.1%氨水溶液,考察对样品中除杂质效果以及目标化合物回收率的影响;固相萃取选择保留机理不同的3种固相萃取柱HLB柱、GCB柱和MWCNTS柱,考察对提取液中去除干扰物和富集目标组分的影响。
试验具体步骤为称取2.0 g样品至25 mL刻度具塞管中,加入提取液定容至刻度线后超声20 min,过滤后取上清液进行固相萃取。3款固相萃取柱HLB柱、GCB柱和MWCNTS柱依据各自的固相萃取步骤进行后,收集滤液过0.22 μm滤膜后上机测定。
1.3.5 方法学验证
称取适量敌螨普标准品,用乙腈溶解配制成100.0μg/mL的储备液,临用前以流动相配制成质量浓度分别为1.0ng/mL、5.0 ng/mL、10.0 ng/mL、50.0 ng/mL、100.0 ng/mL、200.0 ng/mL的标准工作液,绘制标准曲线,其中检出限(limit of detection,LOD)以信噪比(S/N)=3计算,定量限(limit of quantitation,LOQ)以信噪比(S/N)=10计算,并对方法的加标回收率、精密度、稳定性及重复性进行验证。
2 结果与分析
2.1 流动相体系的优化
2.1.1 有机相种类的选择
由图1可知,流动相中有机相的不同主要是影响到敌螨普的出峰时间及色谱峰的峰形。当有机相为甲醇时,样品中的干扰物会对敌螨普的色谱峰存在一定的干扰,且出峰时间较长;而有机相为乙腈时,敌螨普的色谱峰分离度较好,出峰时间也合适,因此选择乙腈作为流动相体系的有机相。
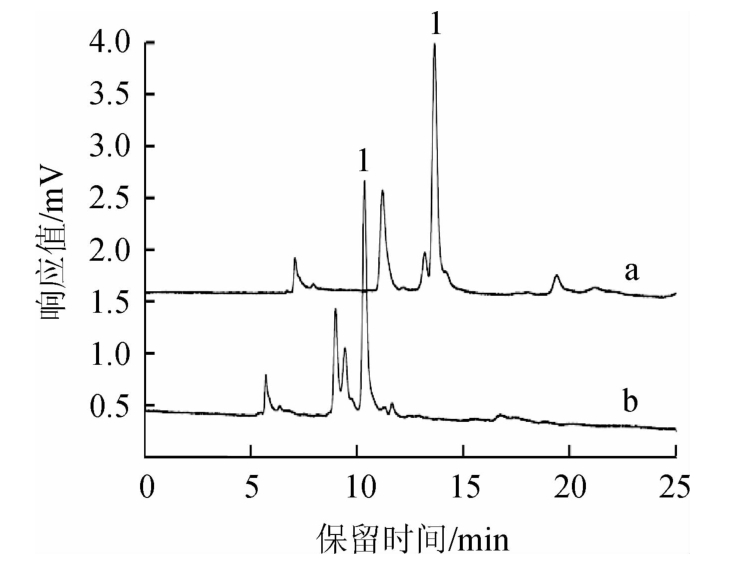
图1 甲醇和乙腈对敌螨普分离效果的影响
Fig.1 Effect of methanol and acetonitrile on separation of dipteroparasin
a为甲醇,b为乙腈;1.敌螨普。下同。
2.1.2 乙腈比例的选择
流动相体系中乙腈比例会影响流动相体系的极性,从而影响目标组分的色谱保留行为[24-26]。实验通过比较流动相中乙腈的不同比例(10%、15%、20%),考察其对敌螨普分离效果的影响,结果见图2。
由图2可知,当流动相中乙腈比例为10%时,流动相体系的极性相对较大,敌螨普的出峰时间较晚,且与样品中的杂质分离度较差;而在乙腈比例为20%时,流动相体系的洗脱能力较强,敌螨普出峰时间提前,但与杂质峰不能完全分离;样品中的敌螨普组分在流动相中乙腈比例为15%时,分离度最好,能与杂质峰分开,不受干扰。所以选择15%的乙腈作为流动相中的有机相比例。
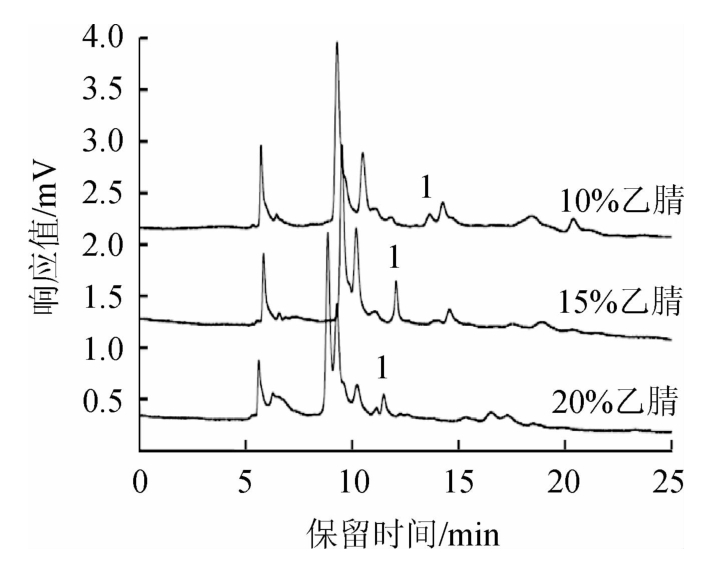
图2 不同乙腈比例对敌螨普分离效果的影响
Fig.2 Effect of different acetonitrile ratio on separation of dipteroparasin
2.1.3 磷酸钾缓冲液浓度选择
在乙腈-磷酸钾缓冲液(15∶85,V/V)的流动相体系中,考察了磷酸钾缓冲液浓度(10 mmol/L、15 mmol/L、20 mmol/L)对敌螨普分离效果的影响,结果见图3。
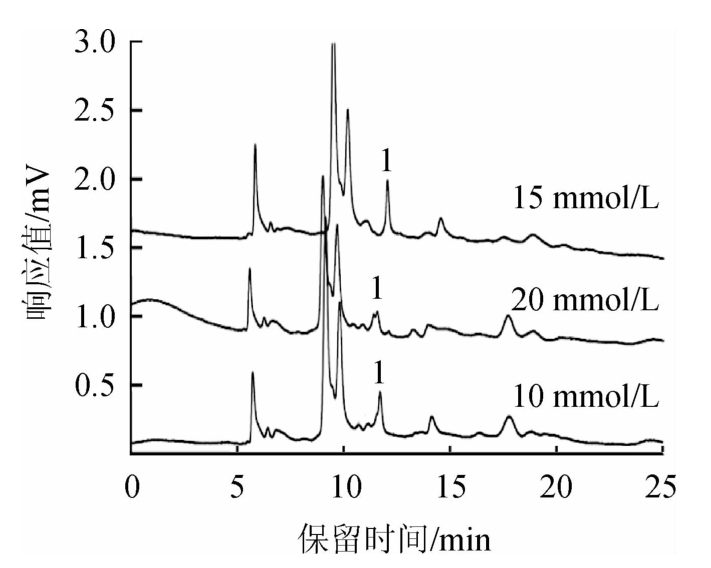
图3 缓冲液浓度对敌螨普分离效果的影响
Fig.3 Effect of buffer concentration on separation of dipteroparasin
由图3可知,当磷酸钾缓冲液浓度为20 mmol/L时,样品中敌螨普目标峰与相邻杂质峰重叠,这是由于电泳中高焦耳热的影响,样品中敌螨普目标峰增宽严重,柱效下降。当磷酸钾缓冲液浓度为10 mmol/L或者15 mmol/L时,敌螨普目标峰都能与相邻杂质峰分开,但后者的分离度更好一些,所以选择15 mmol/L磷酸钾溶液作为流动相缓冲液。
2.1.4 磷酸钾缓冲液pH值的选择
在确定流动相条件下,分别考察不同pH值的磷酸钾缓冲液pH(pH4.0、pH 4.7、pH 6.0、pH 7.0)对敌螨普分离效果的影响,结果见图4。
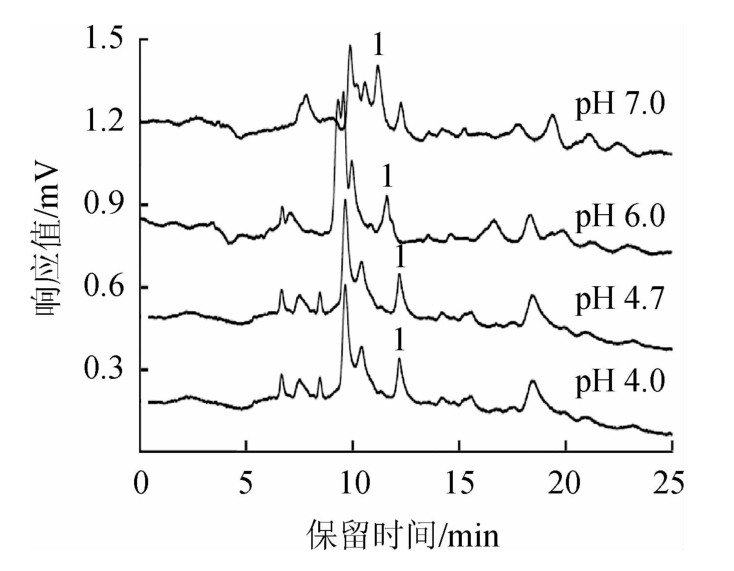
图4 缓冲液pH值对敌螨普分离效果的影响
Fig.4 Effect of buffer pH on separation of dipteroparasin
由图4可知,磷酸钾缓冲液的pH值主要是对敌螨普与干扰物的分离度影响较显著。当缓冲溶液pH值为7.0或者6.0时,敌螨普与相邻干扰物的杂质峰分离度较低,影响定量的准确性;而在缓冲溶液pH值为4.0和4.7时,样品的电泳谱图中敌螨普的目标峰分离较好,出峰时间适宜,并且缓冲溶液直接配制后的pH值即为4.7,无需进一步调节,节省试验时间,所以选择4.7作为磷酸钾缓冲溶液pH值。
2.2 分离电压的选择
在采用乙腈-15 mmol/L pH 4.7磷酸钾缓冲液(15∶85,V/V)为流动相,分别施加+4 kV、+2 kV、0的正向电压和-2 kV、-4 kV、-6 kV的负向电压,考察分离电压对敌螨普分离效果的影响。
由图5a~图5c可知,分别施加-6 kV、-4 kV、-2 kV负向电压时,对样品中敌螨普的出峰时间影响较小。这是因为在毛细管电泳出口端施加负向电压时,电渗流方向朝向毛细管入口端,与系统中压力流方向相反,电渗流作用力与压力流以及电场力相互作用,使得敌螨普的电泳表观淌度减小,表现为目标组分出峰时间变化不大。0电压情况下,敌螨普与杂质峰重叠(图5d)。
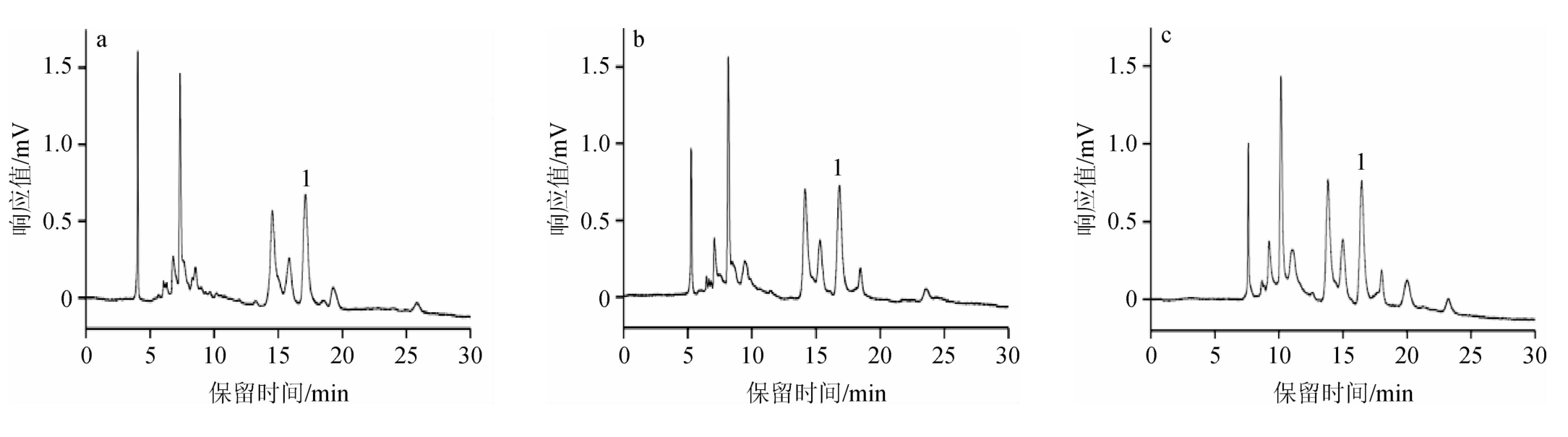
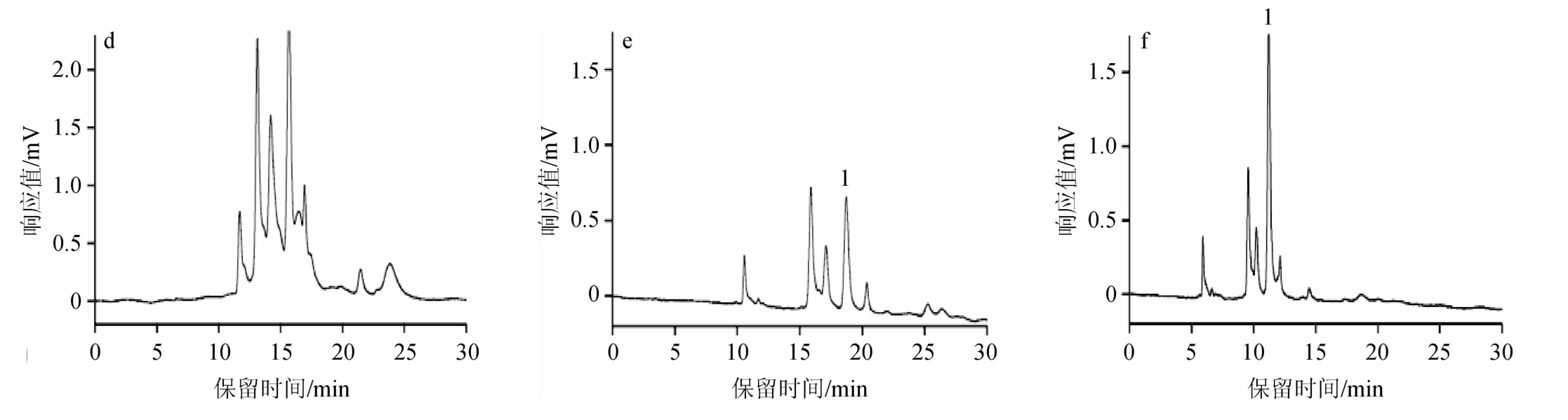
图5 分离电压对样品中敌螨普分离效果的影响
Fig.5 Effect of separation voltage on separation of dipteroparasin
a~f分离电压分别为-6 kV、-4 kV、-2 kV、0、+2 kV、+4 kV。
由图5e和5f可知,施加正向电压时,在电渗流作用力的推动下敌螨普的分离速度明显加快,同时色谱峰形变窄。施加电压为+2 kV时,敌螨普的出峰时间为18 min左右,并且与杂质峰完全分离;当施加电压为+4 kV时,敌螨普的出峰时间变短,但分离度有所降低。综合考虑出峰时间、分离度以及灵敏度,选择+2 kV作为较优的施加电压。
2.3 标准曲线的制作
依据上述实验条件,敌螨普在1.0~200.0 ng/mL质量浓度范围呈线性。实验结果表明,敌螨普在相应的浓度范围内具有良好的线性关系,具体结果见表1。
表1 敌螨普的保留时间、标准曲线回归方程、相关系数、检出限与定量限
Table 1 Retention time,standard curve regression equation,correlation coefficient,detection limit and quantification limit of dipteroparasin

2.4 样品前处理方法的优化
2.4.1 提取溶剂的选择
选用添加目标组分敌螨普的酵素为实验对象,考察不同提取液对目标物组分峰面积及电色谱图的影响,结果见图6。
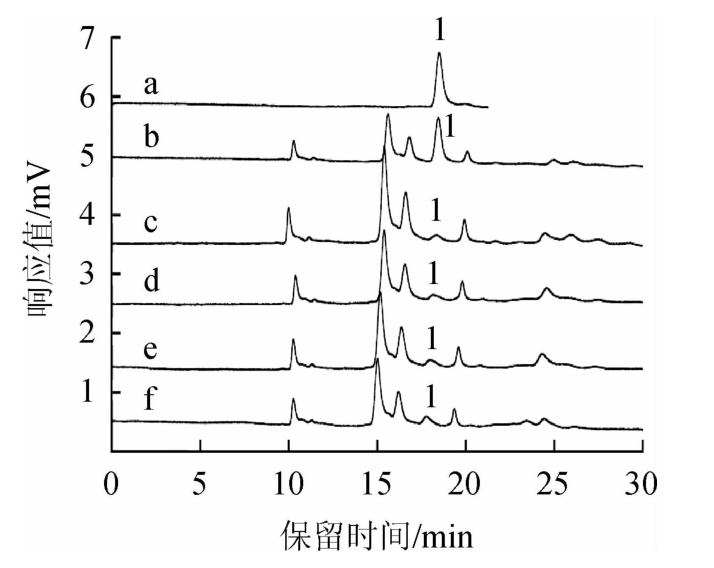
图6 不同提取溶剂提取后样品的pCEC谱图
Fig.6 pCEC chromatograms of samples after extraction with different extraction solvents
a为敌螨普标准品,b为20%乙腈水溶液,c为20%乙腈水溶液(含0.1%甲酸),d为20%乙腈水溶液(含0.1%氨水),e为20%乙醇水溶液,f为0.1%氨水溶液。
由图6可知,5种提取溶剂体现在样品峰面积上是20%乙腈水溶液的效果最好,其他提取方式的图谱上的目标峰面积较小或者有杂质峰干扰,且20%乙腈水溶液方便易得,提取时不易发生乳化现象,因此本研究选择20%乙腈水溶液进行提取。
2.4.2 固相萃取柱的选择
考虑提取液中还会含有小分子酸、酚类、糖类等杂质成分对目标组分产生干扰,前处理一般会选择固相萃取(solid phase extraction,SPE)法和分散固相萃取(quick-easycheap-effective-rugged-safe,QuEChERS)法进行净化。但是针对敌螨普农药残留采用QuEChERS方法时,需要对其中GCB、C18和乙二胺-N-丙基硅烷(primary secondary amine,PSA)三者的配比进行综合考察优化,由于实际样品基质复杂多变,单一配比无法应对所有类型样品,具有一定局限性。本研究采用更为通用的固相萃取法进行实验,分别比较了HLB柱、GCB柱和MWCNTS柱的净化效果,以敌螨普的加标回收率为比较依据,分析这3种固相萃取柱对目标组分净化效果的影响,结果见图7。
图7 提取液经不同固相萃取小柱处理后回收率的比较
Fig.7 Comparison of recovery rates of extracting solution treated with different solid phase extraction columns
组间不同小写字母表示差异显著(P<0.05)。
由图7可知,采用HLB小柱效果较好,敌螨普的加标回收率最高,且与MWCNTS柱和GCB柱间敌螨普组分的峰面积差异显著(P<0.05)。这是由于MWCNTS柱和GCB柱的特异选择性强,敌螨普不能很好地保留在小柱上;而HLB固相萃取小柱适用范围广,适合大多数化合物的分离,能将敌螨普非常好地保留住,所以使用HLB小柱回收效果最好。本试验采用了新型PRiME HLB固相萃取柱,采用的是样品提取液通过型净化方式,相比以前富集型HLB小柱节省了时间,提高了试验效率,故选择PRiME HLB固相萃取小柱作为前处理的净化柱。
2.5 加标回收率及精密度试验
在加标回收率试验中,选用桑葚酵素、苹果酵素、水果酵素、蔬菜酵素4种酵素样品中添加敌螨普,分别添加3.0μg/kg、10.0 μg/kg、30.0 μg/kg三个水平的标准溶液,每个水平测定5次,计算加标回收率以及精密度试验结果相对标准偏差(relative standard deviation,RSD),结果见表2。
表2 方法的加标回收率及精密度试验结果(n=5)
Table 2 Results of standard recovery and precision tests of the method (n=5)
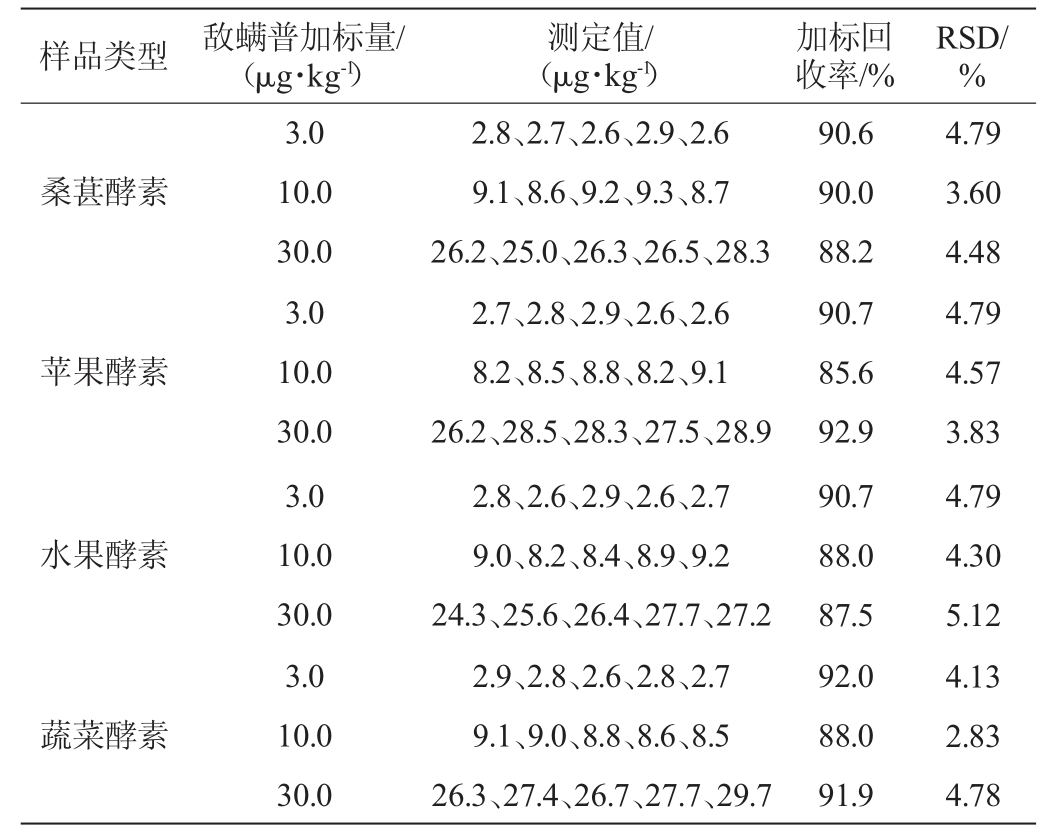
由表2可见,敌螨普的3个水平的加标回收率为85.6%~92.9%,重复测定5次的RSD为2.83%~5.12%,表明本实验所建立的方法能够满足检测实际样品需要。
2.6 重复性与稳定性试验
在上述优化后的方法条件下,对敌螨普标准溶液(20.0 ng/mL)进行加压毛细管电色谱法检测分析,连续测定7 d,每天进样5次,测定敌螨普组分保留时间和峰面积的日间和日内相对标准偏差(relative standard deviation,RSD)。结果显示,敌螨普保留时间的日间和日内RSD范围分别为3.2%~6.3%和3.6%~4.7%;峰面积的日间和日内RSD范围分别为3.8%~6.3%和3.5%~4.6%,说明该方法的稳定性和重复性均良好。
2.7 样品的测定
在上述优化条件下,随机抽取了市售10批次的酵素样品,包含桑葚酵素、苹果酵素、草莓酵素、玫瑰花酵素、蔓越莓酵素、水果酵素、蔬菜酵素等,发现两个批次中有检出,分别为0.06 mg/kg和0.12 mg/kg,其他批次未检出,参照草莓中限量值为0.5 mg/kg,整体情况良好。
3 结论
本研究建立了一种加压毛细管电色谱法测定酵素中敌螨普残留量的方法。该方法前处理以20%乙腈水溶液作为提取溶剂,结合PRiME HLB小柱净化,简化了样品前处理过程,提高了效率。以乙腈-15 mmol/L pH 4.7磷酸钾缓冲液(15∶85,V/V)为流动相,在电压强度+2 kV条件下酵素中的敌螨普能得到良好基线分离,其峰型良好,出峰时间合适。该方法与同类研究方法相比,提高了目标物的检测灵敏度,降低了检测成本,为检测酵素中敌螨普残留量提供一种新的参考方法。
[1]白浩,文佳嘉,费爽雯,等.酵素的功能与综合应用研究进展[J].食品工业,2017,38(6):270-272.
[2]韩齐,赵金敏,高小琴,等.功能性酵素发展研究现状[J].食品工业科技,2019,40(1):337-340.
[3]李希羽,高洁,李云姣,等.水果酵素自然发酵过程中优势菌群与有机酸变化规律分析[J].食品科学,2020,41(24):61-68.
[4]许艳,张汆,陈志宏,等.果桑的研究与加工利用[J].食品研究与开发,2017,38(16):209-213.
[5]杨益军,张波.2020年全球(中国)农药市场状况分析及预测[J].世界农药,2020,42(3):20-30.
[6]马立红.蔬菜中农药残留问题的现状和对策[J].江西农业,2019(14):35-37.
[7]FRANKE A A,LI X N,LAI J F.Analysis of glyphosate,aminomethylphosphonic acid,and glufosinate from human urine by HRAM LC-MS[J].Anal Bioanal Chem,2020,412:8313-8324.
[8]FRANKE A A,LI X N,SHVETSOV Y B,et al.Pilot study on the urinary excretion of the glyphosate metabolite aminomethylphosphonic acid and breast cancer risk:The multiethnic cohort study[J].Environ Pollut,2021,277(2):116-122.
[9]杜月梅,高丽萍,邵华.国内外敌螨普及硝苯菌酯残留检测方法的研究进展[J].北京联合大学学报,2020,34(4):79-84.
[10]黄浩瀚,齐峰,朱有刚.食品安全中农药残留现状及治理措施[J].食品安全导刊,2021,9(2):26-27.
[11]刘娟,刘雪.我国果蔬农药残留现状研究的文献综述[J].现代经济信息,2019,53(16):328-334.
[12]倪佳.农产品中农药残留检测技术研究进展及发展趋势[J].农业与技术,2020,40(2):49-52.
[13]景赞,刘超,刘晓碧.固相萃取-三重四级杆气质联用法测定油桃中硝苯菌酯[J].中国果菜,2019,39(9):28-32.
[14]孔光辉,师君丽,李勇.QuEChERS-UHPLC-MS/MS法测定烟草中硝苯菌酯[J].分析试验室,2018,37(9):1062-1065.
[15]张燕,舒平,陆敏,等.分散固相萃取/衍生化-高效液相色谱-串联质谱法同时测定水和食品中草甘膦、草铵膦和氨甲基膦酸残留[J].食品安全质量检测学报,2017,8(4):1422-1428.
[16]MASIOL M,GIANNÌ B,PRETE M.Herbicides in river water across the northeastern Italy: occurrence and spatial patterns of glyphosate,aminomethylphosphonic acid,and glufosinate ammonium[J]. Environ Sci Pollut Res,2018,25(24):24368-24378.
[17]THOMAS T S,HEEVER J P,LIMANOWKA R E.Determination of glyphosate,AMPA,and glufosinate in honey by online solid-phase extraction-liquid chromatography-tandem mass spectrometry[J].Food Addit Contam A,2019,36(3):434-446.
[18]LEE J S,KIM W,YANG H,et al.Analysis of glyphosate and glufosinate in animal feeds using LC-MS/MS[J].J Korean Chem Soc,2019,63(5):1-5.
[19]YANG L,JEAN MB,ISABELLE C,et al.Validation and application of analytical method for glyphosate and glufosinate in foods by liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2018,1549:31-38.
[20]DEMONTE L D,MICHLIG N,GAGGIOTTI M.Determination of glyphosate,AMPA and glufosinate in dairy farm water from Argentinausing a simplified UHPLC-MS/MS method[J].Sci Total Environ,2018,645:34-43.
[21]张婧雯,张海超,王敬.通过型固相萃取-液相色谱-高分辨质谱法快速测定粮谷中17种酰胺类农药残留量[J].分析试验室,2020,39(2):154-160.
[22]孙能惠.固相萃取及液质联用在茶叶农药残留检测中的应用[J].现代食品,2016(1):57-58.
[23]孙文闪,周婷婷,章虎,等.固相萃取净化液质联用测定茶叶中的草铵膦[J].食品工业,2020,41(7):286-290.
[24]SONG Z,LUO H Y,LIU T,et al.Determination of glyphosate in ground water by high performance liquid chromatography combined with precolumn derivatization[J].Res Environ Eng,2020,34(2):159-163.
[25]JIA G F,XU J,LONG X F,et al.Enantioselective degradation and chiral stability of glufosinate in soil and water samples and formation of 3-methylphosphinicopropionic acid and N-acetyl-glufosinate metabolites[J].J Agr Food Chem,2019,67:11312-11321.
[26]OULKAR D P,HINGMIRE S,GOON A,et al.Optimization and validation of a residue analysis method for glyphosate,glufosinate,and their metabolites in plant matrixes by liquid chromatography with tandem mass spectrometry[J]. J AOAC Int,2017,100(3):631-639.