菜籽粕是油菜籽提取菜籽油后得到的一种副产品,我国自20世纪80年代开始,每年产生超过600万t的菜籽粕,其粗蛋白含量约为35%~45%,且氨基酸较为平衡,是一种物美价廉的植物蛋白资源[1-3]。豆粕是经过大豆提取豆油后得到的一种副产品,其产量巨大、营养丰富,目前仍是动物饲料的主要原料,但近年来对豆粕需求的不断增加导致市场供应需求紧张,为缓解供应紧张、降低成本,已将菜籽粕用于畜牧行业中以减少或替代豆粕使用[4]。与豆粕相比,菜籽粕的维生素B1(vitamin B1,VB1)、VB2、胆碱、烟酸、生物素和钙、磷、硒等矿物质元素含量较高,特别是无机磷[5]。但菜籽粕中含有大量的抗营养因子,如硫苷(glucosinolates,GLS)、芥子碱和单宁等。硫苷会在芥子酶的作用下水解生成嗯唑烷硫酮、异硫氰酸酯、腈等有毒物质,长期摄入会造成动物的肾脏、肝脏等内脏器官的损害和肿大[6]。因此,要想提高菜籽粕的蛋白利用率就必须消除其主要的抗营养因子。微生物发酵技术能有效去除多种饼粕中的抗营养因子[7],从而达到降解和排毒的目的。此外,微生物发酵还能够生成大量的菌体蛋白和一些促进动物肠道内有益菌群生长的活性物质[8]。如司马博锋等[9]以棉粕、菜籽粕和豆粕为原料,发酵制备的发酵蛋白,将粗蛋白含量提高了9%,氨基酸含量提高了11.6%,同时抗营养因子游离棉酚降解了45.4%,异硫氰酸酯降解了27.8%。
发酵、酶解两步法充分利用了微生物在发酵过程中产生酶,无需使用外源酶制剂,生物资源的利用达到最大化,可有效改善低质原料蛋白质品质,降解原料中的抗营养因子,完善氨基酸组成,降低生产成本,改善原料的适口性,提高动物的采食率。相比传统固态发酵,固态发酵、酶解两步法大幅缩短了处理时间,减少了对固态发酵条件的控制依赖,使得终产物得率不仅仅依赖于发酵过程,增大了固态发酵的应用范围。因此,本试验利用米曲霉(Aspergillus oryzae)发酵粮油提取副产物—菜籽粕与豆粕两种蛋白原料,充分利用植物资源,以期为食品行业增加产品附加值的同时,为饲料行业提供一种成本低、动物适口性佳、营养组成合理的新型蛋白原料。
1 材料与方法
1.1 材料与试剂
米曲霉(Aspergillus oryzae)M1:本实验室保藏。
菜籽粕、豆粕、麸皮、玉米蛋白粉:乐山恒峰华邦科技有限公司。
麸皮种子培养基:麸皮∶水=2∶1(W/W)。
葡萄糖、蔗糖、硫酸钾、硫酸镁、吐温-80、乙酸钠、氯化钯、羧甲基纤维素钠、三氯乙酸(trichloroacetic acid,TCA)、氢氧化钠、硼酸、硫酸铜(均为分析纯)、酵母浸粉、牛肉膏(均为生化试剂):成都科龙化工试剂厂;黑芥子硫苷酸钾(分析纯):上海源叶生物有限公司。
1.2 仪器与设备
MF80BSH-2霉菌培养箱:上海新苗医疗器械制造有限公司;QYC-2102C恒温培养摇床:上海福马实验设备有限公司;LS-75HD立式高压蒸汽灭菌锅:江阴滨江医疗设备有限公司;T-114分析天平:北京赛多利斯仪器系统有限公司;T6紫外-可见分光光度计:北京普析通用仪器有限公司;AT-710电位自动滴定计:日本京都电子制造有限公司;SH220F石墨消解仪、K9840自动凯氏定氮仪:海能未来技术集团股份有限公司。
1.3 方法
1.3.1 米曲霉麸皮种子制备
使用接种环勾取2~3环本实验室保藏的米曲霉菌种,接种于装有25 g麸皮种子培养基的500 mL锥形瓶,30 ℃恒温培养72 h。
1.3.2 发酵蛋白原料组成优化
将发酵蛋白原料(菜籽粕、豆粕、玉米蛋白粉)以不同组成(60%、30%、10%;60%、40%、0;70%、25%、5%;70%、20%、10%;70%、30%、0;80%、15%、5%;80%、10%、10%;80%、20%、0)混合均匀,吐温-80溶解于1 000 mg/L的过氧乙酸溶液(温度约50 ℃),吐温-80含量为800 mg/L。用上述溶液调节发酵蛋白原料初始含水量为45%,静置灭菌30 min后,取150 g发酵蛋白原料装于2 L锥形瓶中,接种3%米曲霉麸皮种子,摇匀,棉花塞封口,30 ℃发酵48 h。发酵结束,取140 g发酵样品,调节初始含水量为60%,密封,45 ℃酶解24 h,后70 ℃烘干24 h,粉碎后过40目筛网,测定样品蛋白溶解度、酸溶蛋白/粗蛋白及硫苷含量。
1.3.3 固态发酵蛋白培养条件优化
确定发酵蛋白原料组成后,分别对发酵过程中麸皮种子接种量(1%、2%、3%、4%、5%)、发酵时间(24 h、32 h、40 h、48 h、56 h)、发酵原料初始含水量(30%、35%、40%、45%、50%)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)进行优化。固态发酵结束后按1.3.2的条件酶解,测定样品蛋白溶解度、酸溶蛋白/粗蛋白及硫苷含量。
在单因素试验的基础上,选取影响显著的3个主要因素接种量(A)、发酵温度(B)及发酵时间(C),设计3因素3水平正交试验,对固态发酵蛋白培养条件进行优化,正交试验因素与水平见表1。固态发酵结束后按1.3.2的条件酶解,测定样品蛋白溶解度、酸溶蛋白/粗蛋白及硫苷含量。
表1 固态发酵蛋白培养条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for optimization of protein culture conditions by solid-state fermentation

1.3.4 酶解条件优化
对优化培养条件的发酵样品进行酶解条件优化。分别考察酶解时间(20 h、24 h、28 h、32 h、36 h、40 h)、酶解样品初始含水量(45%、48%、50%、52%、54%、56%、58%、60%)、酶解温度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃)对酶解效果的影响,样品于70 ℃烘干24 h,粉碎后过40目筛网,测定样品蛋白溶解度、酸溶蛋白/粗蛋白及硫苷含量。
1.3.5 测定方法
粗蛋白:根据GB/T 6432—2018《饲料中粗蛋白的测定凯氏定氮法》测定[10];蛋白溶解度:根据GB/T 19541—2017《饲料原料豆粕》氢氧化钾蛋白溶解度的测定[11];酸溶蛋白:采用参考文献[12]的三氯乙酸沉淀法测定;硫苷(GLS)测定:采用参考文献[13]的氯化钯比色法测定。氨基酸测定:采用GB 5009.124—2016《食品中氨基酸的测定》测定[14]。
1.3.6 数据处理
使用Microsoft Excel 2016数据整理,使用SPSS 23对数据进行分析,多组数据使用单因素方差分析(analysis of variance,ANOVA),以Duncan检验法进行多重比较,以P<0.05作为差异性显著判断标准,试验结果采用“平均值±标准差”表示,数值标注不同字母表明差异性显著,采用Origin 2018和Microsoft Excel 2016作图。
2 结果与分析
2.1 原料组成对发酵蛋白品质的影响
酸溶蛋白主要由小分子菜籽粕肽和游离氨基酸组成,其中小肽由2~20个氨基酸组成,是酸溶蛋白中的主要成分,分子质量均低于6 000 Da[13],酸溶蛋白含量越高表明其中小肽和游离氨基酸含量也越高[15-16],其中游离氨基酸和部分小肽可被直接吸收利用[17]。如YAMADA Y等[18-19]分别从菜籽粕水解物中分离出具有降压活性的三肽,其氨基酸序列分别为Arg-Ile-Tyr和Gly-His-Ser,均具有较好的降压效果。酸溶蛋白含量可以有效反映蛋白原料质量的高低。油菜籽经过压榨或其他热处理方式分离油脂与菜籽蛋白时,高温会使菜籽蛋白受到不同程度的不可逆转的热变。热反应会使蛋白溶解度下降,原因为高温使蛋白发生解离,疏水基团暴露蛋白结构性展开,疏水性的增加引起蛋白溶解度下降[20]。但蛋白溶解也受到处理方式的变化存在差异,有时高热变性也具有较高的蛋白溶解度[21]。原料组成对发酵蛋白品质的影响见表2。由表2可知,当原料组成为70%菜籽粕+30%豆粕时,其蛋白溶解度为70.26%,显著高于其他组(P<0.05);酸溶蛋白/粗蛋白的比值也较高,硫苷含量较低。因此,确定发酵蛋白原料组成为70%菜籽粕+30%豆粕。
表2 原料组成对发酵蛋白品质的影响
Table 2 Effect of raw material composition on fermented protein quality
注:同列数据标不同字母表示差异显著(P<0.05)。下同。
2.2 固态发酵蛋白培养条件优化
2.2.1 接种量对发酵蛋白品质的影响
由图1可知,随着米曲霉麸皮种子接种量的增加,发酵蛋白的蛋白溶解度、硫苷含量先升高后降低,酸溶蛋白/粗蛋白变化不大。当接种量为3%时,蛋白溶解度最高,酸溶蛋白/粗蛋白较高且差异不显著(P>0.05),硫苷含量较低且差异不显著(P>0.05)。原因可能是适当增加接种量,由于培养基中产酶增加而蛋白溶解度得到有效改善;但当接种量>3%时,原料中溶氧不足,降解大分子蛋白与硫苷的酶合成受到一定影响[22]。因此初步确定最优米曲霉麸皮种子接种量为3%。

图1 接种量对发酵蛋白品质的影响
Fig.1 Effect of inoculum on fermented protein quality
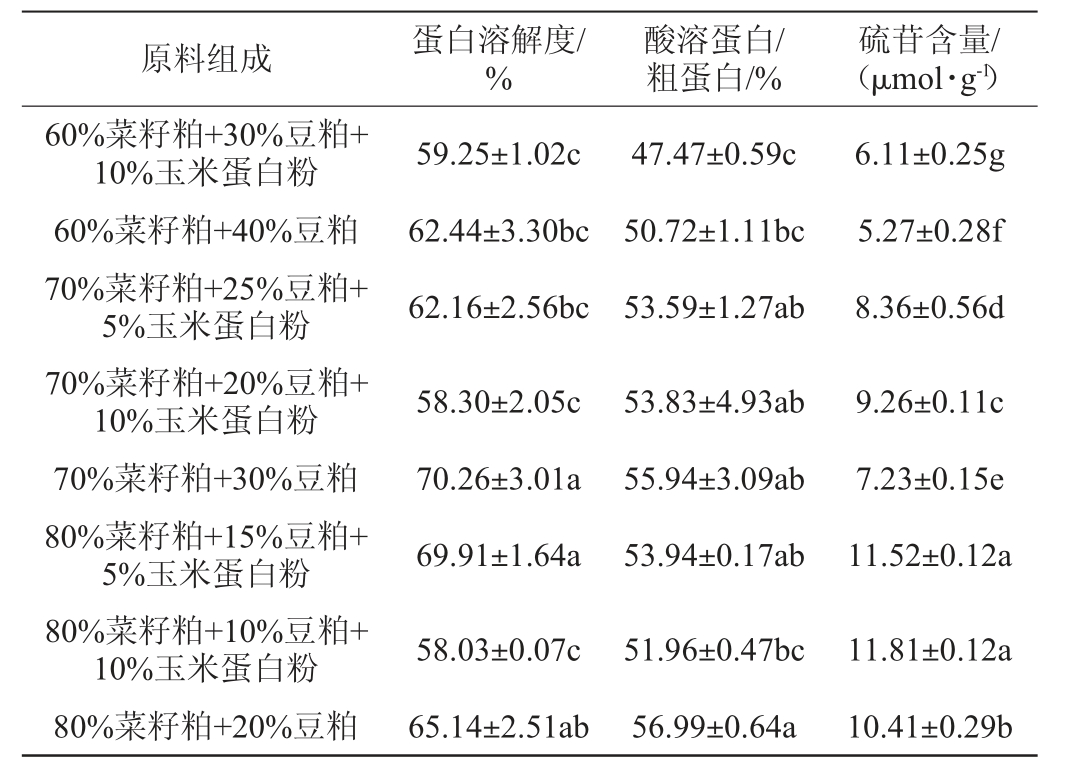
2.2.2 发酵时间对发酵蛋白品质的影响
由图2可知,随发酵时间的延长,发酵蛋白的蛋白溶解度与酸溶蛋白/粗蛋白先升高后降低,硫苷含量升高。在发酵40 h时,蛋白溶解度较高且差异不显著(P>0.05),酸溶蛋白/粗蛋白最高且差异显著(P<0.05),硫苷含量较低且差异不显著(P>0.05)。可能是因为随发酵时间的延长,酶的活性受到影响,从而使酶解阶段的硫苷降解率减少。因此初步确定最优发酵时间为40 h。
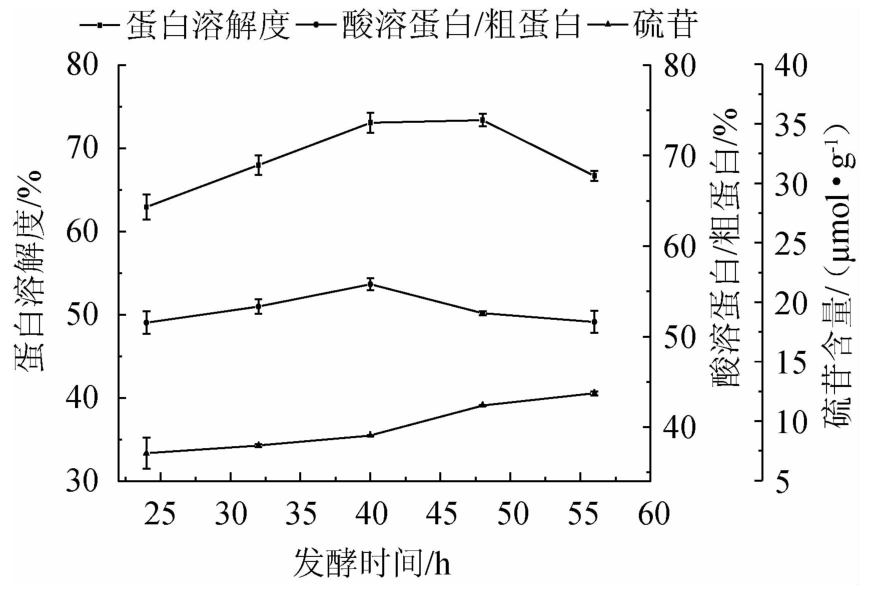
图2 发酵时间对发酵蛋白品质的影响
Fig.2 Effect of fermentation time on fermented protein quality
2.2.3 发酵原料初始含水量对发酵蛋白品质的影响
由图3可知,随着发酵原料初始含水量的增加,蛋白溶解度、酸溶蛋白/粗蛋白呈上升趋势,而硫苷呈现下降趋势;且在水分为45%时,酸溶蛋白/粗蛋白含量最高,为51.83%,但当发酵水分>45%后,蛋白溶解度、酸溶蛋白/粗蛋白开始降低,硫苷升高,且差异显著(P<0.05)。据相关文献报道,米曲霉在曲料上充分生长发育产生酱油发酵所需要的中性及酸性蛋白酶类、氨肽酶、淀粉酶、糖化酶、纤维素酶等[23]。酶产量及活性与微生物生长代谢状况直接相关,水分过高影响培养基中的疏松程度,溶氧量低,会抑制纤维素酶和硫苷水解酶等的产量,从而导致后续酶解阶段对硫苷的降解减弱,而水分过低又会影响麸皮中的活化萌发速度,延迟发酵时间。因此初步确定最优发酵原料初始含水量为45%。
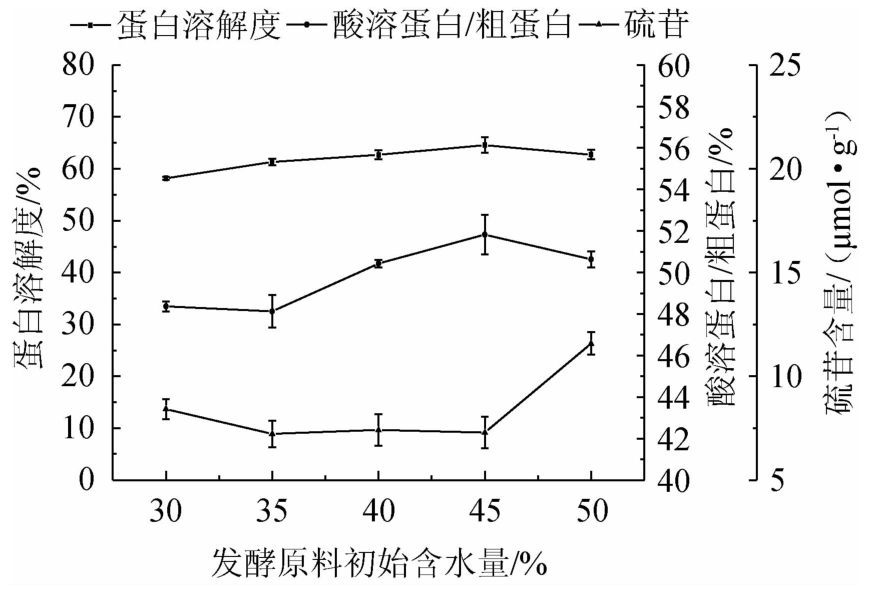
图3 发酵原料初始含水量对发酵蛋白品质的影响
Fig.3 Effect of initial moisture in fermentation raw material on fermented protein quality
2.2.4 发酵温度对发酵蛋白品质的影响
由图4可知,随着发酵温度的升高,发酵蛋白的蛋白溶解度和酸溶蛋白/粗蛋白均先升高后降低,硫苷含量升高。在发酵温度28 ℃时,蛋白溶解度和酸溶蛋白/粗蛋白均达到最高且差异显著(P<0.05),硫苷含量较低且差异不显著(P>0.05)。可能是28 ℃时蛋白酶的产量和酶活力相对较高,硫苷水解酶最适作用温度为40~60 ℃,发酵温度未能达到,主要依靠酶解阶段进行降解。因此初步确定最优发酵温度为28 ℃。
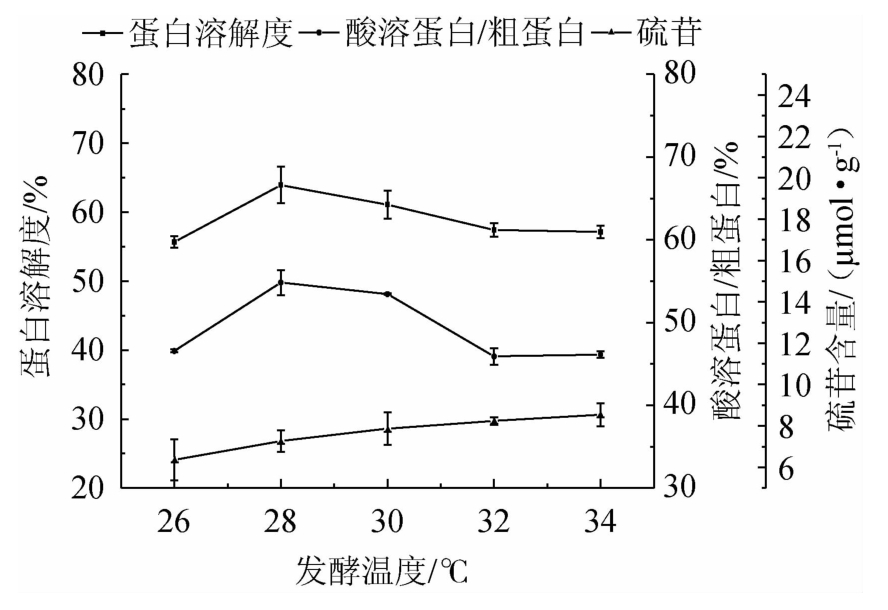
图4 发酵温度对发酵蛋白品质的影响
Fig.4 Effect of fermentation temperature on fermented protein quality
2.2.5 固态发酵蛋白培养条件优化正交试验
由表3可知,3个因素对发酵蛋白蛋白溶解度的影响主次顺序为B>C>A;对酸溶蛋白/粗蛋白的影响主次顺序为C>B>A。以蛋白溶解度、酸溶蛋白/粗蛋白为考察指标时的最优组合均为A2B2C2,即接种量为3%、发酵温度为28 ℃、发酵时间为40 h。在此条件下,发酵蛋白的蛋白溶解度为63.54%,酸溶蛋白/粗蛋白为47.56%,硫苷含量为14.13μmol/g。
表3 固态发酵蛋白培养条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal tests for optimization of protein culture conditions by solid-state fermentation
2.3 酶解条件优化
2.3.1 酶解时间对发酵蛋白品质的影响
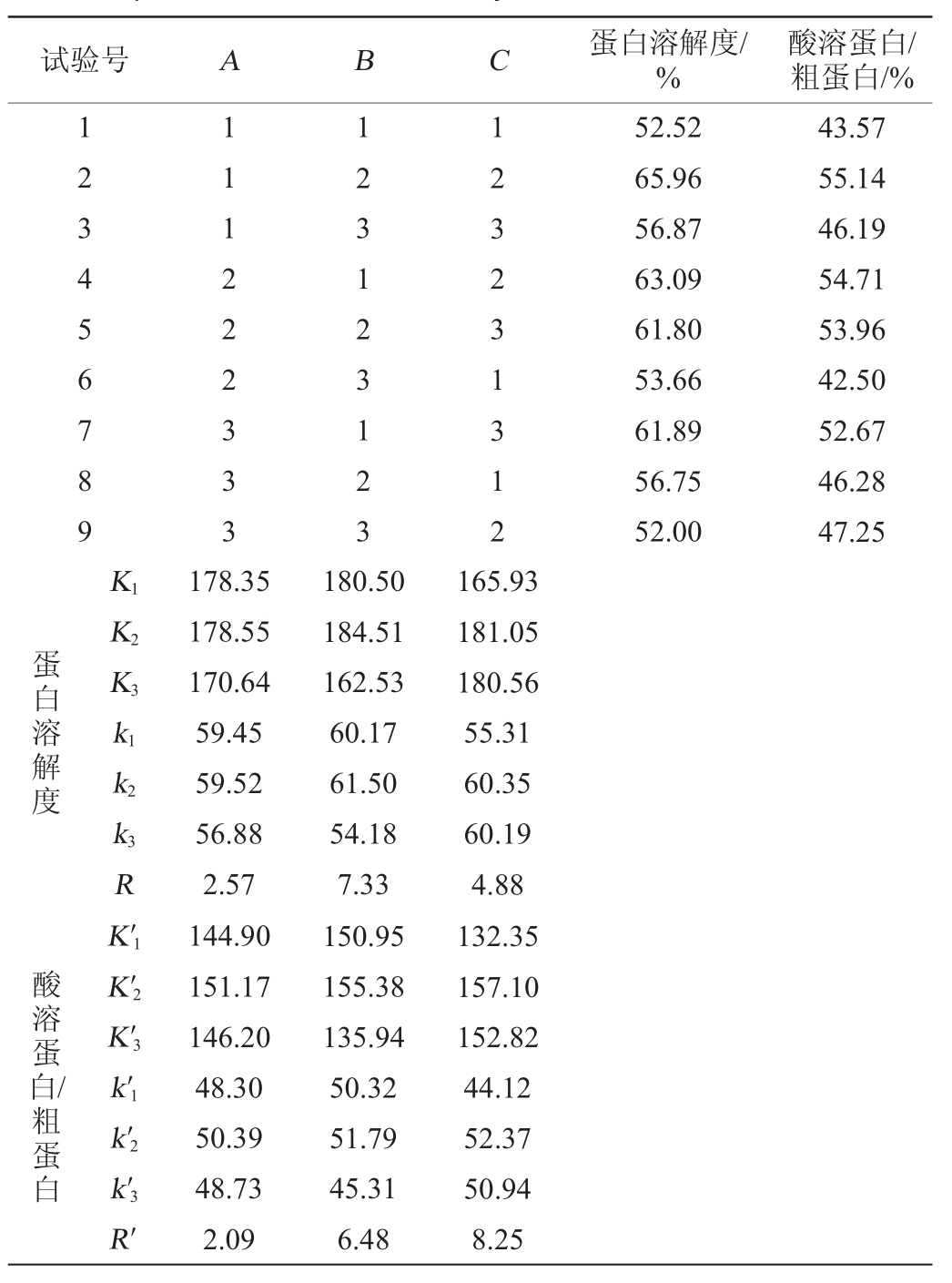
由图5可知,随着酶解时间的延长,蛋白溶解度和酸溶蛋白/粗蛋白有小幅升高,但差异不显著(P>0.05);硫苷含量先升高后降低再缓慢升高。在酶解32 h时,硫苷含量达到最低,可能是固态发酵过程中产生的分解硫苷的酶类有限,当酶解时间超过32 h,酶活性降低,硫苷降解减弱。综合考虑,确定最优酶解时间为32 h。
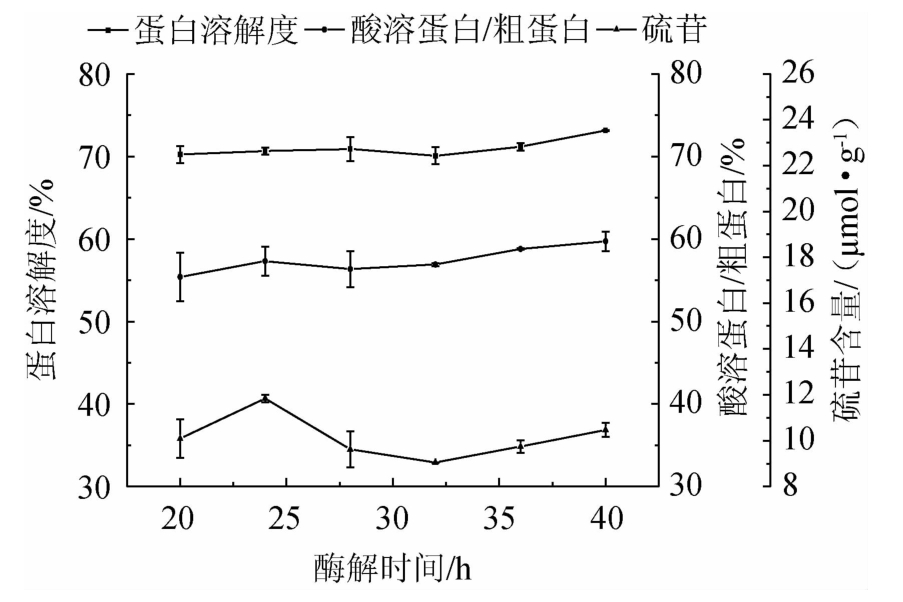
图5 酶解时间对发酵蛋白品质的影响
Fig.5 Effect of enzymolysis time on fermented protein quality
2.3.2 酶解样品初始含水量对发酵蛋白品质的影响
由图6可知,随酶解样品初始含水量的增加,发酵蛋白的蛋白溶解度有小幅度升高后降低,但差异不显著(P>0.05),酸溶蛋白/粗蛋白呈升高趋势且差异显著(P<0.05),硫苷含量先降低后升高,但差异不显著(P>0.05)。在酶解样品初始含水量56%时,酸溶蛋白/粗蛋白达最高。水分含量的高低在影响微生物生长的同时,主要影响酶的作用效果,酶解样品初始含水量超过56%时,蛋白酶的活性和稳定性下降。综合考虑,确定最优酶解样品初始含水量为56%。
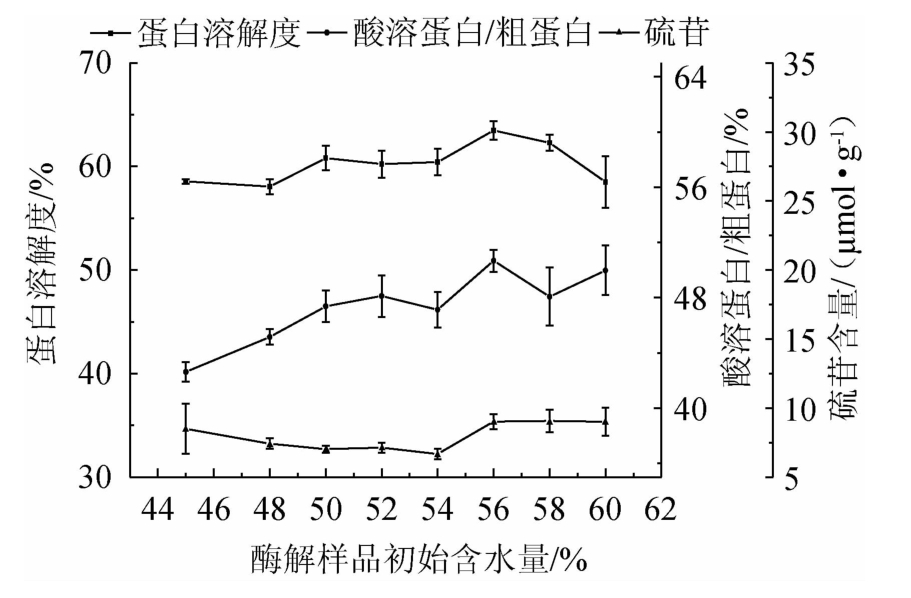
图6 酶解样品初始含水量对发酵蛋白品质的影响
Fig.6 Effect of initial moisture in enzymolysis sample on fermented protein quality
2.3.3 酶解温度对发酵蛋白品质的影响
由图7可知,随酶解温度的升高,发酵蛋白的蛋白溶解度、酸溶蛋白/粗蛋白均先升高后降低,硫苷含量先小幅降低再升高再降低。酶解温度为50 ℃时,发酵蛋白的蛋白溶解度、酸溶蛋白/粗蛋白均达最高且差异显著(P<0.05),硫苷含量降至最低但差异不显著(P>0.05)。综合考虑,确定最优酶解温度为50 ℃。
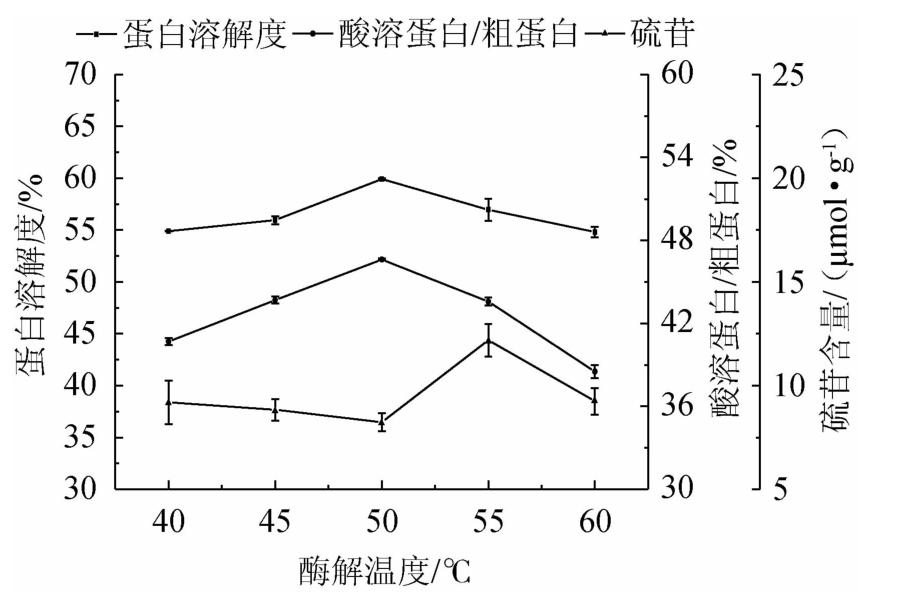
图7 酶解温度对发酵蛋白品质的影响
Fig.7 Effect of enzymolysis temperature on fermented protein quality
2.4 发酵蛋白品质及氨基酸含量分析
氨基酸对动物的免疫机能影响重大,缺乏氨基酸动物就会出现生长受阻,胸腺退化,脾脏淋巴细胞分裂降低等现象[24-26]。由表4可知,与未处理的原料相比,发酵蛋白的蛋白溶解度(65.80%)提高97.49%,酸溶蛋白/粗蛋白(44.13%)提高779.75%,硫苷含量(8.63 μmol/g)降低69.14%。经固态发酵、酶解后,发酵蛋白的天冬氨酸、甘氨酸、丙氨酸、半胱氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、脯氨酸含量均显著提高(P<0.05)。
表4 未处理原料、发酵蛋白品质及氨基酸含量分析
Table 4 Analysis of untreated raw material,fermented protein quality and amino acid content%

注:同行小写字母不同表示差异显著(P<0.05)。
3 结论
本研究采用米曲霉固态发酵+酶解的模式对以菜籽粕为主要原料,豆粕为辅助原料的蛋白原料制作工艺参数进行优化,确定最佳发酵原料组成为70%菜籽粕+30%豆粕;固态发酵的最佳条件为发酵蛋白原料初始含水量45%,米曲霉麸皮种子接种量3%,发酵时间40 h,发酵温度30 ℃;最佳酶解条件为酶解时间32 h,酶解样品初始含水量56%,酶解温度50 ℃。在此工艺条件下,发酵蛋白的蛋白溶解度提高97.49%,酸溶蛋白/粗蛋白提高779.75%,硫苷含量降低69.14%。发酵、酶解两步工艺充分利用了微生物在发酵过程中产生的酶,无需使用外源酶制剂,生物资源的利用达到最大化。相比传统固态发酵,固态发酵、酶解两步法大幅缩短了处理时间,减少了对固态发酵条件的控制依赖,使得终产物得率不仅仅依赖于发酵过程,增大了固态发酵的应用范围。
[1]戴美玲,江涛,谭美,等.微生物菌剂对菜粕好氧堆肥发酵的影响[J].磷肥与复肥,2020,35(5):20-23.
[2]梁永.几种非常规蛋白饲料发酵条件优化及其在肉仔鸡中的应用研究[D].郑州:河南农业大学,2011.
[3]李莹,韩云胜,赵青余,等.豆粕与发酵豆粕中主要营养成分、抗营养因子及体外消化率的比较分析[J].中国饲料,2019(23):76-81.
[4]YUN H M,LEI X J,LEE S I,et al.Rapeseed meal and canola meal can partially replace soybean meal as a protein source in finishing pigs[J].J Appl Anim Res,2017,46(1):195-199.
[5]顾斌.混菌固态发酵菜籽粕生产多肽饲料的研究[D].镇江:江苏大学,2010.
[6]孙林.微生物固态发酵菜籽粕的研究[D].合肥:安徽农业大学,2008.
[7]王永伟,宋丹,李爱科,等.发酵饲料资源开发及应用技术研究进展[J].中国饲料,2019(11):75-80
[8]张昆.菌酶协同固态发酵杂粕生产蛋白饲料的研究[D].武汉:武汉工业学院,2012.
[9]司马博锋,陈代文.固态发酵对复合蛋白饲料营养价值改善效果的研究[J].养猪,2011(2):9-11.
[10]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 6432—2018 饲料中粗蛋白的测定[S].北京:中国标准出版社,2018.
[11]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 19541—2017 饲料原料豆粕[S].北京:中国标准出版社,2017.
[12]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 22492—2008 大豆肽粉[S].北京:中国标准出版社,2008.
[13]WANG X,JIN Q,TONG W,et al.Screening of glucosinolate-degradingstrains and its application in improving the quality of rapeseed meal[J].Ann Microbiol,2012,62(3):1013-1020.
[14]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.124—2016 食品中氨基酸的测定[S].北京:中国标准出版社,2016.
[15]SARMADI B H,ISMAIL A.Antioxidative peptides from food proteins:A review[J].Peptides,2010,31(10):1949-1956.
[16]李旺,何万领,丁轲,等.不同处理方法对豆粕中抗原蛋白和酸溶蛋白的影响[J].西北农林科技大学学报(自然科学版),2020,48(1):25-32.
[17]韩领,张珍,夏晓洋,等.菜籽低聚肽的生理功能研究进展[J].中国油脂,2018,43(12):55-58.
[18]YAMADA Y,OHINATA K,LIPKOWSKI A W,et al.Rapakinin,Arg-Ile-Tyr,derived from rapeseed napin,shows anti-opioid activity via the prostaglandin IP receptor followed by the cholecystokinin CCK2 receptor in mice[J].Peptides,2011,32(2):281-285.
[19]HE R,MALOMO S A,GIRGIH A T,et al.Glycinyl-histidinyl-serine(GHS),a novel rapeseed protein-derived peptide has blood pressurelowering effect in spontaneously hypertensive rats[J].J Agr Food Chem,2013,61(35):8396-8402.
[20]叶荣飞,杨晓泉,郑田要,等.热变性和热聚集对大豆分离蛋白溶解性的影响[J].食品科学,2008,29(7):106-108.
[21]WAGNER J R,SORGENTINI D A,AÑÓN M C.Relation between solubility and surface hydrophobicity as an indicator of modifications during preparation processes of commercial and laboratory-prepared soy protein isolates[J].J Agr Food Chem,2000,48(8):3159-3165.
[22]卫功元,王大慧,陈坚.不同溶氧控制方式下的谷肤甘肤分批发酵过程分析[J].化工学报,2007(9):2330-2332.
[23]路怀金,刘通讯,赵谋明,等.2株米曲霉的特色酶系对酱油理化指标及品质的影响[J].中国食品学报,2021,21(5):230-237.
[24]张浩辉.浅析饲料营养对动物免疫机能的影响[J].今日畜牧兽医,2018,34(7):60.
[25]柏雪,王建萍,丁雪梅,等.氨基酸缺乏诱导细胞自噬的哺乳动物雷帕霉素靶蛋白复合体C1信号通路机制研究进展[J].动物营养学报,2017,29(3):749-754.
[26]黄婷.家禽蛋白质及氨基酸缺乏症的诊治[J].畜牧兽医科技信息,2021(3):198.