马尾藻(Sargassum pallidum)属褐藻门(Phaeophyta),墨角藻目(Fucalus),马尾藻科(Sargassaceae),马尾藻属(Sargassum)[1],是一种暖温带性藻类,盛产于我国渤海和黄海等沿海各地,分布广泛,资源丰富[2]。马尾藻营养丰富,含有膳食纤维、氨基酸、维生素、矿物元素(Ca、P、K等)和不饱和脂肪酸等多种营养成分[3-4],具有良好的保健功能,如马尾藻含有的膳食纤维对雌性激素的吸附作用大于红藻类膳食纤维,且具有良好的通便作用[5]。马尾藻多糖是从马尾藻中提取出的高黏度水溶性物质[6],主要成分为岩藻聚糖硫酸酯(Fucoidan),其单糖组成主要是岩藻糖,并含有活性基团硫酸基,最早是由瑞典科学家Kylin在20世纪初提出来并命名的[7],现有研究发现该糖具有免疫调节[8]、降血脂[9]、降血糖[10]、抗肿瘤[11-12]、抗病毒[13]、抗氧化[14-15]、抗炎等多种生理活性,具有极大的药用价值。
低聚糖(oligosaccharide)又称寡糖,是一种具有特殊生理功能的不消化性糖,具有改善肠道菌群和提高机体免疫力等重要的生理作用。低聚糖的化学本质是一些不能被消化的短链碳水化合物,一般由2~10个单糖单位通过糖苷键连接的直链或支链的小聚合体[16],介于单体单糖与高度聚合的多糖之间。与多糖相比,低聚糖具有黏度低、聚合度低、分子质量小、水溶性好、无抗原性、易吸收、生物利用性好以及在宿主体内积累效应较弱[13,17-18]等显著优势。
马尾藻低聚糖是由马尾藻多糖水解后得到的一种低分子质量的硫酸化海藻低聚糖[19]。海藻低聚糖的制备途径一般有两种:一是从天然原料中直接提取,缺点是得率低且纯度难以保证;二是通过海藻多糖降解,即先从原料中提取多糖,再对多糖进行降解获取海藻低聚糖。海藻多糖降解制备海藻低聚糖的方法主要有化学降解、物理降解和酶法降解,但是传统的化学降解和物理降解存在反应剧烈、设备维护成本高、环境污染严重、产量较低以及产物聚合度难以控制等问题,而与化学降解法和物理降解法相比,酶解法具有反应条件温和、提取效率高、工艺容易控制且对环境友好等特点,因此酶法制备海藻寡糖逐渐成为近年来研究的热点。国内外对酶降解制备低聚糖的研究已有报道,贺秋红等[19]利用商业海藻胶裂解酶制备海藻寡糖,得到了平均聚合度为4.08的海藻寡糖;CHEN J等[20]用需钠弧菌SK 42.001产生的海藻裂解酶降解海藻酸钠获得低聚糖,并对其结构和活性进行了研究。本研究采用水提醇沉法获得马尾藻粗多糖,利用水解酶对马尾藻粗多糖进行降解,并通过单因素试验和响应面试验优化制备马尾藻功能性低聚糖的酶解工艺,对马尾藻低聚糖的制备和生产起到一定指导作用,为马尾藻低聚糖的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
干燥马尾藻:广西北海市云南路水产市场;副干酪乳杆菌(Lactobacillus paracei)TYM201:本实验室保存。
1.1.2 化学试剂
果胶酶(50 000 U/mL)、纤维素酶(700 U/mL)、植物水解酶(5 086 U/mL):诺维信(中国)生物技术有限公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)(分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
MRS液体培养基:蛋白胨10 g/L,牛肉膏5 g/L,酵母粉4 g/L,葡萄糖10 g/L,乙酸钠5 g/L,磷酸二氢钾2 g/L,柠檬酸三铵2 g/L,硫酸镁0.2 g/L,硫酸锰0.05 g/L,吐温80 1 g/L。调pH值至5.7±0.2。121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
HH-4数显恒温水浴锅:上海博讯实业有限公司医疗设备厂;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;TF-FD-1真空冷冻干燥机:上海田枫实业有限公司;XW-80A多用途混匀仪:海门市其林贝尔仪器制造有限公司;HJ-3恒温磁力搅拌器:常州国华电器有限公司;3-18R离心机:湖南恒诺仪器设备有限公司;Infinite M200PRO酶标仪:奥地利Tecan Austria GmbH有限公司;XT-A400多功能粉碎机:永康市红太阳机电有限公司。
1.3 试验方法
1.3.1 马尾藻粗多糖制备
采用水提醇沉法[21]提取马尾藻粗多糖:称取250.00 g干燥马尾藻,用打粉机打成粉末,加入5.00 L蒸馏水,80 ℃热水提取5 h,用纱布滤去残渣,将滤液在8 000 r/min的条件下离心15 min后,取出上清液并浓缩至原来体积的1/5,冷却至室温,向浓缩液中加入5倍体积分数为95%的乙醇,静置于4 ℃醇沉24 h,纱布过滤并收集沉淀,在-18 ℃的条件下冷冻干燥36 h得马尾藻粗多糖。
1.3.2 分析检测
低聚糖得率与还原糖增量呈正相关,以还原糖增量为评价指标,采用DNS比色法[22-23]测定。
葡萄糖标准曲线绘制:以葡萄糖含量为横坐标(X),以OD540nm值为纵坐标(Y),绘制葡萄糖标准曲线得葡萄糖溶液的标准曲线回归方程为Y=0.569 1X-0.021 2,相关系数R2=0.998 3。
样品的制备:准确称取10mg马尾藻粗多糖,溶解于10mL pH为4.5的磷酸盐缓冲液(phosphate buffer solution,PBS)中,其他试验条件设置为:酶解温度50 ℃、酶解时间240 min、酶底比5∶1 000,酶解结束后沸水加热5 min灭酶,冷却。
取马尾藻多糖酶解液和酶解前马尾藻多糖溶液各1 mL于试管中,加入2 mL DNS试剂,混匀,沸水浴2 min,流水冷却,补水至15 mL,混匀,取200 μL于96孔板,测OD540nm值。代入葡萄糖标准曲线回归方程,求得酶解前后的还原糖含量[22,24],其增量计算公式如下:
式中:m1为多糖酶解后的还原糖含量,mg/mL;m0为多糖酶解前的还原糖含量,mg/mL;m为马尾藻多糖初始含量,mg/mL。
1.3.3 酶筛选试验
本试验选用比较常用的几种分解酶:果胶酶(A)、纤维素酶(B)、植物水解酶(C),以还原糖增量及低聚糖对副干酪乳杆菌TYM201的益生作用为评价指标。3种酶以下列组合形式:A、B、C、AB(1∶1)、AC(1∶1)、BC(1∶1)、ABC(1∶1∶1)分别酶解马尾藻多糖,筛选出最佳的酶组合。酶解条件为:酶解温度50 ℃、酶解pH 4.5、酶解时间240 min、酶底比5∶1 000。
(1)不同酶组合对酶解效果的影响
以灭活酶解液(沸水浴5 min)为试验组,酶解前灭活多糖溶液为空白对照,以还原糖增量为评价指标,初步筛选出酶解效果最好的3种酶组合。还原糖增量测定方法参考1.3.2。
(2)不同酶组合对副干酪乳杆菌TYM201生长的影响
去除MRS液体培养基中的葡萄糖和水,加入初筛选出的3种酶组合对应的酶解液,配制低聚糖培养基(记为OX,X为酶组合编号);为排除酶以及多糖自身对试验的影响,用等量同浓度多糖+灭活酶溶液代替OX中的酶解液,配制多糖+灭活酶培养基(记为PEX,X为酶组合编号);去除MRS液体培养基中的葡萄糖,配制空白培养基(记为K)。向上述培养基中接种5%副干酪乳杆菌TYM201,在37 ℃下培养24 h,每隔3 h取100 μL菌液在波长600 nm下测定菌液的OD600nm值。以菌液的OD600nm值为纵坐标绘制生长曲线[25-26],考察不同酶组合对副干酪乳杆菌TYM201生长的影响,从而筛选出综合效果最好的酶组合。
1.3.4 酶解工艺优化
(1)单因素试验
以还原糖增量为指标,酶解工艺基本参数及还原糖增量测定方法参考1.3.2。在基本参数下采用单因素法依次考察酶底比(5∶1 000、6∶1 000、7∶1 000、8∶1 000、9∶1 000)、酶解温度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃)、酶解时间(60 min、90 min、120 min、150 min、180 min)、酶解pH(4.0、4.5、5.0、5.5、6.0)对还原糖增量的影响。
(2)响应面试验
Plackett-Burman试验设计:在单因素试验基础上,利用Plackett-Burman(PB)试验设计(N=12),以还原糖增量为响应值,对酶底比、酶解温度、酶解时间及酶解pH 4个单因素进行评价,筛选出显著性因素,运用Design-Expert 12.0.3软件进行试验设计,共12次试验,设置每个因素的-1、1水平[27],具体试验设计见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman tests design

最陡爬坡试验:根据PB试验结果,去除影响不显著的因素,对剩下因素的相互影响进行探究。采用最陡爬坡试验确定显著因素酶解温度、酶底比与酶解pH的最佳区域。
Box-Behnken试验设计:以最陡爬坡试验得出的最高响应值点作为中心点,设计3因素3水平的响应面优化试验[28-30]。以酶解温度(X1)、酶底比(X2)及酶解pH(X3)为自变量,以还原糖增量(Y)为响应值,采用Design-Expert 12.0.3软件设计Box-Behnken响应面试验方案并对数据进行分析。Box-Behnken试验设计因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken tests design
1.3.5 数据处理
所有试验设计3个平行,试验结果采用“平均值±标准差”表示。采用Origin 9.0对试验数据进行作图,响应面试验结果采用Design-Expert 12.0.3进行分析处理。
2 结果与分析
2.1 酶的种类及组合筛选
2.1.1 不同酶组合对酶解效果的影响
以灭活酶解液为试验组,酶解前灭活多糖溶液为空白对照,测定得酶解前后吸光度值的差值,然后根据标准曲线回归方程计算还原糖增量,结果见表3。
表3 不同酶组合对还原糖增量的影响
Table 3 Effect of different enzyme combinations on reducing sugar increment

由表3可知,C、AC(1∶1)和ABC(1∶1∶1)3种酶组合的酶解效果最好,经3种酶组合酶解后的还原糖增量分别为0.167 7 mg/mg、0.171 5 mg/mg、0.067 9 mg/mg,明显高于其他组。因此,选择C、AC(1∶1)和ABC(1∶1∶1)3种酶组合进行下一步试验。
2.1.2 不同酶组合对副干酪乳杆菌TYM201生长的影响
由图1a、图1b可知,在培养过程中AC和ABC两组中酶解液的OD600nm值均高于空白组的OD600nm值,即酶解液中副干酪乳杆菌TYM201的数量比空白组多,说明酶解液对副干酪乳杆菌TYM201生长具有一定的促进作用,同时多糖+酶溶液的OD600nm值明显高于酶解液组的OD600nm值,说明多糖+酶对副干酪乳杆菌TYM201有益,故不能证明酶解液中的低聚糖能够促进副干酪乳杆菌TYM201的增殖。由图1c可知,C酶(植物水解酶)酶解液的OD600nm值高于多糖+酶溶液的OD600nm值,且24 h时的OD600nm值>0.35,其余两组中酶解液的OD600nm值均低于多糖+酶溶液的OD600nm值,表明经过植物水解酶水解产生的低聚糖对副干酪乳杆菌TYM201生长有促进作用。综上,选择植物水解酶作为本试验用酶。
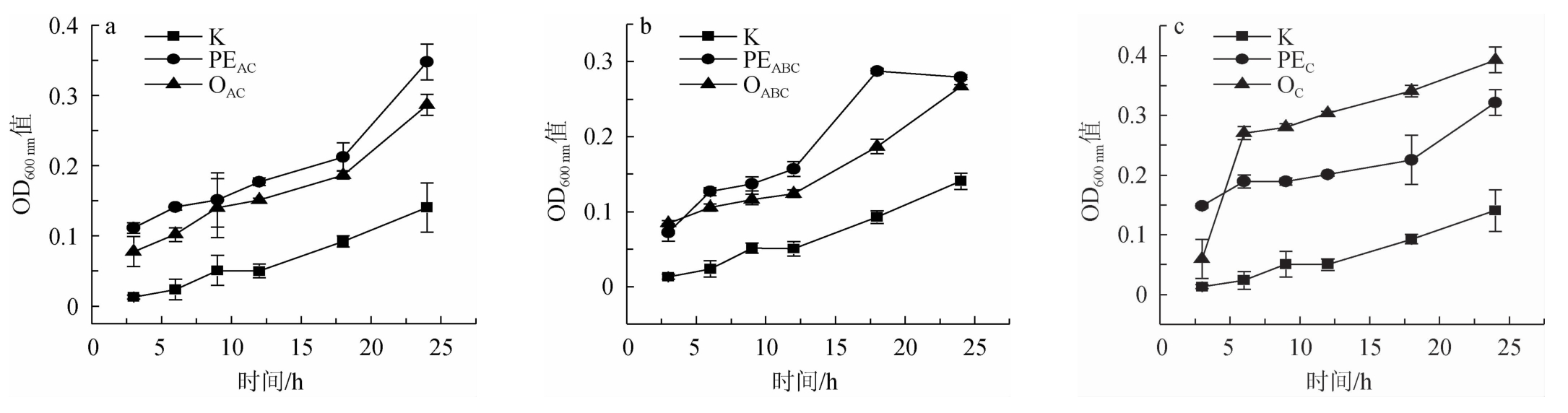
图1 不同酶组合对副干酪乳杆菌TYM201生长的影响
Fig.1 Effect of different enzyme combinations on Lactobacillus paracasei TYM201 growth
2.2 酶解工艺优化单因素试验
2.2.1 酶底比对酶解效果的影响
由图2可知,随着酶底比在5∶1 000~7∶1 000范围内的增高,还原糖增量也逐渐增大;在酶底比达到7∶1 000时,还原糖增量达到最大值,为(0.205 6±0.004 4)mg/mg;酶底比在7∶1 000~9∶1 000范围内继续增加,还原糖增量呈现出下降的趋势。一般而言,随着酶浓度的增加,酶促反应速度加快,即单位时间内生成的产物量增大。但是当酶浓度足够大时,没有多余的底物与酶结合,过量的酶反而会抑制酶反应的进行,从而导致还原糖增量下降[31]。因此,最适酶底比为7∶1 000。
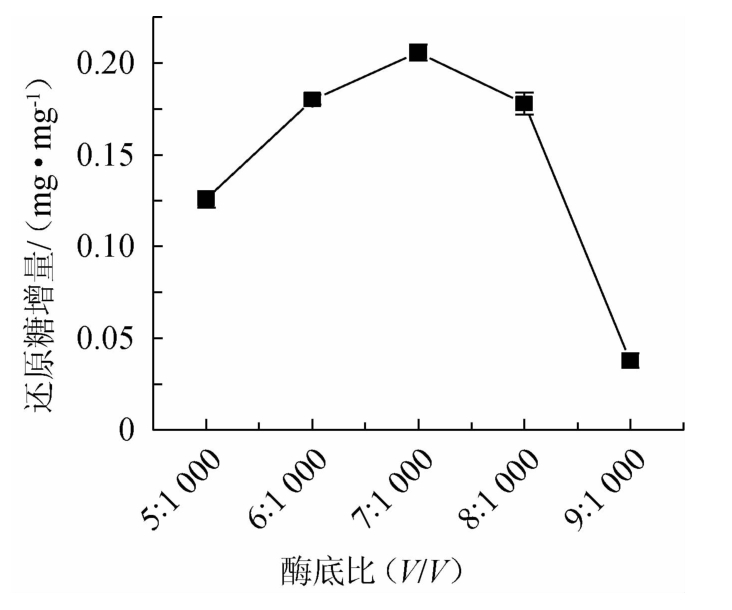
图2 不同酶底比对还原糖增量的影响
Fig.2 Effect of different enzyme and substrate ratios on reducing sugar increment
2.2.2 酶解温度对酶解效果的影响
由图3可知,在酶解温度为40~55 ℃时,还原糖增量随酶解温度升高而增加;在酶解温度为55 ℃时,还原糖增量达到最大值,为(0.218 0±0.002 9)mg/mg;在酶解温度高于55 ℃之后,还原糖增量有所下降。在一定范围内酶活性随着温度的升高而增强,但高于最适温度后,酶活性随着温度的升高而降低甚至失活,造成酶催化活性的降低[17]。因此,最适酶解温度为55 ℃。

图3 不同酶解温度对还原糖增量的影响
Fig.3 Effect of different enzymolysis temperature on reducing sugar increment
2.2.3 酶解时间对酶解效果的影响
由图4可知,当酶解时间为60~120 min时,还原糖增量随酶解时间延长而增高;当酶解时间达到120 min时,还原糖增量达到最大值,为(0.196 7±0.001 5)mg/mg;当酶解时间>120 min之后,还原糖增量有所下降。造成这种现象的原因是随着酶解反应进行,底物浓度降低,酶的活力下降,不利于酶促反应继续进行,从而造成还原糖增量下降[31-32]。因此,最适酶解时间为120 min。

图4 不同酶解时间对还原糖增量的影响
Fig.4 Effects of different enzymolysis time on reducing sugar increment
2.2.4 酶解pH对酶解效果的影响
由图5可知,当pH值4.0~5.5时,随着pH值的升高,还原糖增量也随之增加;当酶解pH值为5.5时,还原糖增量最大,为(0.204 7±0.004 9)mg/mg;当酶解pH值>5.5之后,随着pH值的升高,还原糖增量随之减少。这可能与酶自身的性质和结构有关,即酶在一定的pH值范围内会表现出最大活力,偏离最适pH值时会改变酶的活性中心构像,甚至改变整个酶分子的结构,使酶变性失活,而酶活力下降,影响了酶解反应的进程,减弱了酶解速度,还原糖增量下降[33]。因此,最适酶解pH值为5.5。
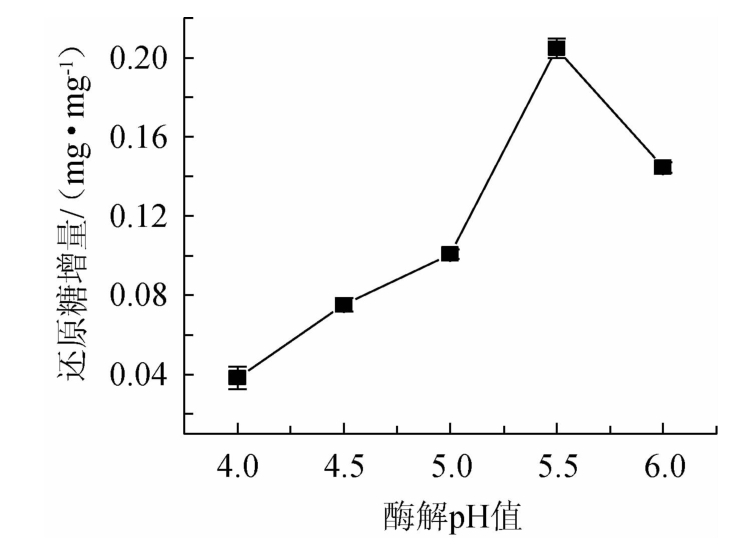
图5 不同酶解pH值对还原糖增量的影响
Fig.5 Effect of different enzymolysis pH on reducing sugar increment
2.3 Plackett-Burman试验结果与分析
对PB试验结果(表4)进行回归分析,结果见表5。由表5可知,酶底比表现为正效应(即随着影响因素值的增大,还原糖增量为升高趋势),酶解温度、酶解时间与酶解pH表现为负效应(即随着影响因素值的增大,还原糖增量为降低趋势)。试验因素酶解pH、酶底比对还原糖增量影响极显著(P<0.01),温度对还原糖增量影响显著(P<0.05),而时间影响不显著(P>0.05),故选择酶解温度、酶底比和酶解pH三个显著影响因素进行马尾藻功能低聚糖制备工艺的响应面优化和设计。由于时间对还原糖增量影响不显著且表现为负效应,因此,在优化提取过程中,考虑到提高效率及节约成本[34],并结合单因素试验结果,将酶解时间固定为120 min。
表4 Plackett-Burman试验设计与结果
Table 4 Design and results of Plackett-Burman tests
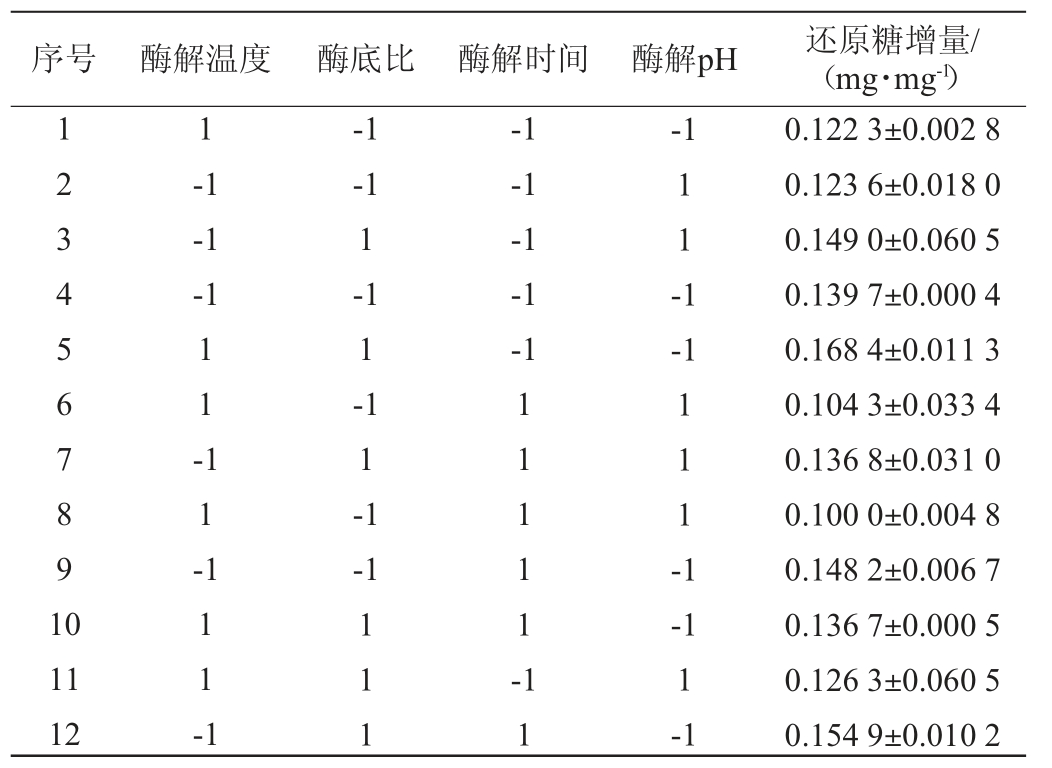
表5 各因素水平、效应值及显著性分析
Table 5 Level,effect value and significance analysis of each factors
注:P<0.01,表示对结果影响极显著;P<0.05,表示对结果影响显著;P>0.05,表示对结果影响不显著。
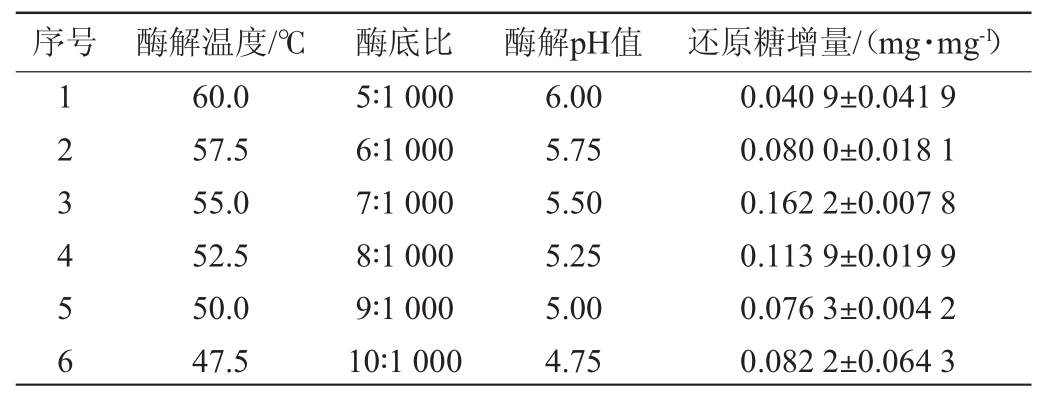
通过最陡爬坡试验可以确定响应面的分析中心。由表6可知,随着酶解温度、酶底比和酶解pH的改变,还原糖的增加量先增加后减少,当酶解温度为55 ℃、酶底比为7∶1 000、酶解pH 5.5时马尾藻还原糖增量最大,因此以第3组水平作为响应面的分析中心,进行下一步优化。
表6 最陡爬坡试验设计与结果
Table 6 Design and results of the steepest ascent tests
2.4 Box-Behnken试验设计及结果
在最陡爬坡试验结果基础上,以酶解温度(X1)、酶底比(X2)及酶解pH(X3)为自变量,还原糖增量为响应值(Y)进行响应面试验,利用Design-Expert 12.0.3进行Box-Behnken试验设计,Box-Behnken试验设计及结果见表7,回归模型方差分析见表8。
表7 Box-Behnken试验设计结果及分析
Table 7 Results and analysis of Box-Behnken tests design
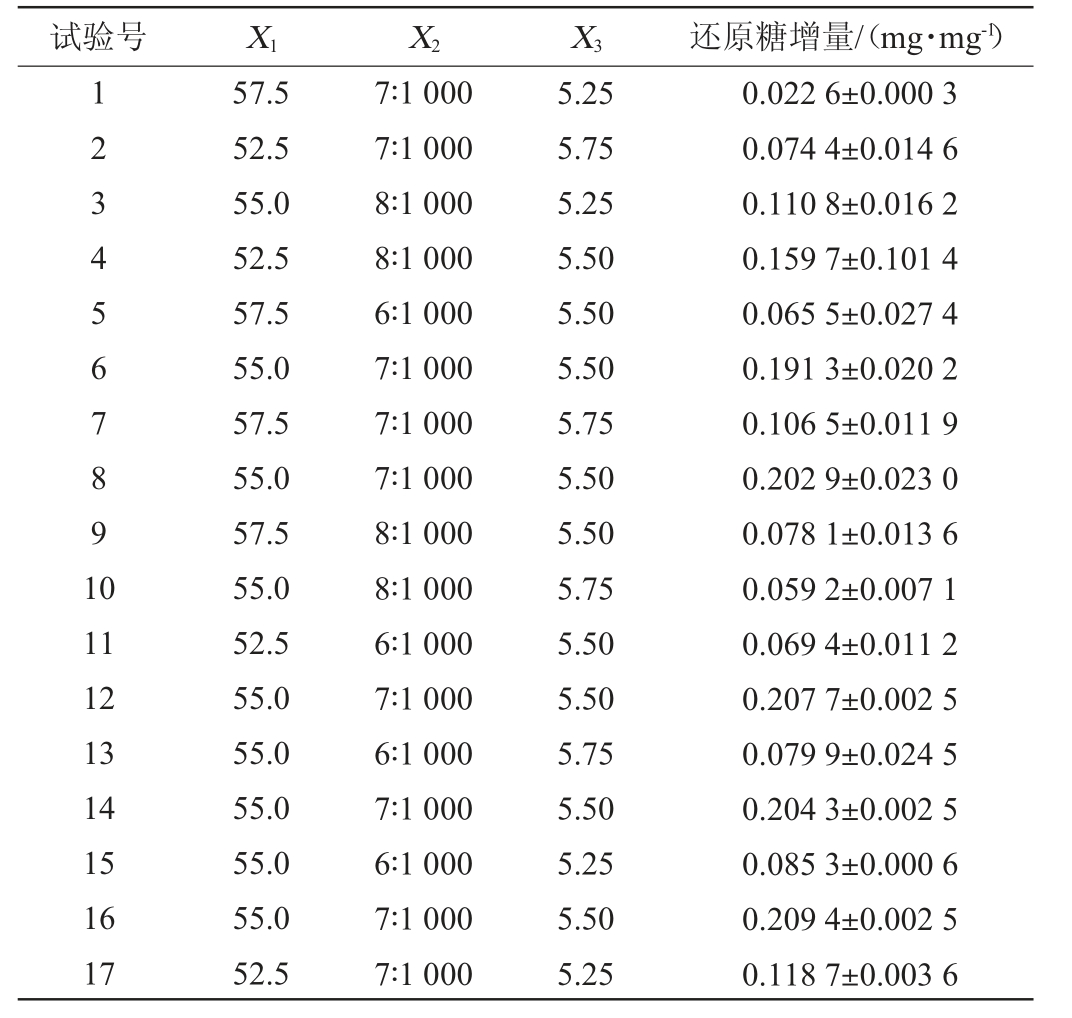
表8 回归模型方差分析
Table 8 Variance analysis of regression model

注:“ns”表示对结果影响不显著(P>0.05)“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
利用Design-Expert 12.0.3对表7的试验数据进行方程拟合分析,以酶解温度(X1)、酶底比(X2)及酶解pH(X3)为自变量,以还原糖增量(Y)为响应值,得到的三次回归方程如下:

由表8可知,所选模型极显著(P<0.01),失拟项不显著(P>0.05),说明所得回归方程拟合度较好,所选模型合适。由P值可知,三次项X12X2、X12X3,二次项X12、X22、X32,交互项X1X2、X1X3对还原糖增量影响极显著(P<0.01),说明各因素对响应值的影响不是简单的线性关系。由F值可知,在影响还原糖增量的3个关键因素中,强弱顺序为X1>X3>X2(即酶解温度>酶解pH>酶底比)。用Design-Expert 12.0.3分析模型的可信度,模型的决定系数R2=99.58%,调整决定系数R2Adj=98.66%,R2接近1,表明模型预测的响应值准确,可用于试验分析和预测。同时模型的变异系数(coefficient of variation,CV)=5.99%<15%(变异系数反映试验的可重复性,其值越小表明试验越精确),说明模型比较精确,可信度较高并可用于拟合试验结果。综上分析,该模型可用于分析预测植物水解酶酶解马尾藻多糖制备马尾藻功能低聚糖的工艺。
2.5 各因素交互作用响应面分析
由Box-Behnken试验结果,利用软件Design-Expert 12.0.3建立3D响应面及等高线见图6。在利用响应面分析因素对响应值的影响时,如果坡面比较陡,表明因素变化对响应值影响显著,反之则表明因素变化对响应值影响不大[35]。等高线则能够直观反映因素交互作用对响应值的影响,椭圆形的等高线表示交互作用显著[36]。由图6可知,3D响应面在X1、X3方向上的坡面较陡,X1X2、X1X3、X2X3的等高线均呈椭圆形,表明X1、X3以及X1X2、X1X3、X2X3的交互作用对还原糖增量的影响显著(P<0.05)。

图6 各因素间交互作用对还原糖增量影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between each factors on reducing sugar increment
2.6 验证试验
通过Design-Expert 12.0.3软件计算得到优化后的酶解工艺参数为:酶解温度54.460 ℃,酶底比7∶1000,酶解pH 5.460。在此条件下,马尾藻多糖酶解后的还原糖增量预测值为0.206 4 mg/mg。为验证此方法的合理性,根据优化后的酶解工艺稍作改动后进行试验,即酶解温度54.5 ℃,酶底比7∶1 000,酶解pH 5.46。在此优化条件下进行3次平行验证试验,得到还原糖增量实际值为0.214 4 mg/mg,与试验模型的预测值0.206 4 mg/mg基本吻合,偏差较小。结果表明,响应面试验优化的结果比较准确,所获得的模型可以应用于对马尾藻功能性多糖酶解制备中还原糖增量的预测。
3 结论
本研究主要探究酶解法制备马尾藻功能性低聚糖的最佳工艺,首先以低聚糖对副干酪乳杆菌TYM201的益生作用为功能指标,筛选出益生效果最好的植物水解酶作为后续试验用酶。通过Plackett-Burman设计和Box-Behnken响应面分析对制备工艺进行优化。最终确定酶法制备马尾藻功能低聚糖的最佳工艺参数:酶解温度54.5 ℃,酶底比7∶1 000,酶解pH 5.46。在此条件下马尾藻多糖经酶解后的还原糖增量为0.214 4 mg/mg。因此,通过响应面优化马尾藻功能低聚糖的制备提取工艺是可行的,本实验可以为马尾藻的进一步加工利用提供科学参考。
[1]叶红.马尾藻多糖的分离纯化、生物活性及结构分析[D].南京:南京农业大学,2008.
[2]黄冰心,丁兰平,谭华强,等.我国沿海马尾藻属(Sargassum)的物种多样性及其区系分布特征[J].海洋与湖沼,2013,44(1):69-76.
[3]胡斌,王秉利,许鹏,等.马尾藻营养成分研究进展[J].水产学杂志,2016,29(1):48-53.
[4]汪梓旭,郑志国,鲍时翔,等.褐藻胶裂解酶酶学性质及酶解马尾藻工艺的响应面优化[J].中国酿造,2020,39(2):103-108.
[5]王芹建.马尾藻多糖的提取工艺优化、结构和活性的研究[D].天津:天津科技大学,2020.
[6]张玲,胡庭俊,陈炳全.马尾藻多糖对鸡脾脏淋巴细胞增殖及氧化应激影响的实验观察[J].西南农业学报,2011,24(5):1967-1971.
[7]林沛纯,谌素华,郑素丽.亨氏马尾藻岩藻聚糖的提取及体外吸附胆酸盐的作用[J].食品工业科技,2020,41(17):58-61.
[8]WU S,ZHANG X,LIU J,et al.Physicochemical characterization of Sargassum fusiforme fucoidan fractions and their antagonistic effect against P-selectin-mediated cell adhesion[J]. Int J Biol Macromol,2019,133:656-662.
[9]GRAUFFEL V,KLOAREG B,MABEAU S,et al.New natural polysaccharides with potent antithrombic activity: fucans from brown algae[J].Biomaterials,1989,10(6):363.
[10]杨成凤.马尾藻寡糖降血糖活性及其作用机制研究[D].福州:福建农林大学,2017.
[11]YU M,JI Y,QI Z,et al.Anti-tumor activity of sulfated polysaccharides from Sargassum fusiforme[J].Saudi Pharm J,2017,25(4):464-468.
[12]梁世忠,李兴芳,陈静,等.马尾藻多糖的抗肿瘤作用及其免疫功能的研究[J].海洋科学,2009,33(3):49-52.
[13]张玉娟,罗福文,姚子昂,等.海藻酸钠寡糖生物活性的研究进展[J].中国酿造,2014,33(1):5-8.
[14]CHEN B,SHI M,CUI S,et al.Improved antioxidant and anti-tyrosinase activity of polysaccharide from Sargassum fusiforme by degradation[J].Int J Biol Macromol,2016,92:715-722.
[15]GUO X,YE X,SUN Y,et al.Ultrasound effects on the degradation kinetics,structure,and antioxidant activity of sea cucumber fucoidan[J].J Agr Food Chem,2014,62(5):1088-1095.
[16]操然.低聚糖生理功能及其提取技术的研究进展[J].中国野生植物资源,2015,34(4):33-37.
[17]MIYAZAWA T,OHTSU S,FUNAZUKURI T.Hydrothermal degradation of polysaccharides in a semi-batch reactor:product distribution as a function of severity parameter[J].J Mater Sci,2008,43(7):2447-2451.
[18]黄菊,丁晨,谢超,等.海藻胶低聚寡糖的酶法制备纯化技术及保水理化性质分析[J].海洋与湖沼,2015,46(3):595-602.
[19]贺秋红,巩志金,颜梅,等.响应面法优化海藻寡糖的酶法提取工艺[J].中国酿造,2019,38(11):59-62.
[20]CHEN J,MENG Q,JIANG B,et al.Structure characterization and in vitro hypoglycemic effect of partially degraded alginate[J].Food Chem,2021,356:129728.
[21]齐丹,赖文婷,肖玉秀.马尾藻多糖提取工艺的优化及抗氧化性[J].海南热带海洋学院学报,2020,27(5):56-61.
[22]高文军,李卫红,王喜明,等.3,5-二硝基水杨酸法测定蔓菁中还原糖和总糖含量[J].中国药业,2020,29(9):113-116.
[23]张珣,王婧,丁华,等.DNS法测定茶叶中掺杂蔗糖含量[J].湖北农业科学,2021,60(21):107-111.
[24]王天龙,仇宏伟,陈海华,等.3,5-二硝基水杨酸法测定果胶酶活力的条件研究[J].食品与机械,2008,24(3):96-99.
[25]张娜,占英,孟迎平,等.功能低聚糖对植物乳杆菌ZDY2013发酵乳发酵特性及冷藏效果的影响[J].现代食品科技,2021,37(11):34-42.
[26]刘丽艳,冯坤,娄文勇,等.益生元对益生菌的增殖效应实验在本科教学中的应用[J].农业工程,2021,11(8):120-124.
[27]赵玉荣,张乐,郭佳慧,等.Plackett-Burman设计结合响应面法优化苦参中氧化苦参碱提取工艺[J].广州化工,2021,49(9):73-76.
[28]IMANDI S B,BANDARU V V R,SOMALANKA S R,et al.Application of statistical experimental designs for the optimization of medium constituents for the production of citric acid from pineapple waste[J].Bioresource Technol,2008,99(10):4445-4450.
[29]XU C,KIM S,HWANG H,et al.Application of statistically based experimental designs for the optimization of exo-polysaccharide production by Cordyceps militaris NG3[J].Biotechnol Appl Biochem,2002,36(2):127-131.
[30]白卫东,沈棚,钱敏,等.响应面优化花生酸奶发酵工艺研究[J].中国乳品工业,2012,40(4):51-54.
[31]杜涓,安晓萍,刘娜,等.酶解对玉米芯多糖结构及体外抗氧化活性的影响[J].饲料工业,2021,42(21):45-50.
[32]王双毅,谢玮,崔少宁,等.响应面分析法优化黑松松花粉多糖提取工艺[J].粮食与油脂,2021,34(11):113-116.
[33]陈淑琼,李晓月,吴晨烁,等.酶解制备褐藻寡糖工艺优化及活性研究[J].食品研究与开发,2019,40(13):51-56.
[34]胡文兵,杨占威,陈慧,等.Plackett-Burman和Box-Behnken试验设计优化超声波-酶法提取青钱柳多糖工艺及结构初探[J].天然产物研究与开发,2017,29(4):671-679.
[35]YIN G,DANG Y.Optimization of extraction technology of the Lycium barbarum polysaccharides by Box-Behnken statistical design[J].Carbohydr Polym,2008,74(3):603-610.
[36]肖怀秋,李玉珍,林亲录,等.响应面优化冷棒花生粕酶解制备花生肽工艺[J].中国粮油学报,2014,29(10):106-111.