随着人们生活水平的不断提高,健康饮食也越发受到关注。作为一种天然色素,红色素具有抗炎、抗癌、预防和治疗糖尿病、调节胆固醇等功效[1],与人工合成的色素相比,红色素具有“天然、营养、多功能”等优点,符合人们对食品着色的健康环保要求,市场需求量较大。三七渣是传统中药三七经提取皂苷等有效成分后的残余物,富含淀粉、蛋白质、多糖等营养元素,适合作为发酵基质使用。采用紫色红曲霉固态发酵三七渣生产红色素,不仅可以实现三七渣的资源化利用、减少固体废弃物污染,还能降低生产成本。发酵动力学的主要任务是研究微生物生长、基质消耗以及产物生成之间的动态定量关系[2-3],通过发酵动力学的研究,有助于深入了解微生物的生长代谢规律、建立合理的发酵工艺或对已有的发酵过程进行优化[4]。由于固态发酵基质成分不均匀且缺乏自由水,再加上固体颗粒传导性较差,因此,对发酵过程的生物量、pH值、温度等培养参数的控制难度较大[5],相应的微生物生长动力学及传质模型研究较少,制约了固态发酵生物反应器的可控操作[6]。本研究通过分析紫色红曲霉固态发酵三七渣生产红色素过程中相关参数随发酵时间的变化情况,考察了紫色红曲霉新陈代谢活动的固有反应速率,并建立了微生物生长动力学、基质消耗动力学以及产物生成动力学模型,以期为反应器放大设计和工业化应用提供基础参数。
1 材料与方法
1.1 材料与试剂
紫色红曲霉(Monascus purpureus)(SICC3.19):四川省微生物资源平台菌种保藏中心;三七渣:成都市某制药厂,经晾晒后置于热风循环烘箱中80 ℃干燥72 h后粉碎、过筛,置于干燥器中备用,该药渣主要成分为粗淀粉33.13%,粗蛋白12.28%,真蛋白9.97%,还原糖1.37%[7]。
磷酸氢二钾、三氯乙酸、羧甲基纤维素钠、冰乙酸、乙酸钠、蒽酮、高氯酸、无水乙醇、乙酸铅、苯酚、亚硫酸氢钠、石油醚、酒石酸钾钠、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)(均为分析纯):成都市科隆化学品有限公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取20.0 g新鲜土豆、2.0 g葡萄糖、2.0 g琼脂粉与100 mL蒸馏水混合制备PDA培养基,121 ℃灭菌30 min;种子液培养基:6.0 g葡萄糖、2.0 g蛋白胨、1.0 g硝酸钠、0.5 g MgSO4·7H2O、1.0 g KH2PO4,蒸馏水100 mL,pH 自然,121 ℃灭菌30 min;三七渣固体培养基:取10.00 g三七渣,0.03 g蛋白胨、0.02 g KH2PO4,加入适量蒸馏水,调整培养基初始水含量为65.17%,pH值自然,121 ℃灭菌40 min。
1.2 仪器与设备
UV-2550紫外可见分光光度计:日本SHIMADZU公司;PYX-280H-C恒温恒湿生化培养箱:广东韶关科力实验仪器有限公司;LDZX-50KB高压灭菌锅:上海申安医疗器械厂;SF-130中药分析研磨机:长沙中南制药机械厂;QYC-211水浴恒温振荡器:上海福玛实验设备有限公司。
1.3 方法
1.3.1 种子液的制备
用打孔器在PDA培养基的边缘取0.5 cm2的红曲霉菌丝块,将其接入盛有100 mL种子液培养基的250 mL锥形瓶中,置于恒温振荡器中,在150 r/min、30 ℃条件下培养5 d。
1.3.2 发酵动力学实验
取120个250 mL锥形瓶,每个锥形瓶中分别装入三七渣固体培养基,121 ℃灭菌30 min,冷却后接入150 mL/kg的紫色红曲霉种子液,30 ℃恒温发酵培养20 d。发酵培养期间,每天取出6个锥形瓶,从其中3个锥形瓶中分别取1.0 g发酵培养物(湿物料)用于测定pH值,然后将这3个锥形瓶中剩余的发酵培养物在60 ℃条件下烘干至质量恒定,粉碎过60目筛后用于淀粉含量、生物量的测试,将其余3个锥形瓶中的发酵培养物在60 ℃条件下烘干至质量恒定,粉碎过60目筛后用于红色素、还原糖和总糖含量的测试。每个实验结果均为3个平行样测定结果的均值。
1.3.3 测定方法
红色素的测定:准确称取1.00 g发酵培养物置于250 mL带塞锥形瓶中,加入50 mL体积分数为70%的乙醇溶液,60 ℃水浴提取60 min,于波长500 nm处测定其吸光度值[8]。
生物量的测定:按照参考文献[9]的方法测定,通过测定的核酸量来反映生物量。
pH值的测定:称取1.00 g发酵湿物料,加入50 mL蒸馏水,搅拌均匀后静置20 min,用PHS-3C型精密pH计测定其pH值。
淀粉的测定:采用酸水解法[10]。
总糖和还原糖的测定:采用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法[11]。
1.3.4 菌体生长动力学模型建立
目前,固态发酵系统大多数采用线性、指数和对数方程研究其动力学,线性方程和指数方程是将微生物生长曲线分为不同阶段,并针对不同的生长阶段采用不同的方程进行描述,而对数方程的数学表达式比较简单,用一个方程式就可以近似表示包括适应期、对数期和稳定期在内的生长曲线,所以使用也最广[5,12-17]。本研究采用Origin9.0软件内置的非线性方程Slogistic 3(公式1)对发酵培养物中紫色红曲霉生物量随发酵时间变化的实验数据进行拟合。紫色红曲霉生物量计算公式如下:
式中:X为t时刻紫色红曲霉生物量,g/g发酵培养物;X0为0时刻的生物量,g/g发酵培养物;Xm为最大生物量,g/g发酵培养物;t为发酵时间,d;α为比增长速率常数,d-1。
1.3.5 产物生成动力学模型
微生物产物形成的动力学模型一般可分为生长偶联型(或称伴随生长的产物形成模型)、部分生长偶联型(或称不完全伴随生长的产物形成模型)、非生长偶联型(或称不伴随生长的产物形成模型)三种。以前文献大多采用Luedeking-Piret方程研究真菌细胞生长和产物形成的过程[18-19]。由于红色素的动态变化呈“S”形曲线,因此,本研究尝试采用Origin 9.0软件内置的非线性方程Boltzmann(公式2)对发酵培养物中红色素色价随时间变化的实验数据进行拟合。红色素色价计算公式如下:
式中:t为发酵时间,d;B1为t=0时发酵培养物中红色素色价,U/g;B2为发酵培养物中红色素色价最大值,U/g;t0为发酵培养物中红色素色价增加到最大值一半时所需要的时间,d;t 为发酵时间,d;α为两条渐近线的差值和拐点处“S”形曲线切线斜率比值的1/4,反映了红色素的合成速率。
1.3.6 基质降解动力学模型
本研究采用Origin 9.0软件里的四参数对数模型对发酵培养物中总糖含量随时间变化的实验数据进行拟合。总糖含量计算公式如下:

式中:D为t时刻发酵培养物中总糖含量,%;t为发酵时间,d;D2为发酵末期(t=20 d)发酵培养物中总糖含量,%;D1为发酵初期(t=0 d)发酵培养物中总糖含量,%;t50%表示以D2为基准的总糖消耗半衰期,d;q为无量纲常数。
2 结果与分析
2.1 紫色红曲霉生物量、红色素色价、发酵培养物pH值的动态变化
发酵过程中紫色红曲霉生物量、红色素色价、发酵培养物pH值的动态变化见图1。
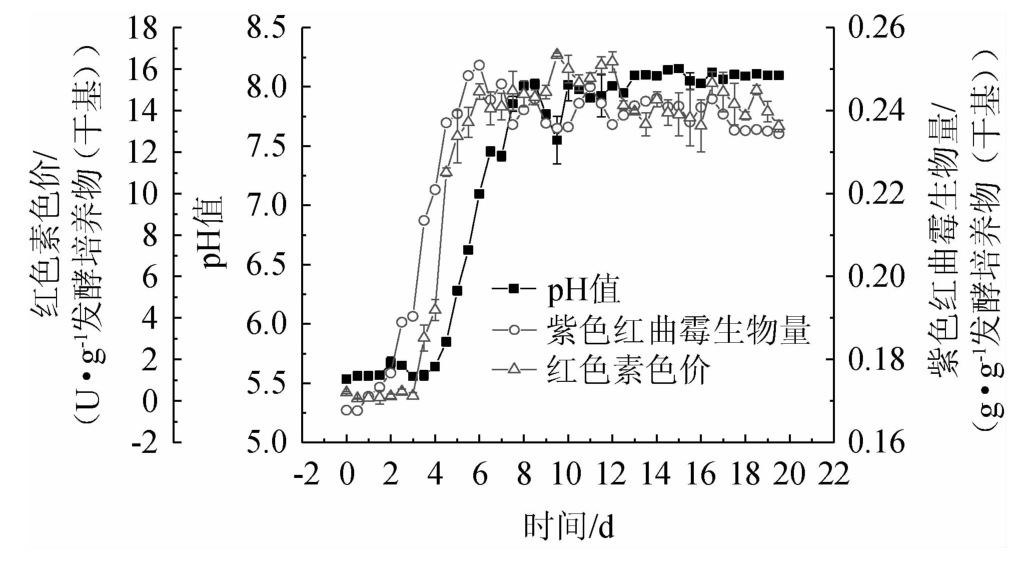
图1 发酵过程中生物量、红色素色价、发酵培养物pH值的动态变化
Fig.1 Dynamic changes of biomass,color value of red pigments and pH of fermentation culture during fermentation
由图1可以看出,发酵过程中生物量、红色素色价、发酵培养物的pH值的动态变化趋势整体相似,都是在发酵初期变化平缓,几天以后快速增长,在到达峰值后又基本维持稳定,呈“S”型曲线:发酵前2 d是适应期,然后是对数生长期,第6天开始进入了稳定期,这与普通微生物生长周期的变化规律一致,而且生物量与红色素色价基本上同时到达峰值,可以认为菌体生长与代谢产物生成具有偶联性,马超[20]采用BP神经网络建立红曲霉固态发酵过程中生物量、总糖含量、红曲色素含量的发酵动力学模型,与本研究结果基本一致。顾玉梅等[21]以玉米淀粉和谷氨酸单钠盐为主要成分通过红曲霉9903进行液态发酵产红色素及桔霉素,发现色素的生产与菌体生长有一定的偶联关系。但其他一些研究结果却有所不同:如程新等[14]在采用红曲霉JR摇瓶分批补料发酵动力学模型的研究中发现,红曲色素发酵属于部分生长偶联型。邵伟等[18]在红曲霉分批发酵生产红色素的研究中,发现该发酵过程属于非生长偶联型。信亚文等[19]采用连续补料的Fed-Batch培养技术用于红曲霉菌的液相培养,发现红曲色素合成与红曲霉菌生长的关系也属于非生长偶联型。衣珊珊[22]在采用紫甘薯淀粉液态发酵制备红曲色素的研究中发现,红曲霉菌体干质量只与胞内色素产量之间呈高度正相关(r=0.984 4),与胞外色素间不存在这种相关性。由图1可以看出,与生物量、红色素色价相比,发酵培养物的pH值延迟2 d左右到达峰值,且一直保持稳定,但在液态发酵产红色素的研究中却发现,pH值先下降后上升[22]。
2.2 总糖、淀粉和还原糖含量的动态变化
发酵过程中总糖、淀粉与还原糖含量的动态变化见图2。
由图2可以看出,发酵前2 d,紫色红曲霉处于适应期,对营养物质消耗很少,总糖含量基本保持不变,随后总糖含量迅速降低,这是由于在对数生长期大量总糖用于合成紫色红曲霉细胞生长、红色素合成以及为其生长代谢提供能量;到第6天后总糖含量基本保持稳定,这与图1中菌体生长规律完全吻合;淀粉含量的变化趋势与总糖含量变化趋势总体相似,但是淀粉含量在发酵前4 d基本保持不变,可能原因在于三七渣中存在比淀粉更容易利用的碳源,比如小分子的单糖和双糖,优先被紫色红曲霉利用,发酵第3~4.5天淀粉含量下降最快,随后降速变缓直到发酵第8天后趋于稳定。还原糖含量在发酵第4天达到峰值,然后快速下降,4.5 d以后降速放缓,6.5 d以后趋于稳定;结合淀粉含量的变化趋势,可以认为,发酵前3 d还原糖的积累主要来自于其他比淀粉更容易水解利用的碳源,随后1.5 d淀粉大量水解产生还原糖供给菌体对数生长期所需。在固态发酵三七渣生产蛋白饲料时,总糖、还原糖、淀粉含量的变化规律与本研究结果相似[23-24]。利用鼠李糖乳杆菌生产L-乳酸时,在发酵过程中也观察到了类似的还原糖变化趋势[25]。发酵初期三七渣中总糖含量与淀粉含量相差3%,但在发酵后期这一差值扩大到了8%左右,说明淀粉是发酵过程中被主要利用的碳源。

图2 发酵过程中总糖、淀粉与还原糖含量的动态变化
Fig.2 Dynamic changes of total sugar,starch and reducing sugar contents during fermentation
2.3 菌体生长动力学模型
紫色红曲霉生物量随发酵时间变化的拟合曲线见图3,相关模型参数及统计参数见表1。
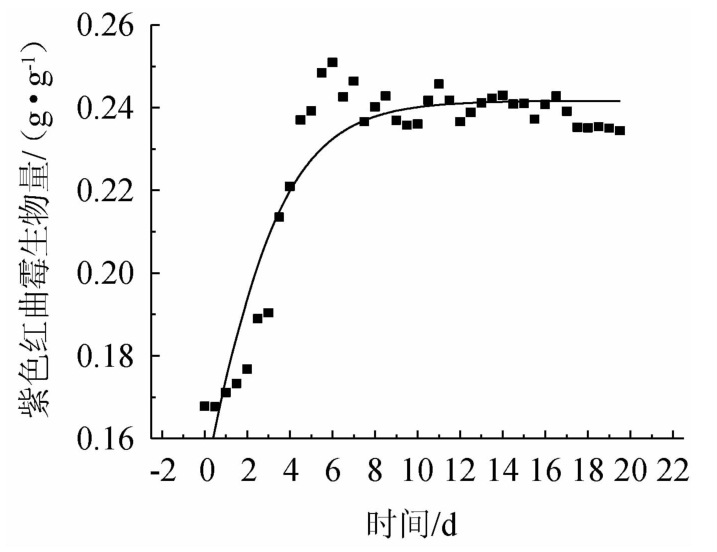
图3 菌体生长拟合曲线
Fig.3 Fitting curve of cell growth
由表1和图3可以看出,实验数据和拟合曲线的相关性较好,符合统计检验要求,菌体生长动力学模型如下:由此可以得出,比生长速率常数μ=0.457 4 d-1,最大菌体生物量Xm=0.241 6 g/g发酵培养物(干基)。
表1 菌体生长动力学模型参数
Table 1 Parameters of cell growth kinetics model


2.4 产物生成动力学模型
红色素色价随发酵时间变化的拟合曲线如图4所示,相关模型参数及统计参数见表2。
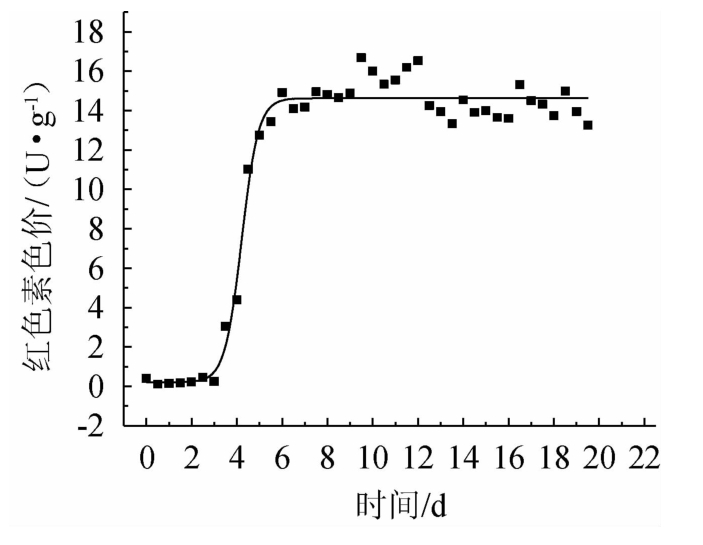
图4 产物生成拟合曲线
Fig.4 Fitting curve of product generation
由表2可知,用Boltzmann模型可以很好地拟合产物生成过程,符合统计检验要求,产物生成动力学模型如下:
表2 产物生成动力学模型参数
Table 2 parameters of product generation kinetic model

由图4可知,红色素色价达到最大值一半时需要的发酵时间t0=4.21 d,最大红色素色价B2=14.63 U/g发酵培养物(干基)。
2.5 基质降解动力学模型
总糖含量随发酵时间变化的拟合曲线如图5所示,以总糖表示的基质降解动力学模型参数及统计参数见表3。
由表3和图5可以看出,用四参数对数模型可很好地拟合基质降解过程,符合统计检验要求,基质降解动力学模型如下:
表3 基质降解动力学模型参数
Table 3 Parameters of substrate degradation kinetics model

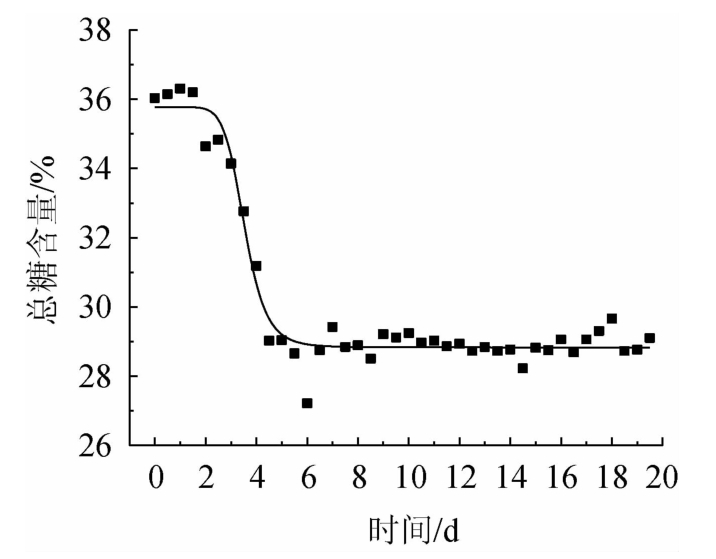
图5 总糖降解拟合曲线
Fig.5 Fitting curve of total sugar degradation

由此可以看出,发酵末期发酵培养物(干基)中总糖含量D2=28.84%,总糖消耗的半衰期t50%=3.536 d。
3 结论
本研究对紫色红曲霉固态发酵三七渣生产红色素的动力学进行了研究,建立了菌体生长、产物生成以及基质降解动力学模型。研究结果表明:采用对数模型对菌体生长动力学进行描述,每克发酵培养物(干基)中最大菌体生物量Xm=0.241 6 g,比生长速率常数μ=0.457 4 d-1;产物生成动力学适合采用Boltzmann模型进行描述,发酵培养物(干基)中最大红色素色价B2=14.63 U/g,红色素色价达到最大值一半时需要的发酵时间t0=4.21 d;基质降解动力学适合采用四参数对数模型进行描述,发酵末期发酵培养物(干基)中总糖含量D2=28.84%,总糖消耗的半衰期t50%=3.536 d。
[1]FENG Y L,SHAO Y C,ZHOU Y X,et al.Monascus pigments[J].Appl Microbiol Biotechnol,2012,96(6):1421-1440.
[2]MORALES-OYERVIDES L,OLIVEIRA J C,SOUSA-GALLAGHER M J,et al.Quantitative assessment of the impact of the type of inoculum on the kinetics of cell growth,substrate consumption and pigment productivity by Penicillium purpurogenum GH2 in liquid culture with an integrated stochastic approach[J].Food Bioprod Process,2015,96:221-231.
[3]靳梦楚,李雪,张宇翔,等.红心火龙果果酒发酵动力学研究[J].食品科技,2017,42(6):106-110.
[4]叶勤.发酵过程原理[M].北京:化学工业出版社,2005:7.
[5]MITCHELL D A,MEIEN O F,KRIEGER N,et al.A review of recent developments in modeling of microbial growth kinetics and intraparticle phenomena in solid-state fermentation[J]. Biochem Eng J,2004,17(1):15-26.
[6]ZOHREHHAMIDI-ESFAHANI Z,HEJAZI P,SHOJAOSADATI S A,et al.A two-phase kinetic model for fungal growth in solid-state cultivation[J].Biochem Eng J,2007,36(2):100-107.
[7]谭显东,黄凡,林巧玉,等.培养基特性对三七渣发酵产红曲色素的影响[J].环境工程学报,2017,11(7):4293-4297.
[8]JOHNS M R,STUART D M.Production of pigments by Monascus purpureus in solid culture[J].J Ind Microbiol,1991,8(1):23-28.
[9]魏培莲,岑沛霖,盛春琦.3种固态发酵生物量测定方法的比较[J].食品与生物技术学报,2006,25(1):60-64,69.
[10]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.9—2016食品中淀粉的测定[S].北京:中国标准出版社,2016.
[11]丛峰松,张圣海,王琦.生物化学实验[M].上海:上海交通大学出版社,2005:91-93.
[12]PANDEY A.Solid-state fermentation[J].Biochem Eng J,2003,13(2-3):81-84.
[13]LAREO C,SPOSITO A F,BOSSIO A L,et al.Characterization of growth and sporulation of Mucor bacilliformis in solid state fermentation on an inert support[J].Enzyme Microb Technol,2006,38(3-4):391-399.
[14]程新,夏海林,黄林,等.红曲霉JR发酵动力学模型的建立[J].江西农业大学学报,2010,32(3):590-594.
[15]谭显东,胡伟,段娅宁,等.三七渣发酵生产蛋白饲料的菌体生长动力学[J].中国粮油学报,2014,29(4):72-77.
[16]谭显东,段娅宁,王君君,等.三七渣固态发酵生产蛋白饲料的动力学[J].食品与生物技术学报,2013,32(11):1188-1193.
[17]谭显东,刘凤梅,段娅宁,等.麦冬渣固态发酵生产蛋白饲料的动力学研究[J].饲料工业,2012,33(23):31-34.
[18]邵伟,熊泽,吴炜,等.红曲色素液体发酵动力学模型的构建[J].江苏调味副食品,2006,23(6):8-10,20.
[19]信亚文,郑允权,石贤爱,等.红曲霉菌液相培养高产色素低产桔霉素的代谢调控研究[J].工业微生物,2011,41(1):46-50.
[20]马超.发酵工艺及大米改性处理对红曲霉产红曲色素的影响[D].西安:陕西师范大学,2011.
[21]顾玉梅,许赣荣,陈蕴,等.红曲霉菌9903发酵工艺条件对色素及桔霉素生产的影响[J].食品与生物技术,2002(1):43-47.
[22]衣珊珊.紫甘薯淀粉制备红曲色素的液态发酵技术研究[D].南京:南京农业大学,2006.
[23]谭显东,王君君,段娅宁,等.三七渣发酵生产蛋白饲料的总糖和淀粉降解动力学[J].农业机械学报,2013,44(1):157-161,156.
[24]谭显东,段娅宁,王君君,等.单菌和混菌固态发酵三七渣生产蛋白饲料的动力学比较[J].中国饲料,2012(17):33-35.
[25]金李玲,孙丽霞,陈思婷,等.鼠李糖乳杆菌半固态发酵法生产L-乳酸及发酵动力学分析[J].食品工业科技,2015,36(19):195-201.