天麻(Gastrodia elate)又名赤箭、离母等[1],其味甘、性平[2],具有镇静催眠、平肝息风、增强记忆、改善阿尔兹海默症等[3-5]功能,其药效成分主要是天麻素(p-hydroxymethylphenyl-β-D-glucopyranoside,GA)、对羟基苯甲醇(p-hydroxybenzyl alcohol,HA)[6],且为2020版《中华人民共和国药典》天麻的指标成分[7]。其中对羟基苯甲醇是天麻素的苷元,天麻素经微生物作用后会分解为对羟基苯甲醇[8],现代药理显示其在失眠、阿尔兹海默症、抑郁、认知障碍等方面有显著疗效[9]。颜汉文等[10]研究发现,对羟基苯甲醇对MCAO/R模型大鼠血脑屏障的保护作用研究,蒋石等[11]研究发现,对羟基苯甲醇对急性脑缺血损伤大鼠具有一定的改善作用,所以对羟基苯甲醇是天麻中的功能性成分。天麻是我国著名的药食同源药材[12],以其为原料生产加工的功能性产品逐渐受到关注。目前,我国的天麻以鲜食和天麻粉等初级加工产品为主,尚缺乏天麻的精深加工产品。食用植物酵素(edible plant source Jiaosu)以植物为原料,是经微生物发酵制得的含有特定生物活性成分(多糖类、寡糖类、蛋白质及多肽、氨基酸类、维生素类等)的可食用的酵素产品[13]。有研究表明,酵素具有美容养颜、降脂、解酒、促进消化等[14-15]功效,而药食两用植物酵素兼具食药两用特点,含有功效酶、多酚、有机酸、多糖等多种活性成分,能降低活性氧引起的机体伤害,增强人体免疫力[16]。朱德艳[17]采用药食两用资源葛根制备葛根酵素,经发酵后的葛根酵素黄酮含量增加、更易于人体吸收。目前,国内外研究主要关注于天麻的药理作用,对天麻酵素的研究少有报道。
因此,该实验以干天麻粉为原料,研究发酵剂用量、糖添加量、发酵温度、发酵时间对天麻酵素中对羟基苯甲醇含量的影响,采用单因素试验结合响应面试验对发酵工艺条件进行优化,并探究酵素化处理对天麻中功能性物质、抗氧化活性的影响,为天麻酵素这种新型功能性产品的开发与应用提供技术参考依据。
1 材料与方法
1.1 材料与试剂
天麻粉:德江县绿通天麻发展有限公司;白砂糖:市售;发酵菌种(酵母菌∶乳酸菌∶醋酸菌=1∶1∶1):贵州省中国科学院天然产物化学重点实验室;甲醇(色谱纯):安徽人地高纯溶剂有限公司;乙醇(分析纯):天津富宇精细化工有限公司;苯酚、浓硫酸、磺基水杨酸、磷酸(均为分析纯):天津市科密欧化学试剂有限公司;硝酸铝、氢氧化钠(均为分析纯):成都金山化学试剂有限公司;芦丁、没食子酸标准品:上海源叶生物科技有限公司;对羟基苯甲醇标准品(纯度>98%)、福林酚、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryhydrazyl,DPPH)自由基清除率、超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total antioxidant capacity,T-AOC)试剂盒:北京索莱宝科技有限公司。
1.2 仪器与设备
Agilent 1100型高效液相色谱仪:美国Agilent公司;UV-1800紫外分光光度计:岛津仪器(苏州)有限公司;VICTOR Nivo酶标仪:珀金埃尔默企业管理有限公司;YH-A20002型电子天平:瑞安市英衡电器有限公司;SPX-100生化培养箱:上海博讯实业有限公司;TG-18W高速离心机:济南爱来宝医疗科技有限公司。
1.3 试验方法
1.3.1 天麻酵素发酵工艺流程与操作要点
天麻粉→溶解→熟化→酶解→接种→发酵→过滤→酵素成品
溶解:称取一定量的天麻粉,按照料液比1∶20(g∶mL)加水溶解。
熟化:将溶解后的天麻液加热煮沸15 min,再添加一定质量的白砂糖,搅拌使白砂糖完全溶化。
酶解:待温度降至50~60 ℃时,添加质量分数0.03%的纤维素酶。
接种:待温度降至30~40 ℃时,最后添加一定量的发酵剂,期间每10 min振荡一次,至产生大量气泡即可。
发酵:混合均匀后置于恒温培养箱中静置培养,以保鲜膜密封,用橡皮圈扎紧。
过滤:将天麻酵素用过200目滤网将滤渣和酵素液分离开来,即得到天麻酵素样品。
1.3.2 天麻酵素发酵工艺优化单因素试验
选取发酵剂的用量(0.1%、0.3%、0.5%、0.7%、0.9%),糖添加量(5%、7%、9%、11%、13%),发酵时间(7 d、14 d、21 d、28 d、35 d),发酵温度(26 ℃、29 ℃、32 ℃、35 ℃、38 ℃)4个因素进行单因素试验,考察以上因素单独变化时对天麻酵素中对羟基苯甲醇含量的影响。
1.3.3 天麻酵素发酵工艺优化响应面试验
在单因素试验的基础上,根据Box-Behnken中心组合试验设计原理,设计4因素3水平响应面试验,以发酵剂用量(A)、糖添加量(B)、发酵时间(C)、发酵温度(D)为自变量,以对羟基苯甲醇的含量(Y)作为响应值,通过建立回归方程确定天麻酵素发酵的最佳工艺条件,响应面试验因素与水平见表1。
表1 天麻酵素发酵条件工艺响应面试验因素与水平
Table 1 Factors and levels of response surface test for Gastrodia elata Jiaosu fermentation process optimization

1.3.4 对羟基苯甲醇、对羟基苯甲醛含量的测定[18]
采用高效液相色谱法测定对羟基苯甲醇、对羟基苯甲醛含量。
高效液相色谱条件:Syncronis C18色谱柱(4.6 mm×250 mm,5 μm),柱温30 ℃;流速1.0 mL/min,进样体积5 μL;检测波长220 nm;流动相A为0.05%磷酸水溶液(体积分数,下同),B为甲醇。梯度洗脱程序:0~10 min,B为10%;10~15 min,B 由10%升 至15%;15~20 min,B 由15%升 至20%;20~30 min,B由20%升至40%;30~40 min,B由40%升至50%。
样品的处理:取2 mL样品10 000 r/min离心5 min,取上清液过0.22 μm水系滤膜上机待测。最后将各种物质的峰面积代入标准曲线(对羟基苯甲醇的标准曲线为:Y=2 905.7X+34.232,R2=0.999 8;对羟基苯甲醛的标准曲线为Y=7 145X+77.17,R2=0.999 7),得到对羟基苯甲醇、对羟基苯甲醛的含量。
1.3.5 理化指标检测
pH采用pH计进行检测;酒精度参照国标GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》的酒精计法测定;多糖采用苯酚-硫酸法[19]进行测定;抗氧化指标DPPH自由基清除率、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)的测定参照试剂盒的测定方法[20]。
游离氨基酸和γ-氨基丁酸的测定:采用氨基酸自动分析仪进行检测,准确称取1.022 g磺基水杨酸至100 mL容量瓶中并定容,配制成1%的磺基水杨酸溶液;取不同样品1 mL分别加入9 mL磺基水杨酸溶液,振荡均匀,10 000 r/min离心15 min,上清液经0.22 μm水系滤膜过滤后上机检测。
1.3.6 数据分析
本试验数据采用Excel 2019和Design Expert V8.0.6对数据进行分析,采用Origin 9.0进行作图。
2 结果与分析
2.1 天麻酵素发酵工艺优化单因素试验
2.1.1 发酵剂用量对天麻酵素中对羟基苯甲醇含量的影响
由图1可知,发酵剂用量过少时,菌种繁殖速度缓慢,发酵周期延长,此时对羟基苯甲醇的含量较低,酵素浑浊,随着发酵剂用量的增加,含量呈现出先上升后下降的趋势,当发酵剂用量为0.3%时,对羟基苯甲醇的含量达到最高为0.51 g/L,此时酵素呈现橙红色,体系澄清透明。而当发酵剂的用量过大时,体系的酸度增加,反而会抑制菌种的增殖,用于转换对羟基苯甲醇的菌种会相应减少[21],且发酵剂的用量过多会导致天麻酵素中酵母味过重,影响酵素的品质[22]。因此,选取0.3%的发酵剂用量进行后续试验。
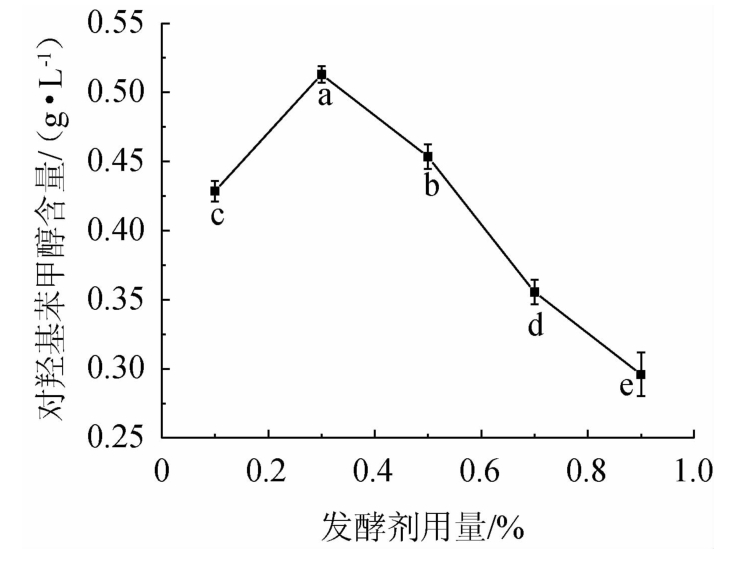
图1 发酵剂用量对天麻酵素中对羟基苯甲醇含量的影响
Fig.1 Effect of starter culture addition on p-hydroxybenzyl alcohol contents in Gastrodia elata Jiaosu
组间不同字母代表差异显著(P<0.05),下同。
2.1.2 糖添加量对天麻酵素中对羟基苯甲醇含量的影响
由图2可知,当白砂糖添加量为5%~7%时,由于糖度不足,无法为微生物的生长提供足够的碳源,微生物的生长代谢速率降低,菌种的增殖受到抑制,天麻素分解成对羟基苯甲醇的速率降低[23],当糖度过低时,酵素口感酸涩、滋味较差。当白砂糖添加量为11%,对羟基苯甲醇的含量达到最高为0.51 g/L,此时酵素的酸甜适宜、苦涩味淡薄,当白砂糖添加量为13%时,糖分过高,易形成高渗透压环境,微生物长期处于高渗环境容易衰老[24],影响对羟基苯甲醇的含量,且过甜会影响酵素的口感。说明此时的白砂糖添加量最佳,可选糖添加量为11%进行下一步试验。
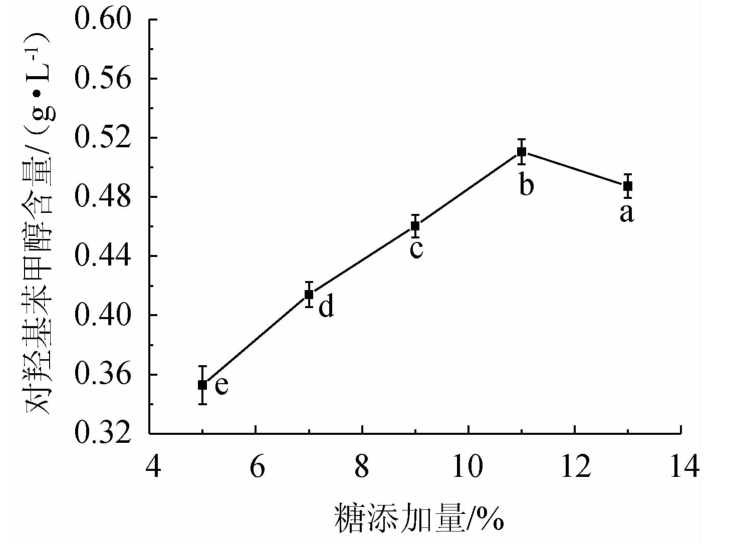
图2 糖添加量对天麻酵素中对羟基苯甲醇含量的影响
Fig.2 Effect of sugar addition on p-hydroxybenzyl alcohol contents in Gastrodia elata Jiaosu
2.1.3 发酵温度对天麻酵素中对羟基苯甲醇含量的影响
发酵温度对微生物的生长具有重要作用。由图3可知,发酵温度在26~32 ℃时,微生物生长缓慢,可能造成不完全发酵[25],对羟基苯甲醇的含量较低,此时酵素浑浊、涩味明显、酸甜不协调,当发酵温度为35 ℃时,对羟基苯甲醇的含量达到最高为0.54 g/L,而当发酵温度为38 ℃时,微生物由于长期处于过高的温度环境导致菌种死亡。说明35 ℃是菌种发酵的最佳温度,此时酵素香气浓郁、口感协调。
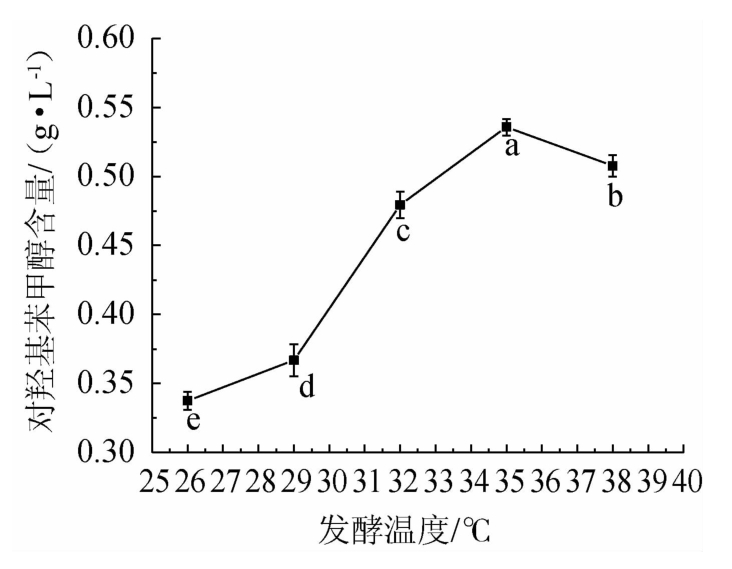
图3 发酵温度对天麻酵素中对羟基苯甲醇含量的影响
Fig.3 Effect of fermentation temperature on p-hydroxybenzyl alcohol contents in Gastrodia elata Jiaosu
2.1.4 发酵时间对天麻酵素中对羟基苯甲醇含量的影响
由图4可知,随着发酵时间的延长,对羟基苯甲醇的含量呈现先上升后下降的趋势,在发酵14 d时对羟基苯甲醇的含量达到最高,当发酵时间低于14 d时,天麻酵素浑浊不澄清、苦涩味明显、滋味不协调、香气淡薄;当发酵时间在14~28 d时,酵母生长旺盛,代谢能力增强,转换对羟基苯甲醇的速率增长较快;发酵时间超过35 d时,由于菌体开始出现衰亡自溶,口感会呈现出苦味,滋味不协调。而采用发酵法制备酵素,在一定程度上,酵素口感较为适宜的条件下,其发酵时间越短越好[26],所以选用发酵14 d为最佳发酵时间。
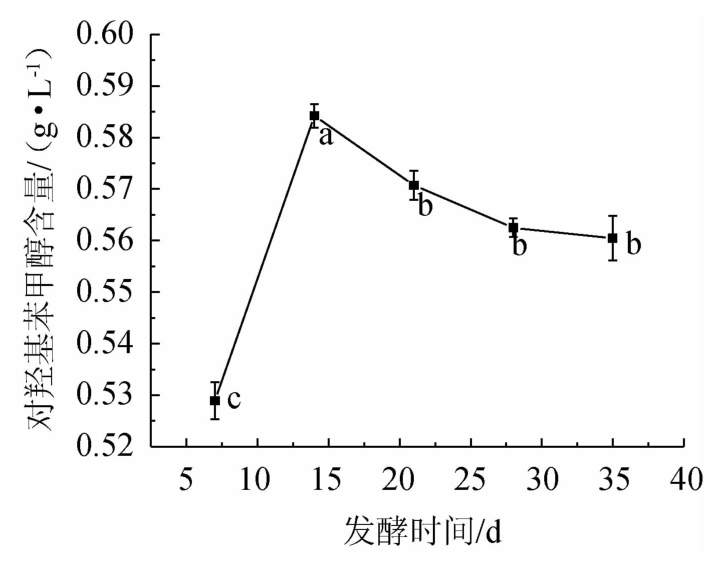
图4 发酵时间对天麻酵素中对羟基苯甲醇含量的影响
Fig.4 Effect of fermentation time on p-hydroxybenzyl alcohol contents in Gastrodia elata Jiaosu
2.2 天麻酵素发酵工艺优化的响应面试验
2.2.1 响应面试验结果与分析
根据Box-Behnken试验设计原理,在单因素试验结果的基础上,进行响应面分析试验,试验设计与结果见表2,回归方程方差分析见表3。
表2 响应面试验设计与结果
Table 2 Design and results of response surface methodology
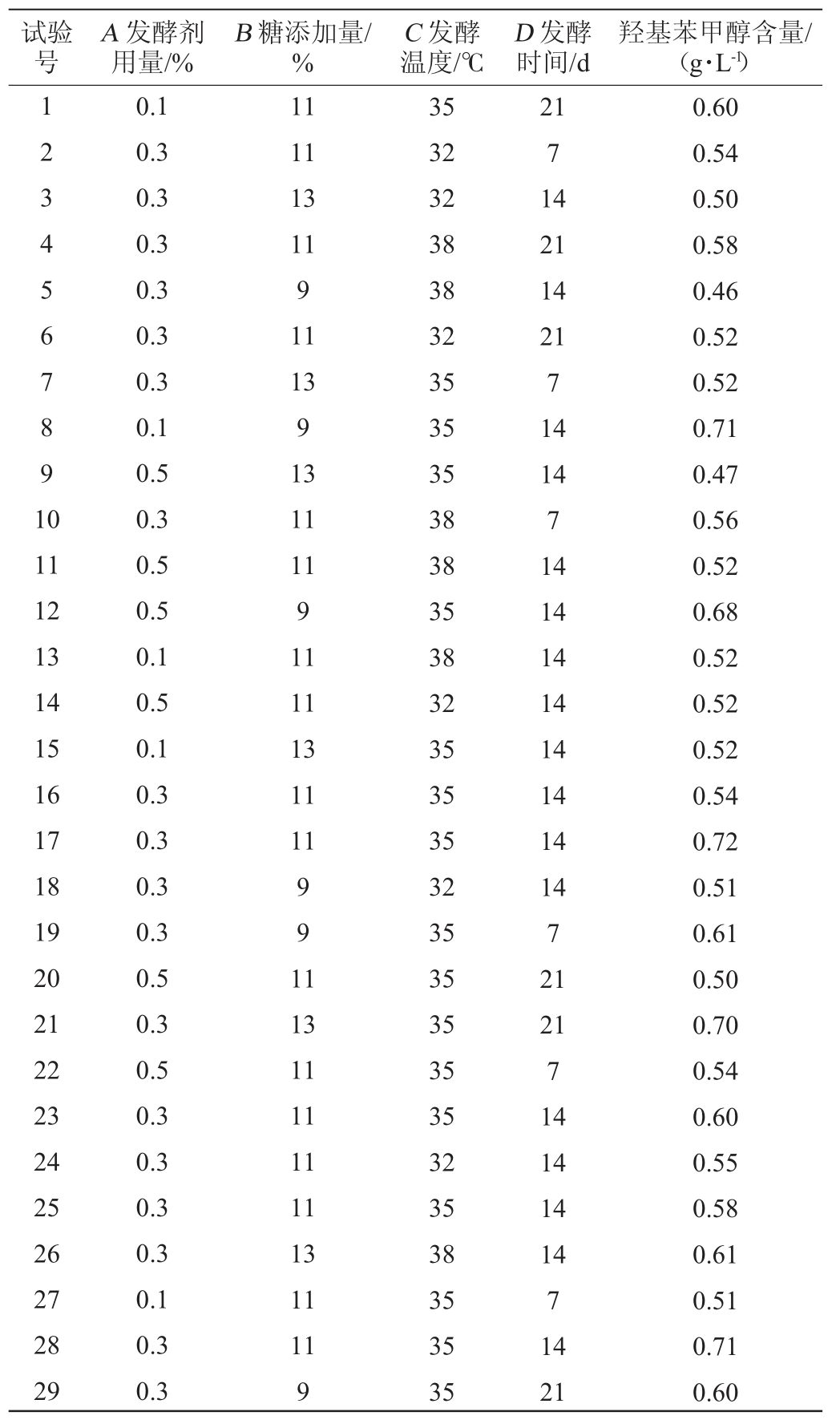
表3 回归方程方差分析
Table 3 Variance analysis of regression equation

注:“**”表示差异极显著(P<0.01);“*”表示差异显著(P<0.05)。
利用Design-Expert 8.0软件对表2的数据进行分析,得到各个因素对对羟基苯甲醇的二次回归方程:Y=0.7-0.013A-6.000E-003B+0.21C-0.023D-0.052AB+3.000E-003AC-0.013AD-7.000E-003BC-0.020BD-0.026CD-0.1A2-0.065B2-0.073C2-0.084D2。
由表3可知,该模型极显著(P<0.000 1),失拟项不显著(P>0.05),模型的决定系数R2=95.84%,表明试验结果与模型拟合度良好,可用该模型推测试验结果。从F值可看出,影响对羟基苯甲醇含量的各因素主次为发酵时间(D)>发酵温度(C)>发酵剂用量(A)>糖添加量(B)。再观察各响应值P值变化,从P值可知,一次项A、C、D及交互项CD对结果影响显著(P<0.05),二次项A2、B2、C2、D2对天麻酵素中的对羟基苯甲醇的含量有极显著的影响(P<0.01),交互项AB、CD对其有显著影响(P<0.05)。
2.2.2 响应面中各因素交互作用对天麻酵素中对羟基苯甲醇含量的影响
由图5可知,糖添加量与发酵剂的曲线最陡峭,等高线呈椭圆形,说明这二者的交互作用对天麻酵素中对羟基苯甲醇的含量影响最显著(P<0.05),其次是发酵时间与发酵温度对对羟基苯甲醇的影响显著(P<0.05),而糖添加量与发酵温度、发酵温度与发酵剂用量、发酵时间与发酵剂用量、糖添加量与发酵时间的响应面图较为平缓,且呈圆形,说明这四者的交互作用对对羟基苯甲醇的含量影响不显著(P>0.05),这与表3的结果一致。

图5 各因素交互作用对天麻酵素中对羟基苯甲醇含量影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on the p-hydroxybenzyl alcohol content in Gastrodia elata Jiaosu
2.2.3 回归模型验证试验
响应面试验得到的最佳工艺参数为发酵剂用量0.29%、糖添加量10.98%、发酵温度35.52 ℃、发酵时间12.89 d。根据试验实际操作条件,得到发酵工艺参数为发酵剂用量0.3%、糖添加量11%、发酵温度35 ℃、发酵时间14 d,在此最佳发酵条件下进行3次验证试验,得到天麻酵素中对羟基苯甲醇的平均含量可达0.69 g/L,与回归方程的预测值0.71 g/L相近,说明该模型能很好的预测天麻酵素发酵工艺与对羟基苯甲醇含量的关系。
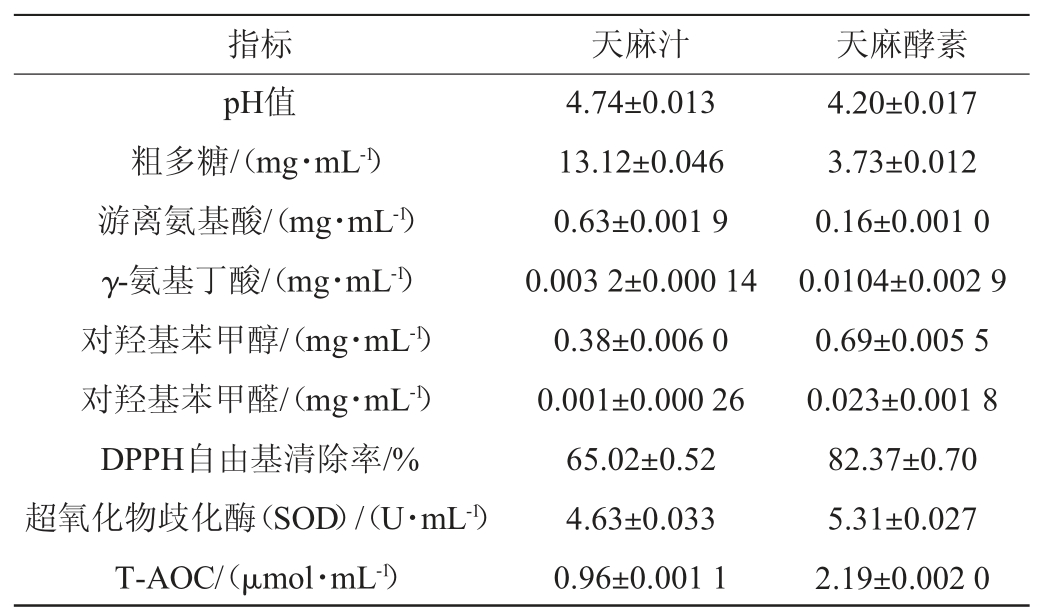
2.3 天麻酵素产品指标
天麻酵素产品的各品质指标测定结果见表4。由表4可知,最佳发酵工艺获得的天麻酵素各指标均符合QB/T 5332—2018《植物酵素》中关于食用植物酵素的标准。其中天麻酵素中粗多糖、游离氨基酸相比于未发酵的天麻汁分别下降71.57%、74.60%,这可能是由于发酵前期酵母菌利用糖类和氨基酸进行无氧发酵转化为酒精以及氨基酸自身的氧化降解,导致氨基酸与多糖含量降低[27]。γ-氨基丁酸、对羟基苯甲醇、对羟基苯甲醛是未发酵的天麻汁的3.25倍、1.8倍、23倍,抗氧化指标DPPH自由基清除率、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)分别上升了26.68%、14.69%、77.19%,说明天麻经酵素化处理后,功能性物质在微生物的作用下大量溶出,天麻酵素中DPPH自由基清除率、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)提升可能与功能性物质含量的升高有关[28]。
表4 天麻酵素各品质指标测定结果
Table 4 Determination results of some indexes of Gastrodia elata Jiaosu
3 结论
本研究通过单因素试验并结合响应面试验优化天麻酵素发酵条件,确定最优发酵工艺条件为发酵剂用量0.3%、糖添加量11%、发酵温度35 ℃、发酵时间14 d。在此最佳发酵条件下得到天麻酵素中对羟基苯甲醇的平均含量可达0.69 g/L,此时的天麻酵素呈橙红色、体系澄清、香气浓郁、酸甜味协调。相比于未发酵天麻汁,天麻酵素的功能性物质γ-氨基丁酸、对羟基苯甲醇、对羟基苯甲醛分别增加了3.25倍、1.8倍、23倍,抗氧化指标DPPH自由基清除率、超氧化物歧化酶(SOD)活力、总抗氧化能力(T-AOC)分别上升了26.68%、14.69%、77.19%。后期将进一步采用动物体内试验研究天麻酵素对中枢神经系统疾病(失眠症、阿尔兹海默症)的作用,系统性阐述其对神经药理活性的作用机制,为研发神经类疾病药物、功能性食品奠定基础。
[1]于倩,张艺,苏瑶,等.天麻提取酒液与天麻渣液态发酵酒的调配酒初探[J].食品科技,2020,45(3):100-104.
[2]肖佳佳,黄红,雷有成,等.天麻HPLC指纹图谱建立及判别分析[J].中国中药杂志,2017,42(13):2524.
[3]WANG N,WU T X,ZHANG Y,et al.Experimental analysis on the main contents of Rhizoma Gastrodiae extract and intertransformation throughout the fermentation process of Grifola frondosa[J]. Arch Pharm Res,2013,36:314.
[4]韩忠,蔡梦洁,成军虎,等.微波对天麻鱼头汤营养和安全性影响[J].现代食品科技,2018,34(2):123.
[5]袁志鹰,李亚林,张朋,等.不同泡制时间天麻酒药效成分动态溶出规律研究[J].时珍国医国药,2020,31(3):609-611.
[6]储瑞,励娜,陈一龙,等.不同加工方式的渝产天麻指纹图谱及化学成分含量分析[J].药物分析杂志,2021,41(9):1621-1633.
[7]国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2015:3-28.
[8]张志龙,郜玉钢,臧埔,等.天麻素、对羟基苯甲醇对中枢神经系统作用机制研究进展[J].中国中药杂志,2020,45(2):312-320.
[9]张成宸,石京山.天麻的酚类成分及其中枢神经药理作用研究进展[J].中药药理与临床,2019,35(2):167.
[10]颜汉文,贾媛媛,杨媛,等.对羟基苯甲醇对MCAO/R模型大鼠血脑屏障的保护作用研究[J].中药药理与临床,2016,32(6):22-25.
[11]蒋石,刘姗姗,向彬,等.对羟基苯甲醇对急性脑缺血损伤大鼠脑内炎症因子的影响[J].中成药,2015,37(10):2132-2135.
[12]柳威,邓林华,祁东利,等.天麻及其有效成分的药理作用概述[J].中药药理与临床,2021,37(4):240-244,12.
[13]中国生物发酵产业协会.T/CBFIA 08003—2017 中国生物发酵产业协会团体标准食用植物酵素[S].北京:中国标准出版社,2017.
[14]PÉREZ-BURILLO S,RUFIÁN-HENARES J A,PASTORIAZ S.Towards an improved global antioxidant response method (GAR+): Physiological-resembling in vitro digestion-fermentation method[J]. Food Chem,2018,239:1 253-1262.
[15]邸鹏月,彭宇,李晨,等.基于宏基因组分析桑葚酵素的微生物多样性[J].中国食品学报,2020,20(5):251-257.
[16]尹欢,方伟.药食两用植物酵素活性成分及发酵机理研究进展[J].农产品加工,2020(3):89-91,94.
[17]朱德艳.酵母菌发酵制备葛根酵素的工艺优化[J].食品工业科技,2020,41(12):82-87.
[18]周美,柳小兰,张明,等.高效液相色谱法测定天麻中4种化合物的含量[J].理化检验(化学分册),2017,53(10):1146-1150.
[19]吴均,黄传书,赵珮,等.响应面试验优化桑葚果酒发酵工艺及其品质分析[J].中国酿造,2021,40(1):98-104.
[20]赵敏,王瑜,李立郎,等.天麻酵素化过程中风味物质及抗氧化活性动态变化[J].食品与发酵工业,2021,47(22):92-98.
[21]洪厚胜,朱曼利,李伟,等.葡萄果渣酵素的发酵工艺优化及其理化特性[J].食品科学,2019,40(8):63-72.
[22]陈树俊,石玥,胡洁,等.响应面法优化萌发藜麦芽乳发酵工艺[J].食品科学,2017,38(16):64-70.
[23]叶林林,杨娟,陈通,等.红提和糯米复合发酵葡萄酒工艺优化及香气成分分析[J].食品科学,2019,40(18):182-188.
[24]于斌,陈娟,张世鹏,等.沙果果酒发酵工艺优化及抗氧化活性的研究[J].中国酿造,2020,39(1):142-145.
[25]梁敏,包怡红.蓝靛果酒发酵工艺优化及发酵过程对花色苷的影响[J].食品科学,2018,39(10):151-157.
[26]苏伟,母雨,齐琦,等.黑糯米酒及黑糯米保健酒品质分析[J].中国酿造,2018,37(12):180-185.
[27]王东伟,黄燕芬,肖默艳,等.猕猴桃果酒发酵条件优化及其抗氧化特性研究[J].食品安全质量检测学报,2019,10(6):1619-1625.
[28]LU J,LIU M A,YE P,et al.Characterization of major properties and aroma profile of kiwi wine co-cultured by Saccharomyces yeast(S.cerevisiae, S.bayanus, S.uvarum) and T.delbrueckin[J]. Eur Food Res Technol,2020,246(4):807-820.