葛根(Pueraria lobata)属于花豆科,形状类似于蝶形,是葛属植物的根,葛根属共有26种,其中具有药用价值的通称为葛根,目前主要分布于亚洲、北美和南美[1]。它源于中国,其根在食品和制药工业中有着悠久的应用历史。我国葛根种类繁多,且产量丰富,其中野葛的产量较多,使用范围较广。它盛产于广东、广西等地[2],主要以栽培为主。葛根中富含淀粉、异黄酮类、黄酮类物质[3]。葛根中葛根素和总黄酮的含量不到根茎的1/10[4]。葛根的生物学和药理作用主要归功于葛根素及其衍生物[5]。根中含有丰富的葛根素,通常被用作营养补充品葛根的唯一来源,而不包括其他地上部分(如叶和茎)[6]。与地上部分相比[7],葛根不仅富含次生代谢产物,还富含植物碳水化合物,包括淀粉、纤维素和水溶性碳水化合物。葛根最早在西汉的《三国志·神农本草经》中就有记述说明,葛根味甘且酸,且性凉,不仅可以有效地缓解人体内的热毒还可以促进人体内津液的分泌[8-9]。《本草纲目》中记述“大约称取葛粉四两,用浸泡了一夜米的水去溶解,煮制,并用米汤服用”有一定的缓解烦躁和止渴的作用。药理学研究表明,葛根中大豆苷元、葛根素、芦丁等多种有效成分与抗氧化、心脏保护、神经保护、抗癌和抗炎活性等药理作用相关[10]。其中的异黄酮类化合物对降血压、血脂和血糖及心脑血管疾病有显著的疗效,还可以分解酒精和保护肝脏,抗糖尿病[11],对骨质疏松还有一定的预防作用[12-13]。
葛根中黄酮类物质的提取方法较多,传统方式主要有熬煮、浸提、水提、乙醇回流提取等,目前提取的新技术则有渗滤、超声波提取、微波提取、超临界提取等[14-17]。韩剑等[18]用正交试验法,优化了葛根的提取条件;赵浩如等[19]通过对几种提取方式的对比分析,最终确定渗滤法是适合葛根的提取方法;彭游等[20]对葛根中的黄酮类化合物用微波辅助法进行提取,研究发现提取效果良好;张喜梅等[21]用超声波辅助提取法对葛根中的总黄酮类物质进行提取,提取率为1.81%;邢秀芳等[22]对葛根先用纤维素酶进行降解,再用乙醇和正丁醇提取从而得到总黄酮,提取率为1.84%;王星敏等[23]采用酶发酵技术,对葛根废渣中的植物组织进行分解,然后从这些分解的植物组织中提取黄酮类化合物,提取率为0.37%。本实验用乙醇回流法提取野葛中的黄酮类化合物,通过单因素试验和正交试验优化野葛总黄酮提取工艺,并采用紫外分光光度法分析野葛总黄酮对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、总还原能力和·OH清除能力,考察其抗氧化活性。以期为合理利用葛根资源以及开发黄酮类制品提供参考依据。
1 材料与方法
1.1 材料与试剂
野葛:同仁堂;无水乙醇、甲醇(色谱纯):天津市科密欧化学试剂有限公司;葛根素对照品、芦丁对照品(纯度>98%):上海源叶生物科技有限公司;DPPH:上海笛医生物科技有限公司;无水硫酸钠、硫酸亚铁、过氧化氢、水杨酸、铁氰化钾、过硫酸钾、三氯乙酸、三氯化铁(均为分析纯):天津市天力化学试剂有限公司。
1.2 仪器与设备
RE-2000B旋转蒸发仪:上海亚荣生化仪器厂;98-Ⅱ-B电子控温磁力搅拌电热套:金坛市金祥龙电子有限公司;SHZ-D(Ⅲ)循环水式多用真空泵:金坛市金祥龙电子有限公司;KQ3200型数控超声波清洗器:昆山市超声仪器有限公司;HC-150T2高速多功能粉碎机:永康市绿可食品机械有限责任公司;HH-2数显恒温水浴锅:金坛市江南仪器厂;BSA224S电子天平:赛多利斯科学仪器;HGZF-101-2烘箱:上海跃进医疗器械有限公司;UV-5100紫外分光光度计:上海元析仪器有限公司。
1.3 试验方法
1.3.1 野葛总黄酮的提取
将野葛洗净之后,切成薄片后晾干并进行粉碎得到野葛粉末。在不同的水浴条件下进行乙醇回流提取,过滤提取液,提取两次,合并滤液,定容、备用。
1.3.2 野葛总黄酮提取工艺优化
(1)单因素试验设计
称取每份5 g的药材共5份。基础单因素条件为:料液比1∶10(g∶mL),体积分数为70%的乙醇溶液,80 ℃,60 min,乙醇回流提取2次。分别在乙醇体积分数为40%、50%、60%、70%、80%;料液比为1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL);提取时间为30 min、60 min、90 min、120 min、150 min;提取温度为50 ℃、60 ℃、70 ℃、80 ℃、90 ℃条件下,考察乙醇体积分数、料液比、提取时间及提取温度对总黄酮提取率的影响。
(2)正交试验设计
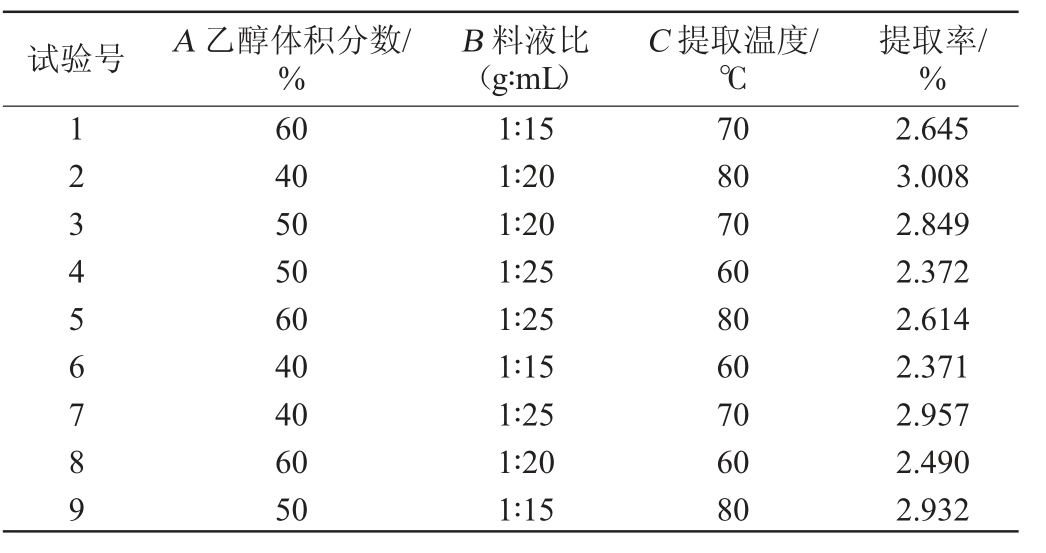
在单因素试验基础上,提取时间60 min,以总黄酮提取率为评价指标,选择乙醇的体积分数(A)、料液比(B)和提取温度(C)为影响因素,进行3因素3水平L9(33)正交试验设计,对野葛总黄酮的提取工艺进行优选。正交试验因素与水平见表1。
表1 提取工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for extraction process optimization

(3)总黄酮含量的测定
总黄酮含量的测定采用紫外分光光度法。
芦丁标准曲线的绘制:称取芦丁标准品5 mg,用2.5 mL的甲醇溶液超声溶解,并加超纯水定容在25 mL的标准容量瓶中,摇匀得到0.2 mg/mL的母液。依次吸取上述母液0、1 mL、2 mL、3 mL、4 mL、5 mL于25 mL的标准容量瓶中,首先加入6 mL的水溶液,然后加入1 mL 5%亚硝酸钠水溶液摇匀后静置5 min,再加1 mL 10%的硝酸铝水溶液,摇匀后静置5 min,最后再加10 mL 4%的氢氧化钠水溶液,并加水稀释至一定刻度,摇匀静置15 min即可,过0.45 μm滤膜。再利用紫外分光光度法在波长500 nm处测定吸光度值。以芦丁标准溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制芦丁标准曲线。得到标准曲线回归方程y=0.014 2x-0.012 0,相关系数为R2=0.994 4。
1.3.3 供试溶液的制备
精密称定浓缩得到的提取物0.1 g,用2.5 mL甲醇溶解在25 mL标准容量瓶中,加水定容至刻度,振荡摇匀后吸取2 mL转移至25 mL的标准容量瓶中,然后根据“制备标准曲线”的方法配制成0.32 mg/mL的样品溶液,过0.45 μm滤膜,在波长500 nm处测定吸光度值,按照标准曲线回归方程计算样品中总黄酮含量。
1.3.4 野葛总黄酮提取率的计算
野葛提取液经过紫外检测后所得到的吸光度值,再通过标准曲线回归方程计算即可得出总黄酮的质量浓度;总黄酮的提取率的计算公式如下:
式中:C为待测物的质量浓度,mg/mL;V1为样液体积,mL;k为稀释倍数;m为药材质量,g;V2为测定用体积,mL。
1.3.5 野葛总黄酮体外抗氧化试验
(1)DPPH·清除能力的测定
配制质量浓度为0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL和1.0 mg/mL的样品溶液和质量浓度为0.05 mg/mL DPPH·溶液。以VC作阳性对照。
对照品:2 mL DPPH·溶液+2 mL无水乙醇,记为A对;样品:2 mL DPPH·溶液+2 mL样品溶液,记为A样;空白:2 mL样品溶液+2 mL无水乙醇,记为A空。
常温下放置30 min后,在波长510 nm处测定吸光度值。DPPH·清除率计算公式如下:
式中:A空为空白吸光度值;A样为样品吸光度值;A对为对照品吸光度值。
(2)总还原能力的测定
取1 mL不同质量浓度的样液,先加2.5 mL 0.2 mol/L磷酸缓冲液和2.5 mL 1%铁氰化钾水溶液混匀,在50 ℃保温20 min,随即添加2.5 mL 10%的三氯乙酸水溶液、5 mL蒸馏水和1 mL 0.1%三氯化铁水溶液,搅拌均匀后,静置10 min为宜,再以无水乙醇代替样液按上述处理作为空白,在波长700 nm处测吸光度值(OD700nm值),以VC作阳性对照[24-26]。
当溶液中加入具有还原性物质,会发生一系列的反应。铁氰化钾会还原成亚铁氰化钾,在酸性条件下,亚铁氰化钾会与三氯化铁进行结合,生成普鲁士蓝。普鲁士蓝在700 nm波长条件下有最强吸收,因此可以通过在对应的波长下测定吸光度来检验还原性物质的总还原能力。吸光度值越大,表示样品的还原能力越强。
(3)·OH清除能力的测定
分别取不同浓度的样品溶液2 mL,然后加2 mL 9 mmol/L的FeSO4水溶液和8.8 mmol/L的H2O2水溶液,振荡均匀后静置10 min,加9 mmol/L的水杨酸溶液2 mL,摇匀后静放30 min。检测在波长510 nm处的吸光度值,记为A;不加野葛黄酮的水溶液,其他操作方法同上,所测吸光度值记为A空;用蒸馏水替代水杨酸,所测吸光度值记为A对;以相同质量浓度的VC溶液作为阳性对照。·OH清除率计算公式如下:
式中:A空为空白吸光度值;A为样品吸光度值;A对为对照吸光度值。
2 结果与分析
2.1 提取工艺优化单因素试验
2.1.1 乙醇体积分数的影响
从图1可以看出,随着乙醇体积分数在40%~80%范围内的增大,提取率呈现先增后减的趋势。在乙醇体积分数为40%~50%时,提取率随之增加;在乙醇体积分数为50%时,提取率达到最高;在乙醇体积分数>50%之后,随着乙醇体积分数的增大,提取率逐渐下降。因此,最佳乙醇体积分数为50%。
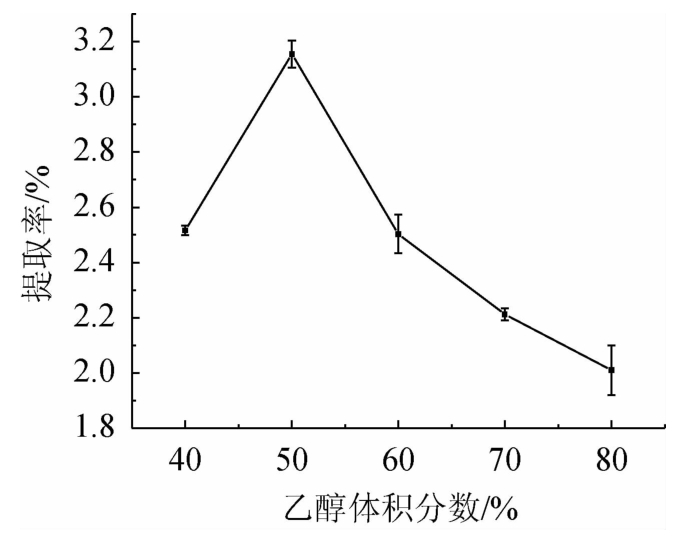
图1 乙醇体积分数对总黄酮提取率的影响
Fig.1 Effect of ethanol volume fraction on the extraction rate of total flavonoids
2.1.2 料液比的影响
从图2可以看出,随着溶剂用量的增大,总黄酮提取率呈先增后减的趋势。当料液比为1∶5~1∶20(g∶mL)时,提取率随之升高;当料液比为1∶20(g∶mL)时,提取率达到最高;当料液比为1∶20~1∶25(g∶mL),提取率随之降低。因此,最佳料液比为1∶20(g∶mL)。
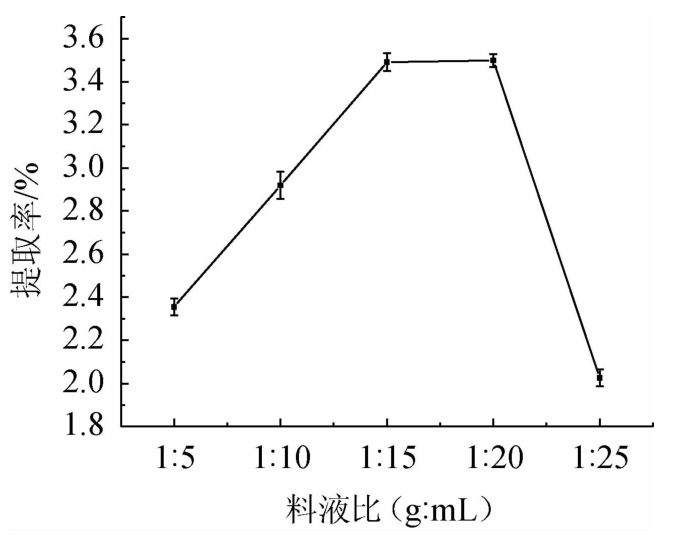
图2 料液比对总黄酮提取率的影响
Fig.2 Effect of solid and liquid ratio on the extraction rate of total flavonoids
2.1.3 提取温度的影响
从图3可以看出,随着提取温度在50~90 ℃范围内的升高,提取率呈现先增后减的趋势。当提取温度为50~70 ℃时,提取率随之增高;当提取温度为70 ℃时,提取率达到最高;当提取温度高于70 ℃之后,提取率反而越来越低。因此,最佳提取温度为70 ℃。
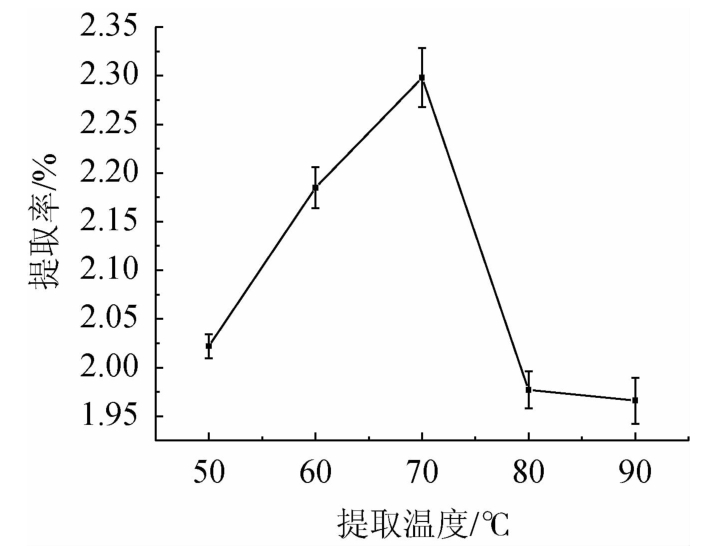
图3 提取温度对总黄酮提取率的影响
Fig.3 Effect of extraction temperature on the extraction rate of total flavonoids
2.1.4 提取时间的影响
从图4可以看出,随着提取时间在30~150 min范围内增加,提取率呈现先增后减的趋势。在提取时间为30~120 min时,提取率随之增高;在提取时间为120 min时,提取率达到最高;在提取时间>120min之后,提取率有所降低低。因此,最佳提取时间为120 min。
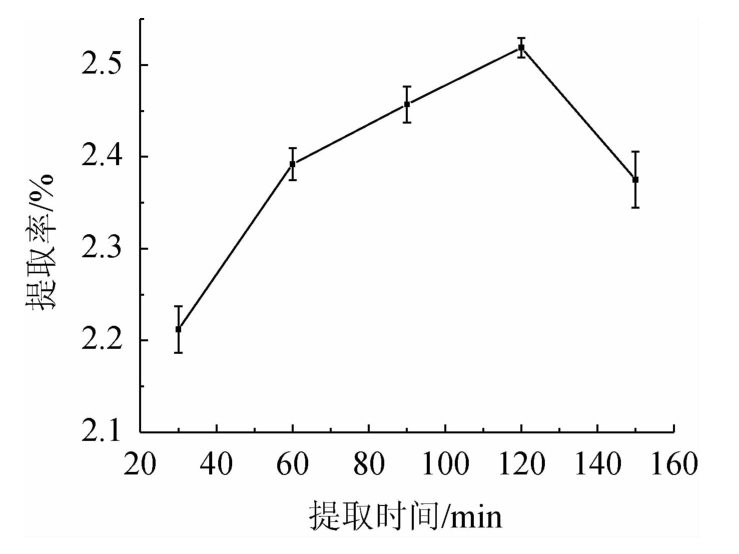
图4 提取时间对总黄酮提取率的影响
Fig.4 Effect of extraction time on the extraction rate of total flavonoids
2.2 提取工艺优化正交试验
在单因素试验结果基础上,固定提取时间为60 min,以总黄酮提取率为评价指标,选择乙醇的体积分数(A)、料液比(B)和提取温度(C)为影响因素,进行3因素3水平L9(33)正交试验设计,正交试验结果与分析见表2。
表2 提取工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for extraction process optimization
续表
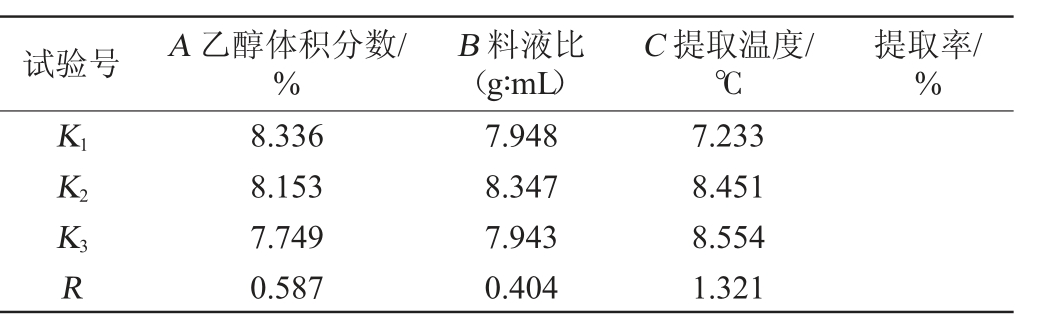
由表2可知,对结果影响的因素由大到小依次为温度(C)>乙醇体积分数(A)>料液比(B),最佳提取工艺组合为A1B2C3,即料液比1∶20(g∶mL),乙醇体积分数40%,80 ℃水浴条件下提取2 h,提取2次,总黄酮的提取率达到3.01%。在此最佳条件下进行3次平行验证试验,提取率分别为3.18%、3.00%、2.99%,平均提取率为3.06%。
2.3 野葛总黄酮体外抗氧化试验结果
2.3.1 野葛总黄酮对DPPH·清除能力的测定
由图5可知,当VC质量浓度在0.2~0.8 mg/mL时,随着VC质量浓度的增加,清除DPPH·的能力增加很快。野葛总黄酮对DPPH·的清除能力随着野葛总黄酮质量浓度的增加逐渐增强,并且DPPH·清除率与总黄酮质量浓度呈正相关。但野葛总黄酮对DPPH·的清除能力和VC相比较而言明显偏低。野葛总黄酮对DPPH·的最大清除率为72.98%。
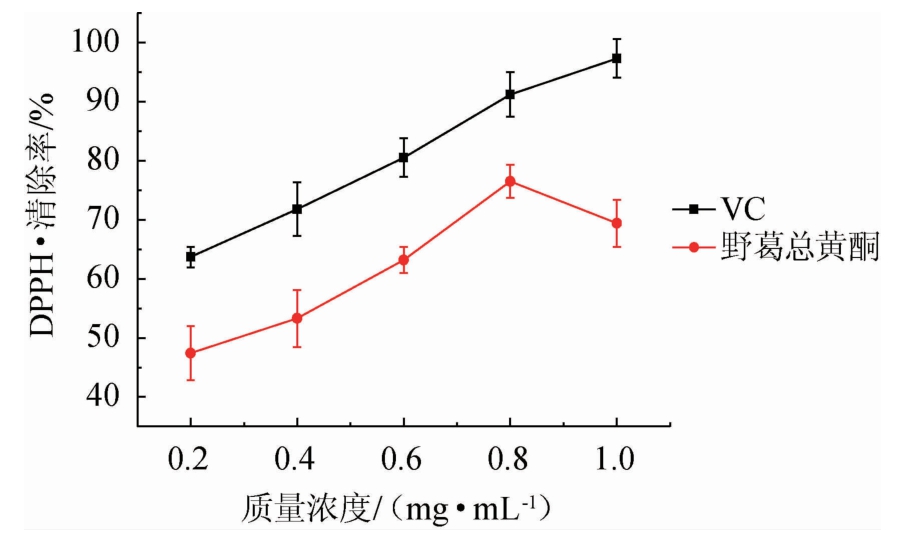
图5 野葛总黄酮对DPPH·的清除能力的影响
Fig.5 Effect of total flavonoids from Pueraria lobata on DPPH·scavenging ability
2.3.2 野葛总黄酮对·OH清除能力的测定
由图6可知,当野葛总黄酮质量浓度在0.2~0.4 mg/mL时,清除·OH的能力逐渐增加,当其质量浓度为0.4 mg/mL,清除能力最强;在0.4 mg/mL以后,野葛清除·OH的能力基本趋于平衡。野葛清除·OH的能力和VC相比较而言明显偏低。野葛总黄酮对·OH的最大清除率为65.38%。
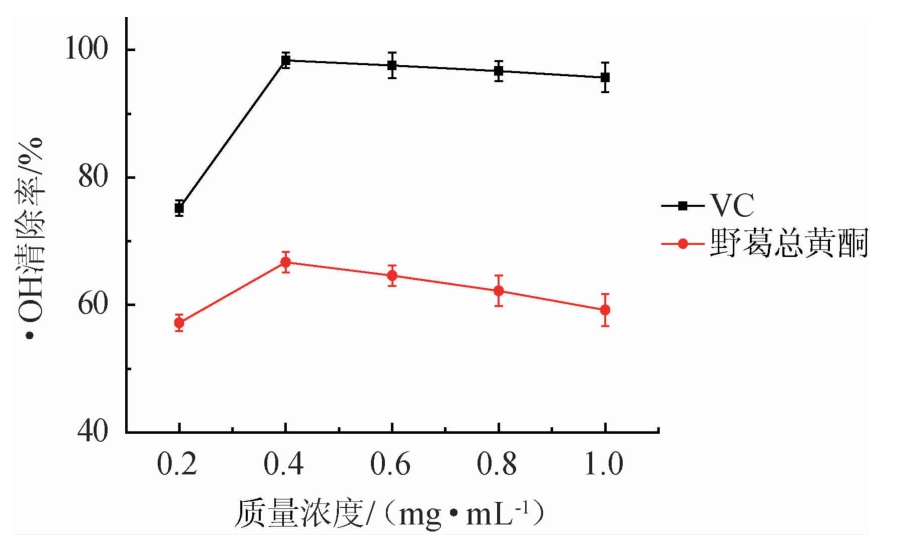
图6 野葛总黄酮对·OH的清除能力的影响
Fig.6 Effect of total flavonoids from Pueraria lobata on OH·scavenging ability
2.3.3 野葛总黄酮总还原能力的测定
物质的抗氧化能力和还原能力呈正比。由图7可知,质量浓度在0.2~0.8 mg/mL的时候,野葛和VC的还原能力随着其相对应浓度的增加而逐渐变大,但野葛的还原活性远远低于VC。野葛总黄酮的最大还原能力为0.16。
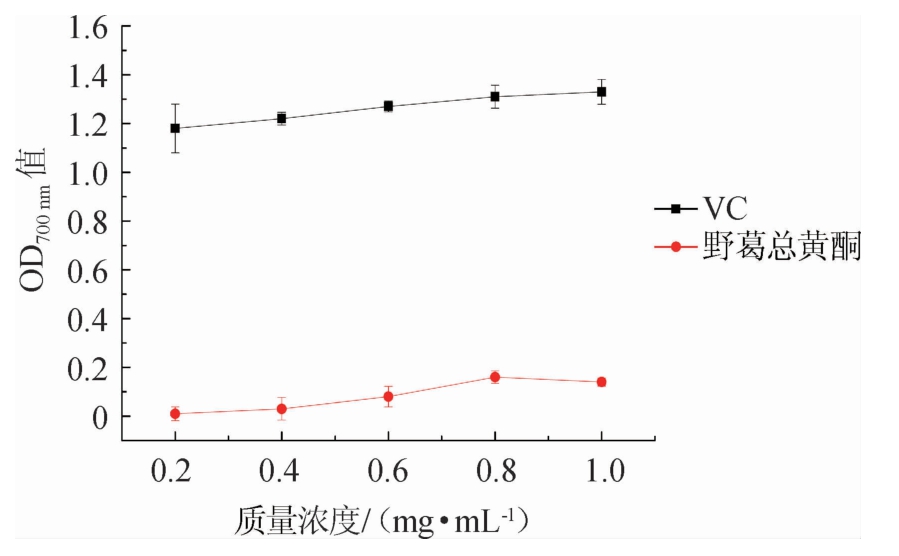
图7 野葛总黄酮总还原能力
Fig.7 Total reducing ability of total flavones from Pueraria lobata
3 结论
本试验采用乙醇回流法从野葛中提取总黄酮,经过单因素试验和正交试验确定其最佳的提取工艺为体积分数为40%乙醇,料液比1∶20(g∶mL),80 ℃水浴提取2 h,共2次,合并滤液。在此优化条件下,总黄酮的提取率是3.06%。抗氧化试验结果表明,野葛总黄酮质量浓度分别为0.8 mg/mL、0.4 mg/mL、0.8 mg/mL时,对DPPH自由基清除能力、OH自由基清除能力、总还原能力最大值分别为72.98%、65.38%、0.16。在试验设计的一定浓度范围内,抗氧化能力随着野葛总黄酮质量浓度的增大而增强,由此说明野葛总黄酮是一种具有抗氧化能力的物质,可用于抗衰老功能食品的开发和应用。
[1]WANG S G,ZHANG S M,WANG S P,et al.A comprehensive review on Pueraria: Insights on its chemistry and medicinal value[J]. Biomed Pharmacother,2020,131:110734.
[2]张雁,张孝祺.葛根的营养保健功能及开发利用[J].食品研究与开发,2000,21(2):37-39.
[3]蒋爱民,赵丽芹.食品原料学[M].南京:东南大学出版社,2011:125-134.
[4]SON E,YOON J M,AN B J.Comparison among activities and isoflavonoids from Pueraria thunbergiana aerial parts and root[J].Molecules,2019,24(5):912.
[5]PRASAIN J K.Identification of puerarin and its metabolites in rats by liquid chromatography-tandem mass spectrometry[J].J Agr Food Chem,2004,52(12):3708-3712.
[6]刘承浩,王睿.葛根素穴位注射治疗中期帕金森病:多中心随机对照试验[J].针刺研究,2015,40(1):59-60.
[7]RASHID M H,UDDIN M N,ASAEDA T,et al.Seasonal variations of carbohydrates in Pueraria lobata related to growth and phenology[J].Weed Biol Manag,2017,17(2):103-111.
[8]孙艳雪,王玉华,杨易,等.葛根中葛根素提取工艺研究[J].中国民族民间医药,2019,28(23):33-37.
[9]李昕,潘俊娴,陈士国,等.葛根化学成分及药理作用研究进展[J].中国食品学报,2017,17(9):189-195.
[10]ZHOU Y X,ZHANG H,PENG C.Puerarin:a review of pharmacological effects[J].Phytother Res,2014,28(7):961-975.
[11]SUN R,DENG X X,ZHANG D D,et al.Anti-diabetic potential of Pueraria lobata root extract through promoting insulin signaling by PTP1B inhibition[J].Bioorg Chem,2019,87:12-15.
[12]张秀胜,吴明华.良药葛根的临床应用[J].中医临床研究,2011,3(6):5-7.
[13]徐兆景.葛根素药理作用机制探讨及临床应用[J].中国现代药物应用,2016,10(8):256-257.
[14]曹雄,艾芳,刘梦瑶,等.葛根素醇提工艺的优化[J].食品与机械,2016,32(1):167-171.
[15]朱德艳.乙醇回流法提取葛根黄酮的工艺优化研究[J].中国酿造,2015,34(11):145-148.
[16]李宁宁,马占玲,陈思,等.山药中多酚的提取及其对亚硝酸盐的清除作用[J].食品安全质量检测学报,2017,8(2):475-480.
[17]吕述权,石国宗,孙丽,等.琼脂凝胶微球纯化葛根素的工艺研究[J].中国中药杂志,2016,41(6):1059-1065.
[18]韩剑,曹伟,尹华,等.正交试验法优选葛根素提取工艺[J].中国医院药学杂志,2007,27(3):332-333.
[19]赵浩如,郜凤香.葛根总黄酮的提取方法研究[J].中成药,2000,22(11):10-12.
[20]彭游,汤明,邓泽元,等.葛根黄酮微波干法辅助提取[J].食品科技,2011,36(5):211-214.
[21]张喜梅,程亮光,李琳,等.超声提取葛根总黄酮成分的研究[J].声学技术,2006,25(2):110-112.
[22]邢秀芳,马桔云,于宏芬,等.纤维素酶在葛根总黄酮提取中的应用[J].中草药,2001(1):39-40.
[23]王星敏,殷钟意,郑旭煦,等.微生物酶解破壁提制葛根黄酮的工艺[J].食品科学,2011,32(2):28-31.
[24]熊春华,周苏果,沈忱,等.响应面法优化提取菊米黄酮及抗氧化活性研究[J].中国食品学报,2014,14(7):118-123.
[25]LADO C,THEN M,VARGA I,et al.Antioxidant property of volatile oils determined by the ferric reducing ability[J]. Z Naturforsch,2015,59(5-6):354-358.
[26]毛跟年,刘艺秀,胡家欢.野艾蒿挥发油的提取工艺及抗氧化活性研究[J].食品科技,2018,43(10):294-299.