玉米须(Stigma maydis)是玉米的花柱和柱头,大部分的玉米须通过烧掉或废弃扔掉等方式进行处理,不仅造成了极大的环境污染,同时也带来了有效资源的浪费[1]。玉米须中含有很多生理活性物质,包括黄酮类化合物[2-3]、花青素[4]、多糖[5-6]、甾醇[7]等。玉米须多糖具有保护肠道[8]、抗氧化[9]、降血糖[10-11]、抗肿瘤[12]等生理功能。
目前,关于玉米须多糖的提取方法研究较多,有化学法[13-14]、物理法[15-16]、物理或化学辅助生物酶法[17]。而生物发酵法制备玉米须多糖目前鲜见报道,生物发酵法是利用菌株发酵产生的淀粉酶、蛋白酶等水解原料中淀粉、蛋白质为微生物的生长代谢提供碳源和氮源,同时生成纤维素酶等代谢产物,得到多糖。食用菌是公认的安全菌株,食用菌生长过程中可生成淀粉酶,蛋白酶等多种酶系。淀粉酶和蛋白酶利用原料中的淀粉和蛋白质,为微生物的生长繁殖提营养物质,提高了原料的利用率。同时,它使得微生物产酶与酶解过程合二为一,省去了酶解反应过程中的分离纯化过程[18]。由于食用真菌“药食同源”的特点,利用食用真菌发酵制备多糖已经成为研究热点。董玉玮等[19]利用固体发酵灵芝产多糖,得到多糖含量为24.85 mg/g。HU W等[20]对猴头菇发酵菌丝体的多糖进行纯化。
本研究玉米须为原料,以黑木耳(Auricularia auricula)为菌株,采用液体发酵制备玉米须多糖,通过单因素试验和响应面试验优化其发酵工艺条件,并考察玉米须多糖清除羟基自由基及1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力,为提高玉米须资源的附加值,为其深度开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原材料
黑木耳(Auricularia auricula)、马铃薯、玉米须(自然晾干,粉碎,过100目):市售。
1.1.2 化学试剂
葡萄糖、酵母粉、磷酸二氢钾、硫酸镁,维生素B1(vitamin B1,VB1)、维生素C(vitamin C,VC)、乙醇、氯化亚铁、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、苯酚、浓硫酸、柠檬酸、氢氧化钠(均为分析纯):北京化工厂;溴化钾(分析纯):上海源叶生物科技有限公司;水杨酸(分析纯):国药集团化学试剂有限公司;DPPH(分析纯):上海瑞永生物科技有限公司。
1.1.3 培养基
菌种培养基:200 g马铃薯切块,加水煮沸30 min,过滤,滤液中添加15 g葡萄糖,充分溶解后过滤,加水定容至1 L,分装,121 ℃高压蒸汽灭菌20 min。
发酵培养基:取10 g粉碎玉米须置于1 L蒸馏水中,调节pH值为6.0,50 ℃保温2 h,添加30 g葡萄糖、4 g酵母粉、1 g KH2PO4、0.5 g MgSO4·7H2O和0.1 g VB1。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
BSA224S电子天平:赛多利斯科学仪器有限公司;MLS-37型高压蒸汽灭菌锅:日本SANYO公司;HZQ全温振荡器:哈尔滨市东联电子技术开发有限公司;BCN-1360净化工作台:上海新苗医疗器械制造有限公司;Cary 300 scan紫外可见分光光度计:美国瓦里安VARIAN公司;VERTEX70傅里叶红外光谱仪:德国Bruker公司。
1.3 方法
1.3.1 玉米须粗多糖的制备
母种培养液的制备:向装液量为50 mL/250 mL的菌种培养基中接种质量为1 g的菌株,在温度25 ℃,摇床转速100 r/min条件下培养5 d,得到母种培养液。
发酵液的制备:在装液量为60 mL/250 mL的发酵培养基中接种一定量的母种培养液,在设定的温度下、摇床转速100 r/min培养一定的时间。
玉米须粗多糖的制备:将发酵液冻干,得到玉米须粗多糖。
1.3.2 分析检测
(1)发酵液中多糖含量测定[21]
采用苯酚-硫酸法测定多糖含量。配制0.1 mg/mL葡萄糖标准溶液,分别吸取0.1 mL、0.2 mL、0.3 mL、0.4 mL及0.5 mL葡萄糖标准溶液,各试管用蒸馏水补至1.0 mL。加入0.5 mL 6%的苯酚溶液和2.5 mL的浓硫酸后振荡混匀,静置冷却30 mL,以蒸馏水1 mL同等操作为空白对照,于波长490 nm处测定吸光度值。以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制葡萄糖标准曲线。得到标准曲线线性回归方程:y=0.024 7x+0.018 7,相关系数R2=0.994 7。
将发酵液根据标准曲线的方法进行处理。于波长490nm处测定吸光度值,代入葡萄糖标准曲线回归方程中计算多糖含量。
(2)发酵液中纤维素酶活性测定[22]
纤维素酶可以水解玉米须中的纤维素,有利于多糖的溶出,因此纤维素酶活也是一个重要指标。
取50 mg滤纸,剪碎后加至4.0 mL 0.1 mol/L柠檬酸缓冲液(pH 5.0)中,加热至50 ℃;添加1 mL发酵液于混合物中,50 ℃水浴保持2 h,采用加热法终止酶反应(95 ℃、10 min);冷却后用DNS比色法测定酶解液中还原糖增加量。纤维素酶酶活定义:1 mL粗酶液单位时间(1 min)内50 ℃水解滤纸产生l μmol葡萄糖定义为一个酶活单位(U/mL)。
纤维素酶酶活计算公式如下:
式中:X为试样纤维素酶的活性,U/g;m为根据标准曲线方程上计算得到的的葡萄糖的质量,mg;M为葡萄糖的摩尔质量,180.2 g/mol;t为酶解反应时间,min;1 000为单位换算因子,1 mmol=1 000 μmol;n为稀释倍数。
(3)粗多糖红外光谱分析[19]
取2 mg冻干后的玉米须粗多糖样品,加入200 mg kBr充分研磨后,进行压片,在波数400~4 000 cm-1范围内用红外光谱仪进行扫描。
1.3.3 发酵工艺优化
(1)单因素试验
以接种量7%,发酵温度25 ℃,发酵时间6 d为基础培养条件,分别单独考察接种量(3%、5%、7%、9%、11%)、发酵温度(15 ℃、20 ℃、25 ℃、30 ℃和35 ℃)和发酵时间(2 d、4 d、6 d、8 d和10 d)对发酵液中多糖含量和纤维素酶活的影响。
(2)响应面试验
利在单因素试验的基础上,以发酵液中多糖含量(Y)为响应值,采用Design-Expert8.0.6软件对接种量(A)、发酵温度(B)和发酵时间(C)3个因素进行响应面设计,Box-Behnken试验设计因素与水平见表1。
表1 Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments

1.3.4 玉米须粗多糖的抗氧化活性测定
(1)对·OH的清除作用
于10mL具塞试管中依次加入2mL质量浓度为1mg/mL、2 mg/mL、4 mg/mL、6 mg/mL、8 mg/mL和10 mg/mL的样品溶液、0.5 mL 9 mmol/L水杨酸-乙醇溶液、0.5 mL 9 mmol/L FeCl2溶液、6.5 mL去离子水和0.5 mL 8.8 mmol/L H2O2溶液,混合均匀,37 ℃水浴反应1 h,反应结束后以蒸馏水调零,在波长510 nm处测吸光度值,以VC作为阳性对照[23]。·OH的清除率计算公式如下:
式中:A1为样品溶液的吸光度值;A2为去离子水代替FeCl2的吸光度值;A3为去离子水代替样品溶液的吸光度值。
(2)对DPPH·的清除作用
于试管中加入2 mL质量浓度分别为1 mg/mL、2 mg/mL、4 mg/mL、6 mg/mL、8 mg/mL和10 mg/mL的样品溶液和2 mL 0.5 mmol/L的DPPH溶液(以体积分数95%乙醇配制),混匀后,室温下避光反应30 min,反应结束后在波长517 nm处测定吸光度值。以VC作为为阳性对照。DPPH·的清除率计算公式如下[24]:
式中:A1为样品溶液的吸光度值;A2为体积分数95%乙醇代替DPPH溶液的吸光度值;A3为去离子水代替样品溶液的吸光度值。
1.3.5 数据处理
利用SPSS 21.0进行数据分析,采用Design-Expert 8.0.6进行响应面试验设计,采用Origin 2018作图。
2 结果与分析
2.1 玉米须多糖发酵工艺优化的单因素试验
2.1.1 接种量对多糖含量和纤维素酶活的影响
对黑木耳进行母种培养后,在装液量为60 mL/250 mL的三角瓶中分别接种3%、5%、7%、9%和11%的母种培养液,25 ℃摇床培养(100 r/min)6 d,测定发酵液中多糖含量和纤维素酶活的结果见图1。
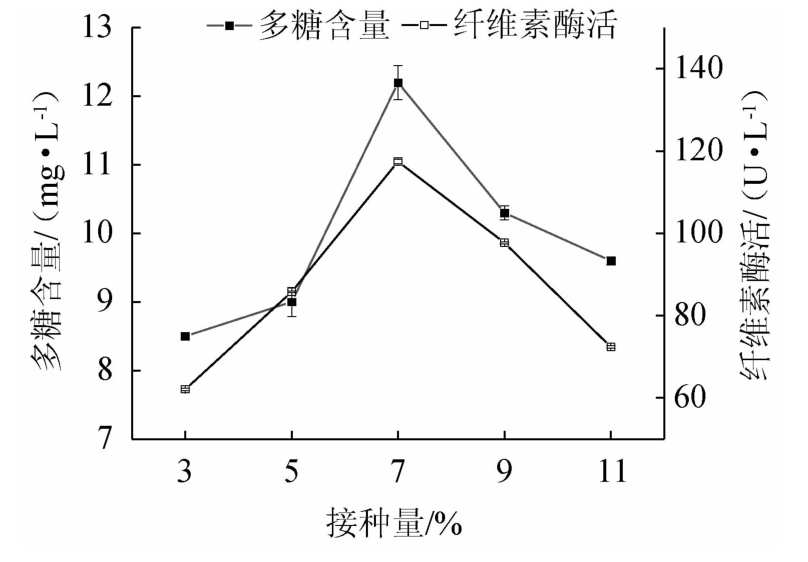
图1 接种量对多糖含量和纤维素酶活的影响
Fig.1 Effect of inoculum on polysaccharide content and cellulase activity
由图1可知,随着接种量在3%~11%范围内的增加,多糖的含量和纤维素酶活均呈现先增加后减小的趋势。当接种量为3%~7%时,多糖含量和纤维素酶活均随之升高;当接种量为7%时,糖含量和纤维素酶活分别为12.2 mg/L和117.5 U/L,均达最大值;当接种量>7%之后,多糖含量和纤维素酶活有所下降。这可能是由于当接种量增加到一定程度时,可以利用的玉米须发酵培养基中的碳源、氮源、无机盐等营养物质有限,不利于发酵代谢产物的产生[25]。因此,选择最佳接种量为7%。
2.1.2 发酵温度对多糖含量和纤维素酶活的影响
温度是影响微生物生长、代谢产物积累的主要因素之一,而且,温度还会影响酶的活性,影响酶促反应的进行,最终影响代谢产物的合成。对黑木耳进行母种培养后,在装液量为60 mL/250 mL的三角瓶中接种7%的母种培养液,发酵温度分别为15 ℃、20 ℃、25 ℃、30 ℃和35 ℃的条件下摇床培养(100 r/min)6 d,测定发酵液中多糖含量和纤维素酶活的结果见图2。

图2 发酵温度对多糖含量和纤维素酶活的影响
Fig.2 Effect of fermentation temperature on polysaccharide content and cellulase activity
由图2可知,随着发酵温度在15~35 ℃范围内的升高,多糖的含量和纤维素酶活均呈现先增加后减小的趋势。当发酵温度为15~25 ℃时,多糖含量和纤维素酶活均随之升高;当发酵温度为25 ℃时,多糖含量和纤维素酶最高,分别为12.52 mg/L和126.4 U/L;当发酵温度高于25 ℃之后,多糖含量和纤维素酶活有所下降。因此,选择最佳发酵温度为25 ℃。
2.1.3 发酵时间对多糖含量和纤维素酶活的影响
对黑木耳进行母种培养后,在装液量为60 mL/250 mL的三角瓶中接种7%的母种培养液,在温度为25 ℃的条件下摇床(100 r/min)分别培养2 d、4 d、6 d、8 d和10 d,测定发酵液中多糖含量和纤维素酶活的结果见图3。
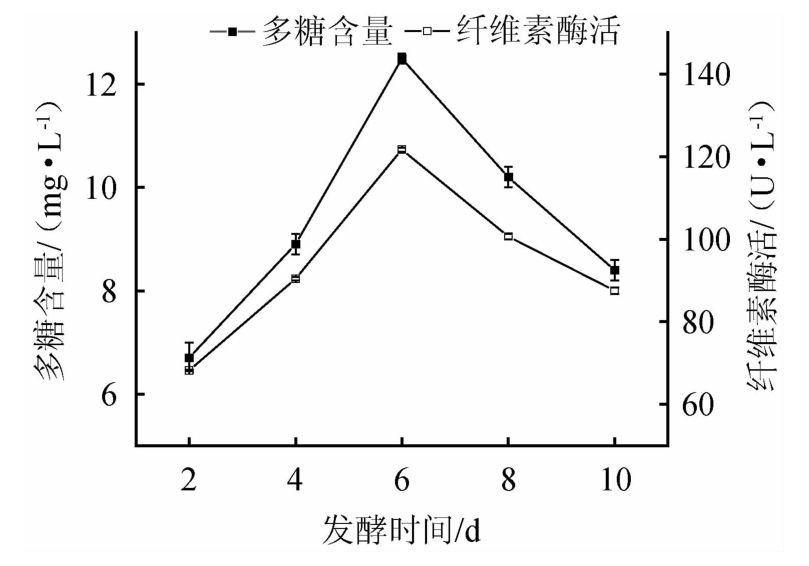
图3 发酵时间对多糖含量和纤维素酶活的影响
Fig.3 Effects of fermentation time on polysaccharide content and cellulase activity
由图3可知,随着发酵时间在2~10 d范围内延长,多糖含量和纤维素酶活均呈先增加后减小的趋势。当发酵时间为2~6 d时,多糖含量和纤维素酶活均随之升高;当发酵时间为6 d时二者达到峰值,分别为12.5 mg/L和121.7 U/L;当发酵时间超过6 d之后,多糖含量和纤维素酶活均有所下降。发酵初期营养充足,多糖逐渐积累,发酵后期营养匮乏,生长环境改变,菌体进入衰亡期,酶活降低,代谢产物不再积累。因此,选择最佳发酵时间为6 d。
2.2 响应面试验结果
基于单因素试验结果,以多糖含量(Y)作为响应值,选取接种量(A)、发酵温度(B)、发酵时间(C)为自变量,进行响应面分析,试验设计结果见表2,方差分析见表3。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments
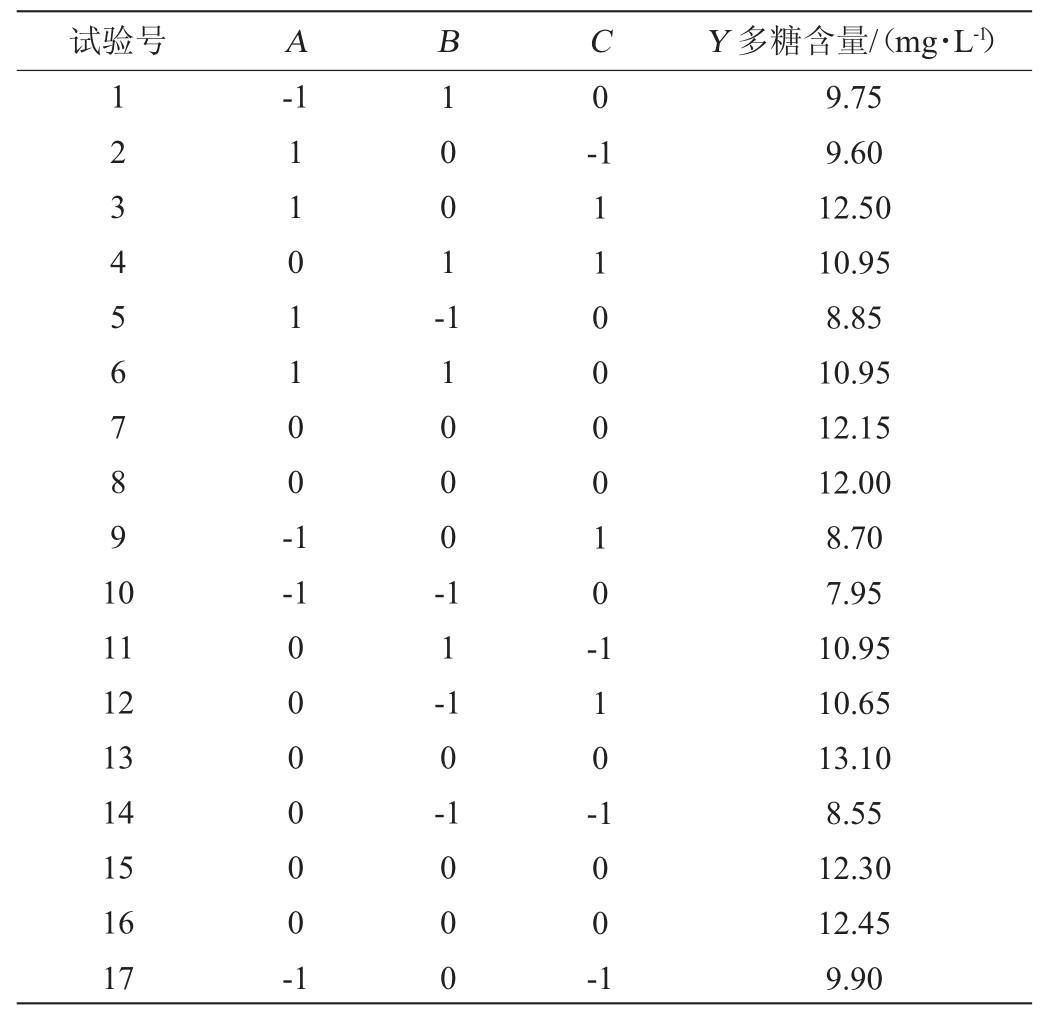
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
将表2试验数据采用Design Expert 8.0.6软件进行非线性多元回归统计分析,建立二次多项式的拟合,得到回归方程如下:Y=12.4+0.7A+0.83B+0.47C+0.075AB+1.03AC-0.52BC-1.56A2-1.46B2-0.66C2。
由表3可知,此模型回归显著(P<0.000 1),失拟项不显著(P>0.05),决定系数R2为0.971 4,表明97.14%试验结果能由此方程解释,校正决定系数R2adj为0.934 7,反映了93%左右的多糖含量变异散布于接种量、发酵温度及发酵时间3个因素内,说明模型拟合度较好[24]。变异系数(coefficient of variation,CV)为3.83%,该值反映每个平均值相对偏离情况,试验稳定性越好CV值越小,因此可以看出本试验具备相对高的置信度及可靠性。综上分析,该响应面试验可以用于黑木耳发酵玉米须制备多糖的参数预测。由表3中F值可知,影响多糖含量的主次顺序为:B(发酵温度)>A(接种量)>C(发酵时间)。由P值可知,一次项A、B,交互项AC及二次项A2、B2对响应值影响作用均达极显著水平(P<0.01),一次项C,交互项BC及二次项C2对响应值影响作用均达显著水平(P<0.05)。
2.3 响应面曲面图分析
运用Design-Expert 8.0.6软件得到各因素交互作用对多糖含量影响的响应面及等高线见图4。3个响应面曲面均为凸形,发酵过程中的参数变化对多糖含量会产生不同的影响。在所选取的试验范围内,响应值存在极大值,可以模拟出该试验的最优条件,响应面越陡,反映出各因素之间的两两交互作用越显著。由图4a可知,接种量和发酵温度的曲面图较平缓,因素间交互作用较小,由图4b和4c可知,发酵时间和接种量、发酵温度和发酵时间的曲面图较陡,交互作用对结果影响显著(P<0.05),这与方差分析结果一致。随着发酵时间的增大,多糖的含量先增加,而后在较高接种量时,增幅不大。

图4 各因素交互作用对多糖含量影响的响应面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between each factor on polysaccharide content
2.4 验证试验结果
由Design-Expert 8.0.6软件得出最佳发酵工艺条件为:接种量8%、发酵温度26 ℃、发酵时间7 d。在此条件下得到玉米须多糖含量理论值为12.77 mg/L。此优化条件下进行3次平行验证试验,得到多糖含量实际值为13.12 mg/L,与理论值12.77 mg/L接近,其发酵液中纤维素酶的活力为130.7 U/L,说明该模型能较好地预测实际多糖含量。
2.5 玉米须粗多糖的红外光谱鉴定
由图5可知,波数3 392 cm-1处的宽吸收峰在3 200~3600cm-1范围内,为饱和的O-H伸缩振动区域,波数2929cm-1的吸收峰在2 800~3 000 cm-1范围内,为饱和C-H伸缩振动吸收峰;波数1 200~1 400 cm-1范围内出现的吸收峰属于C-H的变角振动,波数1 632 cm-1处吸收峰为C=O的非对称伸缩振动吸收峰,波数1 421 cm-1附近吸收峰为C-H的变形振动吸收峰[26],这些区域所出现的峰均为糖类的特异吸收峰。
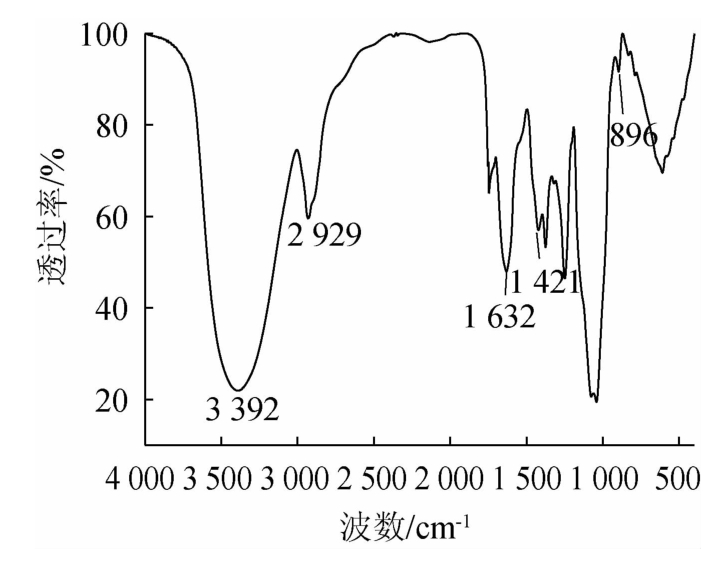
图5 玉米须粗多糖的红外光谱测定结果
Fig.5 Determination results of infrared spectrum of Stigma maydis crude polysaccharide
2.6 玉米须粗多糖的抗氧化能力分析
由图6a可知,玉米须粗多糖对·OH的清除能力存在浓度依赖关系,在10 mg/mL的质量浓度时,多糖对·OH的清除能力与0.1 mg/mL VC持平。玉米须粗多糖对·OH的最大清除率为40%左右。由图6b可知,黑木耳发酵玉米须多糖清除DPPH·的能力较强,但弱于VC。质量浓度在1~10 mg/mL范围内,多糖的清除能力与溶液质量浓度成正比例关系,在多糖质量浓度为10 mg/mL时,其清除率为43.3%。
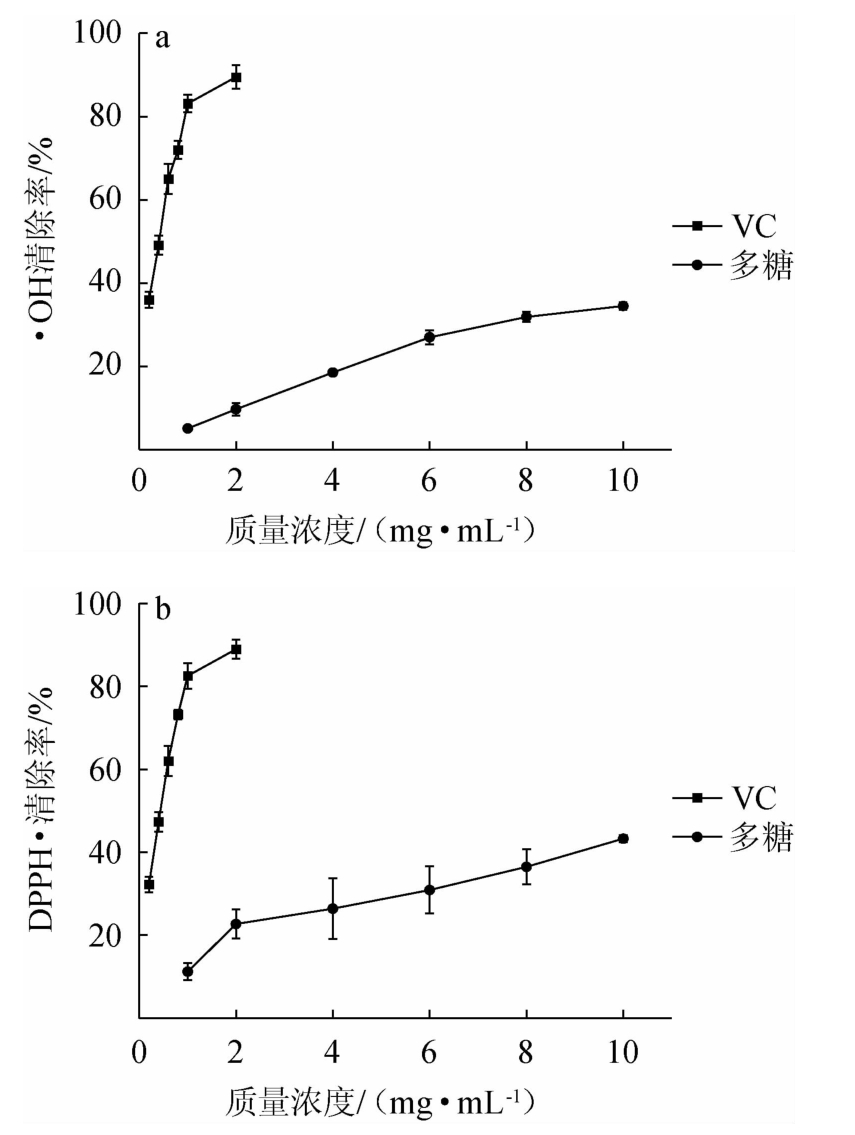
图6 玉米须粗多糖对·OH(a)和DPPH·(b)的清除能力
Fig.6 Scavenging ability of Stigma maydis crude polysaccharide on·OH (a) and DPPH·(b)
3 结论
在单因素试验的基础上对黑木耳发酵玉米须的工艺条件进行优化,优化发酵工艺条件:接种量为8%、发酵温度为26 ℃、发酵时间为7 d。此优化条件下,多糖含量为13.12 mg/L,其发酵液中纤维素酶的活力为130.7 U/L,说明该模型能较好地预测实际提取量。并对得到的多糖进行红外光谱分析和抗氧化能力分析,结果表明其红外谱图具有糖类物质的特征吸收峰,且多糖对羟基(OH)和1,1-二苯基-2-三硝基苯肼(DPPH)自由基最大清除率分别为34.5%和43.3%,后续研究可以对粗多糖对进行纯化,以提高其抗氧化活性。
[1]赵文竹.玉米须功能因子活性评价及其降血糖机理研究[D].长春:吉林大学,2014.
[2]HORA N,SANTANA L F,SILVA V,et al.Identification of bioactive metabolites from corn silk extracts by a combination of metabolite profiling,univariate statistical analysis and chemometrics[J].Food Chem,2021,365(10):130479.
[3]NURRAIHANA H,WAN ROSLI W I,SABREENA S,et al.Optimization extraction procedure and identification of phenolic compounds from fractional extract of corn silk(Zea mays hair)using LC-TOF/MS system[J].J Food Measur Charact,2018,12(3):1-11.
[4]CHATHAM L A,HOWARD J E,JUVIK J A.A natural colorant system from corn:Flavone-anthocyanin copigmentation for altered hues and improved shelf life[J].Food Chem,2020,310:125734.1-125734.12.
[5]MARAN J P,MANIKANDANANIKANDAN S,THIRUHNANASAMBANDHAM K,et al.Box-Behnken design based statistical modeling for ultrasound-assisted extraction of corn silk polysaccharide[J].Carbohydr Polym,2013,92(1):604-611.
[6]CHEN S,CHEN H,TIAN J,et al.Enzymolysis-ultrasonic assisted extraction,chemical characteristics and bioactivities of polysaccharides from corn silk[J].Carbohydr Polym,2014,101:332-341.
[7]张海燕,张杰,尚富德.玉米须中高含量植物甾醇的提纯工艺[J].食品工业科技,2017,38(3):192-195,201.
[8]JIA Y,WANG Y,LI R,et al.The structural characteristic of acidic-hydrolyzed corn silk polysaccharides and its protection on the H2O2-injured intestinal epithelial cells[J].Food Chem,2021(1):129691.
[9]JIA Y N,GAO X D,XUE Z H,et al.Characterization,antioxidant activities,and inhibition on a-glucosidase activity of corn silk polysaccharides obtained by different extraction methods[J].Int J Biol Macromol,2020,163:1640-1648.
[10]GUO Q,CHEN Z,SANTHANAM R K,et al.Hypoglycemic effects of polysaccharides from corn silk(Maydis stigma)and their beneficial roles via regulating the PI3K/Akt signaling pathway in L6 skeletal muscle myotubes-science direct[J].Int J Biol Macromol,2019,121:981-988.
[11]PAN Y,WANG C,CHEN Z,et al.Physicochemical properties and antidiabetic effects of a polysaccharide from corn silk in high-fat diet and streptozotocin-induced diabetic mice[J].Carbohydr Polym,2017,164:370-378.
[12]YANG J,LI X,XUE Y,et al.Anti-hepatoma activity and mechanism of corn silk polysaccharides in H22 tumor-bearing mice[J].Int J Biol Macromol,2014,64:276-280.
[13]宫春宇,刘羽婷,单佳明,等.玉米须多糖的乙醇沉淀分离及体内免疫调节作用研究[J].食品与发酵工业,2021,47(1):143-147.
[14]李亚平,周鸿立.玉米须多糖酸提取工艺及其抗氧化活性的研究[J].粮食与油脂,2020,33(8):86-90.
[15]宫春宇,徐硕,徐先梅,等.超滤分离制备玉米须粗多糖及其促益生菌增殖活性研究[J].食品与发酵工业,2021,47(17):166-171.
[16]宫春宇,单佳明,余世锋,等.超声波提取玉米须多糖工艺及活性研究[J].粮食与油脂,2020,33(5):85-89.
[17]陈珊珊,宋冬晶,李欣欣.玉米须多糖复合酶协同微波提取工艺优化及体外发酵研究[J].粮食与油脂,2021,34(10):104-108.
[18]曹秀娟.发酵米糠多糖的制取及其生物活性研究[D].广州:华南理工大学,2015.
[19]董玉玮,周洁,苗敬芝,等.灵芝在牛蒡固体培养基中发酵工艺优化及菌丝多糖的体外抗氧化活性[J].食品科学,2019,40(10):149-156.
[20]HU W,SONG M,WANG C,et al.Structural characterization of polysaccharide purified from Hericium erinaceus fermented mycelium and its pharmacological basis for application in Alzheimer's disease:Oxidative stress related calcium homeostasis[J].Int J Biol Macromol,2021,193(PA):358-369.
[21]曹慧馨.黑木耳多糖的制备及其抗氧化活性的研究[D].长春:长春大学,2021.
[22]解春艳.茶薪菇发酵制备麦麸膳食纤维与阿魏酰低聚糖及其生物活性研究[D].南京:南京农业大学,2010.
[23]SHARMA S,JAN R,RIAR C S,et al.Analyzing the effect of germination on the pasting,rheological,morphological and in vitro antioxidant characteristics of kodo millet flour and extracts[J].Food Chem,2021,361(21):130073.
[24]ANSARIAN E,AMINZARE M,HASSANZAD A H,et al.Nanoemulsion-based basil seed gum edible film containing resveratrol and clove essential oil: In vitro antioxidant properties and its effect on oxidative stability and sensory characteristic of camel meat during refrigeration storage[J].Meat Sci,2022,185:108716.
[25]胡永乐,张传海,林崇展,等.响应面法优化蛹虫草与厚朴双向液体发酵工艺[J].菌物学报,2020,39(5):944-954.
[26]马萍苹,鄢莉,张佳兰.米曲霉液态发酵香菇残次品产蛋白酶条件优化[J].中国酿造,2021,40(9):211-215.