果酒是以水果汁(浆)为原料利用酵母菌的发酵作用产生乙醇和二氧化碳后得到的含酒精饮料。百香果果实中含有丰富的可溶性糖、有机酸和维生素C等营养物质以及挥发性物质,香气浓郁,甜酸怡人,具有良好的加工食用价值[1]。由于近年来百香果种植面积扩大,导致百香果价格降低,市场滞销现象时有发生[2]。而百香果果酒作为百香果深加工产品之一,具有丰富的保健功效[3],能够增加百香果鲜果的附加值。目前,百香果果酒的酿造大多采用游离酵母发酵方式,如程宏桢等[4]以紫皮百香果为原料,采用游离发酵方式对百香果全果进行发酵,并优化了发酵工艺。胡来丽等[5]为提升百香果果酒品质,以百香果全果和果汁为原料进行百香果果酒的酿制,发现全果发酵得到的果酒风味更为突出。
随着固定化细胞技术的进步,将酵母菌固定在载体上(即酵母固定化)进行酒精发酵的方式受到广泛关注,有关固定化酵母发酵生产各种酒类(如香槟、葡萄酒等)的报道也不断增多[6-8]。固定化酵母发酵技术的优点有很多,如能够增加细胞的稳定性和活力、提高发酵的生产效率、细胞能够重复回收利用和改善发酵产品的质量等。酵母细胞的固定化首先要解决固定化载体的选择问题。一般地,对应用于果酒生产的酵母细胞的固定化载体的要求是惰性且卫生无毒的材料,同时也要求载体材料来源丰富,价格低廉等[9]。甘蔗渣是甘蔗制糖产业中产生的废弃产物,在南方地区来源丰富,使用成本低。而且,甘蔗渣中的纤维素含量丰富、结晶度高[10],已有研究将甘蔗渣作为固定化载体吸附细胞进行发酵,如发酵葡萄酒[11]、发酵桑葚果酒[12]、雪莲果-西番莲果酒[13]等。但目前利用甘蔗渣固定化酿酒酵母发酵制备百香果果酒的研究较少。
为了考察甘蔗渣固定化酿酒酵母(Saccharomyces cerevisiae)应用于百香果果酒的酒精发酵的可行性,本研究以甘蔗渣为载体吸附固定酿酒酵母YJSF190制备固定化酿酒酵母,并以游离酿酒酵母YJSF190作为对照,采用固定化酿酒酵母酿造百香果果酒,采用气相色谱法和液相色谱法等方法测定果酒中的乙醇、残糖、有机酸和乙酸乙酯的含量,考察甘蔗渣固定化酿酒酵母重复6个批次发酵百香果果浆的效果,为固定化酵母发酵百香果果酒提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
甘蔗渣:甘蔗去皮后经压榨装置除去甘蔗汁而得的普通蔗渣,从售卖甘蔗汁的小摊贩处获得;百香果果浆(初始糖度16.3°Bx,蔗糖70.44 g/L,葡萄糖42.27 g/L,果糖42.19 g/L,pH 2.83):广西铕熠果业有限公司;酿酒酵母(Saccharomyces cerevisiae)YJSF1909:本实验室从自然发酵的百香果果酒中分离纯化、鉴定得到,保存于甘油管中。
1.1.2 化学试剂
蛋白胨、酵母膏(均为生化试剂):英国Oxiod公司;琼脂(生化试剂):广东环凯微生物科技有限公司;焦亚硫酸钾(分析纯):浙江一诺生物科技有限公司;氢氧化钠(分析纯):广东西陇科学股份有限公司。3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):天津市光复精细化工研究所;无水葡萄糖(分析纯):北京奥博星生物技术有限责任公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)固体培养基:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂20 g/L,水1 000 mL,115 ℃条件下灭菌20 min。
YPD液体培养基:酵母膏10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,水1 000 mL,115 ℃条件下灭菌20 min。
1.2 仪器与设备
Hitachi SU8100电子显微镜、Hitachi L 2000高效液相色谱仪:日立制作所株式会社;Scion 456-GC气相色谱:天美(中国)科学仪器有限公司;PHS-25CW pH计:上海般特仪器制造有限公司;LS-B100L-1型立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;TDL-5离心机:江苏省金坛市医疗仪器厂;HWY-2112智能恒温培养摇床:上海智诚分析仪器制造有限公司;SWCJ-TB标准净化工作台:苏州安泰空气技术有限公司;WYT-4手持糖度计:山东桑泽仪器仪表有限公司。
1.3 实验方法
1.3.1 种子液的制备
将酿酒酵母YJSF1909接种在YPD固体培养基上,置于30 ℃恒温培养箱中活化48 h;取两环活化后的酵母菌接种至装液量为5 mL/25 mL YPD液体培养基中,30 ℃、120 r/min条件下摇床培养12 h,得到一级种子液。将5 mL一级种子液接种至装液量为200 mL/500 mL YPD液体培养基中,30 ℃、120 r/min条件下摇床培养12 h,得到二级种子液,备用。
1.3.2 甘蔗渣的预处理
为提高甘蔗渣与酵母细胞的结合力,参照SURENDHIRAN D 等[14]的方法,甘蔗渣需先经碱液预处理以除去甘蔗渣中的纤维素,再应用于酵母的吸附固定。具体方法为:将甘蔗渣切成0.5 cm×0.5 cm大小的甘蔗渣片,放入装有适量蒸馏水的烧杯中煮沸30 min,使残余糖分渗出,取出甘蔗渣片并将其浸泡于0.5 mol/L氢氧化钠溶液中12 h后取出,用清水洗涤甘蔗渣片至水洗液pH值为中性,接着在真空烘箱中70 ℃条件下烘干,最后在121 ℃灭菌15 min。
1.3.3 甘蔗渣固定化酵母的制备
分别取200 mL酵母细胞二级种子液置于编号为A、B的500 mL锥形瓶中,在A瓶中加入1 g经预处理后的甘蔗渣,然后将A、B两份种子液均在4 ℃条件下放置24 h,使A瓶中的蔗渣充分吸附酵母菌。然后,晃动A、B两个锥形瓶使酵母菌分布均匀后,用移液枪取样,采用血球计数板测定A、B两瓶中的游离酵母菌数量。B瓶的酵母菌计数减去A瓶的酵母菌计数即得到吸附于蔗渣上的酵母菌数量。将A瓶中的发酵液倾倒除去发酵液中未固定的酵母细胞,并用灭菌生理盐水轻轻冲洗两次,得到含固定化酵母的蔗渣片[12]。将含有固定化酵母的蔗渣片送至武汉赛维尔生物科技有限公司进行电子显微镜扫描。
1.3.4 百香果果酒的制备
用白砂糖将百香果果浆的糖度调至20°Bx,同时加入焦亚硫酸钾(50 mg/L),以防止杂菌污染。然后分别采用1.3.3制得的含固定化酵母的蔗渣片对百香果果浆进行重复6个批次酒精发酵,同时以游离态酵母发酵百香果果浆为对照组。具体方法如下:
固定化酵母发酵:取200 mL百香果果浆于锥形瓶中,接入1.3.3所制得的含固定化酵母的蔗渣片(酵母菌数量约为6.45×109个/g蔗渣),置于摇床中进行酒精发酵,发酵温度30 ℃、摇床转速120 r/min。每隔8 h用糖度计测定糖浓度,当糖浓度稳定不变时,视为酒精发酵结束,记录发酵时间。为了考察甘蔗渣固定化酵母的发酵稳定性,固定化发酵重复6个批次。每次发酵结束后,取出含固定化酵母的蔗渣片,用灭菌生理盐水洗涤两次后,重复利用于下一批次的发酵中。每次发酵使用的百香果果浆量和发酵的条件均相同。
游离酵母发酵(对照组):接入与蔗渣片所固定的酵母相同数量(酵母菌数量约为6.45×109个/g蔗渣)的游离酵母于200 mL百香果果浆中,在与固定化发酵相同条件下进行游离酵母发酵。
1.3.5 分析检测
(1)乙醇含量的测定
采用气相色谱法测定乙醇含量[15]。取2 mL 酒精发酵结束后的发酵浆液离心(10 000 r/min、10 min)取上清液,稀释10倍后取适量稀释液装入进样瓶中进行乙醇含量测定。气相色谱检测条件为:火焰离子化检测器(flame ionization detector,FID):进样口温度150 ℃;检测器温度180 ℃;进样量0.5 μL;毛细管色谱柱(30 m×0.25 mm×0.25 μm);氮气(N2)流速25 mL/min;氢气(H2)流速30.0 mL/min;空气流速300.0 mL/min。程序升温:40 ℃保持1 min,以5 ℃/min增加到100 ℃保持2 min。分流比为20∶1。
(2)有机酸的测定
采用高效液相色谱法测定[16]。取2 mL 发酵结束后的发酵浆液离心(10 000 r/min、10 min)取上清液,稀释10倍后取适量稀释液装入进样瓶中进行有机酸含量测定。高效液相色谱条件:C18色谱柱(250 mm×4.6 mm×5 μm);流动相为磷酸盐缓冲液,流速1.0 mL/min,柱温30 ℃;二极管阵列检测器(diode array detector,DAD);空气流速2.0 L/min。
(3)果糖、葡萄糖、蔗糖的测定
采用高效液相色谱法测定[17]。取2 mL 发酵结束后的发酵浆液离心(10 000 r/min、10 min)取上清液,稀释10倍后取适量稀释液装入进样瓶中进行糖类物质的含量测定。高效液相色谱条件:氨基色谱柱(250 mm×4.6 mm×5 μm);流动相为乙腈∶超纯水=75∶25(V/V),流速1.0 mL/min,柱温30 ℃;示差折光检测器(refractive index detector,RID);温度30 ℃。
(4)总残糖的测定
总残糖含量通过3,5-二硝基水杨酸(DNS)法测定[18],将0.1 mL样品和3.9 mL去离子水在试管中混合,然后将0.08 mL 12 mol/L HCl添加到混合物中。在90 ℃水解15 min,并用0.2 mL 5 mol/L NaOH中和后,取样品和不同质量浓度(0、1 mg/mL、2 mg/mL、3 mg/mL、4 mg/mL、5 mg/mL、6 mg/mL、7 mg/mL)的葡萄糖标准溶液各1 mL,分别置于25 mL容量瓶中,各加入DNS溶液2 mL,置沸水浴中煮2 min进行显色,迅速冷却,定容至25 mL。在波长540 nm处测定吸光度值。以葡萄糖标准溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得到标准曲线回归方程:y=0.193 4x+0.016 7(相关系数R2>0.99),并按照回归方程计算样品中总残糖量。
(5)乙酸乙酯的测定
采用气相色谱法测定乙酸乙酯[19]。取2 mL发酵结束后的发酵浆液离心(10 000 r/min、10 min)取上清液,装入进样瓶中进行乙酸乙酯含量测定。气相色谱条件为:火焰离子化检测器(FID),进样口温度210 ℃,检测器温度230 ℃,进样量0.5 μL,毛细管色谱柱(30 m×0.25 mm×0.25 μm),氮气(N2)(纯度99.999%)流速25 mL/min;氢气(H2)流速30.0 mL/min;空气流速300.0 mL/min。程序升温:40 ℃保持3 min,以5 ℃/min升温至80 ℃保持2 min,再以8 ℃/min升温至200 ℃,保持2 min。分流比为20∶1。
1.3.6 统计学分析
对每个实验都进行3次平行测定,数据以“平均值±标准差”表示,利用Microsoft Office Excel 2016、Origin 9.0、SPSS 22.0软件进行数据分析。
2 结果与分析
2.1 甘蔗渣固定化酵母的制备
酵母细胞固定化的方式主要有吸附法、包埋法、共价键结合法、交联法四种[20]。本研究中采用蔗渣为载体通过吸附的方法对酵母细胞进行固定化。酵母细胞吸附于蔗渣上的扫描电镜结果见图1。
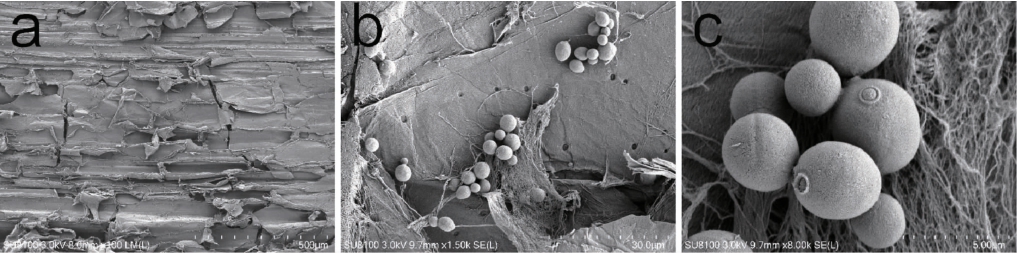
图1 蔗渣固定化酵母的电镜扫描结果
Fig.1 Electron microscope scanning results of immobilized yeast with bagasse
a为固定化后甘蔗渣表面形态结构(100倍);b为甘蔗渣薄壁组织内的酵母(1 500倍);c为甘蔗渣薄壁组织内酵母(8 000倍)。
由图1可知,酵母菌能够被吸附于蔗渣的薄壁组织上。酵母细胞的吸附主要依赖于蔗渣和带电荷的细胞表面之间的静电作用,以及甘蔗渣多孔结构的自然诱捕,这两种方式使得酵母细胞与甘蔗渣表面保持密切接触,使得酵母细胞牢牢的吸附在甘蔗渣上并进行繁殖。有研究证实了一些植物材料如玉米颗粒、葡萄皮和西瓜皮等均能够吸附酵母菌并应用于酒精发酵中[21-22]。通过对吸附于蔗渣上的酵母菌的数量的测定,采用蔗渣吸附酵母菌能力数量达到了6.45×109个/g蔗渣,效果要优于之前研究的其他植物材料,如有报道称玉米颗粒吸附酵母菌的数量为3.4×107个/g玉米粒[23]。
2.2 两种酵母酒精发酵的乙醇产出
相比于游离发酵,固定化发酵的优点之一是酵母细胞可以重复回收利用,因此利用固定化酵母发酵时,固定化酵母的重复发酵稳定性及其对产品品质的影响是需要考察的重点方面。ARGYRIS T等[24]采用葡萄渣固定化酵母酿造葡萄酒,并重复使用固定化酵母连续发酵10批次。KOURKOUTAS Y等[25]通过将酵母固定在苹果皮上进行连续批次发酵葡萄酒,并进行了5个批次发酵。综合考虑固定化酵母能够重复利用的特点,本研究中以游离酵母发酵为对照,采用甘蔗渣固定化酿酒酵母进行6批次连续发酵百香果果浆,每批次发酵结束后,将固定有酵母细胞的甘蔗渣用灭菌生理盐水进行清洗后应用于下一次的重复使用。两种酵母酒精发酵的乙醇产出情况见表1。
表1 固定化酵母和游离酵母酿造百香果果酒的乙醇产出比较
Table 1 Comparison of ethanol production of passion fruit wine brewed by immobilized yeast and free yeast
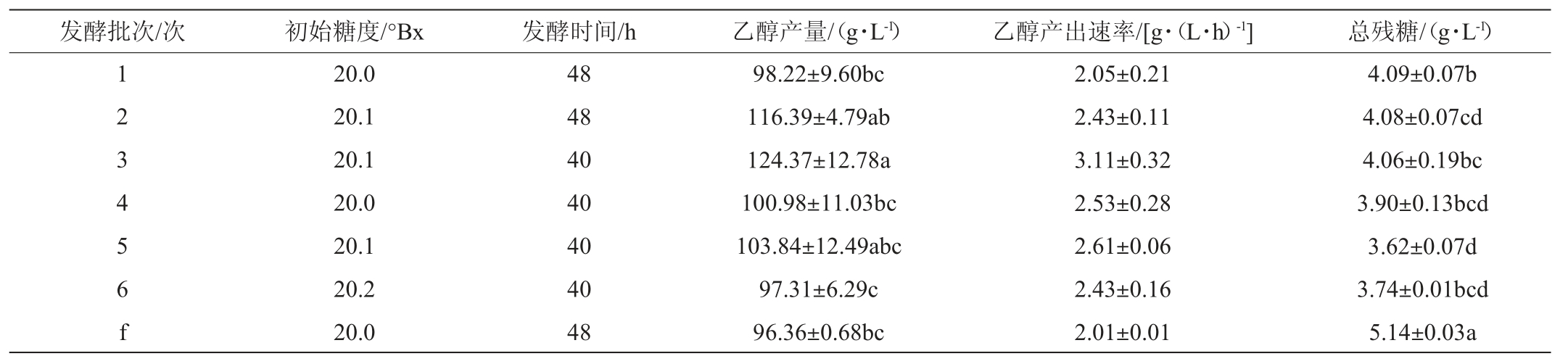
注:f表示游离酵母细胞发酵。不同字母表示差异显著(P<0.05)。下同。
相比于游离酵母发酵,使用固定化酵母连续六批次发酵结束时乙醇产量均比游离酵母发酵高,差值为1.86~28.01 g/L,且从第三批次开始,甘蔗渣固定化酵母完成发酵所需的时间约缩短8 h。这可能是酵母细胞固定化后其对乙醇和酸性的耐受性提高,因此固定化酵母发酵比游离酵母发酵活性更好的缘故[26]。游离酵母酿造百香果果酒乙醇产量为96.36 g/L、乙醇产出速率为2.01 g/(L·h)、总残糖为5.14 g/L,固定化酵母酿造百香果果酒乙醇产量为98.22~124.37 g/L,乙醇产出速率为2.05~3.11g/(L·h),总残糖为3.62~4.09 g/L。结果表明固定化酵母发酵对糖类物质利用更加彻底。
综上,固定化酵母酿造百香果果酒的乙醇产量和乙醇产出速率优于游离酵母。
2.3 两种酵母酒精发酵的残糖构成
对发酵结束后发酵液中的蔗糖、葡萄糖和果糖的含量进行测定,结果见表2。
百香果果浆中蔗糖70.44 g/L,葡萄糖42.27 g/L,果糖42.19 g/L。由表2可知,两种发酵方式的发酵结束后发酵浆液中蔗糖、葡萄糖和果糖的质量浓度都较低,固定化酵母发酵蔗糖和葡萄糖最低分别可降至0.07 g/L、0.19 g/L,而果糖能够得到完全消耗。游离酵母发酵蔗糖、葡萄糖和果糖质量浓度分别降至1.27 g/L、0.43 g/L、0.46 g/L。说明两种发酵方式都能很好地利用底物中的糖类物质。
表2 固定化酵母和游离酵母酿造百香果果酒残糖组成比较
Table 2 Comparison of residual sugar composition of passion fruit wine brewed by immobilized yeast and free yeast
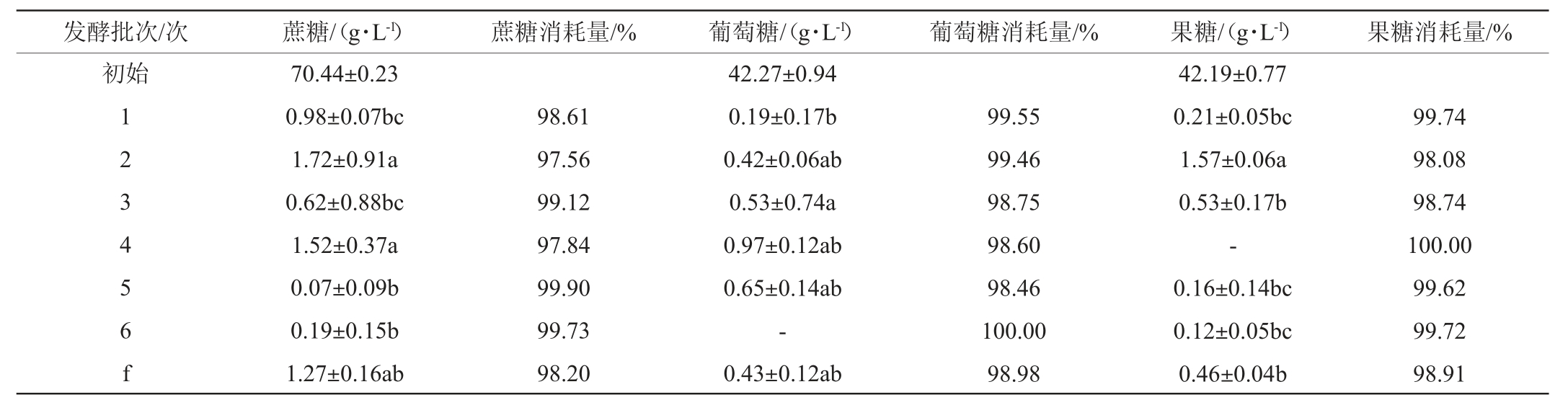
注:“-”表示未检出。
固定化酵母发酵对蔗糖的消耗量平均值为98.79%,对葡萄糖的消耗量平均值为99.14%,对果糖的消耗量平均值为99.32%。游离酵母发酵对蔗糖的消耗量为98.20%,对葡萄糖的消耗量为98.98%,对果糖的消耗量为98.91%。
综上,可以看出,固定化酵母发酵对蔗糖、葡萄糖和果糖的消耗利用率稍高于游离发酵,这种情况与利用葡萄皮固定化酵母细胞连续发酵葡萄酒的结果相似[26]。
2.4 两种酵母酒精发酵的有机酸含量
果酒中有机酸主要有草酸、酒石酸、苹果酸、乙酸、柠檬酸和琥珀酸,主要来源于发酵的果汁中和发酵过程中的酵母代谢[27]。对发酵结束后发酵液中部分有机酸含量进行测定,结果见表3。
表3 固定化酵母和游离酵母酿造百香果果酒的有机酸含量比较
Table 3 Comparison of organic acid contents of passion fruit wine brewed by immobilized yeast and free yeast
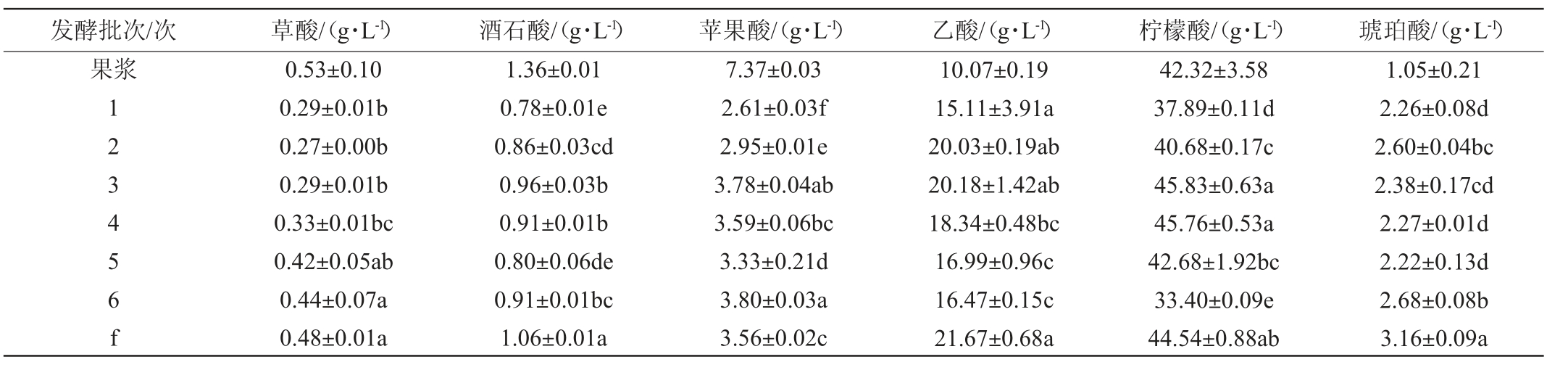
草酸是一种二元酸,有酸的口感,但并没有香气[28]。由表3可知,草酸含量经过两种方式发酵后均有所下降,固定化酵母发酵草酸含量下降至0.29~0.44 g/L,游离酵母发酵草酸含量下降至0.48 g/L,说明固定化酵母发酵能够更有效的降低草酸含量。
酒石酸对酒体口感以及稳定性影响较大,酒石酸含量过高,会使酒体口感有涩味[29]。百香果果浆经过固定化发酵后,酒石酸含量由1.36 g/L降低至0.78~0.96 g/L,而经过游离发酵后,酒石酸含量降低至1.06 g/L,固定化酵母发酵产生的酒石酸与游离酵母发酵产生的有显著性差异(P<0.05)。
高含量的苹果酸会让酒体口感酸涩[30]。百香果果浆中苹果酸的含量为7.37 g/L,经过固定化发酵后,苹果酸含量降低至2.61~3.80 g/L,6个批次发酵的平均值为3.34 g/L。游离酵母发酵后,苹果酸含量降至3.56 g/L,固定化酵母发酵与游离酵母发酵相比,固定化酵母发酵能有效降低苹果酸含量。
乙酸作为果酒中不良有机酸,其较高含量会掩盖果酒的香气,使酒体口感不协调[31]。百香果果浆经过两种方式发酵后,乙酸含量都有所上升,这是由于乙酸可通过酵母菌参与三羧酸循环产生[32]。固定化酵母发酵的乙酸含量由10.07 g/L升至15.11~20.18 g/L,但低于游离酵母发酵产生的乙酸含量(21.67 g/L),说明固定化酵母发酵的应用可以减少乙酸对果酒香气的影响。
柠檬酸的酸味温和清爽,能够赋予果酒适宜的酸度感受[33]。经过固定化酵母发酵后,柠檬酸含量处于33.40~45.83 g/L的范围,6个批次发酵的平均值为41.04 g/L,低于游离酵母发酵的柠檬酸含量44.54 g/L。
琥珀酸能够影响酒体风味的形成,是酒中最富于味觉反应的一种酸[34]。琥珀酸含量在发酵之后升高,是由于酵母菌在三羧酸循环中代谢产生以及果汁中谷氨酸的转化[35]。固定化酵母发酵使得琥珀酸由原来的1.05 g/L升至2.68 g/L,而游离酵母发酵升至3.16 g/L,固定化酵母发酵产生的琥珀酸明显少于游离酵母发酵。
综上,固定化酵母发酵的果酒中草酸、酒石酸、苹果酸、柠檬酸含量都有所下降,乙酸和琥珀酸含量上升。相比较两种发酵方式,固定化酵母发酵的果酒中有机酸含量除柠檬酸外均低于游离酵母发酵。
2.5 乙酸乙酯含量
乙酸乙酯是果酒中重要的挥发性化合物之一,它的存在对果酒感官特性有着积极的影响,少量的乙酸乙酯会令果酒产生花香和果香,但过多的乙酸乙酯会给果酒带来苦涩的口感[36]。实验中对发酵结束后发酵液中乙酸乙酯的含量进行了测定,结果见图2。
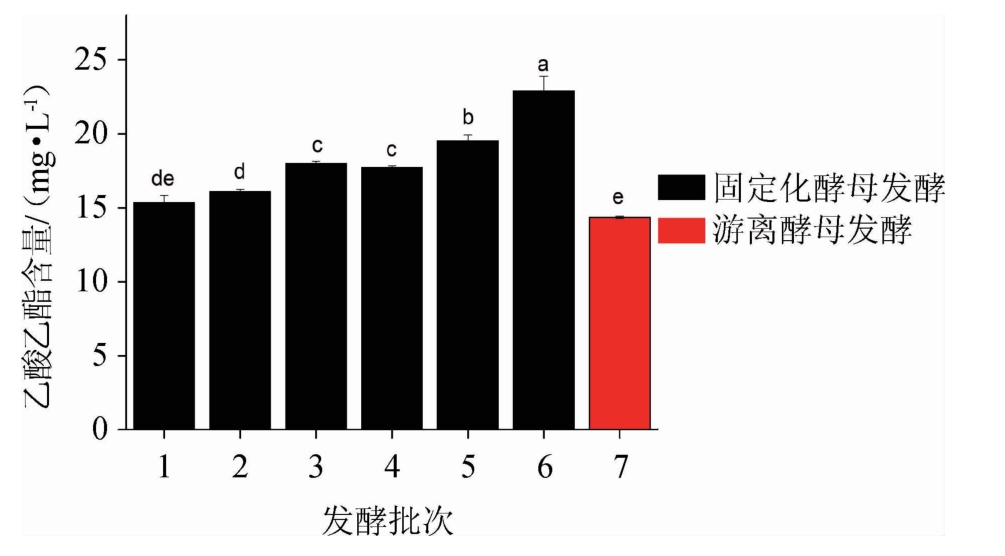
图2 固定化酵母和游离酵母酿造百香果果酒的乙酸乙酯含量比较
Fig.2 Comparison of ethyl acetate contents of passion fruit wine brewed by immobilized yeast and free yeast
不同字母表示差异显著(P<0.05)。
由图2可知,固定化酵母发酵所得百香果果酒的乙酸乙酯含量为15.7~22.86 mg/L,而游离酵母发酵所得百香果果酒乙酸乙酯含量为14.3 mg/L,乙酸乙酯在发酵过程中由发酵液中的乙酸和乙醇通过酯化反应而来[37],结合表2中采用固定化发酵的样品中乙酸含量较游离发酵低可知,乙酸的减少可能是参与了酯化反应,因此固定化酵母发酵的样品中乙酸乙酯含量均稍高于游离酵母发酵,证明固定化后酵母细胞活性较好。
综上,固定化酵母发酵乙酸乙酯含量优于游离发酵,为百香果果酒增加了果香。
3 结论
本实验以游离酵母发酵作为对照,采用甘蔗渣固定化酿酒酵母连续重复6批次发酵百香果果浆,比较了各批次发酵结束后乙醇、残糖、有机酸和乙酸乙酯的含量。结果显示,甘蔗渣吸附固定酵母细胞的数量为6.45×109个/g蔗渣,电镜观察到酵母细胞能够被吸附分布于甘蔗渣的表面。百香果果酒发酵过程中,固定化酵母发酵对糖类物质的利用较彻底,乙醇产出量与产出速率要高,且增加了乙酸乙酯含量,对百香果果酒的口感与风味可能有益。连续重复批次发酵的结果表明,固定化酵母在重复批次发酵的过程中具有较好的发酵稳定性,具有一定的连续发酵百香果果酒的能力。因此,甘蔗渣固定化酵母应用于百香果果酒的酿造是可行的。
[1]李悦,郭文场.百香果的品种简介[J].特种经济动植物,2017,20(11):52-53.
[2]陈俊彬,李梓龙,韩群鑫,等.广东省百香果产业风险控制和对策研究[J].南方农村,2020,36(3):9-13.
[3]杨玉霞,康超,段振华,等.响应面法优化百香果酒发酵工艺研究[J].食品工业科技,2018,39(8):167-172,189.
[4]程宏桢,蔡志鹏,王静,等.百香果全果酒发酵工艺优化及体外抗氧化性比较分析[J].中国酿造,2020,39(4):91-97.
[5]胡来丽,秦礼康,王玉珠.百香果全果与果汁发酵酒滋味成分及香气成分对比[J].食品与机械,2021,37(12):10-19.
[6]GENISHEVA Z,MACEDO S,MUSSATTO S I,et al.Production of white wine by Saccharomyces cerevisiae immobilized on grape pomace[J]. J I Brewing,2012,118(2):163-173.
[7]VARAKUMAR S,NARESH K,REDDY O V S.Preparation of Mango(Mangifera indica L.) wine using a new yeast-mango-peel immobilised biocatalyst system[J].Czech J Food Sci,2012,30(6):557-566.
[8]毛利厂.双菌种共固定化发酵白葡萄酒的研究[D].郑州:河南工业大学,2010.
[9]JAIME M G,TERESA G M,MAURICIO J C,et al.Yeast immobilization systems for alcoholic wine fermentations:actual trends and future perspectives[J].Front Microbiol,2018,9:241.
[10]何炯灵.新型果醋固定化发酵工艺探索[D].杭州:浙江工商大学,2018.
[11]REDDY L V,REDDY L P,WEE Y J,et al.Production and characterization of wine with sugarcane piece immobilized yeast biocatalyst[J].Food Bioprocess Tech,2011,4(1):142-148.
[12]杨文君.酿酒酵母固定化及其对桑椹果酒发酵过程中花色苷的影响研究[D].淮阴:淮阴工学院,2020.
[13]潘嫣丽,覃海元,黄友琴,等.固定化酵母发酵雪莲果-西番莲复合果酒工艺的研究[J].中国酿造,2011,30(2):178-182.
[14]SURENDHIRAN D,VIJAY M,SIRAJUNNISA A R.Biodiesel production from marine microalga Chlorella salina using whole cell yeast immobilized on sugarcane bagasse[J].J Environ Chem Eng,2014,2(3):1294-1300.
[15]黎东,陈仕伟,李小川,等.高效液相色谱(HPLC)分析方法同时测定山楂果醋中七种有机酸[J].现代食品,2019,6(10):176-180,186.
[16]鲁玉侠.高效液相色谱法检测橄榄果酒中的Vc和糖类物质[J].现代食品科技,2011,27(7):861-862,872.
[17]张珣,王婧,丁华,等.DNS法测定茶叶中掺杂蔗糖含量[J].湖北农业科学,2021,60(21):107-111.
[18]方海仙,普娅丽,普家云,等.气相色谱法测定白酒中甲醇、乙酸乙酯和己酸乙酯含量的优化[J].食品安全质量检测学报,2021,12(17):6879-6886.
[19]BERBEGAL C,POLO L,GARCÍA-ESPARZA M J,et al.Immobilisation of yeasts on oak chips or cellulose powder for use in bottle-fermented sparkling wine[J].Food Microbiol,2019,78:25-37.
[20]NG K S,WANG S Y,CHEN M J.A novel immobilized cell system involving Taiwanese kefir microorganisms and sugar cane pieces for fermented milk production[J].J Dairy Sci,2020,103(1):141-149.
[21]REDDY L V,REDDY Y H K,REDDY L P A,et al.Wine production by novel yeast biocatalyst prepared by immobilization on watermelon(Citrullus vulgaris) rind pieces and characterization of volatile compounds[J].Process Biochem,2008,43(7):748-752.
[22]GENISHEVA Z,MUSSATTO S I,OLIVEIRA J M,et al.Evaluating the potential of wine-making residues and corn cobs as support materials for cell immobilization for ethanol production[J].Ind Crop Prod,2011,34(1):979-985.
[23]KANDYLIS P,MANTZARI A,KOUTINAS A A,et al.Modelling of low temperature wine-making,using immobilized cells[J].Food Chem,2012,133(4):1341-1348.
[24]TSAKIRIS A,SIPSAS V,BEKATOROU A,et al.Red wine making by immobilized cells and influence on volatile composition[J].J Agr Food Chem,2004,52(5):1357-1363.
[25]KOURKOUTAS Y,KOUTINAS A A,KANELLAKI M,et al.Continuous wine fermentation using a psychrophilic yeast immobilized on apple cuts at different temperatures[J]. Food Microbiol,2002,19(2-3): 127-134.
[26]GENISHEVA Z,VILANOVA M,MUSSATTO S I,et al.Consecutive alcoholic fermentations of white grape musts with yeasts immobilized on grape skins-effect of biocatalyst storage and SO2 concentration on wine characteristics[J].LWT-Food Sci Technol,2014,59(2):1114-1122.
[27]赵伟,赵兵涛,次仁潘多,等.酿酒酵母代谢有机酸对乙醇发酵的影响[J].可再生能源,2017,35(7):971-977.
[28]蒋成,陈安均,付云云,等.酵母对无花果酒有机酸的影响[J].食品与机械,2018,34(7):39-42.
[29]朱会霞,孙金旭,李湘阳.高效液相色谱法对比分析覆盆子果酒发酵前后有机酸变化[J].山东化工,2019,48(24):70-71,74.
[30]刘晓艳,白卫东,蒋爱民,等.荔枝果酒加工过程中有机酸的变化研究[J].中国酿造,2011,30(11):65-69.
[31]曾竟蓝,马胤鹏,秦丹,等.果酒中有机酸的作用及检测方法研究[J].中国酿造,2018,37(6):183-187.
[32]张浩然,范昊安,顾逸菲,等.沙棘酵素发酵过程中代谢产物及抗氧化活性研究[J].食品工业科技,2020,41(11):125-133.
[33]李明瑕,刘春凤,王壬,等.黄桃果酒发酵工艺优化及香气成分分析[J].食品与生物技术学报,2021,40(10):39-49.
[34]姜欢笑,郭建华,时小棠,等.果酒中有机酸成分分析及降酸技术研究现状[J].现代食品,2020(9):10-14.
[35]严超,侯丽娟,齐晓茹,等.红枣白兰地发酵过程中酒醅氨基酸和有机酸的变化分析[J].食品工业科技,2017,38(14):121-125.
[36]李凯,王金晶,李永仙,等.红心火龙果果酒特征香气分析[J].食品与发酵工业,2019,45(13):217-223.
[37]李大和,彭奎,王超凯,等.谈浓香型白酒生产中乙酸乙酯升高的应对措施[J].酿酒,2020,47(6):15-20.