四甲基吡嗪(tetramethylpyrazine,TTMP)别名川芎嗪,属含氮杂环化合物,从川芎中提取获得,可用于治疗心脑血管疾病[1],具有坚果、花生、榛子、可可香气[2]。白酒中的四甲基吡嗪赋予白酒中“健康因子”的美誉,是酱香型和芝麻香型白酒的重要香气成分之一[3]。近年来,国内很多酒企开展了利用加强发酵酒曲及发酵条件优化提高白酒中四甲基吡嗪含量的研究[4-5]。
白酒中的四甲基吡嗪来源于微生物代谢合成,糖降解产生丙酮酸,两分子的丙酮酸进行缩合反应形成α-乙酰乳酸,α-乙酰乳酸脱羧生成3-羟基丁酮(又称乙偶姻),乙偶姻进一步与氨经过非酶促反应生成四甲基吡嗪[6]。白酒生产过程中产四甲基吡嗪的微生物多为芽孢杆菌,尤其以枯草芽孢杆菌和地衣芽孢杆菌为主。芽孢杆菌能代谢产生大量具有酱味的吡嗪类物质和酸味的物质[7],能够调和酒香,有助于提升大曲白酒的品质[8]。赵兴秀等[9]运用稀释平板涂布法结合固态发酵闻香从大曲中分离得到3株产酱香浓郁的枯草芽孢杆菌;李晓霞等[10]从汾酒大曲中分离得到了3株高产四甲基吡嗪的芽孢杆菌,其中2株为枯草芽孢杆菌,1株为弯曲芽孢杆菌;张温清等[11]在宣酒大曲中筛选出的高产四甲基吡嗪功能菌株解淀粉芽孢杆菌固态发酵生产麸皮曲,其四甲基吡嗪产量可达202.54 mg/kg。陈梦圆等[12]在高温大曲中筛选出高产四甲基吡嗪的地衣芽孢杆菌和暹罗芽孢杆菌。赵德义等[13]从中温大曲中分离筛选到一株产四甲基吡嗪的枯草芽孢杆菌,其四甲基吡嗪产量可达11.42 g/L。
很多研究者将高产四甲基吡嗪的芽孢杆菌用于增强曲中并进行发酵条件的优化,可显著提高白酒中四甲基吡嗪的含量。王小平等[14]在酱香大曲中获得3株高产四甲基吡嗪的地衣芽孢杆菌,通过发酵优化,逐级升温等可显著提高酱香风味。王西等[15]将从高温大曲中筛选得到的产香枯草芽孢杆菌应用到酱香型白酒生产中,在堆积之前加入枯草芽孢杆菌,四甲基吡嗪含量明显提高,感官品质明显增强。祝赛峰等[16]通过响应面确定枯草芽孢杆菌S0507在最佳培养条件时四甲基吡嗪的产量为332.70 mg/L;王晓丹等[17]在窖池的中层菌株添加量为5%时,糟醅中的四甲基吡嗪产量达6.81 μg/L。周榆林等[18]通过加热强化工艺制成的高温大曲酱香突出,酒体醇厚。利用酒糟进行固态发酵可以提高麸曲中的四甲基吡嗪含量[19]。提高乙偶姻的合成能力以及添加铵盐都能够显著提高产物四甲基吡嗪的含量。通过对培养条件和培养基成分进行优化,凝结芽孢杆菌可以获得2.54 g/L的四甲基吡嗪[20]。马美荣等[21]将筛选的高产四甲基吡嗪的芽孢杆菌用于清香型白酒可提高原酒中四甲基吡嗪的含量。
本研究从高温芝麻香大曲中筛选高产四甲基吡嗪的芽孢杆菌,通过形态学观察、生理生化和分子生物学鉴定高产四甲基吡嗪菌株,再通过两步发酵策略,发酵第一阶段培养条件有利于菌株的生长繁殖和四甲基吡嗪前体物质乙偶姻的合成,发酵第二阶段对生产四甲基吡嗪的发酵条件进行优化,旨在获得菌株高产四甲基吡嗪的发酵条件,深入了解芽孢杆菌高产四甲基吡嗪的发酵特性,为后续利用该菌株制备高产四甲基吡嗪的复配曲提供一定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
洪昊牌芝麻香型高温大曲:梁山洪昊制曲厂。
1.1.2 化学试剂
氢氧化钠、氯化钠、甲基红、盐酸(均为分析纯):国药集团化学试剂有限公司;四甲基吡嗪、无水乙醇(均为色谱纯):西格玛奥德里奇(上海)贸易有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:上海生物工程有限公司;Voges-Proskauer(V-P)试剂:青岛海博生物技术有限公司。
1.1.3 培养基
分离培养基采用营养肉汤培养基:蛋白胨10 g/L,牛肉膏3 g/L,氯化钠5 g/L,调节pH为7.0,121 ℃高压灭菌15 min。营养肉汤固体培养基中加入20 g/L的琼脂。
种子培养基:蛋白胨10 g/L,酵母膏5 g/L,氯化钠5 g/L,121 ℃高压灭菌20 min。
发酵培养基:蛋白胨20 g/L,酵母膏10 g/L,磷酸氢二钾3 g/L,葡萄糖100 g/L,磷酸氢二铵30 g/L,115 ℃高压灭菌15 min。
1.2 仪器与设备
7890B气相色谱仪:美国安捷伦科技有限公司;UB203i显微镜:重庆澳浦光电技术有限公司;Sigma 1-14K小型冷冻离心机:西格玛奥德里奇(上海)贸易有限公司;ZHJHC1112C超净工作台:上海智诚分析仪器制造有限公司;LRHS-150-II恒温恒湿培养箱:上海跃进医疗器械有限公司;GI54DWS高压灭菌锅:致微(厦门)仪器有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司。
1.3 方法
1.3.1 大曲中芽孢杆菌的分离纯化
样品处理:称取大曲10 g,于三角瓶中加入已灭菌的生理盐水90 mL,振荡30 s后37 ℃、180 r/min摇床过夜培养。菌液置于水浴锅中80 ℃水浴20 min,灭活营养细胞,将处理过的菌悬液分别稀释成10-4,10-5,10-6,10-7,各取0.1 mL在平板上涂布,每个稀释度做3个平行,37 ℃恒温恒湿培养箱中培养2 d,观察菌落形态,将形态不同的单菌落挑出重新划线接至固体平板上继续培养,直到分离纯化得到单菌落,菌株于-80 ℃条件下超低温保藏。
1.3.2 高产四甲基吡嗪菌株的初筛
四甲基吡嗪的前体物质乙偶姻在碱性条件下被氧化为2,3-丁二酮,而后与肌酸产生粉红色复合物。通过V-P实验对菌株发酵液中乙偶姻进行初步检测,实现对产四甲基吡嗪菌株的初筛。
将纯化的菌种分别接入装液量为5 mL/45 mL的种子培养基中,37 ℃、200 r/min培养12 h,得到菌株种子液。将种子液按照4%接种量接入装液量为5 mL/45 mL发酵培养基内,37 ℃、200 r/min培养36 h,得到菌株发酵液。取1 mL菌株发酵液,加入V-P试剂振荡混匀,放置5 min,观察颜色变化,选取反应后颜色变为红色的菌株进行高产四甲基吡嗪菌株的复筛。
1.3.3 高产四甲基吡嗪菌株的复筛
将经过初筛的菌株接至装液量为30 mL/250 mL液态发酵培养基中,37 ℃、200 r/min培养48 h,得到菌株发酵液。取发酵液在8 000 r/min条件下离心10 min,取2 mL样品稀释液中加入2 mL二氯甲烷静置过夜萃取,取萃取下相经0.22 μm有机膜过滤,用于气相色谱仪测定TTMP的含量,复筛高产四甲基吡嗪菌株。
1.3.4 四甲基吡嗪含量的检测
四甲基吡嗪含量的检测采用气相色谱法。称取四甲基吡嗪的标准品,溶解于无水乙醇中,稀释配制成1 g/L的四甲基吡嗪标准溶液。气相色谱条件:进样量1 μL;进样口温度250 ℃;毛细管色谱柱(60 m×0.25 mm×0.2 μm);升温程序:起始温度60 ℃,恒温5 min,以5 ℃/min程序升温至200 ℃,继续恒温10 min;载气为高纯氮气(N2),流速为1.0 mL/min,分流比20∶1;氢气流速为40 mL/min;空气流速为400 mL/min;尾吹气30 mL/min;氢火焰离子化检测器(flame ionization ditector,FID)温度:240 ℃。根据出峰时间进行定性,采用外标法定量[22]。
1.3.5 高产四甲基吡嗪菌株的鉴定
(1)形态学观察
将菌株划线转接到营养肉汤培养基中,37 ℃条件下培养36 h后观察其在营养肉汤平板上的颜色、大小、表面光滑性等菌落形态特征。将菌株制片,通过革兰氏染色进行镜检,在100倍显微镜下观察细胞形态。
(2)生理生化试验
依照《伯杰细菌鉴定手册》和《微生物学试验》对菌株进行生化特性试验。
(3)分子生物学鉴定
通过DNA提取试剂盒提取高产四甲基吡嗪菌株的基因组DNA,以其为模板利用细菌16S rDNA通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR扩增体系(50 μL):基因组DNA模板2.5 μL,引物27F 2.5 μL,引物1492R 2.5 μL,2×PCR Mix 25 μL,超纯水补足至50 μL。PCR扩增条件:95 ℃预变性5 min;然后95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min,循环34次;最后72 ℃延伸10 min,降温至4 ℃保存。PCR产物交由华大基因股份有限公司进行测序鉴定,测序结果通过美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行同源性比较,利用MEGA7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.6 菌株产四甲基吡嗪后发酵条件优化
菌株生产四甲基吡嗪分为两个发酵阶段进行,第一阶段为四甲基吡嗪前体物质乙偶姻合成阶段,第二阶段为四甲基吡嗪生产阶段。首先将斜面菌种取一环接种至种子培养基中,37 ℃、200 r/min培养过夜,接种1 mL种子液至装液量为30 mL/250 mL的发酵培养基中,37 ℃、200 r/min培养72 h。第一阶段发酵结束后对四甲基吡嗪生产的后培养阶段发酵条件进行优化。
后发酵温度的确定:后发酵温度分别为45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃,200 r/min培养24 h,测定四甲基吡嗪产量。
后发酵时间的确定:后培养温度60 ℃,200 r/min培养,培养时间5 h、10 h、15 h、20 h、25 h,测定四甲基吡嗪含量。
培养基初始pH的确定:液体发酵培养基初始pH值分别为5.5、6.0、6.5、7.0、7.5,后培养温度60 ℃,200 r/min培养20 h,测定四甲基吡嗪的产量。
铵盐添加量的确定:后培养阶段分别补加1 g/L、2 g/L、3 g/L、4 g/L、5 g/L的(NH3)2HPO4溶液,60 ℃、200 r/min培养20 h,测定四甲基吡嗪的产量。
2 结果与分析
2.1 产TTMP芽孢杆菌的筛选
通过V-P实验进行初筛,得到20株呈阳性反应且红色较深的产四甲基吡嗪菌株,分别编号为WH1~WH20。其TTMP产量测定结果见图1。
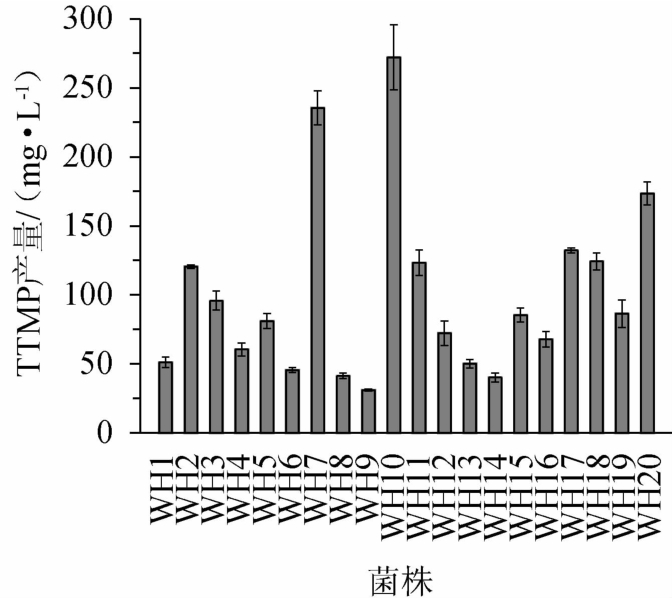
图1 筛选菌株四甲基吡嗪的产量测定结果
Fig.1 Determination results of tetramethylpyrazine yield of screened strains
由图1可知,TTMP产量最高的3株菌编号为WH7、WH10、WH20,TTMP产量分别是235.46 mg/L、272.15 mg/L、173.57 mg/L,将菌株WH7、WH10、WH20进行鉴定。
2.2 筛选菌株的鉴定
2.2.1 筛选菌株的菌落形态和细胞形态
菌株WH7、WH10、WH20菌落及细胞形态见图2。
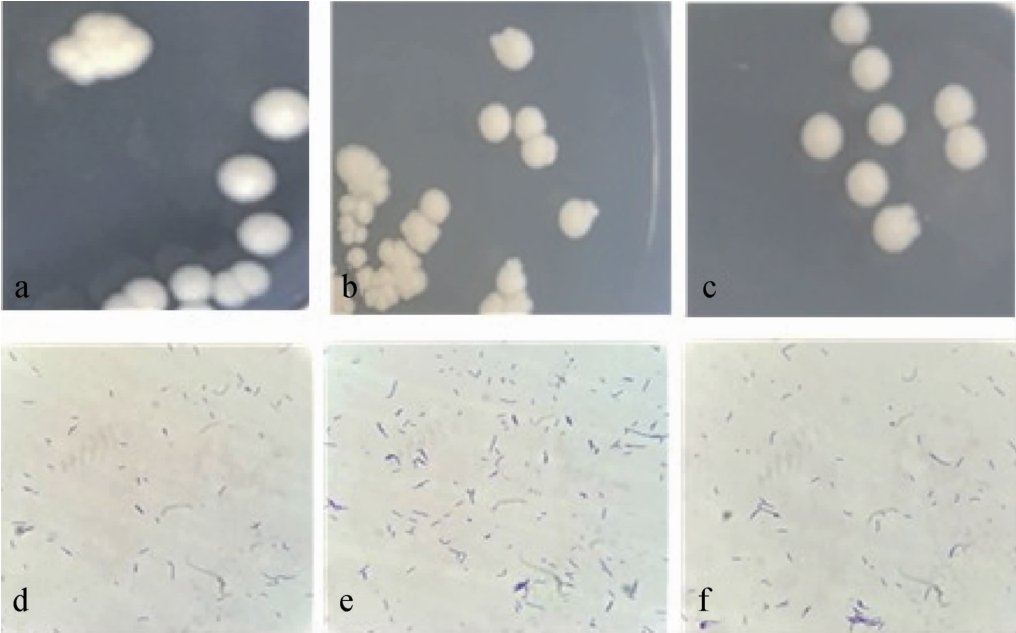
图2 菌株WH7、WH10及WH20的菌落形态(a、b、c)和细胞形态(d、e、f)
Fig.2 Colony morphology (a,b,c) and cell morphology (d,e,f) of strain WH7,WH10 and WH20
由图2可知,菌株WH7、WH10、WH20的菌落特征较为相似,白色,圆形,边缘较整齐,不透明,表面光泽湿润。菌株WH7、WH10、WH20经革兰氏染色观察后属于革兰氏阳性菌,短杆状,菌体两端钝圆。
2.2.2 筛选菌株的生理生化试验
对菌株WH7、WH10、WH20进行生理生化鉴定,结果表明,菌株WH7、WH10、WH20在3%过氧化氢溶液中均产生气泡,表明这三株菌都能产生过氧化氢酶,是需氧菌;在淀粉水解试验中均产生不变色透明圈,表明菌株WH7、WH10、WH20能够利用淀粉。进行柠檬酸盐试验时,培养基均由绿色变为蓝色,证明菌株WH7、WH10、WH20能利用柠檬酸盐。
2.2.3 筛选菌株的分子生物学鉴定
菌株WH7、WH10及WH20的系统发育树见图3。
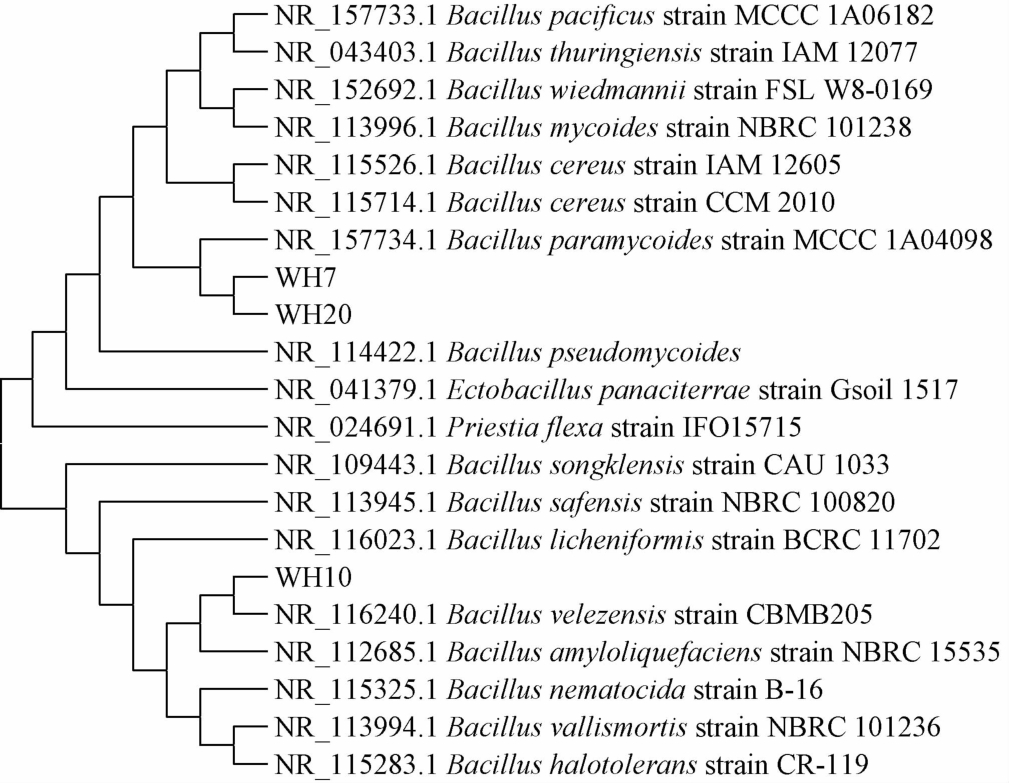
图3 基于16S rDNA序列菌株WH7、WH10和WH20的系统发育树
Fig.3 Phylogenetic tree of strains WH7,WH10 and WH20 based on 16S rDNA gene sequences
由图3可知,菌株WH7和WH20菌株与副淀粉芽孢杆菌(Bacillus paramycoides)聚集在了同一个分支上,同源性99.78%;菌株WH10与贝莱斯芽胞杆菌(Bacillus velezensis)聚集在了同一个分支上,同源性98.86%。因此,菌株WH7和WH20被鉴定为副淀粉芽孢杆菌(Bacillus paramycoides),菌株WH10被鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。
2.3 菌株WH10产四甲基吡嗪发酵条件优化
2.3.1 后发酵温度对四甲基吡嗪产量的影响
高温有利于四甲基吡嗪的合成,酱香型白酒的独特工艺高温制曲和高温堆积是导致酱香型白酒中四甲基吡嗪含量较高的重要原因[18]。后发酵温度对四甲基吡嗪合成的影响,结果见图4。由图4可知,随着后发酵温度在45~60 ℃范围内的的升高,四甲基吡嗪的产量有所升高;后发酵温度在60 ℃下培养四甲基吡嗪的产量最高,达到537.61 mg/L;后发酵温度>60 ℃之后,四甲基吡嗪的产量有所下降。因此,最佳后发酵温度为60 ℃。
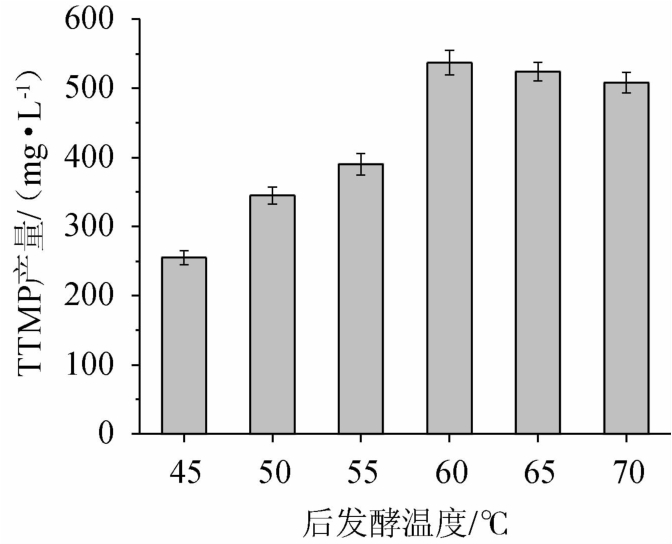
图4 后发酵温度对四甲基吡嗪产量的影响
Fig.4 Effect of post-fermentation temperature on tetramethylpyrazine yield
2.3.2 后发酵时间对四甲基吡嗪产量的影响
由图5可知,后发酵时间在0~20 h范围内,随着后培养时间的延长,四甲基吡嗪产量逐渐升高;后发酵时间在20 h时,四甲基吡嗪产量最大,达到557.26 mg/L;后发酵时间超过20 h之后,四甲基吡嗪的产量反而降低。其主要原因是四甲基吡嗪与2,3-丁二醇都由乙偶姻生成,两者存在竞争机制,乙偶姻与四甲基吡嗪是可逆反应,在高温有铵盐的条件下,乙偶姻主要生成四甲基吡嗪[2];但随着时间的延长,反应更有利于由乙偶姻向TTMP的竞争产物2,3-丁二醇的转化,故四甲基吡嗪产量有所降低[6]。因此,最佳后发酵时间为20 h。
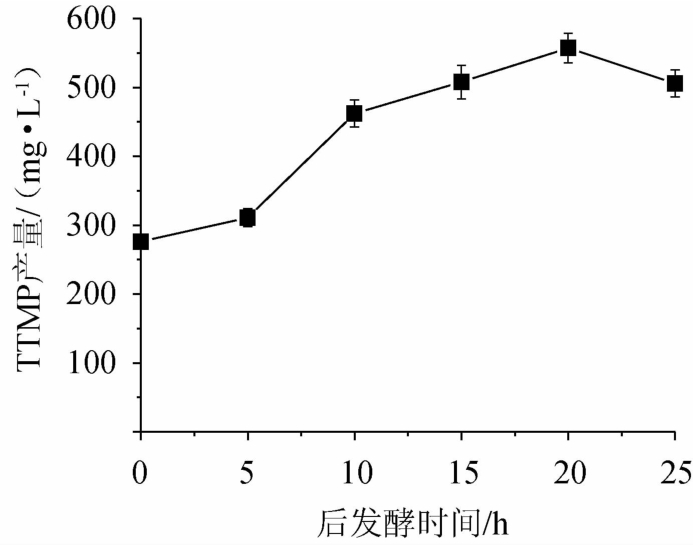
图5 后发酵时间对四甲基吡嗪产量的影响
Fig.5 Effect of post-fermentation time on tetramethylpyrazine yield
2.3.3 初始pH值对四甲基吡嗪产量的影响
初始pH值对四甲基吡嗪合成的影响,结果见图6。由图6可知,在培养基初始pH值为5.5~6.5时,随着初始pH值的升高,四甲基吡嗪产量随之增加;当初始pH值为6.5时,四甲基吡嗪产量最高,达到557.42 mg/L;初始pH值>6.5之后,四甲基吡嗪有所下降,说明初始pH对菌株产四甲基吡嗪影响较大。初始pH通过影响菌株的生长和代谢,以及酶的活性来影响最终四甲基吡嗪的产量[23-25]。因此,最佳培养基初始pH值为6.5。
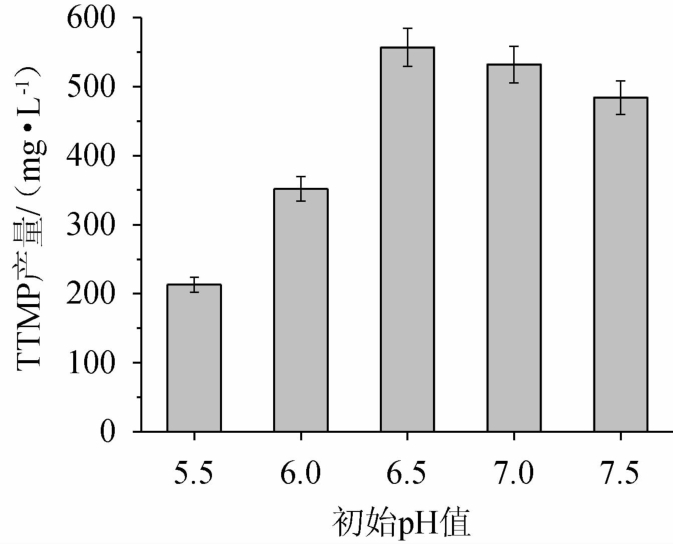
图6 初始pH值对四甲基吡嗪产量的影响
Fig.6 Effect of initial pH on tetramethylpyrazine yield
2.3.4 铵盐添加量对四甲基吡嗪产量的影响
乙偶姻与氨在高温条件下通过非酶促反应生成四甲基吡嗪[6]。作为四甲基吡嗪合成的原料,铵盐的添加对四甲基吡嗪的合成至关重要。铵盐添加量对四甲基吡嗪合成的影响,结果见图7。由图7可知,当补加0~4 g/L铵盐时,四甲基吡嗪产量升高;当补加4 g/L铵盐时,四甲基吡嗪产量最大,达到728.38 mg/L;在补加铵盐>4 g/L之后,四甲基吡嗪产量反而有所降低。因此,最佳铵盐添加量为4 g/L。
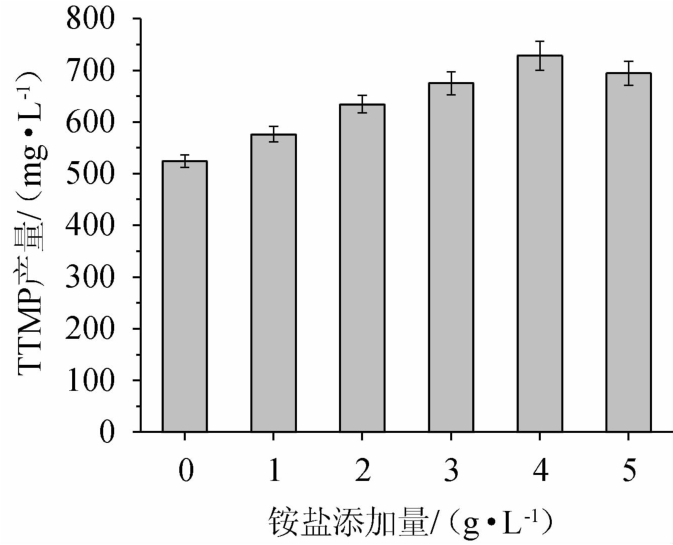
图7 铵盐添加量对四甲基吡嗪产量的影响
Fig.7 Effect of ammonium salt addition on tetramethylpyrazine yield
3 结论
通过稀释涂布法,从高温大曲中分离获得20株可产四甲基吡嗪的能力的芽孢杆菌。在发酵培养基中,有3株相对高产四甲基吡嗪的菌株(WH7、WH10和WH20),其四甲基吡嗪产量分别为235.46 mg/L、272.15 mg/L、173.57 mg/L。结合菌株形态学观察和分子生物学方法,菌株WH7和WH20为副淀粉芽孢杆菌(Bacillus paramycoides),菌株WH10为贝莱斯芽孢杆菌(Bacillus velezensis)。菌株WH10产TTMP发酵条件为:前发酵温度及时间分别为37 ℃、72 h,后发酵温度60 ℃,发酵时间为20 h,初始pH 6.5,铵盐添加量为4 g/L,在此优化条件下,TTMP产量为728.38 mg/L。
[1]LI J,LU J,MA Z L,et al.A green route for high-yield production of tetramethylpyrazine from non-food raw materials[J].Front Bioeng Biotechnol,2021,9:792023.
[2]侯孝元,顾如林,梁文龙,等.利用发酵法生产四甲基吡嗪研究进展[J].生物技术通报,2016,32(1):58-64.
[3]FAN W L,XU Y,ZHANG Y H.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J]. J Agr Food Chem,2007,55(24):9956-9962.
[4]卢君,张颖,李福荣,等.菌种强化结合工艺优化提高酱香白酒基酒中四甲基吡嗪含量的研究[J].中国酿造,2020,39(10):162-166.
[5]吴钱弟,吴茗花,沈毅,等.芽孢杆菌与酵母菌和根霉曲混合发酵提高四甲基吡嗪含量的研究[J].酿酒科技,2021(5):17-21.
[6]徐岩,吴群,范文来,等.中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J].酿酒科技,2011(7):37-40.
[7]张小龙,邱树毅,王晓丹,等.酱香型大曲中挥发性成分与微生物代谢关系[J].中国酿造,2020,39(12):51-57.
[8]沈毅,陈波,张亚东,等.高产吡嗪类物质芽孢杆菌在高温大曲中的应用研究[J].酿酒科技,2019(10):101-105.
[9]赵兴秀,何义国,赵长青,等.产酱香功能菌的筛选及其风味物质研究[J].食品工业科技,2016,37(6):196-200.
[10]李晓霞,李晶晶,张秀红.汾酒大曲中高产四甲基吡嗪菌株的筛选与鉴定[J].食品与机械,2016,32(6):49-51.
[11]张温清,司冠儒,梅婕,等.江南小窖宣酒酿造微生态系统中高产四甲基吡嗪功能微生物的筛选与鉴定[J].酿酒科技,2020(2):55-59.
[12]陈梦圆,李志军,罗爱民.高温大曲中高产四甲基吡嗪菌株的筛选及鉴定[J].酿酒科技,2018(8):24-29.
[13]赵德义,汤丹丹,曹建全,等.产四甲基吡嗪微生物菌株的选育[J].中国酿造,2015,34(3):102-106.
[14]王小平,黄永光,周文美.产酱香风味菌株的分离筛选及鉴定[J].食品与发酵工业,2020,46(10):179-184.
[15]王西,沈毅,张亚东,等.产香枯草芽孢杆菌在酱香型白酒生产中的应用[J].酿酒科技,2018(7):70-75.
[16]祝赛峰,吴建峰,赵希荣.响应面法优化枯草芽孢杆菌S0507产四甲基吡嗪的培养条件[J].食品科学,2014,35(9):218-223.
[17]王晓丹,雷安亮,王婧,等.产四甲基吡嗪地衣芽孢杆菌的应用[J].中国酿造,2017,36(2):35-38.
[18]周榆林,吴钱弟,罗爱民.加热强化大曲对酱香型白酒酿造的影响研究[J].中国酿造,2020,39(2):67-72.
[19]ZHANG W Q,SI G R,RAO Z M,et al.High yield of tetramethylpyrazine in functional Fuqu using Bacillus amyloliquefaciens[J]. Food Biosci,2019,31:100435.
[20]ZHONG H X,SHEN J,MENG Z,et al.Tetramethylpyrazine production fromediblematerialsbytheprobioticBacilluscoagulans[J].Prep Biochem Biotech,2020,50(9):935-942.
[21]马美荣,周林艳,王德斌,等.高产四甲基吡嗪芽孢杆菌的筛选及在清香型原酒生产中的应用研究[J].酿酒科技,2018(7):104-107
[22]司冠儒,张温清,饶志明,等.芝麻香型白酒中健康功能因子四甲基吡嗪测定方法的对比研究[J].酿酒科技,2019(3):29-32.
[23]ZHU B F,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J]. J Ind Microbiol Biot,2010,37(8):815-821.
[24]钟桂芳,张帆,郭辉祥,等.高温大曲中产四甲基吡嗪细菌的筛选及鉴定[J].中国酿造,2020,39(8):107-111.
[25]陈诗佳,李玲玲,陈叶福,等.高产乙偶姻酵母菌种的选育与提高白酒中四甲基吡嗪含量的研究[J].酿酒科技,2018(10):114-119.