木聚糖是植物半纤维素的一种主要组成成分,是除纤维素外自然界含量最丰富的多糖,降解后可产生低聚木糖及其他小分子物质应用于工业生产[1]。木聚糖结构复杂,主链以β-1,4-D糖苷键连接木糖而成,侧链主要由O-乙酰基、β-L-阿拉伯呋喃甲酰基、葡萄糖醛基、4-甲基葡糖醛基以及酚酸等构成[2]。木聚糖的完全降解需要多种酶如木聚糖酶、α-L-阿拉伯糖苷酶以及α-D葡糖苷酸酶等酶系相互协同作用[3]。其中,木聚糖酶可作用于木聚糖β-1,4-糖苷键,将其水解为木糖、木二糖、木三糖等其他低聚木糖,对木聚糖的解聚起着主要作用[4]。木聚糖酶也是一种重要的工业酶制剂,在纸浆漂白、食品和饲料加工等工业领域有着广阔的应用前景[5]。木聚糖酶往往需要在极端的环境下参与工业化生产进程,如高温、强酸强碱、高盐等环境,而大多数天然木聚糖酶在极端环境下稳定性较差,从而限制了木聚糖酶的使用范围[6]。热稳定性一直都是木聚糖酶工业化应用的一种限制性因素,如在饲料加工过程中,木聚糖酶作为饲料添加剂需要一个高温处理的过程[7]。自然界大多数木聚糖酶属于中温木聚糖酶,热稳定性较差,难以满足工业需求,为了解决这一问题,诸多研究者对木聚糖酶进行研究,以提高木聚糖酶热稳定性[8]。如刘回民等[9]对玉米半胱氨酸蛋白酶进行W308C突变,获得突变体W308C,该突变体在70 ℃保温120 min仍能保持15%左右的酶活性,而野生型在10%左右,催化活性也提高了86%。李同彪等[10]对来源于黑曲霉(Aspergillus niger)XZ-3S的木聚糖酶XynZF-2 N-端进行定点突变,得到突变体XynZF-2V1C,该突变体最适温度为50 ℃,比野生型提高了10 ℃,酶活性半衰期t1/245℃提高了10 min。蔡刘滕子等[11]对黑曲霉(Aspergillus niger)XZ-3S木聚糖酶XynZF-2进行定点突变,构建突变体XynCDH(V1C/G116D/N171H),该突变体比野生型XynZF-2最适温度提高了5 ℃,酶活性半衰期t1/240℃、t1/245℃分别提高了5 min和8 min。以上研究表明,定点突变引入半胱氨酸(Cysteine,Cys)对酶的酶学性质改变有较大的影响。
本研究利用快速定点突变技术,在溶糖曲霉(Aspergillus saccharolyticus)JOP1030-1木聚糖酶XynASP的Loop结构第95位点引入半胱氨酸(Cys),获得突变基因xynN95C,构建重组表达载体,在大肠杆菌(Escherichia coli)BL21(DE3)中异源表达,并进行酶学性质分析,旨在获得热稳定性有所改良的木聚糖酶突变体,探究Loop结构引入半胱氨酸对木聚糖酶热稳定性的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与质粒
大肠杆菌(Escherichia coli)BL21(DE3)和大肠杆菌(Escherichia coli)DH5α:瑞士Novagen公司。
重组质粒pET-28a-xynASP:由Sangon公司合成,本实验室保存。
1.1.2 试剂
T4脱氧核糖核酸连接酶(T4 deoxyribonucleic acid ligase,T4 DNA Ligase)、限制性内切酶DpnⅠ、异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG):日本TaKaRa公司;榉木木聚糖:德国Sigma公司;DNA Marker、DNA质粒提取试剂盒、Ni-NTA蛋白纯化试剂盒(NO.C600332)、酵母提取物、蛋白胨、胰蛋白胨、琼脂、甘油(均为生化试剂):生工生物工程(上海)有限公司;DNA片段回收试剂盒:北京鼎国昌盛生物技术公司。
1.1.3 培养基
LB液体培养基:酵母提取物5 g,蛋白胨10 g,氯化钠10 g,蒸馏水1 000 mL,pH 7.4。
LB固体培养基:LB液体培养基中添加20 g/L琼脂。TB培养基:胰蛋白胨14 g,酵母提取物27 g,甘油9 mL,蒸馏水1 000 mL。
以上培养基均于121 ℃灭菌20 min。
1.2 仪器与设备
T100梯度聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国Bio-Rad公司;DYY-6C电泳仪:北京六一生物科技有限公司;XMTE-3102恒温摇床:江苏科析仪器有限公司;SIGMA 3-18K型冷冻高速离心机:北京金运创新科技发展有限公司;DSX-18L高压蒸汽灭菌锅:上海申安医疗器械厂。
1.3 方法
1.3.1 重组木聚糖酶XynASP同源建模及模型优化评估
将重组木聚糖酶的XynASP 氨基酸序列提交至SWISS-MODEL(https://swissmodel.expasy.org/),进行同源建模,并利用Discovery Studio进行模型优化。同时,利用Ramanchandran Plot评估二面角以及Profile-3D评估氨基酸匹配度。
1.3.2 定点突变
基于快速定点突变策略[12]设计定点突变引物(表1),以重组质粒pET-28a-xynASP为模板,利用单点突变引物进行重叠延伸聚合酶链式反应(gene splicing by overlap extension polymerase chain reaction,SOE PCR)法扩增[13],构建重组突变质粒pET-28a-xynN95C。再将重组质粒用化学法转入大肠杆菌DH5α,经卡那霉素(kalamycin,Kan)抗性筛选后,挑选出阳性单克隆子[14],送Sangon公司进行基因测序。
表1 引物序列
Table 1 Sequences of primer
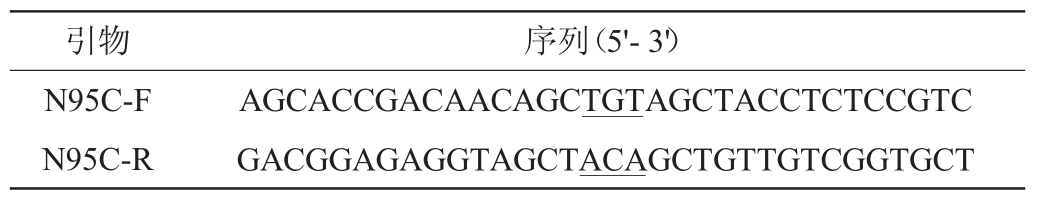
注:下划线为突变位点。
1.3.3 重组木聚糖酶诱导表达及纯化
将测序正确的克隆子提取质粒,化学法转入大肠杆菌BL21(DE3),构建大肠杆菌基因工程菌[15],挑取单克隆子接种于2mL的LB液体培养基(含Kan终质量浓度为50μg/mL),37 ℃、180 r/min过夜培养[16],转接于TB培养基,37 ℃、180 r/min培养3 h,加入IPTG(终浓度为2 mmol/L),30 ℃、180 r/min诱导2 h。诱导结束后,6 000 r/min离心10 min,收集菌体,加入10 mL磷酸氢二钠-柠檬酸缓冲液重悬后,进行细胞破碎(细胞破碎条件:5 s,间隙时间:5 s,工作总时间:7 min,频率:10%),破碎后将细胞破碎液分装于2 mL离心管中离心(11 000 r/min、4 ℃、20 min),取上清液用作粗酶[17]。
利用Ni-NTA蛋白纯化试剂盒对重组木聚糖酶进行纯化[18],纯化步骤参照试剂盒说明书。以10%分离胶和5%浓缩胶对纯化后的重组木聚糖酶进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测分析[19]。
1.3.4 重组木聚糖酶酶活性测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法进行木聚糖酶活性测定[20],取1.5 mL 0.5%的榉木木聚糖和1 mL适当稀释的酶液在适当温度下反应15 min,加入2.5 mL DNS终止反应,水浴煮沸反应7 min;冷却后加5 mL双蒸水(ddH2O),振荡混匀,于波长540 nm处测定吸光度值。
木聚糖酶的活力单位定义:在上述测定活性条件下,每分钟水解木聚糖生成1 μmol木糖所需要的酶量,U。
1.3.5 酶学性质测定
重组木聚糖酶最适温度及热稳定性测定:采用DNS法,在35~60 ℃条件下测定野生型XynASP和突变体XynN95C酶活性,以最高酶活性为100%,计算各温度条件下酶的相对酶活性。将野生型XynASP和突变体XynN95C分别在35 ℃和40 ℃保温1 h,每隔10 min取样,在各自最适温度下测定残余酶活性,以未保温酶的酶活性为100%,计算不同保温时间下酶的残余酶活性。
重组木聚糖酶最适pH及pH稳定性测定:采用DNS法,在最适反应温度下,分别测定pH 3.0~8.0条件下野生型XynASP和突变体XynN95C酶活性,以最高酶活性为100%,计算各pH值条件下酶的相对酶活性。酶在不同pH条件下,35 ℃保温1 h后测定残余酶活性,以未保温酶的酶活性为100%,计算不同pH条件下酶的残余酶活性。
重组木聚糖酶金属离子及有机溶剂耐受性测定:野生型XynASP和突变体XynN95C金属离子及有机溶剂耐受性测定方法参照文献[21]。
2 结果与分析
2.1 重组木聚糖酶XynASP三维结构建立及突变位点确定
利用SWISS-MODEL(https://swissmodel.expasy.org/)对重组木聚糖酶XynASP进行同源建模。将建模结构提交至Discovery Studio进行优化,优化后模型见图1。
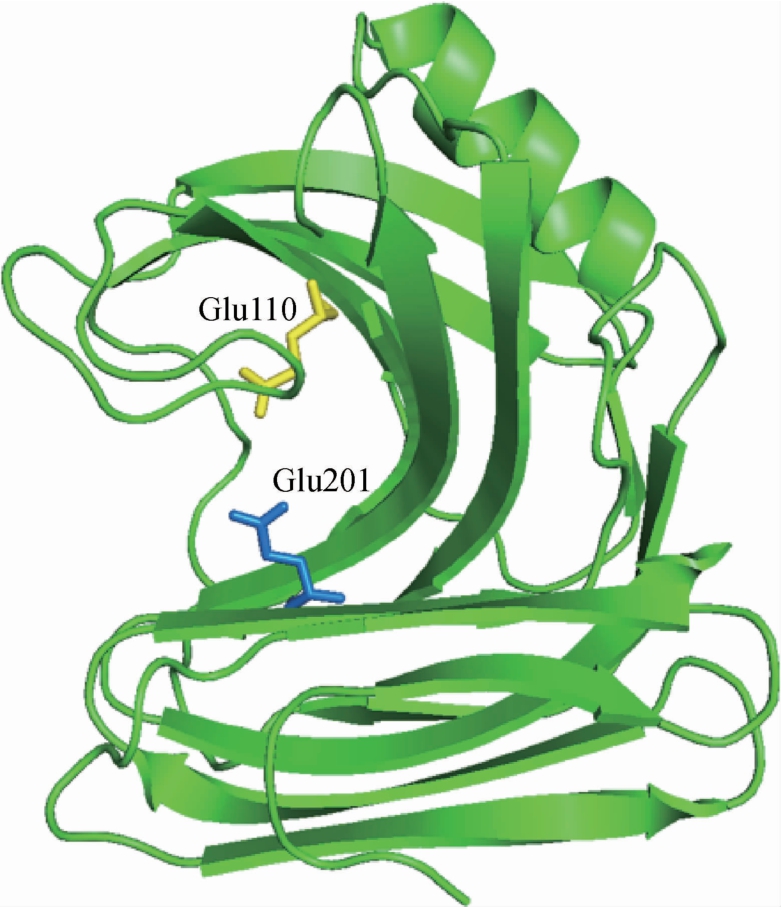
图1 木聚糖酶XynASP三维结构模型
Fig.1 Three-dimensional structure model of xylanase XynASP
图中棒状结构表示催化残基Glu110和Glu201。
由图1可知,XynASP空间结构主要由一个α-螺旋和两个反向平行的β-折叠片层构成,呈右手半握状结构,催化残基由谷氨酸(glutamic acid,Glu)110和谷氨酸(Glu)201组成,属于GH11家族木聚糖酶。XynASP的结构模型经Ramanchandran Plot评估得出该模型中95%氨基酸的二面角在允许的区域内,且有90%的氨基酸在最适区域内,经Profile-3D评估发现模型与自身氨基酸序列匹配度较高,匹配度得分为110.43,远高于期望值(87.06),并且发现模型中氨基酸相容性得分(verify score)均在“0线”以上,表明构建的XynASP模型的氨基酸空间构象合理(图2)。以上评估结果说明该建模结构的可信度高,可用于XynASP热稳定性分子理性设计的可靠结构。

图2 基于Ramanchandran Plot(a)、Profile-3D(b)XynASP模型评估结果
Fig.2 Evaluation results of XynASP model based on Ramanchandran Plot (a) and profile-3D (b)
利用DNAMAN6.0以及DS Client 2016对木聚糖酶XynASP氨基酸序列以及结构分析。同时,利用氨基酸结构相似性,将第95位点的天冬酰胺(asparagine,Asn)替换为半胱氨酸(Cys),构建突变体XynN95C。
2.2 快速定点突变和重组木聚糖酶表达及纯化
以重组质粒pET-28a-xynASP为模板,利用引物N95C-F和N95C-R进行PCR扩增突变质粒pET-28a-xynN95C,经限制性内切酶Dpn I消化模板,化学法转入大肠杆菌DH5α,经Kan抗性筛选后,挑取阳性单克隆送生工生物工程(上海)股份有限公司进行基因测序,测序结果见图3。
由图3可知,经过测序发现,原来第95位点的天冬酰胺密码子AAC突变成半胱氨酸密码子TGT,因此基因突变成功。将重组大肠杆菌工程菌BL21/pET-28a-xynASP和BL21/pET-28a-xynN95C分别进行蛋白诱导表达,经超声波破碎细胞获得粗酶液,并利用Ni-NTA蛋白纯化试剂盒获得纯化的重组木聚糖酶,对重组木聚糖酶粗酶液和纯化后的酶液进行SDS-PAGE电泳,结果见图4。

图3 突变质粒pET-28a-xynN95C测序结果
Fig.3 Sequencing results of mutated plasmid pET-28a-xynN95C
红色方框表示突变密码子。
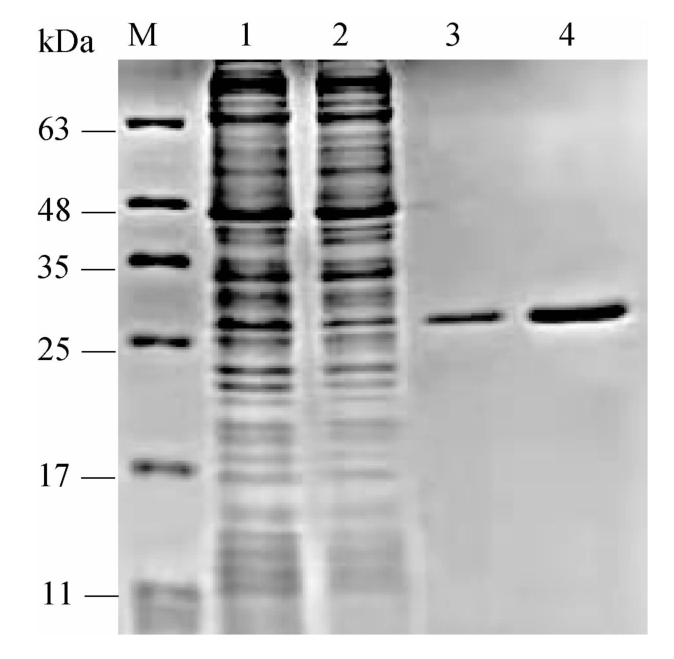
图4 重组木聚糖酶XynASP和XynN95C的SDS-PAGE分析结果
Fig.4 SDS-PAGE analysis results of the recombinant xylanase XynASP and XynN95C
M表示蛋白质Marker,1表示突变体XynN95C的粗酶液;2表示野生型XynASP的粗酶液;3表示突变体XynN95C的纯酶液;4表示野生型XynASP的纯酶液。
由图4可知,野生型XynASP和突变体XynN95C的粗酶液和纯酶液均在27 kDa处有明显条带,且纯化后的蛋白样品纯度较高,达到了电泳纯,可满足酶学性质分析要求。
2.3 酶学性质比较与分析
2.3.1 温度对野生型XynASP与突变体XynN95C酶活性的影响
由图5可知,野生型XynASP最适温度为45 ℃,突变体XynN95C最适温度为50 ℃,相比野生型(45 ℃)提高了5 ℃。测定重组木聚糖酶热稳定性发现,在35 ℃保温60 min后,野生型XynASP和突变体XynN95C均保留较高的稳定性。突变体XynN95C的残余酶活性为91.2%,相比于野生型(87.5%)略有提高;40 ℃保温20 min后,野生型XynASP相对酶活性明显下降,仅保留了50.6%的残余酶活性,而突变体XynN95C残余酶活性仍高达77.56%;40 ℃保温40 min后,突变体XynN95C仍保留了54.6%的残余酶活性,而野生型残余酶活性下降到了41.0%。
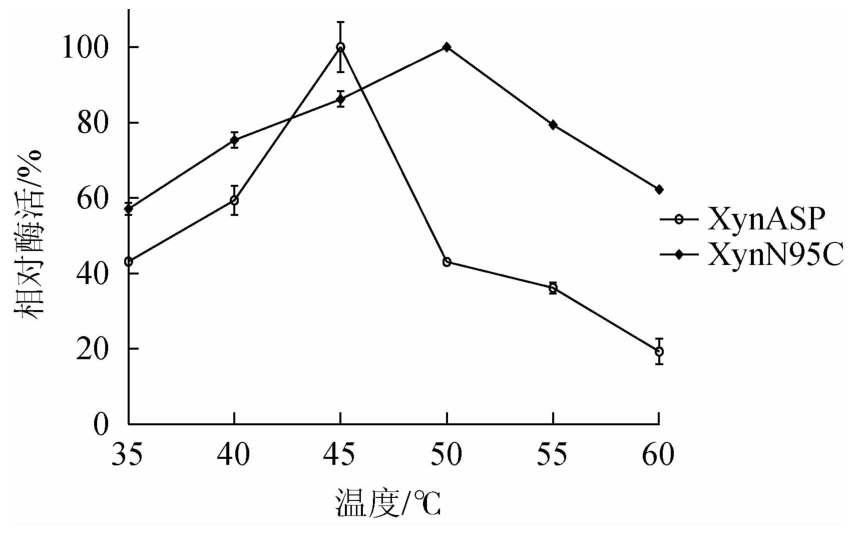
图5 野生型XynASP和突变体XynN95C最适温度比较
Fig.5 Comparison of optimum temperature between the wild-type XynASP and mutant XynN95C
由图6可知,突变体XynN95C的半衰期t1/240℃为38 min,相比野生型提高了18 min。由此表明,突变体XynN95C热稳定性相比野生型XynASP明显提高。
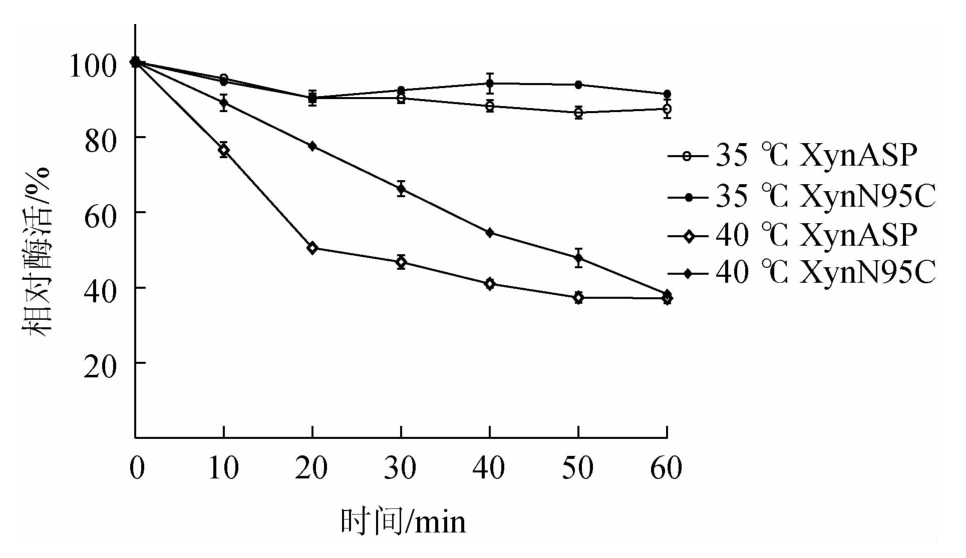
图6 野生型XynASP和突变体XynN95C热稳定性比较
Fig.6 Comparison of thermal stability between the wild-type XynASP and mutant XynN95C
2.3.2 突变体XynN95C与野生型XynASP最适pH及pH稳定性比较
由图7可知,在pH值为3.0、4.0、5.0、6.0、7.0和8.0条件下,野生型XynASP的最适pH为6.0,突变体XynN95C的最适pH为5.0。相比野生型,突变体XynN95C的最适pH有所降低,更偏酸性。

图7 突变体XynN95C与野生型XynASP最适pH比较
Fig.7 Comparison of optimum pH between mutant XynN95C and wild-type XynASP
由图8可知,在pH 3.0~8.0条件范围内,野生型XynASP与突变体XynN95C残余酶活性均在40.0%~80.0%之间,突变体XynN95C对于酶的pH稳定性没有明显改善。
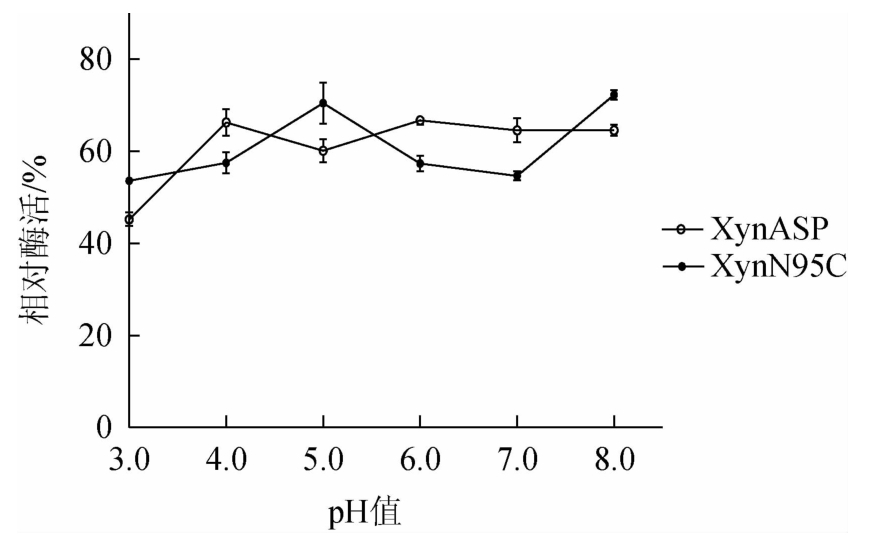
图8 突变体XynN95C与野生型XynASP pH稳定性比较
Fig.8 Comparison of pH stability between mutant XynN95C and wild type XynASP
2.3.3 突变体XynN95C与野生型XynASP金属离子和有机溶剂稳定性比较
由图9可知,在40 ℃条件下,将金属离子(K+、Na+、Fe2+、Cu2+、Ca2+、Zn2+、Mg2+、Fe3+)分别与野生型XynASP和突变体XynN95C保温1 h,测定重组木聚糖酶酶活性,以不加金属离子的重组木聚糖酶酶活性为100%,分析金属离子对野生型XynASP和突变体XynN95C酶活性影响,结果见图9。由图9可知,K+、Na+和Mg2+对野生型XynASP的酶活性有明显的激活作用,相对酶活性分别为112.1%、108.8%和120.9%,而Fe3+对野生型XynASP酶活性有明显抑制作用。其他金属离子对野生型XynASP的酶活性基本没有影响。突变体XynN95C酶活性受Cu2+的影响较大,表现出较大的抑制作用,相对酶活性为52.2%。值得关注的是,Fe3+处理后,突变体XynN95C相对酶活性高达93.9%,而野生型XynASP相对酶活性为65.9%。由此得出,突变体XynN95C对Fe3+有较高的耐受性。
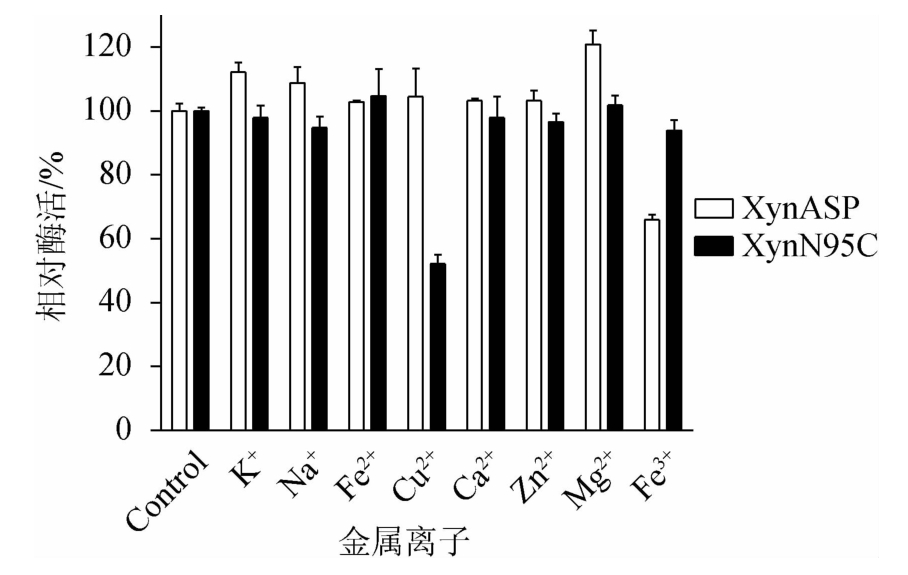
图9 突变体XynN95C与野生型XynASP金属离子稳定性比较
Fig.9 Comparison of metal ions stability between mutant XynN95C
and wild-type XynASP
由图10可知,通过分析不同浓度的有机溶剂(甲醇、乙醇和异丙醇)对野生型XynASP和突变体XynN95C酶活性影响发现,随着甲醇、乙醇和异丙醇浓度的增加,野生型XynASP和突变体XynN95C对这三种有机溶剂的耐受性均有所下降,且突变体XynN95C下降的更为明显。
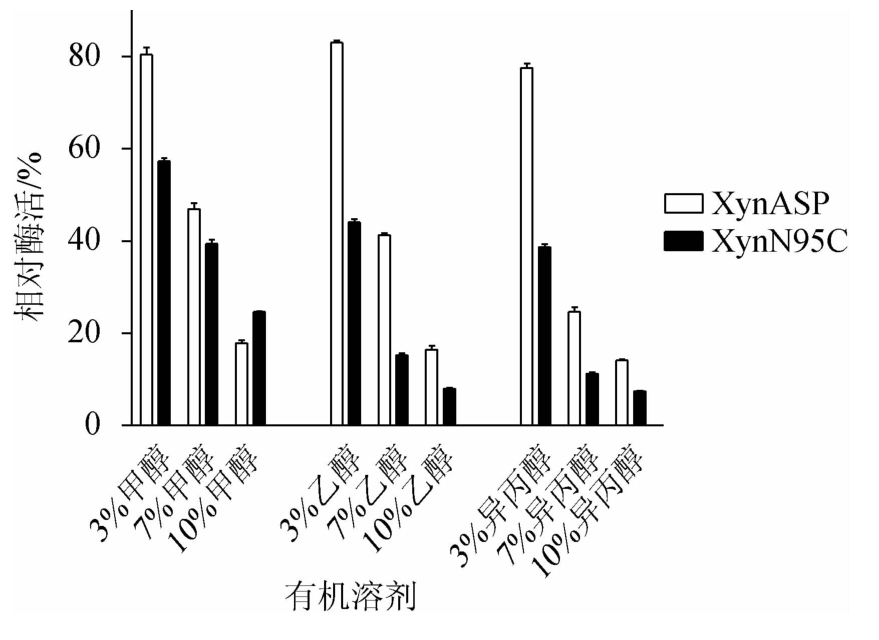
图10 突变体XynN95C与野生型XynASP有机溶剂稳定性比较
Fig.10 Comparison of organic solvent stability between mutant XynN95C and wild-type XynASP
2.3.4 重组木聚糖酶结构分析
以野生型XynASP三维结构为模板,对突变体XynN95C同源建模,并进行结构比对分析,结果见图11。

图11 野生型XynASP和突变体XynN95C结构比对
Fig.11 Structure alignment of wild-type XynASP and mutant XynN95C
图中蓝色cartoon表示野生型XynASP结构,绿色cartoon表示突变体XynN95C结构,黄色棒状表示野生型中残基Asn95,绿色棒状表示XynN95C中残基Cys95,红色箭头表示突变体
XynN95C结构偏移方向。
由图11可知,突变体XynN95C由于第95位点天冬酰胺(Asn)突变成半胱氨酸(Cys),使得第95位点附近结构向活性中心内发生一定的偏移,且第95位点结构由原来的Loop结构进一步演变成β-折叠,相比柔性较大的Loop结构更加稳定,因此,这就可能导致蛋白结构更加的稳定,从而改善了酶的热稳定性。
2.4 讨论
由于GH11家族木聚糖酶对木聚糖有较高的特异性,催化效率较高,专一性强,可以更多地应用于食品、纺织、饲料和制浆等工业,获得更多有价值的产品[22-23]。随着木聚糖酶工业应用环境的不断拓展,木聚糖酶性能的改善引起了研究者的重视,尤其是木聚糖酶热稳定性的改善。很多研究者通过定点突变技术对木聚糖酶进行热稳定性分子改造,获得可喜的成就,并为后续木聚糖酶热稳定性分子改造提供了方向,如陈亚文等[24]在黑曲霉(Aspergillus niger)XZ-3S木聚糖酶XynZF-2 N-端引入半胱氨酸,得到的突变体Xyn-E27C最适温度相比野生型提高了5 ℃,且半衰期t1/245℃增加了17 min,酶的热稳定性得到了很大提高。由此可见,在木聚糖酶N-端引入半胱氨酸对木聚糖酶的热稳定性有一定的影响[25]。
3 结论
本研究以溶糖曲霉(Aspergillussaccharolyticus)JOP1030-1木聚糖酶XynASP为研究对象,在其Loop结构中引入半胱氨酸(Cys),进行N95C定点突变,获得突变体XynN95C,并在大肠杆菌BL21(DE3)中诱导表达,通过酶学性质分析,突变体XynN95C最适温度相比野生型XynASP提高5 ℃,半衰期t1/240℃为38 min,相比野生型提高了18 min,热稳定性大大提高,且最适pH从6.0降至5.0。突变体XynN95C结构相比野生型发生一定的改变,第95位点结构由原来的Loop结构变成β-折叠,导致该部位更加的稳定,进而改善了XynASP的热稳定性。由此得出,在Loop结构引入半胱氨酸也可提高木聚糖酶的热稳定性,为GH11家族木聚糖酶的热稳定性改造提供又一思路。
[1]LI J F,GAO S J,LIU X T,et al.Modified pPIC9K vector-mediated expression of a family 11 xylanase gene,Aoxyn11A,from Aspergillus oryzae in Pichia pastoris[J].Ann Microbiol,2013,63(3):1109-1120.
[2]WATANABEM,INOUE H,INOUE B,et al.Xylanase (GH11) from Acremonium cellulolyticus:homologous expression and characterization[J].AMB Express,2014,4:1-8.
[3]葛雨杭,陈美汐,孙博,等.木聚糖酶TgXyn2的酶学特性研究[J].食品工业科技,2022,43(4):138-144.
[4]徐君飞,张居作.微生物β-1,4-内切木聚糖酶研究进展[J].中国酿造,2014,33(5):15-17.
[5]WANG L J,CAO K,PEDROSO M M,et al.Sequence-and structureguided improvement of the catalytic performance of a GH11 family xylanase from Bacillus subtilis[J].J Biol Chem,2021,297(5):101262.
[6]WU X Y,ZHANG Q,ZHANG L Z,et al.Insights into the role of exposed surface charged residues in the alkali-tolerance of GH11 xylanase[J].Front Microbiol,2020,11:872.
[7]吴凤梅,周燕霞,姚冬生,等.定向引入N-糖基化位点改进黑曲霉β-1,4-内切木聚糖酶热稳定性[J].微生物学通报,2020,47(7):2128-2139.
[8]吴芹,臧嘉,胡蝶,等.定点饱和突变改善米曲霉木聚糖酶的温度特性[J].食品与生物技术学报,2019,38(7):65-70.
[9]刘回民,程国栋,陈方奇,等.玉米半胱氨酸蛋白酶突变体W308C的原核表达和酶学性质表征[J].食品科学,2014,35(15):122-126.
[10]李同彪,周晨妍,朱新术,等.V1C定点突变木聚糖酶XynZF-2对酶热稳定性的影响[J].食品与发酵工业,2015,41(4):39-43.
[11]蔡刘滕子,张米帅,何优,等.V1C、G116D、N171H定点突变对黑曲霉(Aspergillus niger)XZ-3S木聚糖酶XynZF-2热稳定性的影响[J].生物技术,2018,28(3):249-254.
[12]LIU Y,LI Z Y,GUO C,et al.Enhancing the thermal stability of ketoreductase ChKRED12 using the FireProt web server[J].Process Biochem,2021,101:207-212.
[13]何敏超,刘云云,陈小燕,等.木聚糖酶产生菌的筛选、发酵及酶学性质[J].中国酿造,2019,38(12):107-111.
[14]余天意.极端耐热木聚糖酶XYNH的异源表达及酶学性质鉴定[D].武汉:中南民族大学,2016.
[15]ZHOU K X,WANG H,ZHU X T,et al.Enhancing thermostability of xylanase from rumen microbiota by molecular cyclization[J].Chinese J Biotechnol,2020,36(5):920-931.
[16]LIU R,CHEN L,JIANG Y P,et al.A novel transcription factor specifically regulates GH11 xylanase genes in Trichoderma reesei[J].Biotechnol Biofuels,2017,10(1):1-14.
[17]王石全.Paenibacillus sp.SSG-1来源一种新颖木聚糖酶的克隆、表达、纯化和酶学性质研究[J].轻工科技,2021,37(11):20-21,34.
[18]丁睿,谢会芳,韩正刚,等.海洋微生物Cellulophaga algicola DSM 14237木聚糖酶的分子鉴定及酶学性质[J].武汉轻工大学学报,2022,41(1):16-24.
[19]LIU L W,SUN X F,YAN P F,et al.Non-structured amino-acid impact on GH11 differs from GH10 xylanase[J].PloS One,2012,7(9):e45762.
[20]TAN Z B,TANG C D,WU M C,et al.Exploration of disulfide bridge and N-glycosylation contributing to high thermostability of a hybrid xylanase[J].Protein Pept Lett,2014,21(7):657-662.
[21]付冠华.黑曲霉XZ-3S木聚糖酶基因克隆、表达及重组酶酶学性质分析[D].新乡:新乡医学院,2013.
[22]KARLSSON E N,SCHMITZ E,LINARES-PASTÉN J A,et al.Endoxylanases as tools for production of substituted xylooligosaccharides with prebiotic properties[J].Appl Microbiol Biotechnol,2018,102(21):9081-9088.
[23]SHANG T T,SI D Y,ZHANG D Y,et al.Enhancement of thermoalkaliphilic xylanase production by Pichia pastoris hrough novel fed-batch strategy in high cell-density fermentation[J].BMC Biotechnol,2017,17(1):55.
[24]陈亚文,周晨妍,谢晶晶,等.引入中性氨基酸对木聚糖酶XynZF-2热稳定性的影响[J].中国酿造,2015,34(10):27-31.
[25]吴占东,韩文杰,周同,等.通过理性改造提高11家族木聚糖酶热稳定性研究进展[J].微生物学杂志,2017,37(5):103-107.