鲊菜是指以米粉或玉米粉为原料,以豇豆、冬瓜和萝卜等各种切碎的蔬菜为辅料,加入食盐和花椒密封发酵而成的一种传统发酵食品[1]。鲊菜制作工艺相对简单,制作环境相对开放,在湖北省仙桃市、天门市、荆门市和潜江市等地区有着广泛的食用人群。有研究表明,由于受制作原料和当地生态环境的影响,不同地区制作的同一发酵食品可能形成了各自较为独特的微生物类群[2],而独特的微生物类群又对其产品品质的形成及食用安全性具有重要的影响作用[3]。仙桃市位于华中腹地,北依汉水,南靠长江,具有全年气候温和、四季分明及无霜期长的特点,得天独厚的自然条件和地理环境可能使当地制作的鲊菜蕴含了较为丰富和独特的微生物类群,然而目前关于此方面的研究尚少。
近年来以Illumina MiSeq为代表的第二代高通量测序技术在泡菜[4]、腊肉[5]、腐乳[6]和豆瓣酱[7]等我国传统发酵食品的微生物多样性解析中有着广泛的应用,具有通量高和价格相对低廉的优点[8]。作为华中和西南地区另一特色发酵食品,鲊广椒亦是以米粉或玉米粉为原料密封发酵而成,与鲊菜的不同之处在于其使用的为二荆条辣椒,在湖北省恩施土家族苗族自治州、宜昌市、荆州市和神农架林区有着广泛的食用人群[9]。通过采用MiSeq高通量测序技术,王玉荣等[10]对宜昌市当阳地区鲊广椒细菌群落结构进行了解析,发现乳杆菌属(Lactobacillus)为其主要优势细菌属,且Lactobacillus和普氏菌属(Prevotella)对鲊广椒风味的形成具有积极的作用;李娜等[11]对荆州市洪湖地区鲊广椒的乳酸菌多样性进行了分析,发现Lactobacillus为其主要乳酸菌属;席啦等[12]对宜昌市秭归地区鲊广椒细菌多样性进行解析,发现Lactobacillus、戊糖片球菌属(Pediococcus)和假单胞菌属(Pseudomonas)为其优势菌属。鲊菜和鲊广椒作为湖北地区特色发酵食品,虽然在制作原料上存在一定的差异,但其制作工艺具有一定相似性,加之MiSeq高通量测序技术在鲊广椒微生物类群解析中有了成功的应用,因而将该技术应用于鲊菜的微生物群落结构解析中具有较强的可行性。乳酸菌已广泛应用于乳制品、肉制品和果汁制品的生产加工中[13],且对于人体的肠道防御、血糖血脂调节和身体免疫力提升等均具有明显的作用[14],是目前食品加工领域使用的主要菌种资源之一。前期研究亦证明鲊广椒中存在丰富的乳酸菌资源,因而在对鲊菜微生物多样性进行解析的同时,采用传统的微生物学手段对鲊菜中蕴含的乳酸菌资源进行收集亦具有积极的意义。
本研究采用纯培养和MiSeq高通量测序技术相结合的手段对仙桃地区鲊菜中细菌菌群多样性进行解析,对其蕴含的乳酸菌资源进行挖掘,在为鲊菜这一特色传统发酵食品微生物类群解析提供数据支撑的同时,亦可为其后续产业化推动提供菌株支持。
1 材料与方法
1.1 材料与试剂
从湖北省仙桃市(E112°55′~113°49′,N30°04′~30°32′)城南菜市场、昌盛菜市场和沙嘴桥菜市场采集鲊菜样品共9个,所有鲊菜的发酵时间在30~40 d之间,制作原料均为大米粉,添加蔬菜均为冬瓜。
QIAGEN DNeasy mericon Food Kit脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;5×TransStartTM FastPfu Buffer、FastPfu Fly DNA Polymerase和脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)Mix:北京全式金生物技术有限公司;MRS合成培养基:北京陆桥技术股份有限公司;琼脂糖(生化试剂):北京索来宝生物技术有限公司;聚合酶链式反应(polymerase chain reaction,PCR)清洁试剂盒:武汉天一辉远生物科技有限公司;克隆载体pMD18-T:大连宝生物工程有限公司。
1.2 仪器与设备
vetiri梯度基因扩增仪:美国AB公司;PE300高通量测序平台:美国Illumina公司;DG250型厌氧工作站:英国Don Whitley公司;CR21N型高速离心机:日本日立金属株式会社;1645050基础电泳仪:美国Bio-Rad公司;UVPCDS8000凝胶成像分析系统:美国ProteinSimple公司。
1.3 实验方法
1.3.1 鲊菜乳酸菌的分离鉴定
称取10 g鲊菜样品于装有90 mL无菌生理盐水的三角瓶中,30 ℃振荡0.5 h,使用MRS培养基于厌氧条件下培养48 h,挑取革兰氏染色结果为阳性和过氧化氢酶结果为阴性的疑似乳酸菌菌株使用30%甘油保存[15],-80 ℃备用。
使用溴化十六烷基三甲铵(cetyltrimethyl ammonjum bromide,CTAB)法对疑似乳酸菌菌株中的DNA进行提取[16],并参照曾维友等[17]的方法对所提取的DNA进行PCR扩增,扩增产物经电泳(120 V,30 min)检测合格后进行一系列的清洁、连接、转化和克隆子的鉴定,挑选阳性克隆子送往武汉天一辉生物有限公司测序。测序序列进行拼接并去除引物,在美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,统计分离到的乳酸菌数量及鉴定种类。
1.3.2 鲊菜中微生物宏基因组DNA提取和Illumina MiSeq高通量测序
使用基因组提取试剂盒对鲊菜微生物宏基因组DNA进行提取,置于-20 ℃备用,以宏基因组DNA为模板,使用在前段加入了7个碱基核苷酸标签(barcode)的338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')引物,按照WANG Y等[18]的PCR扩增体系和扩增条件对鲊菜样品中的细菌16S rRNA进行PCR扩增,随后进行琼脂糖凝胶电泳检测,将检测合格的PCR扩增产物于Illumina MiSeq PE300平台进行高通量测序。
1.3.3 序列质控和生物信息学分析
参照GUO Z等[19]的方法对测序的原始数据进行拼接、质控和以QIIME平台为依托进行生物信息学分析。即:序列经PyNAST软件进行标准比对和对齐后选取100%和97%相似度进行两步UCLUST划分,从而构建分类操作单元(operational taxonomic units,OTU)矩阵,随后使用Chimera Slayer软件剔除含有嵌合体的OTU,最后选取代表性序列在核糖体数据库项目(ribosomal database project,RDP)进行同源性比对,进而明确鲊菜中微生物类群的分类学地位。
1.3.4 数据处理
使用MEGA 7.0和R软件相结合的方法对乳酸菌分离株的系统发育树进行构建,使用Excel 2010软件对乳酸菌分离株相对含量的子母饼图进行绘制,使用Origin 2017软件对鲊菜中平均相对含量>1.0%的门和属柱形图进行绘制,使用R软件对核心OTU相对含量的热图进行绘制。
2 结果与分析
2.1 仙桃地区鲊菜中乳酸菌的分离、鉴定及相对含量分析
本研究通过纯培养手段从14 个鲊菜中共分离得到了44 株乳酸菌,在对其16S rRNA基因序列进行PCR扩增、测序和BLAST比对的基础上,将其与模式菌株混合构建了系统发育树,结果见图1。
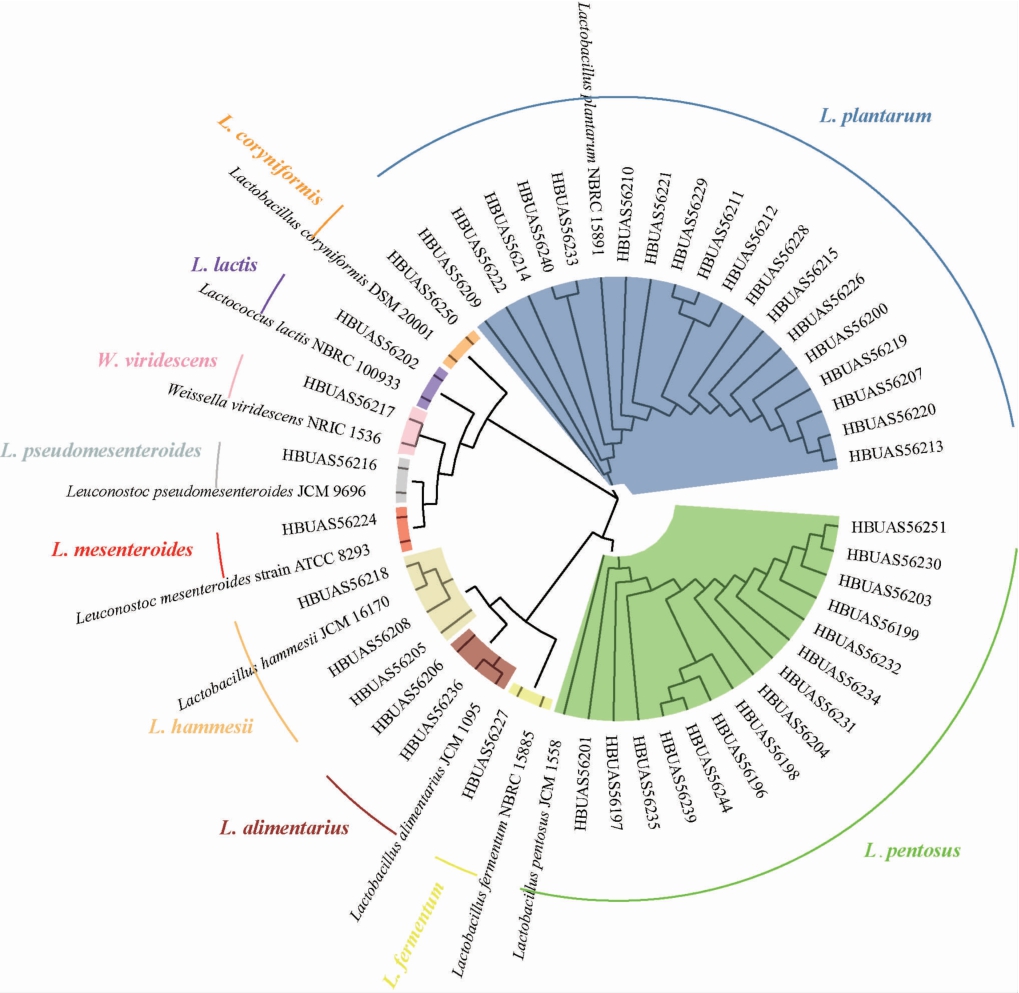
图1 鲊菜中乳酸菌分离株的系统发育树
Fig.1 Phylogenetic tree of lactic acid bacteria isolates in Zha-vegetable
由图1可知,HBUAS56196等18株菌株被鉴定为植物乳杆菌(Lactobacillus plantarum),HBUAS56207等15株菌株被鉴定为戊糖乳杆菌(L.pentosus),菌株HBUAS56205、HBUAS56208和HBUAS56218被鉴定为黑氏乳杆菌(L.hammesii),菌株HBUAS56206和HBUAS56236被鉴定为消化乳杆菌(L.alimentarius),菌株HBUAS56250被鉴定为棒状乳杆菌(L.coryniformis),菌株HBUAS56227被鉴定为发酵乳杆菌(L.fermentum),菌株HBUAS56202被鉴定为乳酸乳球菌(Lactococcus lactis),菌株HBUAS56217被鉴定为绿色魏斯氏菌(Weissella viridescens),菌株HBUAS56224被鉴定为肠膜明串珠球菌(Leuconostoc mesenteroides),菌株HBUAS56216被鉴定为假肠膜明串珠球菌(L.pseudomesenteroides)。由此可见,仙桃地区鲊菜中乳酸菌分离株主要隶属于Lactobacillus,累计占总分离株的90.91%。进一步对各乳酸菌分离株的类群构成及其相对含量进行分析,结果见图2。
由图2可知,隶属于Lactobacillus的种包含6 个,为L.plantarum、L.pentosus、L.hammesii、L.alimentarius、L.fermentum和L.coryniformis,分别占总分离株含量的40.91%、34.09%、6.82%、4.55%、2.27%和2.27%;隶属于Leuconostoc的种包含2 个,分别为L.mesenteroides和L.pseudomesenteroides,均占总分离株含量的2.27%;隶属于Weissella和Lactococcus的种各有1 个,分别为W.viridescens和L.lactis,均占总分离株含量的2.27%。由此可见,L.plantarum和L.pentosus为仙桃鲊菜中的优势乳酸菌。大米或玉米等谷物在发酵过程中,L.plantarum的存在能显著提升谷物的质构、蒸煮及感官品质,并使得其蛋白质、脂肪及灰分含量显著减少,总淀粉和直链淀粉含量显著增加,同时使糊化黏度和起始糊化温度降低,糊化焓值增加,从而更有利于谷物品质的提高[20]。本研究发现,仙桃地区鲊菜中含有L.pentosus,有研究指出在发酵过程中该类群菌株具有较强降解亚硝酸盐的能力[21]。
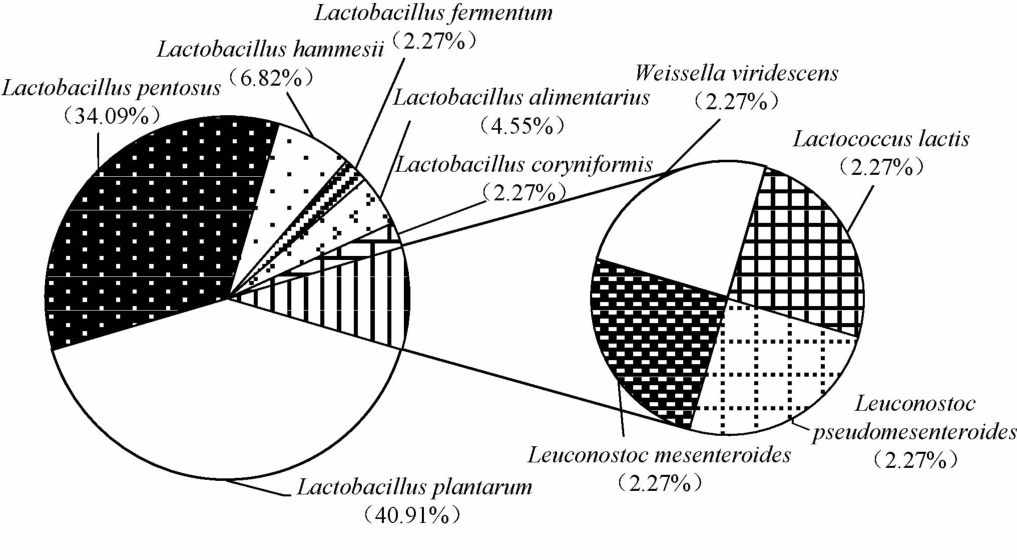
图2 鲊菜中乳酸菌分离株相对含量的饼图
Fig.2 Pie plot of relative contents of lactic acid bacteria isolates in Zha-vegetable
2.2 基于门和属分类水平鲊菜细菌相对含量的分析
本研究进一步对14个鲊菜中微生物基因组进行了提取,在对9 个样品微生物基因组进行成功提取的基础上,使用MiSeq高通量技术对其细菌多样性进行解析。结果发现,9个样品共产生286 471条高质量的16S rRNA序列,经比对鉴定为7个门、18个纲、32个目、68个科和142个属,其中不能鉴定到门和属水平的序列占总序列数的0.87%和19.36%。若在9 个样品中某一细菌门或属的平均相对含量≥1.00%,则将其定义为优势细菌门或属,鲊菜中优势细菌门的构成见图3。
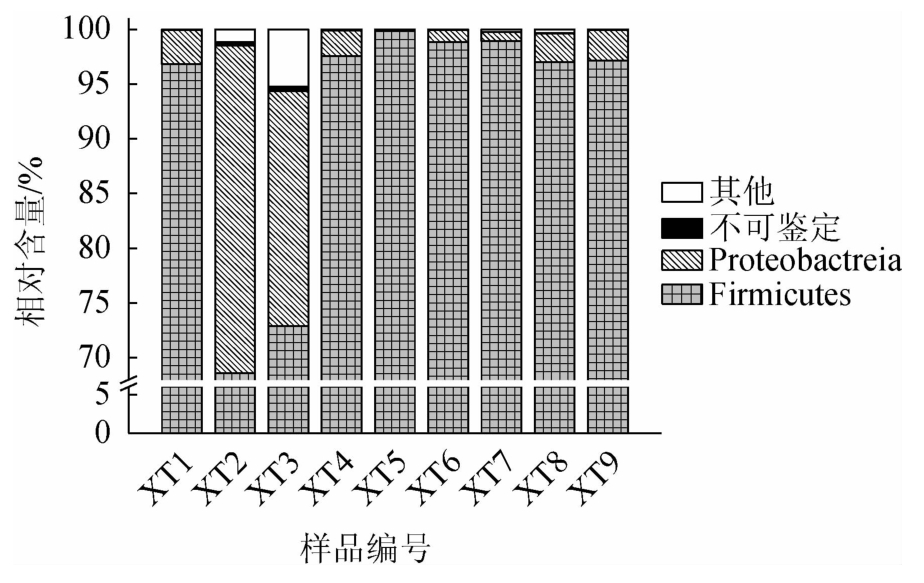
图3 鲊菜中优势细菌门的相对含量
Fig.3 Relative contents of dominant bacterial phyla in Zha-vegetable
由图3可知,仙桃地区鲊菜中的优势细菌门为硬壁菌门(Firmicutes)和变形菌门(Proteobacteria),其平均相对含量分别为91.97%和7.13%。不同样品在门水平上细菌类群的构成即存在一定差异,样品XT2和XT3中Proteobacteria相对含量高达68.62%和72.89%,而其他7 个样品以Firmicutes为主且平均相对含量高达95.00%以上。为进一步揭示不同样品间细菌类群的差异,本研究进一步对优势细菌属的含量进行解析,结果见图4。
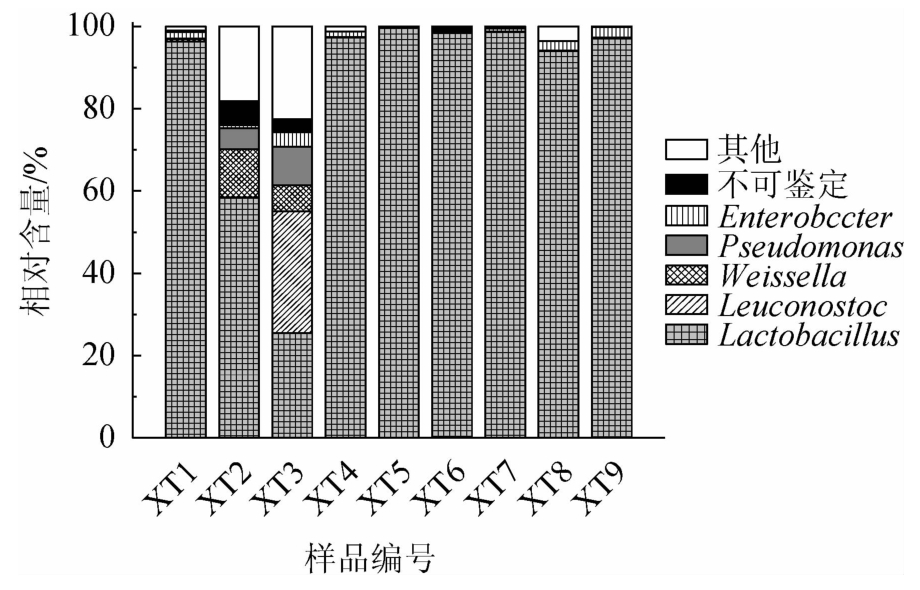
图4 鲊菜中优势细菌属的相对含量
Fig.4 Relative contents of dominant bacterial genera in Zha-vegetable
由图4可知,鲊菜中优势细菌属主要包括Lactobacillus、Leuconostoc、Weissella、Pseudomonas 和肠杆菌属(Enterobacter),其中Lactobacillus、Leuconostoc和Weissella均隶属于Firmicutes,其相对含量分别为85.03%、3.31%和1.68%;Pseudomonas和Enterobacter隶属于Proteobacteria,相对含量分别为1.50%和1.05%。Lactobacillus、Leuconostoc和Weissella均为乳酸菌,累计相对含量高达90.02%,且通过纯培养方式获得了隶属于上述菌属的分离株。由此可见,仙桃地区鲊菜中蕴藏着丰富的乳酸菌资源。乳酸菌可以产生多种氨基酸、维生素和酶等活性物质,从而提高和改善发酵食品的营养价值,在发酵过程中通过厌氧发酵产生乳酸和丙酸从而对发酵环境中某些腐败微生物和致病微生物的生长具有抑制作用[22]。
由图4亦可知,样品XT2和XT3中蕴含细菌的多样性明显高于其他7 个样品,其中样品XT2除含有58.36%的Lactobacillus外,亦含有Enterobacter、Weissella、根瘤菌属(Rhizobium)、克雷伯氏菌属(Klebsiella)、Pediococcus和沙雷氏菌属(Serratia)等细菌,相对含量分别为5.84%、5.03%、4.80%、4.74%、2.42%和1.63%;样品XT3中Lactobacillus的相对含量仅为25.46%,但其Leuconostoc的相对含量高达29.66%,除此以外亦含有Weissella、Lactococcus、Pseudomonas、稳杆菌属(Empedobacter)、Enterobacter、漫游球菌属(Vagococcus)、Klebsiella和塔特姆菌属(Tatumella),相对含量分别为9.41%、4.83%、3.53%、3.51%、3.15%、1.88%、1.40%和1.10%。经对其α多样性进行计算发现,在测序深度为14 000条时,样品XT2和XT3的香农指数分别为4.90和6.38,而其他7个样品的平均香农指数仅为2.81。Enterobacter[23]、Klebsiella[24]、Serratia[25]和Empedobacter[26]多为条件致病菌,可引起原发性或继发性的感染,因而样品XT2和XT3在食用过程中可能存在一定的安全隐患,究其原因可能是在发酵过程中陶坛没有密封好或原料受到了外界环境的污染[10]。
2.3 核心OTU及其在各样品中的分布
采用两步UCLUST对序列进行划分且去除嵌合体后,本研究共得到了9 230个OTU,若某一OTU在9个样品中均存在则将其定义为核心OTU。虽然纳入本研究的样品细菌多样性存在一定差异,但解析不同样品中共有的细菌类群,对探讨发酵食品品质的形成和食用安全性均具有较大的意义[27]。本研究共发现6个核心OTU,其系统发育树及各OTU在9个样品中的含量见图5。
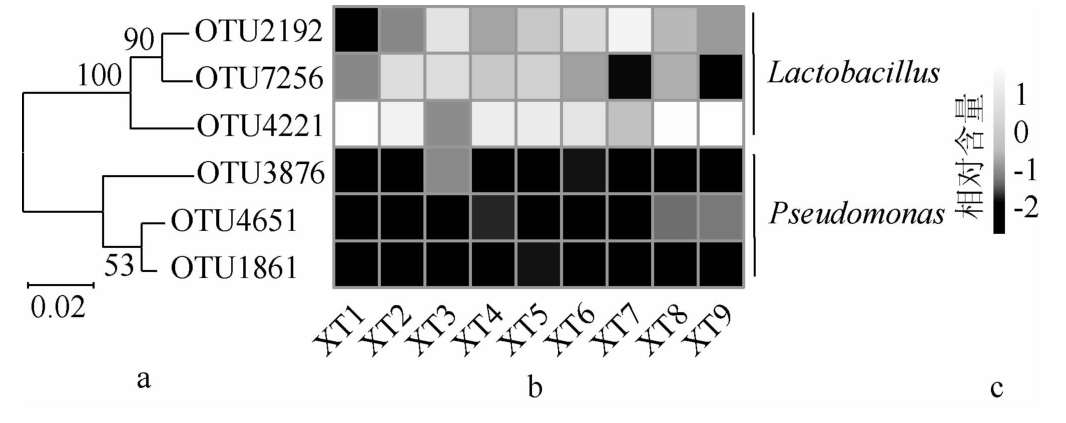
图5 核心操作分类单元矩阵系统发育树及其在各鲊菜中的相对含量
Fig.5 Phylogenetic tree of core operational taxonomic units and their relative contents in each Zha-vegetable
a为系统发育树,b为各核心OTU在各样品中相对含量的热图,c为以Log10为底变换后的相对含量。
由图5可知,6个核心OTU在系统发育树中整体划分为2个大类,其中OTU2192、OTU7256和OTU4221隶属于Lactobacillus,其在9 个样品的平均相对含量分别为6.59%、1.91%和39.96%;OTU3876、OTU4651和OTU1861隶属于Pseudomonas,平均相对含量分别为0.02%、0.03%和0.01%。由此可见,Lactobacillus是仙桃地区鲊菜中的主要核心细菌类群。虽然各样品中Pseudomonas的相对含量较低,但有研究指出该菌株致病力较低但其抗药性较强,在自然界中广泛存在,是导致伤口感染的细菌之一[28]。由此可见,在鲊菜制作及发酵过程中,保证环境及发酵器皿的洁净度、对发生腐败及霉变的原料及时剔除和保证鲊菜发酵过程中陶坛的密封性是极为必要的[10]。
3 结论
本研究采用传统微生物学方法和高通量测序技术对仙桃地区14 份鲊菜样品中细菌菌群多样性进行了解析,结果发现Firmicutes和Proteobacteria为鲊菜中的优势细菌门,Lactobacillus、Leuconostoc、Weissella、Pseudomonas 和Enterobacter为鲊菜中优势细菌属,L.plantarum和L.pentosus为鲊菜中主要的乳酸菌类群。
[1]刘甜甜.豆角鲊菜腌制过程中主要成分变化的研究[D].长沙:湖南农业大学,2012.
[2]CAI W C,TANG F X,WANG Y R,et al.Bacterial diversity and flavor profile of Zha-chili,a traditional fermented food in China[J]. Food Res Int,2021,141:110112.
[3]FILIPPIS F D,VALENTINO V,ALVAREZ-ORDÓÑEZ A,et al.Environmental microbiome mapping as a strategy to improve quality and safety in the food industry[J].Curr Opin Food Sci,2021,38:168-176.
[4]LIANG H P,YIN L G,ZHANG Y H,et al.Dynamics and diversity of a microbial community during the fermentation of industrialized Qingcai paocai,a traditional Chinese fermented vegetable food,as assessed by Illumina MiSeq sequencing,DGGE and qPCR assay[J].Ann Microbiol,2018,68(2):111-122.
[5]董蕴,王玉荣,王尧,等.基于变性梯度凝胶电泳和MiSeq高通量测序技术分析恩施地区腊肉的细菌多样性[J].肉类研究,2018,32(10):37-42.
[6]ZHANG Z D,WANG Y R,XIANG F S,et al.Distinct bacterial community of a solid-state fermented Chinese traditional food huase sufu revealed by high-throughput sequencing[J]. Food Sci Biotechnol,2021,30: 1233-1241.
[7]赵馨馨,崔梦君,董蕴,等.应用Illumina MiSeq高通量测序技术分析巴东地区豆瓣酱中微生物多样性[J].现代食品科技,2019,35(9):297-303.
[8]NYGAARD A B,TUNIJØ H S,MEISAL R,et al.A preliminary study on the potential of Nanopore MinION and Illumina MiSeq 16S rRNA gene sequencing to characterize building-dust microbiomes[J].Sci Rep,2020,10(1):1-10.
[9]GUO Z,WANG Y R,XIANG F S,et al.Evaluating the flavor and divergent bacterial communities in corn-based Zha-chili[J].Food Biosci,2022,46:101563.
[10]王玉荣,沈馨,董蕴,等.鲊广椒细菌多样性评价及其对风味的影响[J].食品与机械,2018,34(4):25-30.
[11]李娜,崔梦君,马佳佳,等.基于Illumina MiSeq测序和传统可培养方法的洪湖鲊广椒乳酸菌多样性研究[J].食品与发酵工业,2021,47(4):110-115,122.
[12]席啦,向凡舒,张彦,等.秭归地区鲊广椒中乳酸菌及细菌多样性研究[J].中国酿造,2021,40(11):122-126.
[13]MORADI M,KOUSHEH S A,ALMASI H,et al.Postbiotics produced by lactic acid bacteria: the next frontier in food safety[J]. Compr Rev Food Sci Food Saf,2020,19(6):3390-3415.
[14]MATHUR H,BERESFORD T P,COTTER P D.Health benefits of lactic acid bacteria(LAB)fermentates[J].Nutrients,2020,12(6):1679.
[15]REUBEN R C,ROY P C,SARKAR S L,et al.Isolation,characterization,and assessment of lactic acid bacteria toward their selection as poultry probiotics[J].BMC Microbiol,2019,19(1):253.
[16]张逸舒,王玉荣,陈芸曼,等.保康鲊广椒中乳酸菌的分离鉴定及其发酵特性的评价[J].食品研究与开发,2019,40(16):159-165.
[17]曾维友,周於强,池浩.泡菜中乳酸菌的分离鉴定及抗性筛选[J].中国酿造,2021,40(10):163-167.
[18]WANG Y R,XIANG F S,ZHANG Z D,et al.Characterization of bacterial community and flavor differences of different types of Douchi[J].Food Sci Nutr,2021,9(7):3460-3469.
[19]GUO Z,WANG Y R,XIANG F S,et al.Bacterial diversity in pickled cowpea(Vigna unguiculata[Linn.]Walp)as determined by llumina MiSeq sequencing and culture-dependent methods[J]. Current Microbiol,2021,78:1286-1297.
[20]ESPIRITO-SANTO A P,MOUQUET-RIVIER C,HUMBLOT C,et al.Influence of cofermentation by amylolytic Lactobacillus strains and probiotic bacteria on the fermentation process,viscosity and microstructure of gruels made of rice,soy milk and passion fruit fiber[J].Food Res Int,2014,57:104-113.
[21]XIAO Y Q,LI P J,ZHOU Y,et al.Effect of inoculating Lactobacillus pentosus R3 on N-nitrosamines and bacterial communities in dry fermented sausages[J].Food Control,2018,87:126-134.
[22]陈嘉佳,李璐,余元善,等.发酵蔬菜抗氧化活性的研究进展[J].中国酿造,2022,41(1):13-18.
[23]YOON J W,WANDERMAN N R,KEREZOUDIS P,et al.Enterobacter infection after spine surgery:an institutional experience[J].World Neurosurg,2019,123:e330-e337.
[24]BENGOECHEA J A,PESSOA J S.Klebsiella pneumoniae infection biology:living to counteract host defences[J].FEMS Microbiol Rev,2019,43(2):123-144.
[25]GILBERT R,TORRES M,CLEMENS R,et al.Spaceflight and simulated microgravity conditions increase virulence of Serratia marcescens in the Drosophila melanogaster infection model[J].NPJ Microgravity,2020,6:4.
[26]CHENG Y Y,CHEN Y,LIU Y,et al.Identification of novel tetracycline resistance gene tet(X14)and its co-occurrence with tet(X2)in a tigecycline-resistant and colistin-resistant Empedobacter stercoris[J]. Emerg Microbes Infect,2020,9(1):1843-1852.
[27]CHAILLOU S,CHAULOT-TALMON A,CAEKEBEKE H,et al.Origin and ecological selection of core and food-specific bacterial communities associated with meat and seafood spoilage[J]. ISME J,2015,9: 1105-1118.
[28]MAYER-HAMBLETT N,RETSCH-BOGART G,KLOSTER M,et al.Azithromycin for early Pseudomonas infection in cystic fibrosis.The OPTIMIZE randomized trial[J].Am J Resp Crit Care,2018,198(9):1177-1187.