阿魏酸,又名4-羟基-3-甲氧基肉桂酸(C10H10O4),易溶于极性溶剂[1],是由阿魏酸酯酶(ferulic acid esterases,FAEs)水解酯键产生的酚酸类物质[2],普遍存在于禾本科植物(如麦麸、高粱皮、豌豆皮、作物秸秆等)中[3-4],通常以酯键、缩醛键等与大分子物质构成交联的致密成分,保持细胞的机械完整性[5-8],具有疏散血小板、清除自由基、提高免疫力、预防阿尔兹海默症等功效[9-10],是药品、食品等行业领域的重要原料[11-13]。水解阿魏酸的方法有多种,其中微生物酶解法具有低成本、安全环保、高效率等的优点,因此,筛选能够产生阿魏酸酯酶的菌株,发酵释放阿魏酸是最经济适用的方式[14-15]。
“有美酒必备佳曲”、“曲为酒之骨”[16],浓香型大曲是以高梁为主要原料,混合大麦、小麦,并配以一定比例的豌豆粉碎成颗粒状[17-18],加水拌料制成砖块状的曲坯,在可控的温度和湿度环境下培养而成的中高温大曲[19]。大曲富含有许多微生物和酶类[20],在白酒生产过程中具有糖化和生香作用[21];此外,白酒中风味化合物的形成也是源于酒曲中微生物的发酵作用[22]。目前,我国各种名优白酒大都使用传统的大曲法固态发酵酿造[23]。近年来,增加白酒中健康成分的含量,提高白酒的营养价值,是中国白酒酿造产业的发展趋势[24],因此,众多白酒研究人员致力于分离筛选更多功能性菌株。目前,有关产阿魏酸酯酶菌株的筛选主要是从土壤或者腐质样品中筛选,而在白酒相关中的研究较少且酶活力较低[25-26]。
该研究采用透明圈法从浓香型白酒大曲中筛选高产阿魏酸酯酶的菌株,通过形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定,并以阿魏酸酯酶活力为评价指标,通过单因素试验及响应面试验对其发酵条件进行优化,以期提高白酒中阿魏酸的含量,提高白酒品质,为白酒增添更多功能性的健康因子。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
浓香型白酒大曲:河南蔡洪坊酒业有限公司;麸皮:郑州某超市。
1.1.2 试剂
硫酸铵、硫酸镁、FeCl3、柠檬酸、柠檬酸钠(均为分析纯):天津市科密欧化学试剂有限公司;无水乙醇(色谱纯)、琼脂粉(生化试剂):上海麦克林生化科技有限公司;阿魏酸、阿魏酸乙酯(均为分析纯):赛国生物科技有限公司;其他试剂为国产分析纯。
1.1.3 培养基
初筛培养基[25]:NaCl0.3g/L,K2HPO40.3g/L,MgSO4·7H2O 0.3 g/L,(NH4)2SO4 1.3 g/L,琼脂粉18 g/L,10%阿魏酸乙酯溶液(溶于N,N-二甲基甲酰胺)15 mL/L,pH 7.0,121 ℃高压蒸汽灭菌20 min。
LB固体培养基[25]:NaCl 0.1 g/L,蛋白胨0.1 g/L,酵母粉0.05g/L,琼脂粉0.18g/L,pH自然,121℃高压蒸汽灭菌20min。
产酶液体培养基[25]:酵母粉1 g/L,KH2PO4 0.37 g/L,(NH4)2SO41.3 g/L,MgSO4·7H2O 0.3 g/L,CaCl2·2H2O 0.07 g/L,FeCl3 0.02 g/L,10%阿魏酸乙酯溶液(溶于N,N-二甲基甲酰胺)5 mL/L,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
DNP-9272BS型恒温培养箱、DYY-6C型电泳仪:北京六一生物科技有限公司;DGL-50B立式高压蒸汽灭菌锅:上海力辰仪器有限公司;3-18KS型高速冷冻离心机:德国Sigma公司;FUB紫外可见分光光度计:上海科晓科学仪器有限公司;GelDoc-IT2 315凝胶成像系统:美国UVP公司。
1.3 方法
1.3.1 产阿魏酸酯酶菌株的分离及筛选
将酿酒大曲粉碎,称取20 g加入含180 mL无菌水的三角瓶,于28 ℃、200 r/min的恒温摇床培养40 min,室温静置3 min,取上清液按10倍梯度系列稀释至10-7,取50 μL稀释的菌悬液涂布于初筛培养基上,28 ℃静置培养24 h。
初筛:挑取具有透明圈的菌株划线于LB固体培养基上进行多次分离、纯化,得到单菌落[27]。
复筛:将初筛得到的菌株接种于产酶液体培养基中,28 ℃、180 r/min条件下72 h,测定发酵液中阿魏酸酯酶酶活力,筛选酶活力最大的菌株为目标菌种,保藏备用[28]。
1.3.2 阿魏酸酯酶酶活力的测定
取发酵液1 mL,12 000 r/min离心15 min,弃沉淀取上清[29-30]。以去淀粉麦麸[31]为底物测定酶活,以煮沸失活的酶液为空白,每组3个平行实验,具体方法参照文献[32-33]。以阿魏酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制得到阿魏酸的标准曲线,得到回归方程:y=0.089 4x-0.088 8,相关系数R2=0.996 0,说明阿魏酸质量浓度与吸光度值在此范围内线性关系良好。
酶活力定义:在反应条件55 ℃、pH值6.0时,每分钟水解底物释放1 μmol阿魏酸所需要的酶量定义为一个酶活力单位(U)。
1.3.3 菌种鉴定
形态学鉴定:观察菌落的形状、表面特征,挑取单菌落染色制片,光学显微镜下观察细胞形态。
生理生化鉴定:参照《伯杰氏系统细菌学手册》[34]进行生理生化试验。
分子生物学鉴定[35]:委托生工生物工程(上海)有限公司对菌株的16S rDNA基因序列进行扩增并测序,将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST同源性搜索,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA11软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 菌株产阿魏酸酯酶发酵条件优化
单因素试验:以菌株接种量4%(V/V)、发酵温度28 ℃、转速180 r/min、培养基初始pH自然、发酵时间72 h作为初始发酵条件[36],分别探究发酵温度(28 ℃、30 ℃、32 ℃、34 ℃、36 ℃)、发酵时间(36 h、48 h、60 h、72 h、84 h)、接种量(2%、3%、4%、5%、6%)、初始pH值(5.0、5.5、6.0、6.5、7.0)对菌株产阿魏酸酯酶活力的影响。
响应面试验:在单因素试验结果的基础上,选出对目标菌株产阿魏酸酯酶酶活力影响最大的3个因素接种量(A)、发酵温度(B)和初始pH值(C)作为自变量(X),酶活力为响应值(Y),采用Design-Expert 8.0.6设计Box-Behnken试验[37]。
1.3.5 数据处理
使用IBM SPSS V22.0软件进行单因素方差分析,采用Design-Expert 8.0.6分析响应面回归模型,试验重复3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 产阿魏酸酯酶菌株的筛选结果
2.1.1 初筛结果
将大曲样品稀释后涂布于初筛培养基上,经分离和筛选后,共获得9株产透明圈的菌株,命名为M1~M9。
2.1.2 复筛结果
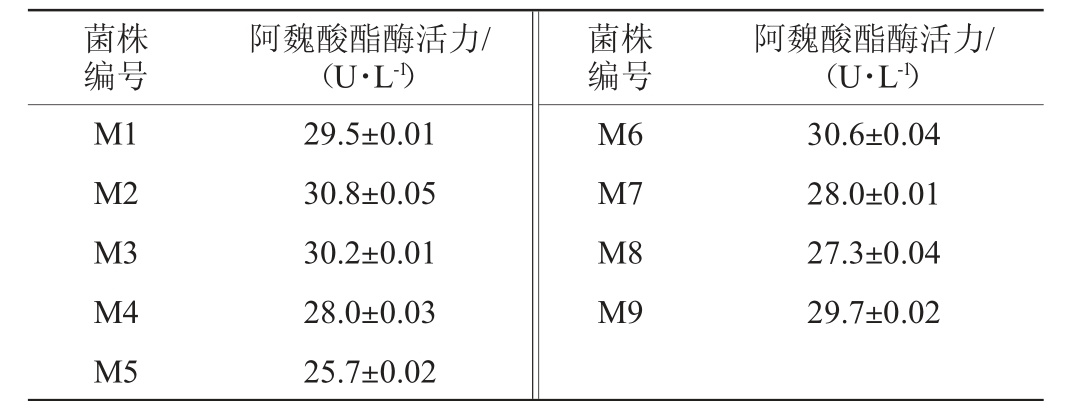
测定初筛得到的9株菌的阿魏酸酯酶酶活力,结果见表1。由表1可知,菌株M2的阿魏酸酯酶活力最高,为(30.8±0.05)U/L,因此,以菌株M2为目标菌株。
表1 初筛菌株阿魏酸酯酶活力测定结果
Table 1 Determination results of ferulic acid esterase activity of the first screening strains
2.2 菌株M2的鉴定
2.2.1 形态学鉴定
菌株M2的菌落及细胞形态见图1。由图1a可知,菌株M2的单菌落为乳白色,形状为规则的圆形,表面光滑,菌落中心凸起,边缘整齐。由图1b可知,细胞呈长杆状,细菌特征明显,革兰氏染色呈紫色,为革兰氏阳性菌(G+)。

图1 菌株M2的菌落(a)及细胞(b)形态特征
Fig.1 Colony (a) and cell (b) morphological characteristics of strain M2
2.2.2 生理生化鉴定
菌株M2的生理生化试验结果见表2。由表2可知,菌株M2可水解利用淀粉、乳糖、麦芽糖,VP试验、MR试验及明胶试验结果均为阳性,H2S试验结果为阴性。根据《常见细菌系统鉴定手册》,初步鉴定菌株M2为芽孢杆菌属(Bacillus sp.)。
表2 菌株M2的生理生化试验结果
Table 2 Results of physiological and biochemical experiments of strain M2
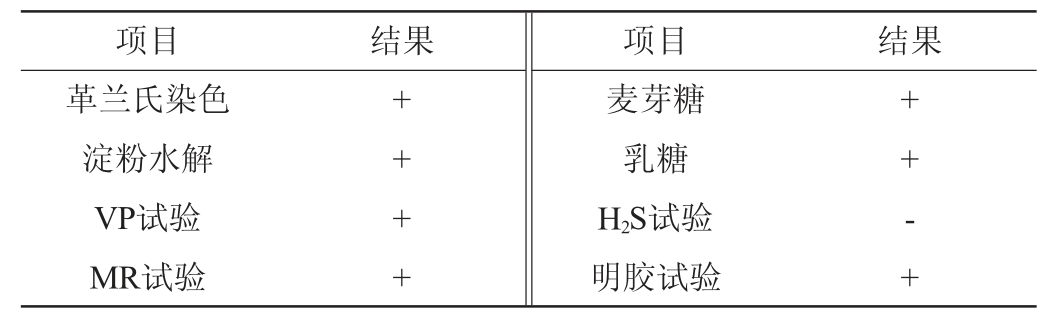
注:“+”表示试验结果呈阳性;“-”表示试验结果呈阴性。
2.2.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株M2的系统发育树,结果见图2。由图2可知,菌株M2与蜡样芽孢杆菌(Bacillus cereus)在进化关系上具有最近的亲缘关系,结合菌株M2的菌落形态特征及生理生化鉴定结果,最终鉴定菌株M2为蜡样芽孢杆菌(Bacillus cereus)。

图2 基于16S rDNA基因序列菌株M2的系统发育树
Fig.2 Phylogenetic tree of strain M2 based on 16S rDNA gene sequences
2.3 菌株M2产阿魏酸酯酶发酵条件优化单因素试验结果
2.3.1 发酵温度对菌株M2产阿魏酸酯酶活力的影响
由图3可知,随着发酵温度的升高,阿魏酸酯酶活力呈先升高后下降的趋势,分析原因可能是随着温度的升高,菌株的部分理化条件遭到破坏,导致其产酶能力下降[38-39]。当发酵温度为30 ℃时,酶活力最高,为32.95 U/L,由此确定该菌株产阿魏酸酯酶的最佳发酵温度为30 ℃。
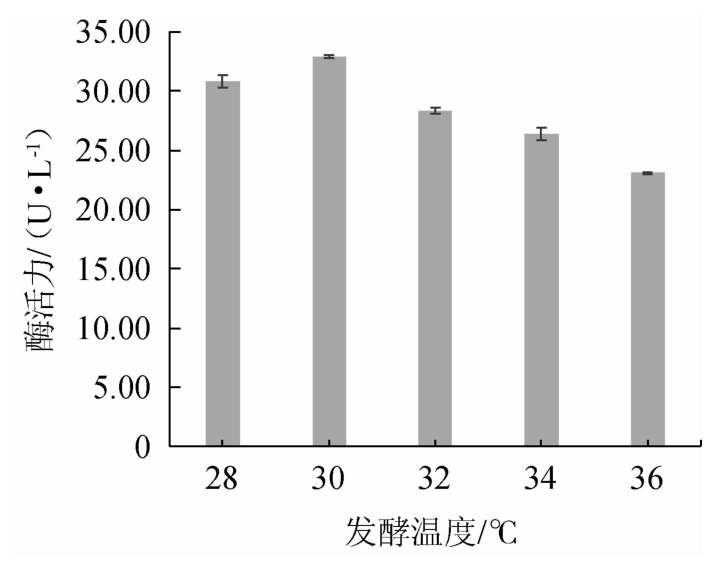
图3 发酵温度对菌株M2产阿魏酸酯酶活力的影响
Fig.3 Effect of fermentation temperature on the activities of ferulic acid esterase produced by strain M2
2.3.2 发酵培养时间对菌株产酶活力的影响
由图4可知,当发酵时间在36~72 h范围时,随着发酵时间的延长,酶活力呈升高趋势,可能是由于发酵初期氧气充足,菌体繁殖快;当发酵时间为72 h时,酶活力最高,为30.80 U/L;当发酵时间>72 h之后,酶活力呈下降趋势,可能是由于培养时间超过了菌株的对数生长期,菌株开始衰亡,且产生的代谢副产物对产酶造成不利影响[40]。由此确定该菌株产酶的最佳培养时间为72 h。
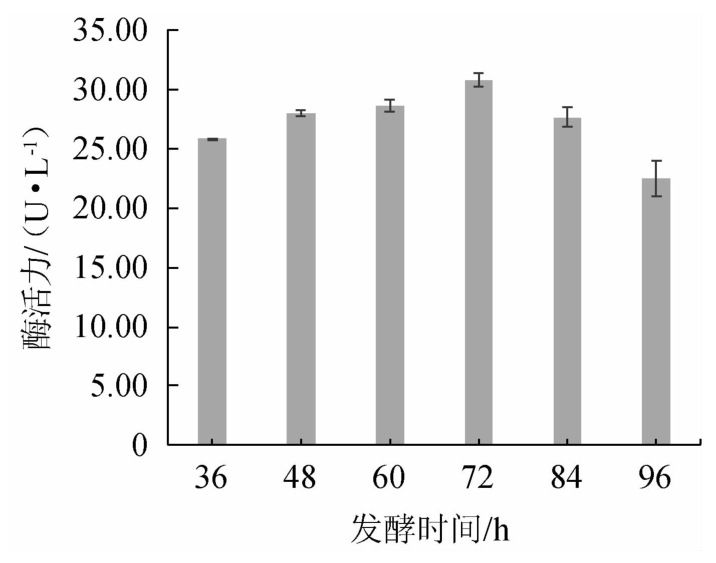
图4 发酵时间对菌株M2产阿魏酸酯酶活力的影响
Fig.4 Effect of fermentation time on the activities of ferulic acid esterase produced by strain M2
2.3.3 接种量对菌株产酶活力的影响
由图5可知,在接种量为2%~5%的范围内,随着接种量的增大,酶活力呈升高趋势,可能是由于发酵初期营养充足,菌体生长状况良好[41];当接种量为5%时,酶活力达到最大值,为32.60 U/L;当接种量>5%之后,酶活力降低,可能是由于菌种之间竞争激烈,导致产酶能力减弱[41-42]。由此确定该菌株产酶的最适接种量为5%。
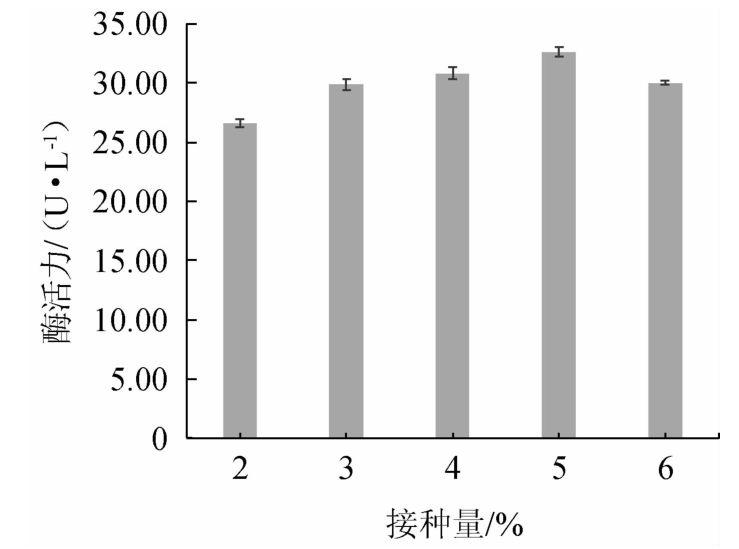
图5 接种量对菌株M2产阿魏酸酯酶活力的影响
Fig.5 Effect of inoculum on the activities of ferulic acid esterase produced by strain M2
2.3.4 初始pH对菌株产酶活力的影响
由图6可知,当初始pH值<5.5之前,阿魏酸酯酶活力呈升高的趋势;当初始pH值为5.5时,酶活力达到最大值,为32.83 U/L;当初始pH值>5.5时,酶活力呈缓慢递减趋势,说明培养基初始pH值的升高或降低都会减弱菌株的产酶能力。由此确定该菌株产酶的最佳初始pH值为5.5。
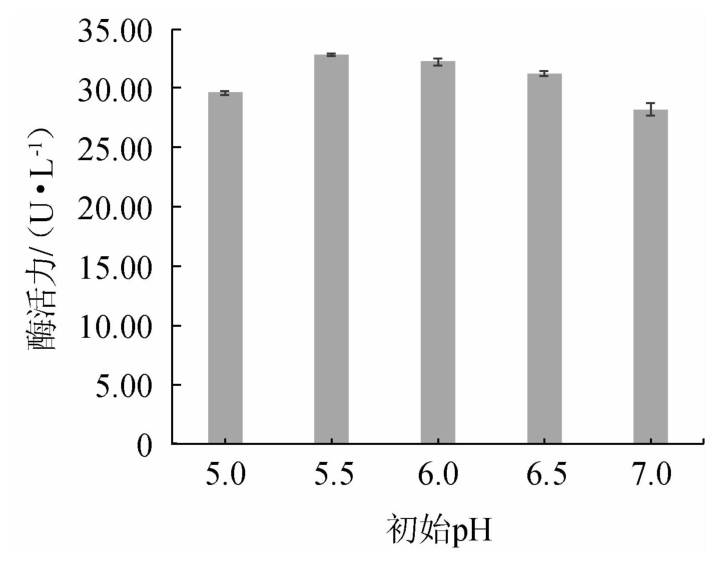
图6 初始pH对菌株M2产阿魏酸酯酶活力的影响
Fig.6 Effect of initial pH on the activities of ferulic acid esterase produced by strain M2
2.4 菌株M2产阿魏酸酯酶条件优化响应面试验结果
2.4.1 响应面试验结果与分析
使用IBM SPSS V22.0软件分析单因素试验结果,选定影响显著的因素接种量(A)、发酵温度(B)和初始pH值(C),以阿魏酸酯酶活力(Y)为响应值,依据Box-Behnken试验设计原理,设计3因素3水平的响应面试验,试验设计及结果见表3,回归模型的方差分析见表4。
表3 Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken tests
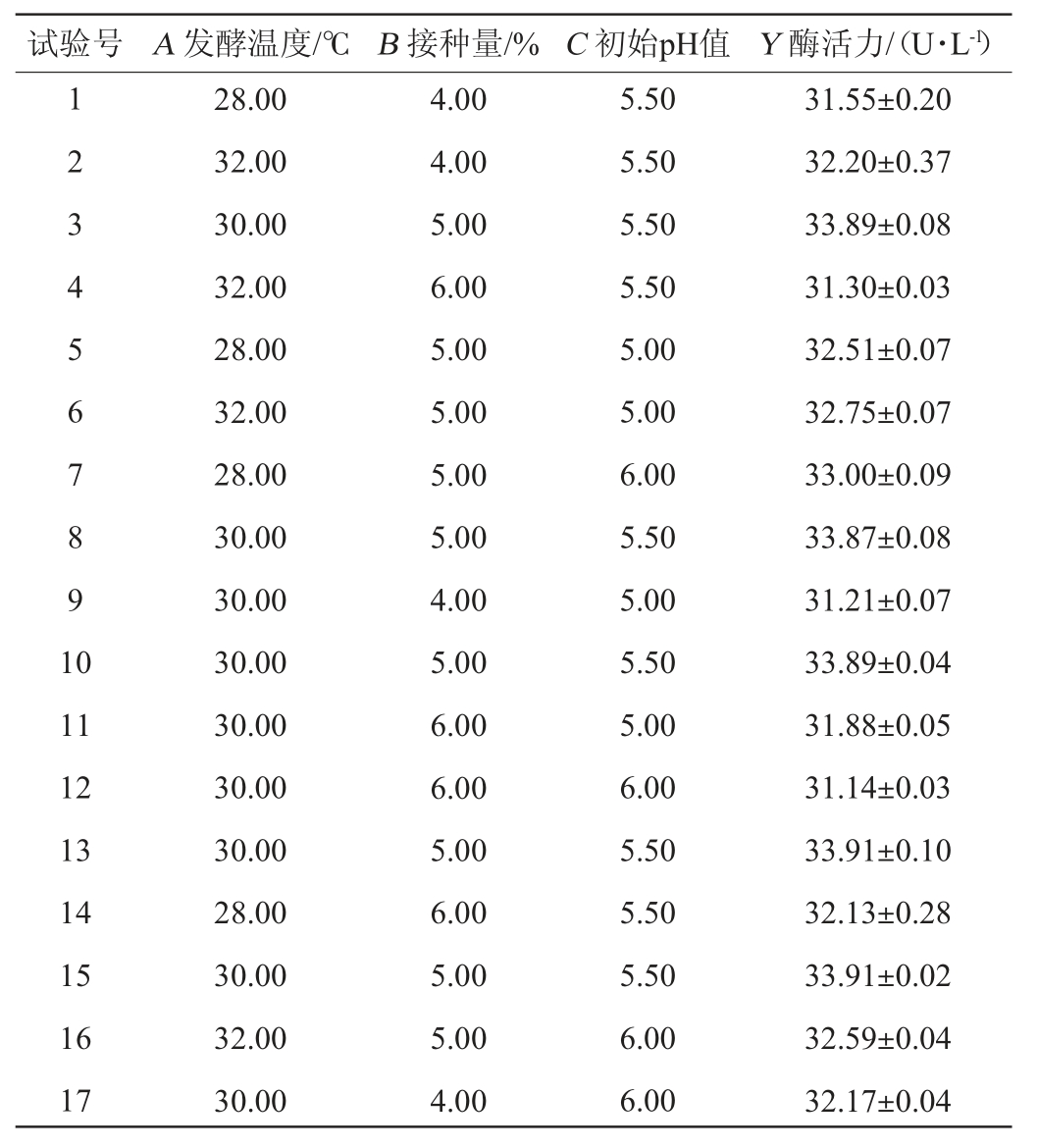
表4 回归模型方差分析
Table 4 Variance analysis of regression model
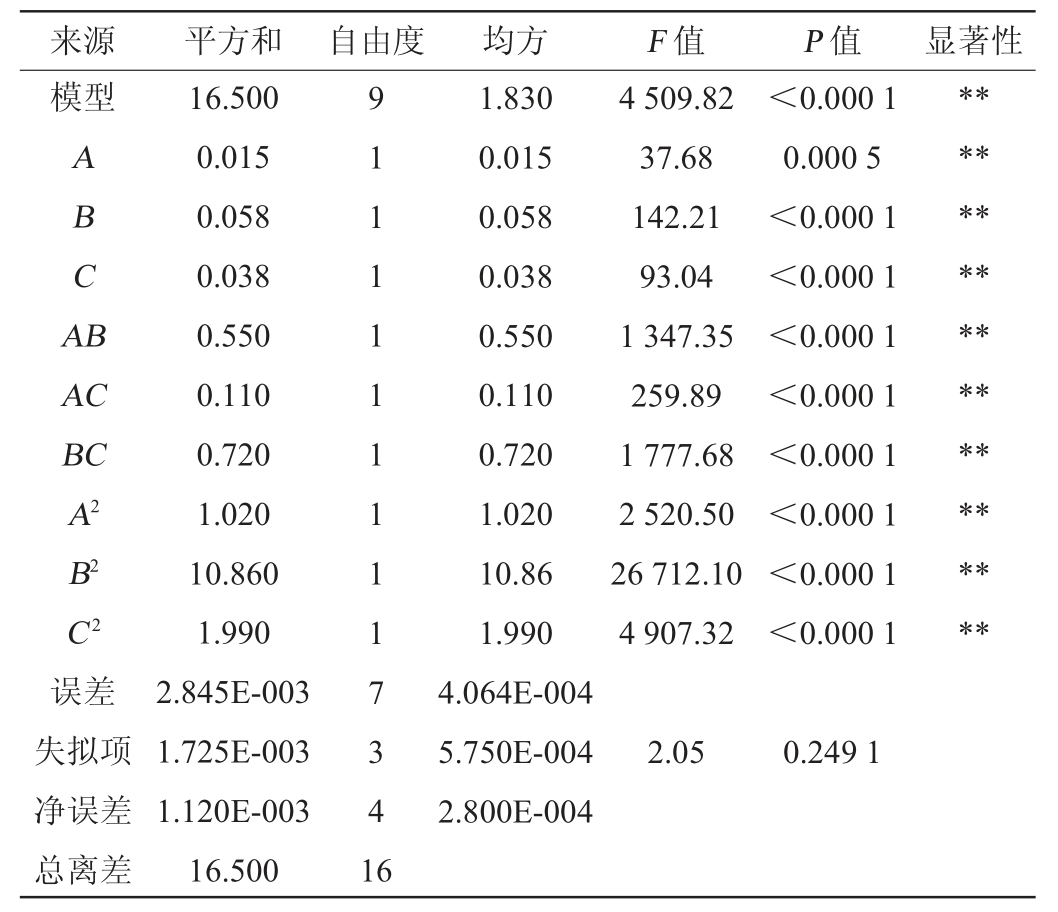
注:“**”表示对结果影响极显著(P<0.01)。
根据Design-Expert 8.0.6软件中对表3数据进行多元回归拟合分析,得到菌株M2产阿魏酸酯酶酶活力(Y)对发酵温度(A)、接种量(B)及初始pH值(C)的多元二次回归模型:
由表4可知,模型P值<0.000 1,极显著(P<0.01),失拟项P=0.249 1,不显著(P>0.05),模型的决定系数R2=0.999 8,调整决定系数R2Adj=0.999 6,说明该回归模型具有良好的拟合性。综合分析,该回归方程适用于对菌株M2产阿魏酸酯酶发酵条件的优化分析及预测。由P值可知,所有项对结果影响极显著(P<0.01)。
2.4.2 各因素间交互作用的响应面及等高线
探究各因素间交互作用的影响,对优化试验数据进行二次响应面立体分析,并创建相应的响应面及等高线,结果见图7。由图7可知,各因素间交互作用对菌株M2产阿魏酸酯酶活力影响的响应面均呈凸形,存在最高点;等高线均呈椭圆形,说明交互作用极显著,这与方差分析结果一致。

图7 发酵温度、初始pH值、接种量间交互作用对菌株M2产阿魏酸酯酶活力影响的响应面和等高线
Fig.7 Response surface plots and contour lines of effect of interaction between fermentation temperature,initial pH and inoculum on the activity of ferulic acid esterase produced by strain M2
2.4.3 最佳产酶条件的确定及验证
采用Design-Expert 8.0.6对回归拟合方程进行求解,得到最优发酵条件为发酵温度29.91 ℃,接种量4.97%,初始pH值5.53。在该发酵条件下,阿魏酸酯酶活力理论值为33.90 U/L。为便于实际操作,将最佳发酵条件修订为发酵温度30 ℃,接种量5%,初始pH值5.5,发酵时间72 h,采用最优条件重复3次试验,得到阿魏酸酯酶活力的实际值为(33.89±0.02)U/L,与预测值接近。结果表明,该模型的预测值与实际值具有良好拟合度,可用于对菌株M2产阿魏酸酯酶发酵条件的优化及预测。
3 结论
本研究从白酒酿酒大曲中筛选到一株产阿魏酸酯酶的菌株,编号为M2,通过形态观察、生理生化试验及分子生物学技术鉴定该菌株为蜡样芽孢杆菌(Bacillus cereus)。通过单因素试验及响应面试验确定该菌株产酶的最佳条件为接种量5%,发酵温度30 ℃,初始pH值5.5,发酵时间72 h,在此优化条件下,酶活力为33.89 U/L,比优化之前提高了10.03%,阿魏酸是白酒中的健康成分,阿魏酸酯酶对白酒酿造过程中阿魏酸的释放有积极作用,本研究为提高白酒中阿魏酸的含量提供了理论基础,下一步可将该菌株用于白酒酿造,预期可提高白酒的健康成分。
[1]MOHAMMED F,RASHID-DOUBELL F,CASSIDY S,et al.A comparative study of the spectral,fluorometric properties and photostability of natural curcumin,iron-and boron-complexed curcumin[J].Spectrochim Acta A,2017(183):439-450.
[2]OGIWARA T,SATOHK K.Radical scavenging activity and cytotoxicity of ferulic acid[J].Anticancer Res,2002,22(5):2711-2717.
[3]李双双,赵辉.微生物阿魏酸酯酶性质及应用研究进展[J].食品与发酵科技,2020,56(5):75-80.
[4]MATHEW S,ABRAHAM T E.Ferulic acid: an antioxidant found naturally in plant cell walls and feruloyl esterases involved in its release and their applications[J].Crit Rev Biotechnol,2004,24(2-3):59-83.
[5]BUANAFINA M M,COSGROVE D J,FINCHER G,et al.Feruloylation in grasses:Current and future perspectives[J].Mol Plant,2009,2(5):861-872.
[6]MANCUSO C,SANTANGELO R.Ferulic acid: Pharmacological and toxicological aspects[J].Food Chem Toxicol,2014(65):185-195.
[7]KUMAR N,PRUTHI V.Potential applications of ferulic acid from natural sources[J].Biotechnol Rep,2014(4):86-93.
[8]PEDERSEN M B,BUNZEL M,SCHFER J,et al.Ferulic acid dehydrodimer and dehydrotrimer profiles of distiller's dried grains with solubles from different cereal species[J].J Agr Food Chem,2015,63(7): 2006-2012.
[9]GHOSH S,BASAK P,DUTTA S,et al.New insights into the ameliorative effects of ferulic acid in pathophysiological conditions[J]. Food Chem Toxicol,2017(103):41-55.
[10]SGARBOSSA A,GIACOMAZZA D,DI C M.Ferulic acid: a hope for Alzheimer's disease therapy from plants[J].Nutrients,2015,7(7):5764-5782.
[11]CAI W D,ZHU J,WU L X,et al.Preparation,characterization,rheological and antioxidant properties of ferulic acid-grafted curdlan conjugates[J].Food Chem,2019(300):125221.
[12]BOUNEGRU A V,APETREI C.Development of a novel electrochemical biosensor based on carbon nanofibers-gold nanoparticles-tyrosinase for the detection of ferulic acid in cosmetics[J]. Sensors,2020,20(23):6724.
[13]ZDU N′ SKA K,DANA A,KOLODZIEJCZAK A,et al.Antioxidant properties of ferulic acid and its possible application[J].Skin Pharmacol Physiol,2018,31(6):332-336.
[14]尹志娜,吴晖,赖富饶,等.两种丝状真菌发酵小麦麸皮中酚酸的释放及与阿魏酸酯酶和木聚糖酶的关系[J].现代食品科技,2017,33(3):81-87.
[15]孙晓明,辛嘉英,王艳,等.微生物发酵产阿魏酸酯酶及释放阿魏酸研究概述[J].食品研究与开发,2019,40(1):201-206.
[16]JIANG X,HU X,HUANG H,et al.Detecting total acid content quickly and accurately by combining hyperspectral imaging and an optimized algorithm method[J].J Food Process Eng,2021,44(11):e13844.
[17]ZHANG J,LIU S,SUN H,et al.Metagenomics-based insights into the microbial community profiling and flavor development potentiality of Baijiu Daqu and Huangjiu wheat Qu[J].Food Res Int,2021:110707.
[18]LING Y,LI W,TONG T,et al.Assessing the microbial communities in four different daqus by using PCR-DGGE,PLFA,and biolog analyses[J].Pol J Microbiol,2020,69(1):27.
[19]CAI W,WANG Y,NI H,et al.Diversity of microbiota,microbial functions,and flavor in different types of low-temperature Daqu[J]. Food Res Int,2021(150):110734.
[20]ZHAO Q S,YANG J G,ZHANG K Z,et al.Lactic acid bacteria in the brewing of traditional Daqu liquor[J]. J I Brewing,2020,126(1):14-23.
[21]DU H,WANG X,ZHANG Y,et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019(297):32-40.
[22]HE G,HUANG J,ZHOU R,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J]. Front Microbiol,2019(10):56.
[23]YE H,WANG J,SHI J,et al.Automatic and intelligent technologies of solid-state fermentation process of Baijiu production:applications,challenges,and prospects[J].Foods,2021,10(3):680.
[24]孙宝国,黄明泉,王娟.白酒风味化学与健康功效研究进展[J].中国食品学报,2021,21(5):1-13.
[25]李丽,章宇丹,刘军,等.浓香型白酒酿造过程中一株产阿魏酸酯酶菌株的筛选和鉴定[J].食品工业科技,2021,42(5):126-131,137.
[26]章宇丹,温雪瓶,李丽,等.考氏科萨克氏菌产阿魏酸酯酶条件优化、酶学性质及其初步应用[J].中国酿造,2021,40(2):47-52.
[27]胡博涵,吴晖,赖富饶,等.产阿魏酸酯酶菌株的筛选及其酚酸释放研究[J].现代食品科技,2015,31(7):92-98.
[28]胡泓宇,周燕燕,陈静,等.一株产阿魏酸酯酶丝状真菌的分离鉴定及其粗酶性质研究[J].生物技术通报,2014(7):162-167.
[29]高兆建,许祥,王先凤,等.深绿木霉嗜酸性阿魏酸酯酶酶学性质及生物质转化分析[J].食品科学,2019,40(10):121-128.
[30]XIE C,GU Z,YOU X,et al.Screening of edible mushrooms for release of ferulic acid from wheat bran by fermentation[J].Enzyme Microb Technol,2010,46(2):125-128.
[31]李干.产阿魏酸酯酶菌筛选、培养条件及酶学性质研究[D].南京:南京林业大学,2011.
[32]王洪川,陈洪章.高产阿魏酸酯酶菌株的筛选及其固态发酵的研究[J].食品与发酵工业,2007,33(4):11-14.
[33]康超,甘丽妃,梁媛文,等.产阿魏酸酯酶菌株的筛选及其产酶条件优化[J].食品科技,2019,44(10):22-27.
[34]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].北京:科学出版社,1988:254-259.
[35]段晓莉,江波,张涛.产阿魏酸酯酶菌株的筛选与产酶条件优化[J].食品与发酵工业,2021,47(12):154-160.
[36]王祥锋,汪乔,袁慧君,等.高产阿魏酸酯酶菌株的筛选鉴定及其酶活测定条件优化[J].生物技术通报,2020,36(10):135-141.
[37]李松,徐朝旭,林陈莹,等.产阿魏酸酯酶丝状真菌筛选及发酵条件优化[J].食品与发酵工业,2020,46(23):74-80.
[38]王丹,郭萌萌,杜金华.小麦与小麦芽阿魏酸酯酶酶活力的测定及其酶学性质研究[J].食品与发酵工业,2011,37(5):181-185.
[39]曹艳,夏其乐,陈剑兵,等.1株阿魏酸酯酶产生菌的筛选鉴定及发酵条件优化[J].微生物学杂志,2019,39(5):8-15.
[40]李翠翠,毛健,刘双平,等.产阿魏酸酯酶的枝状枝孢霉筛选、发酵特性及在黄酒中应用研究[J].食品与生物技术学报,2018,37(8):793-801.
[41]牛双.重组阿魏酸酯酶的酶学性质及水解功能研究[D].长春:吉林大学,2012.
[42]陈锦,胡茂丰,吴章华,等.高产阿魏酸酯酶菌株的筛选及其产酶条件优化[J].食品工业科技,2015,36(8):218-221,239.