随着世界人口的剧增和耕地的锐减,利用海洋湖泊资源进行微藻养殖备受关注。相较于陆生植物,微藻具有生长速度快、光合效率高、不占用耕地、能进行碳中和排放及生成大量生物活性物质等优点[1],因此在食品、功能食品、药品、饲料和化妆领域有巨大的应用潜力,国际上研究和应用最多的微藻种类是螺旋藻和小球藻[2-3]。绿藻门(Chlorphyta)绿藻纲(Chlorophyceae)绿球藻目(Chlorococcales)卵囊藻科(Oocystaceae)小球藻属(Chlorella)微藻是普生性单细胞藻类,生态分布极广,在淡水、海水中均有发现[3-4]。小球藻有多个种属,如核蛋白小球藻(C.pyrenoidosa)、普通小球藻(C.vulgaris)、椭圆小球藻(C.ellipsoidea)、索罗金小球藻(C.sorokiniana)、佐夫小球藻(C.zofingiensis)等[3]。小球藻富含蛋白质、膳食纤维、脂类、维生素、叶绿素和类胡萝卜素等,具有免疫调节、治疗糖尿病、抗过敏、降血压等功效[3,5]。目前小球藻属中蛋白核小球藻和普通小球藻在食品领域应用最为广泛,蛋白核小球藻于2012年被国家批准为新资源食品,普通小球藻、蛋白核小球藻在美国、欧盟已被允许使用[5],小球藻则被联合国粮食及农业组织认定为“绿色健康食品”[2-3]。小球藻细胞由细胞壁、细胞膜、细胞质、细胞核、细胞器(叶绿体、高尔基体)组成,球形或椭圆形,直径仅数微米,无鞭毛,浮游生活,可自养、混养和异养[4,6]。普通小球藻营养丰富,被誉为高产不饱和脂肪酸、胡萝卜素、活性肽、活性多糖等物质的“细胞工厂”[7]。小球藻在食品、饲料医药和化妆品行业均有应用,世界年供应量已超过5 000 t[7]。因小球藻养殖费用大、下游加工成本高、质量不稳定等,使其在食品市场的应用受限[1,8]。目前仅日本、美国、德国、荷兰、澳大利亚、马来西亚以及中国台湾省等少数国家和地区可工业化生产和加工[4-5]。大陆在20世纪60年代开始对小球藻进行研究,并取得了一定的成果,但最近十年才大规模养殖。目前,小球藻行业在微藻细胞的培养方面仍以开放式池塘自养养殖为主,与国外先进企业的管式封闭养殖存在较大差距;在食品深加工及应用方面,小球藻企业与传统食品行业的结合度在国内较低,市面上鲜见有知名品牌食品添加小球藻,产品形式局限于小球藻企业自产的全藻粉(液、片)产品;在小球藻营养成分高效利用的研究方面,虽然国内研发人员贡献度较高,但仅限于实验室水平分离纯化及功能确认,尚未触及工业化研究。工业化脱腥和破壁技术的缺失、对小球藻活性成分及传统食品添加小球藻对风味和质构的认识不足,是制约其在国内食品领域转化少的主要因素。为此,本文对近十年发表的小球藻外文文献进行收集整理,并综述小球藻的营养成分与功效、在食品领域的应用与存在问题、传统和新兴细胞破碎技术、产业发展策略与趋势四个方面,以期为国内同行的研发和应用提供相关的技术信息。
1 小球藻的营养成分与功效
小球藻是“天然多功能补品”[5],富含活性物质,如ω-3-脂肪酸、胡萝卜素、活性肽、活性多糖等[7],适合在食品工业中开发应用。普通小球藻干物质中含51%~58%蛋白质、14%~22%脂肪、12%~17%碳水化合物,而蛋白核小球藻干物质中含57%蛋白质、2%脂肪、26%碳水化合物[9]。
1.1 多糖
小球藻多糖分为胞外多糖、细胞壁多糖、胞内贮存多糖和结构多糖[3-4,10],具有免疫调节、抗氧化、抗高脂血症、抗肿瘤、抗哮喘等功效[3]。细胞壁多糖由半纤维素,半乳糖、甘露糖、阿拉伯糖、木糖和鼠李糖等构成[3]。淀粉是普通小球藻的主要贮存多糖[10],在细胞稳定期的含量高于指数生长期的含量[11]。细胞外多糖与细胞壁多糖的组成相近,均含有由1,3-,1,6-和1,3,6-连接的半乳糖残基组成的半乳聚糖,对B淋巴细胞具有免疫刺激作用[10]。小球藻所含的β-葡聚糖可降低人体低密度脂蛋白胆固醇的浓度[4,12]。
小球藻多糖功能评价均基于粗提物,对其结构的分析仅限于单糖的组成。小球藻多糖提取方式多样,如反复冻融法、微波法、超声波辅助法、碱法、热水法和纤维素酶解法等[13-14]。CHEN Y X等[13]采用超声波辅助不同浓度乙醇提取蛋白核小球藻多糖,发现体积分数70%乙醇提取的多糖体外抗氧化性最强;同时发现体积分数为40%乙醇沉淀得到多糖的平均分子质量为9 950 Da,主要由D-葡萄糖、D-半乳糖和D-甘露糖组成,具有抗氧化和抗衰老能力[13-14]。YU M E等[15]对采用反复冻融法、微波法、超声波法、碱法等对提取普通小球藻多糖进行比较,发现超声波提取的多糖体外抗氧化能力最强。ZHANGJZ等[16]用体积分数为70%乙醇沉淀,得到普通小球藻胞外多糖的平均分子质量为1.88×104 Da,由11种单糖组成,有显著的抗肿瘤和清除自由基的能力。
1.2 蛋白质
小球藻的蛋白、蛋白水解物、肽等均可应用于食品领域,其中肽的活性成为人们关注的焦点。普通小球藻总蛋白近20%结合在细胞壁上,50%在细胞内,30%分泌到细胞外[17]。经二维电泳测试,普通小球藻蛋白质有200余种,大部分等电点在pH 4.0~5.5,少量等电点在pH 6~8;一维电泳表明大多数蛋白质的分子质量集中在12~75 kDa,藻液蛋白质沉淀pH为3~5与电泳测定的等电点不一致,可能是因藻体内蛋白质多以大分子聚集体存在有关[18]。普通小球藻蛋白的必需氨基酸占总氨基酸的44.7%,除异亮氨酸略低外,其他必需氨基酸含量均高于联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)的建议膳食参考标准(见表1)。
表1 普通小球藻必需氨基酸含量与联合国粮农组织建议标准的比较
Table 1 Comparison of essential amino acids contents of Chlorella vulgaris with recommended standards of Food and Agriculture Organization of the United Nations
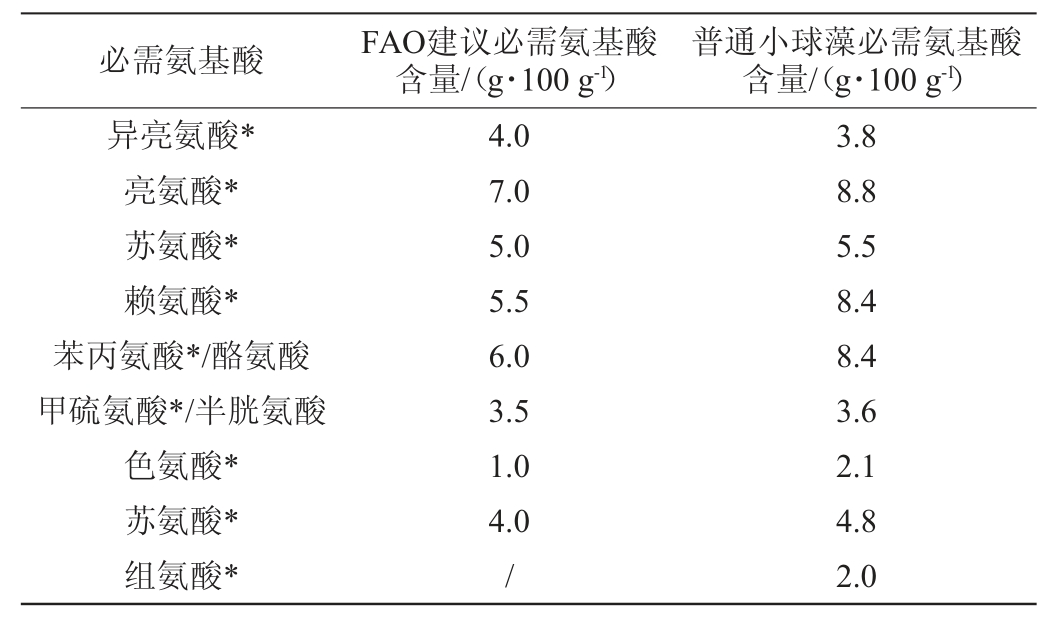
注:“*”表示必需氨基酸。
小球藻蛋白产品的营养价值与消化率、必需氨基酸含量、水解多肽的生物活性有关[19]。分子质量为10~20 kDa的蛋白核小球藻和普通小球藻蛋白质的部分水解物具有良好乳化和起泡功能[6,19],而分子质量为2~5 kDa的活性肽具有抗氧化、降压、免疫调节等功效[19]。从普通小球藻提取的两个三肽:Thr-Thr-Trp(TTW)和Val-His-Trp(VHW)是血管紧张素I转换酶的非竞争性体外抑制剂,降压功效显著[20]。从小球藻胃蛋白酶水解物中分离出的Leu-Asn-Gly-Asp-Val-Trp和Val-Glu-Cys-Tyr-Gly-Pro-Asn-Arg-Pro-Glu-Phe,具有较强的超氧化物和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力[21]。
1.3 脂肪
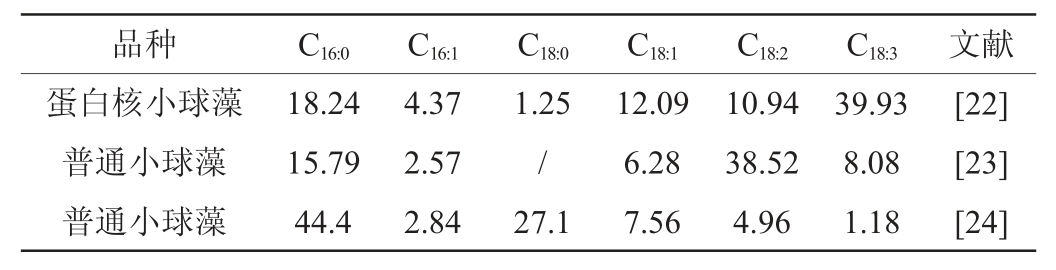
小球藻的脂类可开发成生物柴油,也可应用于食品保健品领域。小球藻脂肪分为磷脂、糖脂和中性油脂,由叶绿体合成,位于细胞壁和细胞器(叶绿体和线粒体膜)膜上,占细胞干质量的5%~40%[4-5]。中性油脂以油滴的形式作为能量贮存在叶绿体间的类囊上或细胞质中,不是细胞的功能脂类[4]。脂类的脂肪酸组成受生长条件和培养形式的影响,因此可有目的调控藻类的脂肪酸谱来开发新产品。如调整培养条件,使饱和脂肪酸、单不饱和脂肪酸占60%~68%而用于生产生物柴油,也可以让小球藻富含亚油酸、亚麻酸等高不饱和脂肪酸而作为保健品生产原料[4,12]。亚麻酸是人体不能自行合成的必需脂肪酸之一,具备诸多生理功能如防血栓、降血脂等,有保健作用[7]。蛋白核小球藻和普通小球藻的必需脂肪酸组成见表2[22-24]。
表2 蛋白核小球藻和普通小球藻的必需脂肪酸组成
Table 2 Essential fatty acid composition of Chlorella pyrenoidosa and Chlorella vulgaris
1.4 色素
小球藻作为天然色素和抗氧化剂在食品领域有着巨大的应用潜力,小球藻富含叶绿素类和类胡萝卜素类的色素[2],叶绿素是含卟啉环的绿色色素[25],类胡萝卜素是含40个碳的四萜黄色或红色色素[7],普通小球藻中色素分布见表3[4]。微藻类胡萝卜素有30余种,分为不含氧的胡萝卜素类化合物(β-胡萝卜素,番茄红素)和含氧的胡萝卜素衍生物(虾青素、叶黄素等)[2]。类胡萝卜素具有强抗氧化能力,而叶黄素是活性氧的猝灭剂[2,21],人体内的β-胡萝卜素会转化成维生素A起保健作用[12]。
表3 普通小球藻的色素分布与含量
Table 3 Pigments distribution and content of Chlorella vulgaris

1.5 其他
普通小球藻还含有丰富的钾、钙、镁等矿物质及维生素B2、维生素B3、维生素C等,对人体健康有益[4]。同时,小球藻提取液被誉为“细胞生长因子”,由核酸、氨基酸、维生素、矿物质、多糖、糖蛋白和β-葡聚糖等组成的水溶性复合物[21]。小球藻藻粉的生物或药理作用是由多种活性成分协同作用所决定的,非单一化合物[5]。小球藻表现出来的生物活性可能与自身组成相关,也可能与下游加工和胃肠道消化有关[1]。
2 在食品领域的应用与存在的问题
2.1 应用概况
目前,在全球营养市场上微藻作为膳食补充剂以藻粉、藻片、胶囊等形式销售,但在传统食品中的应用有限[2,26]。藻粉在传统食品中的应用分为两种:一种是着色剂,另一种则是用于改善终产品的营养、物理化学或感官属性并以之为营销卖点[2,26]。小球藻在国际食品工业中,已应用于面包、意大利面、面条、饼干、膨化食品、酸奶、果露、果汁奶酪、香肠、汉堡、蛋黄酱等当中[6,21,27]。知名公司产品有:西班牙Grupo Dulcesol公司的桔子绿藻饼干、波兰Majami公司的软糖、澳大利亚Evasis Edibles公司的威化饼干和调料汁、新西兰Frecious公司的浓果汁、德国Greenic公司的咀嚼棒、罗马尼亚Honest Fields公司的泡芙等[26]。相比较而言,小球藻在国内食品领域的工业化应用较少,小球藻养殖企业主要出售未破壁的藻粉原料。
2.2 存在的问题
小球藻的干燥加工过程耗能较大,成本较高,在传统食品的应用也存在诸多问题。小球藻细胞壁坚硬,厚度达17~21 nm[4,10],不易被人体消化而影响人们对其营养成分的吸收[9-10]。目前,国内藻粉和藻片的生产多是离心后直接喷雾干燥,未经破壁和去腥处理,口感不佳,市场认知度低。小球藻在传统食品中的添加量一般不高,主要因其产量低、加工成本高[2,12,26]。小球藻含硫化合物和脂肪衍生挥发物会产生浓烈的海腥味、藻体呈墨绿色,用于食品中不易被消费者接受[1-2]。当然,小绿藻的绿色和海腥味可作为特色强化加入绿色蔬菜汁和海鲜风味食品中。普通小球藻粉加入小麦粉中会影响面包品质,添加量为3 g/100 g时面包的面筋网络结构最强、品质最佳,过多则引起面包老化和质构变差[28]。
3 小球藻细胞破壁技术
细胞破碎技术包括机械破碎(球磨、高压均质、超声波处理、微波处理等)、非机械破壁(酶解、酸/碱解等)及其他新兴技术。目前,缺乏成本低、效率高、对营养物质破坏性小的工业化破壁技术,破壁成本高已成为制约小球藻企业产业发展的瓶颈。通过研发,最终要建立一种运行成本低、产品回收率高且能保持藻类生化物质的功能和活性的破壁技术[9,19,29]。
3.1 传统细胞破壁技术
传统细胞破碎技术在国外均有研究报道,本文对7种传统细胞破碎方式的破壁机理、影响因素及优缺点进行总结,见表4[9,19,29]。可见对组分活性的影响是传统小球藻细胞破碎技术的共性问题。
表4 主要传统破壁技术的原理、影响因素及优缺点比较
Table 4 Comparison of principles,influencing factors,advantages and disadvantages of traditional wall-breaking technology

实际上,不同传统细胞破碎技术的破壁率和产物得率差异较大,为提高破壁率和产物得率,学者们进行了大量研究。SAFI C等[30]比较四种普通小球藻破壁方式,发现影响蛋白质提取率破壁方式依次是球磨>高压均质>化学水解>超声波。电镜结果证实,化学水解和超声波处理后细胞仍保持圆形,而经过球磨和高压均质处理后大部分细胞则不是球形[30]。蛋白质在水相中的扩散率与水相中蛋白质浓度的增加没有显著相关性,推测是由于细胞壁破裂后、细胞内部细胞器尚未完全破碎引起的[30]。POSTMA P R等[31]研究球磨破碎小球藻时细胞破碎率与蛋白质提取率之间的关系,发现总蛋白质中的水溶性蛋白释放速度快于细胞破碎速度,通过控制藻体解体程度选择性地提取水溶性蛋白,使水溶性得率达到32%~42%,能耗降低85%,降低对水溶性蛋白的功能破坏。CANELLI G等[32]用复合酶将小球藻酶解,使蛋白质和脂肪的生物可及性分别达58.7%和21.1%,而高压均质破壁对应的生物可及性分别是61.8%和59.8%。经酶处理的藻体氧化稳定性可维持3个月以上,而经高压均质处理的藻液易产生氧化风味不耐贮存[32]。用胰酶酶解普通小球藻,蛋白质体外消化率达到70%,而对组照仅为35%[33]。用胞外β-葡萄糖苷酶、海藻酸裂解酶、肽聚糖N-乙酰胞壁酸脱乙酰酶和溶菌酶对普通小球藻进行复合酶解,增加了蛋白质和不饱和脂肪酸的提取率[24]。LUENGO E等[34]研究发现,不同强度下脉冲电场处理小球藻的细胞质膜电穿孔率与类胡萝卜素、叶绿素提取率之间的关系,经脉冲电场处理1 h不可逆电穿孔率与色素提取率之间的相关性高达0.93,而处理刚结束立刻进行提取其相关性仅为0.67。GILLE A等[35]采用低pH多酶体外消化模型评价了超声破碎普通小球藻色素的生物可及性,发现未处理的β-胡萝卜素和叶黄素的生物可及性仅为0和7%,而经超声处理后分别提高到10%和15%。SANKARAN R等[36]采用超声波辅助液体双相糖析浮选技术对普通小球藻中的蛋白质进行提取,使蛋白质得率达93.33%。传统细胞破碎技术间的组合,可进一步提高组分的提取率。URSU A V等[18,37]在碱性(pH=12)条件下高压均质破壁普通小球藻,使蛋白提取率达到75%~76%,而中性条件下为53%。以上文献多是实验室级别的研究成果,尚无相关工业化数据可以比较,如小球藻产业关注的破壁率和耗能成本等。
3.2 新兴细胞破壁技术
针对传统破壁技术对活性成分的损害,出现了诸多基于“柔性”理念的破壁技术初探。如压力辅助臭氧氧化破壁,可使普通小球藻的细胞破碎率达80.3%,与超声波的83.8%破壁率相近[38]。糖析辅助液体双相电浮选系统,通过两相上的电作用进行细胞破碎,实现了藻体的破壁和蛋白质提取的有机结合,蛋白质提取率达69.67%[39]。另外,激光处理、微射流高压均质、脉冲电弧、高频聚焦超声和阳离子聚合物包覆膜等是新涌现的细胞破碎技术[29]。
4 产业发展策略与趋势
4.1 发展策略
小球藻虽营养丰富,但产量少,生产成本高,较传统作物难以形成经济优势[8,12]。国内市售藻片/粉营养品多未经破壁和去腥处理,存在消化率不高,风味不佳,应用于传统食品中存在诸多问题[1,12,26],如今国内小球藻的学术研发较多,但实际应用较少。鉴于此,国内小球藻产业应以降低生产成本、提高组分高值化利用为关键点,明确长远发展的方向,从上游的养殖和下游的加工系统发力,推动产业的健康发展[8,29,40]。
近期应以工业化破壁和实现藻粉的脱腥为突破点,结合中国食品工业现状,挖掘全藻粉在营养品及传统食品中的应用潜力。中期研发主线是挖掘小球藻中的活性成分,探讨小球藻的多组分高效低耗利用。长期则以生物精炼为愿景,借鉴石油精炼的全产品链高值化利用理念,从育种、活性认知、分离纯化、设备创新、技术研发等全方面深度挖潜,系统整合,实现小球藻各组分同时高值化利用的工业实践[8,12,40]。
4.2 发展趋势
基于国外的微藻生物精炼概念,小球藻的发展路线如下:①明确细胞壁和高价值组分的结构与特性;②建立高效低耗收获技术;③研发破碎程度可控的温和破壁方式,实现细胞壁透性增加、细胞壁完全破裂以及细胞器破裂的可控;④在保持活性成分功能的前提下,将疏水性成分和亲水性成分选择性分离;⑤根据组分特性进行纯化;⑥探讨各环节的融合,实现全产品链高值化利用。
4.3 小球藻产业健康发展规划
为推动小球藻产业的健康发展,需在育种、养殖、收获、破壁、提取纯化、食品应用投入更多的研发[40]。
4.3.1 特色藻种选育
通过传统和现代育种技术,选育出优良藻种高产色素等。利用化学诱变培养出普通小球藻叶绿体突变株颜色为黄色和白色,叶绿素含量较野生型菌株分别降低了80%和99%,而蛋白含量分别增加了30%和60%[41]。利用重离子辐照诱变选育出核蛋白小球藻突变株,蛋白质含量提高31.8%,并实现了突变株用甜高粱汁进行低成本异养培养[42]。
4.3.2 优质高效的养殖技术
小球藻培养类型分为自养、异养、混合,自养型需进行光合作用而异养型则要代谢碳源并避光培养,混合型是两者结合[11,17]。工业实践中仍以自养为主,小球藻自养的培养容器分两种:开放式的池塘养殖池和封闭式的透光养殖反应器(塑料或玻璃质的管状、塑料袋、平板或柱状[17])。小球藻培养所处的环境、培养条件以及培养反应器的结构参数均影响小球藻的藻体培养效率和目标产物产率[17]。通常通过优化养殖条件,来提高特定目标产物的含量。一般在适宜的营养条件下会促进藻体、贮存多糖和蛋白质的生成,而贫氮等条件下促进脂类和色素的生成[6,13,43]。如使用L-苯丙氨酸作强化剂,可提高蛋白核小球藻和普通小球藻的黄酮和脂类的含量[43];低光强度自养培养条件下添加硝酸盐可提高叶黄素的含量[44]。通过优化蛋白核小球藻养殖条件,其脂肪比例高达27.12%,多不饱和脂肪酸占53.25%,α-亚麻酸占39.93%[22]。用葡萄酒糟等废料也可实现小球藻中试级混合培养[45]。
4.3.3 高效低耗的收获技术
工业上,小球藻收获多采用高能耗的离心和高运行成本的膜过滤完成。若将水体湍流与氮磷胁迫结合进行小球藻自絮凝沉降收集,藻体回收率高达94.5%[46]。
4.3.4 工业化破壁技术
珠磨、高压均质、高速均质均有成熟的工业化设备,相对破壁率高,但易破坏活性成分[8,29]。已有100 m3/h容量的超声波和脉冲电场上市,为小球藻破壁提供了新选择[9,29]。但这些设备存在共同缺陷,比能耗高,只能作用于较低浓度的藻浆[29]。新兴的固体超微粉碎技术在微藻破壁工业中值得深入研究探讨,而目前尚无可产业化且适合生物精炼的温和细胞破碎技术[9,29]。
4.3.5 多组分高效的提取纯化技术
生物精炼的实质是在保持活性的前提下,分离纯化多组分[8,40]。如结合球磨破壁、脂酶酶解,提取到68%的水溶性蛋白质、74%的糖类、88%的脂肪,可避免有机溶剂对蛋白质功能性的不可逆破坏[47];用StargenTM和CarezymeTM复合酶辅助结合正丁醇/硫酸铵体系三相分配技术,在温和条件下实现蛋白核小球藻脂肪和蛋白质的同时提取,蛋白质提取率达78.1%[48];采用两次三相分配技术对普通小球藻的藻泥进行多组分分离提取,即酶解离心上清液使用正丁醇和硫酸铵体系分离蛋白质、多糖,对离心沉淀酸化后用正戊烷/乙醇体系分离脂类、蛋白质、脱镁叶绿素[25]。利用微波辅助正丁醇/硫酸铵体系三相分配技术,普通小球藻蛋白质得率提高2.54倍[49]。采用脉冲电场辅助乙醇提取色素,较单纯的溶剂提取,叶黄素得率提高2.2倍、叶绿素得率提高5.2倍[50]。
5 结论
小球藻营养丰富,具有多种保健功能,但生产成本高。国内小球藻藻粉和藻片多为未破壁的喷雾干燥产品,消化率低,亟需进行工业化细胞破碎处理。目前,消费者对小球藻营养功效不甚了解,将其用于传统食品中易引发颜色、质构、风味(海腥味)等变化,限制了小球藻大规模推广。实现基于全产品链高值化利用的生物精炼是小球藻产业的终极发展目标,需从育种、养殖、下游处理、食品开发等环节进行机理、技术、设备的深度研发。只有研究机构与企业的通力合作,才能生产出更多受消费者喜欢的小球藻食品,将小球藻产业做大做强。
[1]GEADA P,MOREIRA C,SILVA M,et al.Algal proteins: Production strategies and nutritional and functional properties[J].Bioresource Technol,2021,332:125125.
[2]SAHNI P,SACHDEV P A,SHARMA S,et al.Nuances of microalgal technology in food and nutraceuticals:a review[J].Nutr Food Sci,2019,49(5):866-885.
[3]YUAN Q X,LI H,WEI Z Y,et al.Isolation,structures and biological activities of polysaccharides from Chlorella:A review[J].Int J Biol Macromol,2020,163:2199-2209.
[4]SAFI C,ZEBIB B,MERAH O,et al.Morphology,composition,production,processing and applications of Chlorella vulgaris:A review[J].Renew Sust Energ Rev,2014,35:265-278.
[5]PANAHI Y,DARVISHI B,JOWZI N,et al.Chlorella vulgaris:A multifunctional dietary supplement with diverse medicinal properties[J]. Curr Pharm Des,2016,22(2):164-173.
[6]BERNAERTS T M M,GHEYSEN L,FOUBERT I,et al.The potential of microalgae and their biopolymers as structuring ingredients in food:A review[J].Biotechnol Adv,2019,37(8):107419.
[7]NETHRAVATHY M U,JITENDRA G M,SANDEEP N M,et al.Recent advances in microalgal bioactives for food,feed and healthcare products:Commercial potential,market space and sustainability[J]. Compr Rev Food Sci Food Saf,2019,18(6):1882-1897.
[8]LAM G P,VERMUË M H,EPPINK M H M,et al.Multi-product microalgae biorefineries: from concept towards reality[J]. Trends Biotechnol,2018,36(2):216-227.
[9]AMORIMA M L,SOARES J,COIMBRA J S R,et al.Microalgae proteins:production,separation,isolation,quantification,and application in food and feed[J].Crit Rev Food Sci,2021,61(12):1976-2002.
[10]FERREIRA A S,FERREIRA S S,CORREIA A,et al.Reserve,structural and extracellular polysaccharides of Chlorella vulgaris:A holistic approach[J].Algal Res,2020,45:101757.
[11]CANELLI G,MARTÍNEZ P M,AUSTIN S,et al.Biochemical and morphological characterization of heterotrophic Crypthecodinium cohnii and Chlorella vulgaris cell walls[J]. J Agr Food Chem,2021,69(7):2226-2235.
[12]TORRES-TIJI Y,FIELDS F J,MAYFIELD S P,et al.Microalgae as a future food source[J].Biotechnol Adv,2020,41:107536.
[13]CHEN Y X,LIU X Y,XIAO Z,et al.Antioxidant activities of polysaccharides obtained from Chlorella pyrenoidosa via different ethanol concentrations[J].Int J Biol Macromol,2016,91:505-509.
[14]CHEN Y X,LIU X Y,WU L X,et al.Physicochemical characterization of polysaccharides from Chlorella pyrenoidosa and its anti-ageing effects in Drosophila melanogaster[J].Carbohyd Polym,2018,185:120-126.
[15]YU M E,CHEN M J,GUI J L,et al.Preparation of Chlorella vulgaris polysaccharides and their antioxidant activity in vitro and in vivo[J]. Int J Biol Macromol,2019,137:139-150.
[16]ZHANG J Z,LIU L,CHEN F,et al.Production and characterization of exopolysaccharides from Chlorella zofingiensis and Chlorella vulgaris with anti-colorectal cancer activity[J].Int J Biol Macromol,2019,134:976-983.
[17]GROSSMANNA L,HINRICHS J,WEISS J,et al.Cultivation and downstream processing of microalgae and cyanobacteria to generate proteinbased technofunctional food ingredients[J]. Crit Rev Food Sci,2020,60(17):2961-2989.
[18]URSU A V,MARCATI A,SAYD T,et al.Extraction fractionation and functional properties of proteins from the microalgae Chlorella vulgar[J].Bioresource Technol,2014,157:134-139.
[19]SOTO-SIERRA L,STOYKOVA P,NIKOLOV Z L,et al.Extraction and fractionation of microalgae-based protein products[J].Algal Res,2018,36:175-192.
[20]XIE J L,CHEN X J,WU J J,et al.Antihypertensive effects,molecular dockingstudyandisothermaltitrationcalorimetryassayofthe angiotensin I converting enzyme inhibitorypeptides from Chlorella vulgaris[J].J Agr Food Chem,2018,66(6):1359-1368.
[21]BARKIA I,SAARI N,MANNING S R,et al.Microalgae for high-value products towards human health and nutrition[J].Mar Drugs,2019,17(5):304.
[22]CHANGPASERT W,WONG S L.Optimized process parameters for production of Chlorella pyrenoidosa biomass and lipids using response surface methodology[J].Aquacult Int,2020,28(3):1213-1226.
[23]HEO Y M,LEE H,LEE C,et al.An integrative process for obtaining lipids and glucose from Chlorella vulgaris biomass with a single treatment of cell disruption[J].Algal Res,2017,27:286-294.
[24]COEIHO D,LOPES P A,CARDOSO V,et al.Novel combination of feed enzymes to improve the degradation of Chlorella vulgaris recalcitrant cell wall[J].Sci Rep,2019,9:5382.
[25]ZHAO W H,DUAN M R,ZHANG X,et al.A mild extraction and separation procedure of polysaccharide,lipid,chlorophyll and protein from Chlorella spp.[J].Renew Energ,2018,118:701-708.
[26]LAFARGA T.Effect of microalgal biomass incorporation into foods:Nutritional and sensorial attributes of the end products[J]. Algal Res,2019,41:101566.
[27]NOVA P,MARTINS A P,TEIXEIRA C,et al.Foods with microalgae and seaweeds fostering consumers health: a review on scientific and market innovations[J].J Appl Phycol,2020,32(3):1789-1802.
[28]GRAÇA C,FRADINHO P,SOUSA I,et al.Impact of Chlorella vulgaris on the rheology of wheat flour dough and bread texture[J].LWT-Food Sci Technol,2018,89:466-474.
[29]GÜNERKEN E,D'HONDT E,EPPINK M H M,et al.Cell disruption for microalgae biorefineries[J].Biotechnol Adv,2015,33(2):243-260.
[30]SAFI C,FRANCES C,URSU A V,et al.Understanding the effect of cell disruption methods on the diffusion of Chlorella vulgaris proteins and pigments in the aqueous phase[J].Algal Res,2015,8:61-68.
[31]POSTMA P R,MIRON T L,OLIVIERI G,et al.Mild disintegration of the green microalgae Chlorella vulgaris using bead milling[J]. Bioresource Technol,2015,184:297-304.
[32]CANELLI G,MARTÍNEZ P M,HAUSER B M,et al.Tailored enzymatic treatment of Chlorella vulgaris cell wall leads to effective disruption while preserving oxidative stability[J].LWT-Food Sci Technol,2021,143:111157.
[33]KOSE A,OZEN M O,TLIBOL M,et al.Investigation of in vitro digestibility of dietary microalga Chlorella vulgaris and cyanobacterium Spirulina platensis as a nutritional supplement[J].3 Biotech,2017,7(3):170.
[34]LUENGO E,CONDON-ABANTO S,ALVAREZ I,et al.Effect of pulsed electric field treatments on permeabilization and extraction of pigments from Chlorella vulgaris[J].J Membrane Biol,2014,247(12):1269-1277.
[35]GILLE A,TRAUTMANN A,POSTEN C,et al.Bioaccessibility of carotenoids from Chlorella vulgaris and Chlamydomonas reinhardtii[J].Int J Food Sci Nutr,2016,67(5):507-513.
[36]SANKARAN R,MANICKAM S,YAP Y J,et al.Extraction of proteins from microalgae using integrated method of sugaring-out assisted liquid biphasic flotation(LBF) and ultrasound[J]. Ultrason Sonochem,2018,48:231-239.
[37]KULKARNI S,NIKOLOV Z.Process for selective extraction of pigments and functional proteins from Chlorella vulgaris[J].Algal Res,2018,35:185-193.
[38]HUANG Y X,QIN S N,ZHANG D F,et al.Evaluation of cell disruption of Chlorella vulgaris by pressure-assisted ozonation and ultrasonication[J].Energies,2016,9(3):173.
[39]KOYANDE A K,CHEW K W,LIM J W,et al.Optimization of protein extraction from Chlorella vulgaris via novel sugaring-out assisted liquid biphasic electric flotation system[J]. Eng Life Sci,2019,19(12): 968-977.
[40]EPPINK M H M,OLIVIERI G,REITH H,et al.From current algae products to future biorefinery practices:A review[J].Adv Biochem Eng Biotechnol,2017,166:99-123.
[41]SCHÜLER L,MORAIS E G,TROVÃO M,et al.Isolation and characterization of novel Chlorella vulgaris mutants with low chlorophyll and improved protein contents for food applications[J].Front Bioeng Biotechnol,2020,8:469.
[42]SONG X J,WANG J,WANG Y C,et al.Artificial creation of Chlorella pyrenoidosa mutants for economic sustainable food production[J].Bio-resource Technol,2018,268:340-345.
[43]YADAVALLI R,RATNAPURAM H,MOTAMARRY S,et al.Simultaneous production of flavonoids and lipids from Chlorella vulgaris and Chlorella pyrenoidosa[J].Biomass Convers Bior,2020:372.
[44]MCCLURE D D,NIGHTNGALE J K,LUIZ A,et al.Pilot-scale production of lutein using Chlorella vulgaris[J].Algal Res,2019,44:101707.
[45]SALATI S,D'IMPORZANO G,MENIN B,et al.Mixotrophic cultivation of Chlorella for local protein production using agro-food by-products[J].Bioresource Technol,2017,230:82-89.
[46]LI L,CHEN W H,WANG Y Y,et al.Effect of hydrodynamics on autoflocculation and gravity sedimentation of Chlorella vulgaris[J].J Water Process Eng,2021,43:102259.
[47]ALAVIJEH R S,KARIMI K,WIJFFELS R H,et al.Combined bead milling and enzymatic hydrolysis for efficient fractionation of lipids,proteins,and carbohydrates of Chlorella vulgaris microalgae[J].Bioresource Technol,2020,309:123321.
[48]WAGHMARE A G,SALVE M J,LEBLANC J G,et al.Concentration and characterization of microalgae proteins from Chlorella pyrenoidosa[J].BIOB,2016,3:16.
[49]CHEW K W,CHIA S R,LEE S Y,et al.Enhanced microagal protein extraction and purification using sustainable microwave-assisted multiphase partitioning technique[J].Chem Eng J,2019,367:1-8.
[50]SOLO-SIERRA L,KULLARNI S,WOODARD S L,et al.Processing of permeabilized Chlorella vulgaris biomass into lutein and protein-rich products[J].J Appl Phycol,2020,32(3):1697-1707.