植物多酚(polyphenols)是一种通过植物次生代谢,由磷酸戊糖、草酸盐和苯丙烷途径合成的一种酚性羟基有机化合物[1],可根据结构和化学性质分为黄酮类和非黄酮类[2],具有良好的抑菌消炎、降糖脂、抗动脉硬化等功能[3-6]。植物多酚在果实中主要以两种形式存在-结合多酚(纤维素-多酚、果胶-多酚、木质素-多酚等)和游离多酚[7],其作为人类第7营养素具有来源广泛(茶叶、葡萄、松树和菜籽等)、储藏量大等优点[8-10],但是不同来源多酚的有效利用率低,很难投入到大规模工业生产化中,因此,挖掘不同植物源的多酚,并对其产游离态多酚发酵条件的优化成为目前的研究热点。
蓝靛果(Lonicera caerulea)是一种位于冷凉湿润性气候的具有重要经济价值的蓝色小浆果,多年生灌木植物,高度抗寒,种植地区具有区域性[11],其中多酚作为蓝靛果中重要的活性物质,其含量(865mg/100g)均高于常见的小浆果,如黑加仑(812 mg/100 g)、蓝莓(684 mg/100 g)、树莓(333 mg/100 g)等[12],目前,常见的多酚转化方法主要有物理法、化学法及微生物转化法,与前两种转化技术相比[13],微生物转化法通过化学结构修饰[14]、多种生物化学反应[15]等途径将结合态多酚转化为游离态多酚,以提高游离多酚利用率,具有绿色、安全及副产物少等特点[16-18]。近年来,微生物转化法中采用的微生物主要为乳酸菌属[19]、芽孢杆菌属[20]及腐生菌属[21]等。研究发现,通过红曲霉和芽孢杆菌混合发酵番石榴叶,游离态多酚含量显著提高,其游离态多酚组分中槲皮素含量提升最为显著[22];以乳酸菌为发酵菌株对猕猴桃果汁进行发酵条件优化,相比于猕猴桃原汁游离态多酚中总黄酮含量提高25.45%[23]。
目前,鲜见通过鼠李糖乳杆菌(Lactobacillus rhamnosus)发酵蓝靛果多酚的报道,本研究通过Lactobacillus rhamnosus CICC6224发酵蓝靛果产多酚,并采用单因素试验结合响应面法对其发酵工艺进行优化,以期为微生物发酵应用果蔬益生元开发及利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株及材料
鼠李糖乳杆菌(Lactobacillus rhamnosus)CICC6224:保藏于中国工业微生物菌种保藏管理中心(China center of industrial culture collection,CICC);蓓蕾蓝靛果果实:东北农业大学。
1.1.2 化学试剂
乙酸钠、磷酸氢二钾、硫酸镁、硫酸锰、柠檬酸氢铵、葡萄糖、吐温-80(均为分析纯):天津市科密欧化学试剂有限公司;牛肉膏、酪蛋白胨、酵母提取物(均为生化试剂):北京奥博星生物技术有限责任公司;福林酚、没食子酸(均为分析纯):上海源叶生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
发酵培养基:蓝靛果去梗后,用去离子水清洗蓝靛果表面,擦拭蓝靛果表面水分,热吹风机干燥处理,使用打浆机将蓝靛果进行破碎,收集样品,108 ℃高压蒸汽灭菌20 min,灭活蓝靛果果汁中的酶、有害杂菌。
驯化培养基[24]:将发酵培养基与MRS培养基按体积比1∶1混合,108 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
L3-LJ170榨汁机:山东九阳股份有限公司;SW-CJ超净工作台:苏州安泰空气技术有限公司;UltraGEM2超纯水器:英国ELGA LabWater公司;MLS-3780 SANYO蒸汽压力灭菌锅:上海精宏实验设备有限公司;ZHWY-211C恒温培养振荡器:上海智城分析仪器制造有限公司;FE20 pH Meter pH计:梅特勒-托利多上海有限公司;UVmini-1240紫外可见分光光度计:岛津国际贸易上海有限公司。
1.3 试验方法
1.3.1 菌种的驯化
将L.rhamnosus CICC6224菌液以2%(V/V)的接种量接种于驯化培养基,37 ℃、140 r/min培养24 h,得到驯化菌液。
1.3.2 鼠李糖乳杆菌发酵蓝靛果产多酚发酵条件优化单因素试验
将L.rhamnosus CICC6224驯化菌液按2%(V/V)的接种量接种于装液量为50 mL发酵培养基(蓝靛果与水的质量体积比为1∶3(g∶mL))的250 mL三角瓶中,37 ℃条件下发酵24 h。在此基础上,采用单因素轮换法依次考察不同料液比(1∶5、1∶4、1∶3、1∶2、1∶1)(g∶mL)、接种量(1%、2%、3%、4%、5%)、装液量(30 mL、50 mL、70 mL、90 mL、110 mL)、发酵温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、发酵时间(18 h、24 h、30 h、36 h、42 h)对发酵液中多酚含量的影响,确定最佳发酵条件。
1.3.3 鼠李糖乳杆菌发酵蓝靛果产多酚发酵条件优化响应面试验
(1)Plackett-Burman试验设计
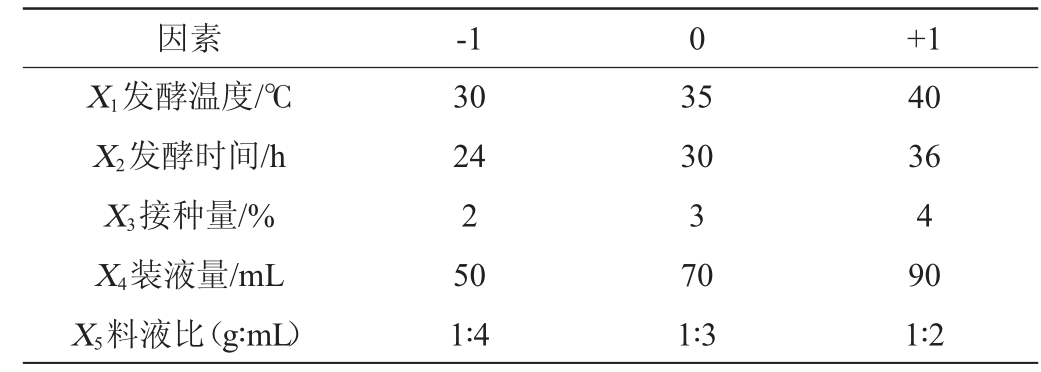
根据单因素试验的结果,选择影响多酚含量的5个因素(发酵温度、装液量、发酵时间、接种量、料液比),以多酚含量(Y)为响应值,利用Design Expert 10软件设计5因素3水平的PB试验,PB试验设计因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design
(2)最陡爬坡试验
在PB试验的基础上,选取影响较大的因素,根据其正负效应设计最陡爬坡试验。
(3)中心组合试验设计
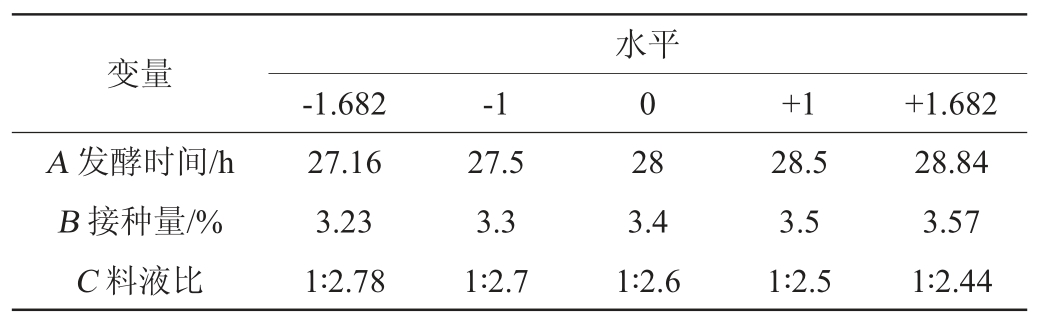
根据PB试验及最陡爬坡试验结果,以多酚含量(Y)为响应值,以发酵时间(A)、接种量(B)、料液比(C)为考察因素,应用Design Expert 10软件设计中心组合设计(central composite design,CCD)试验,试验设计因素与水平见表2。
表2 中心组合试验设计因素与水平
Table 2 Factors and levels of central composite experiments design
1.3.4 多酚含量的测定
多酚含量的测定参照ZHENG Y等[25]的方法进行改良。通过福林-酚法测定多酚含量,以没食子酸含量(X)为横坐标,吸光度值(Y)为纵坐标,绘制没食子酸标准曲线,得到没食子酸标准曲线回归方程为:Y=1.353 8X+0.003 6,R2=0.998 1。根据标准曲线回归方程计算发酵液中多酚的含量。
1.3.5 数据处理
每组试验设计3组平行试验,结果以“平均值±标准差”表示,采用Design Expert 10、IBM SPSS Statistics 27、Origin 2021设计试验、分析数据及作图。
2 结果与分析
2.1 鼠李糖乳杆菌发酵蓝靛果产多酚发酵条件优化单因素试验结果
不同发酵条件对L.rhamnosus CICC6224发酵蓝靛果产多酚的影响见图1。蓝靛果果浆中的一些营养物质(如糖类、蛋白质等)是L.rhamnosus CICC6224发酵的主要底物,通过持续加水不仅使得榨取蓝靛果果浆更为细腻,而且缓解了发酵液中过高的渗透压对菌株生长的影响,但过低的料液比稀释了发酵液中的糖类等营养物质,无法维持菌株的自身生长,不利于发酵[26],由图1A可知,随着料液比的升高,多酚含量呈先升高后降低的趋势,当料液比为1∶3(g∶mL)时,多酚含量最高,为(1 014.43±18.56)mg/100 g,因此,确定最佳料液比为1∶3(g∶mL)。
L.rhamnosus CICC6224通过微生物修饰作用将结合酚转化为游离酚,当菌株密度过高时,发酵液中的底物无法为菌株的生长提供充足的营养物质,导致过多的菌株利用游离酚作为碳源来维持自身生长[27]。由图1B可知,随着接种量的升高,多酚含量呈先升高后下降的趋势,说明接种量过低及接种量过高均不利于发酵液中多酚的积累,当接种量为3%(V/V)时,多酚含量最高,为(1 074.62±17.60)mg/100 g,因此,确定最佳接种量为3%(V/V)。
L.rhamnosus CICC6224为好氧微生物,装液量的升高为菌株生长提供了充分的底物,但同时也减少了锥形瓶中氧气的含量,装液量过多不利于菌株的正常生长,从而影响多酚的转化[28]。由图1C可知,随着装液量的升高,多酚含量呈先升高后下降的趋势,当装液量为70 mL时,多酚含量最高,为(1 162.16±22.14 mg/100 g),因此,确定最佳装液量为70 mL。
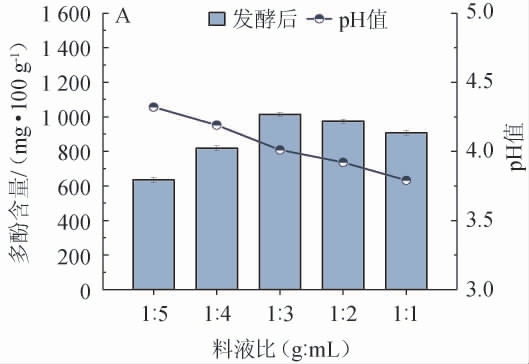
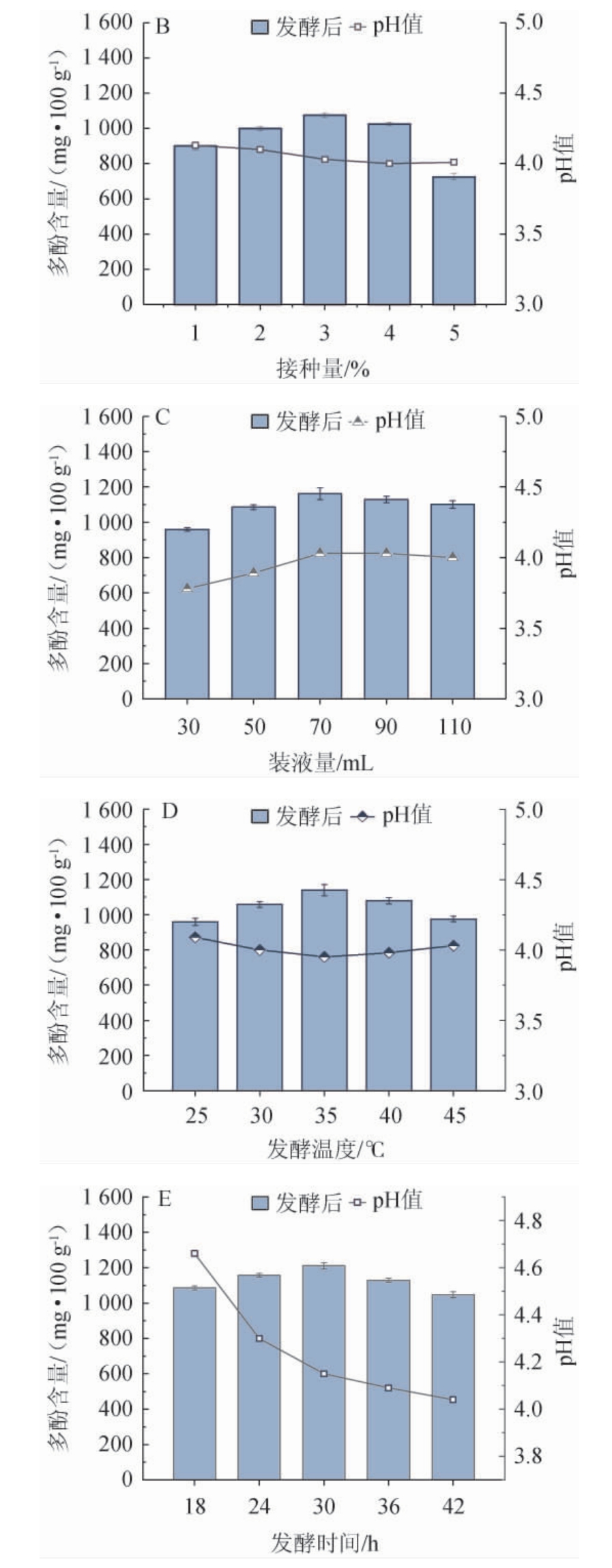
图1 料液比(A)、接种量(B)、装液量(C)、发酵温度(D)及发酵时间(E)对多酚含量的影响
Fig.1 Effect of material and liquid ratio (A),inoculum (B),loaded liquid (C),fermentation temperature (D) and fermentation time (E) on polyphenolic content
培养温度的变化影响了菌株的生长,温度的升高和发酵过程中酒精等发酵产物的积累降低了多酚的转化速度[29]。由图1D可知,随着发酵温度的升高,多酚含量呈先升高后下降的趋势,当发酵温度为35 ℃时,多酚含量最高,为(1 140.27±23.32)mg/100 g,因此,确定最佳发酵温度为35 ℃。
在发酵过程中,菌株通过利用发酵液的底物进行繁殖传代,通过微生物作用转化多酚类物质的组分,但营养物质的含量随着发酵时间的增加而减少,部分菌株赖以生长的碳源由糖类转变为游离酚,多酚的积累量逐渐减少[30]。由图1E可知,随着发酵时间的延长,多酚含量呈先升高后下降的趋势,当发酵时间为30 h时,多酚含量达到最高,为(1 211.40±23.62)mg/100 g,因此,确定最佳发酵时间为30 h。
综上,选取料液比1∶3(g∶mL)、接种量3%(V/V)、装液量70 mL、发酵温度35 ℃和发酵时间30 h为最佳发酵条件。
2.2 PB试验结果及分析
根据单因素试验结果,以多酚含量(Y)为响应值,设计PB试验,试验设计及结果见表3,方差分析结果见表4。
表3 Plackett-Burman试验设计与结果
Table 3 Design and results of Plackett-Burman experiments
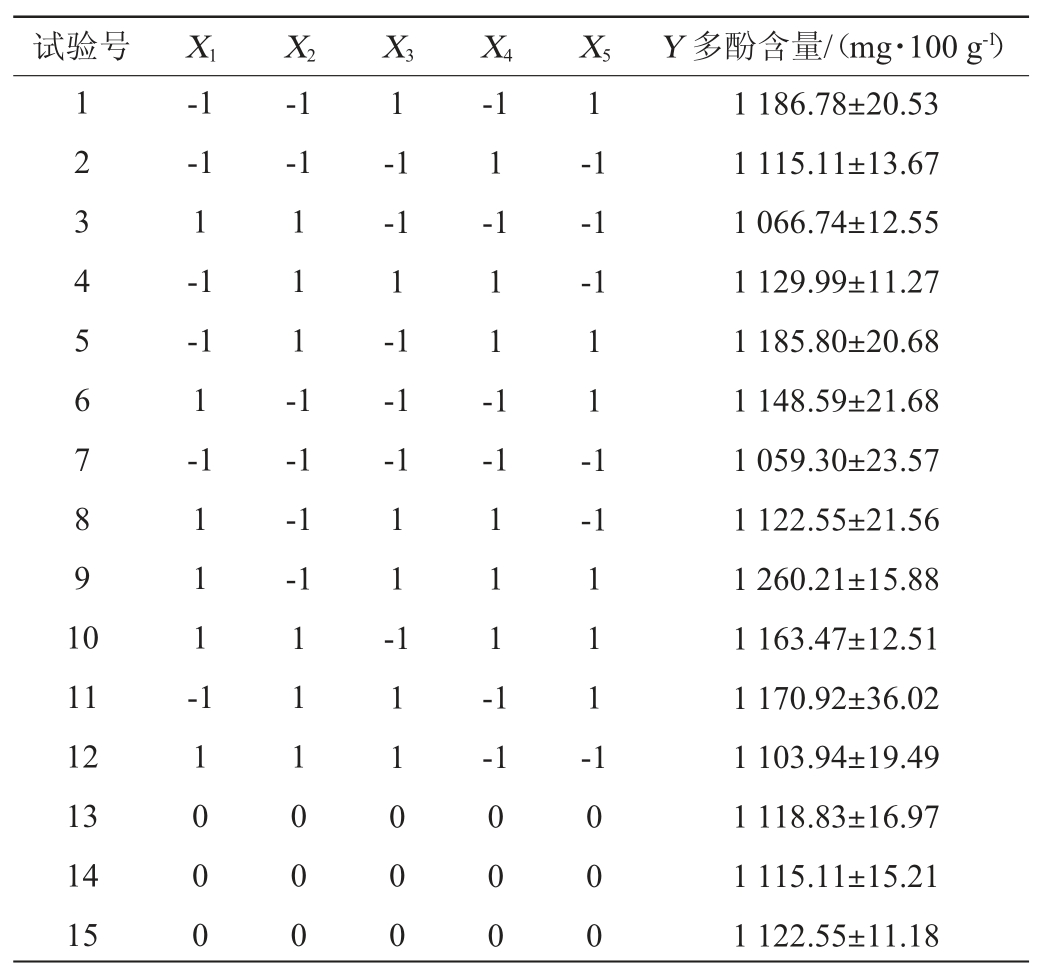
表4 Plackett-Burman试验结果方差分析
Table 4 Variance analysis of Plackett-Burman experiments results
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。下同。
采用Design Expert 10软件对表3试验结果进行多元回归拟合,得到各变量与多酚物质含量关系的模型拟合方程为Y=1 142.78+1.47X1-5.97X2+19.62X3+20.07X4+43.18X5,其中X1、X3、X4、X5对试验结果呈正效应,X2呈负效应。由表4可知,回归模型极显著(P<0.01),决定系数R2值为0.937 5,表明93.75%的变异都可以用此方程估测。由表4亦可知,X3、X4、X5对结果影响显著(P<0.05),其他因素对结果影响不显著(P>0.05)。
2.3 最陡爬坡试验
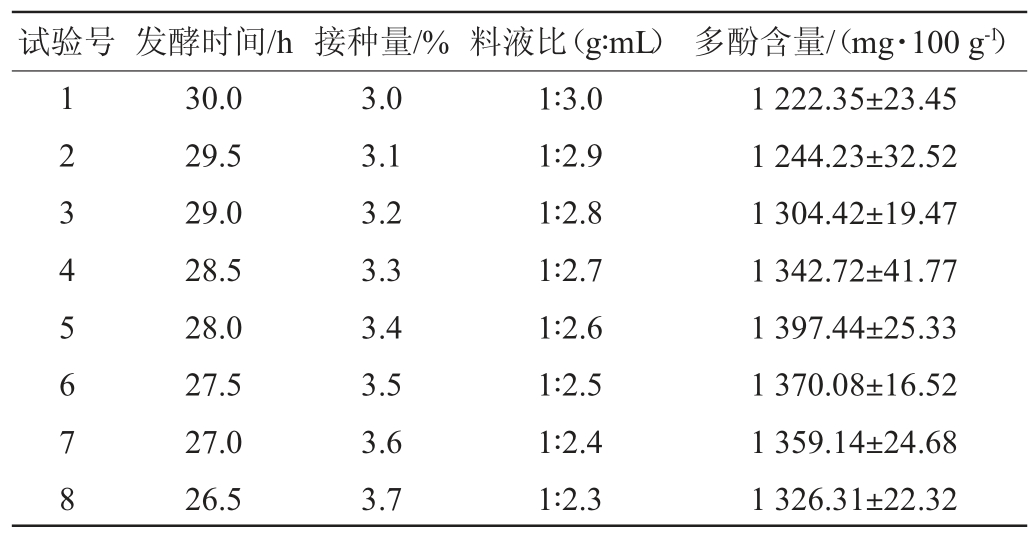
根据PB试验结果设计最陡爬坡试验,其试验设计及结果见表5。由表5可知,试验4条件下,即发酵时间28 h,接种量3.4%,料液比1∶2.6(g∶mL)时,鼠李糖乳杆菌CICC6224发酵蓝靛果发酵液中多酚含量最高,达到1 397.44 mg/100 g,因此选取该处理中各变量取值作为CCD试验中心点进行后续优化试验。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest ascent test
2.4 响应面试验结果及分析
CCD试验设计及结果见表6,方差分析结果见表7。
表6 中心组合试验试验设计及结果
Table 5 Design and results of central composite experiments
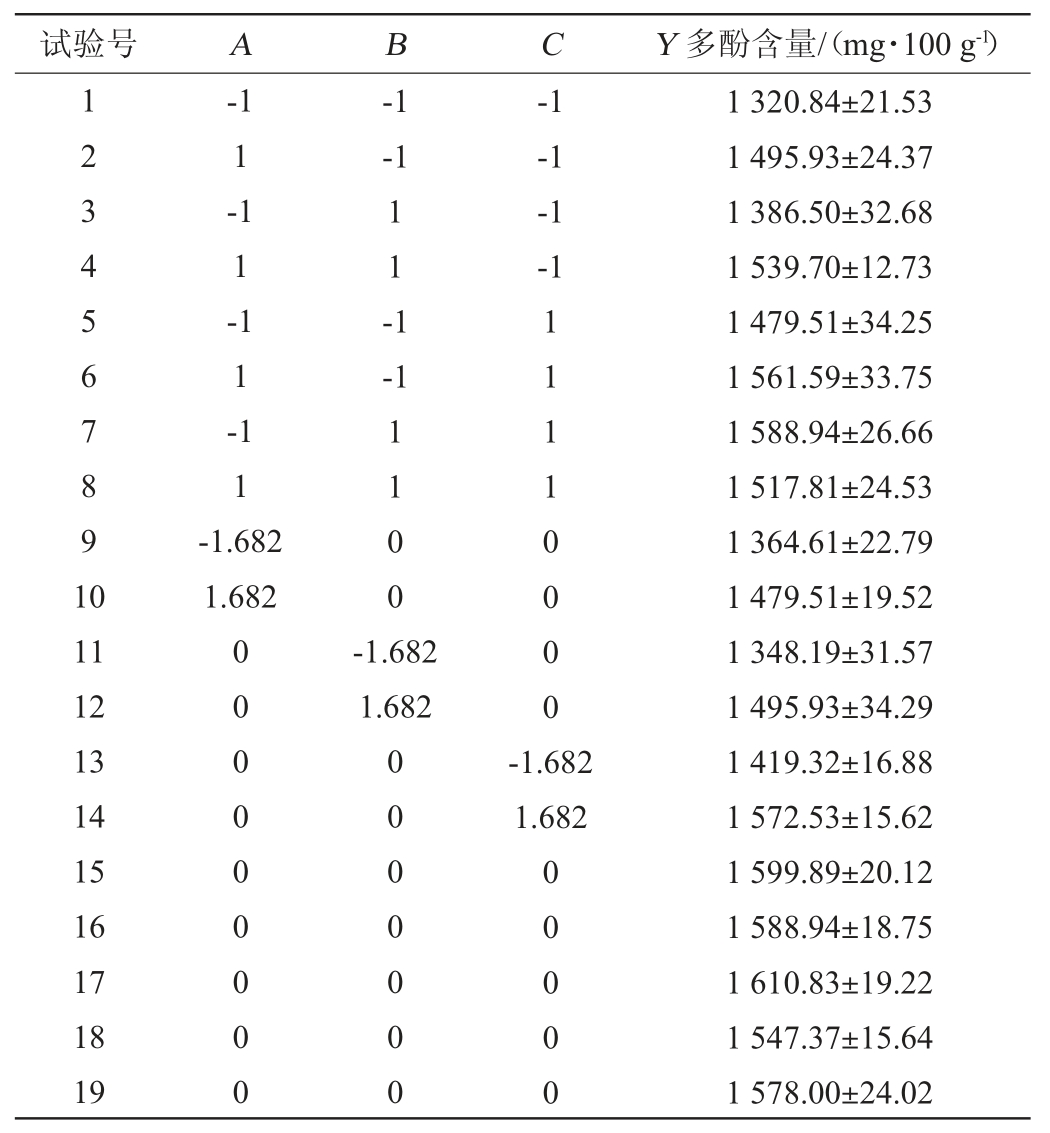
表7 中心组合试验试验结果的方差分析
Table 7 Variance analysis of central composite experiments results
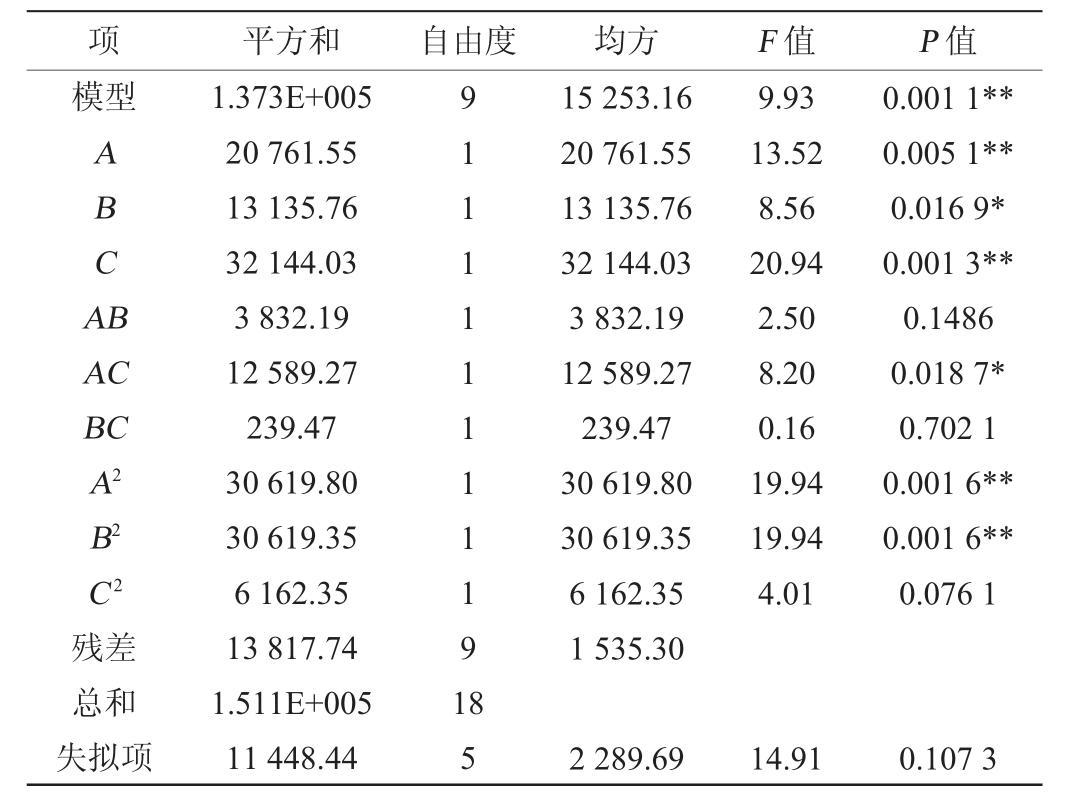
采用Design Expert 10软件对表6试验结果进行多元二次回归拟合,得到各因素对多酚含量的多元二次拟合回归方程为Y=1583.14+38.99A+31.01B+48.51C-21.89AB-39.67AC-5.47BC-47.36A2-47.36B2-24.08C2。由表7可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明回归模型拟合性较好,模型可靠。决定系数R2=0.908 6,调整决定系数R2Adj=0.817 1,说明81.71%的试验数据的变异性可用此回归模型解释。由表7亦可知,一次项A、C和二次项A2、B2对结果影响极显著(P<0.01),一次项B及交互项AC对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
各因素间交互作用对多酚含量影响的响应面及等高线见图2。由图2可知,响应曲面开口均朝下,存在最高点,其中交互项AC的等高线呈椭圆形,说明对结果影响显著,与方差分析结果一致。
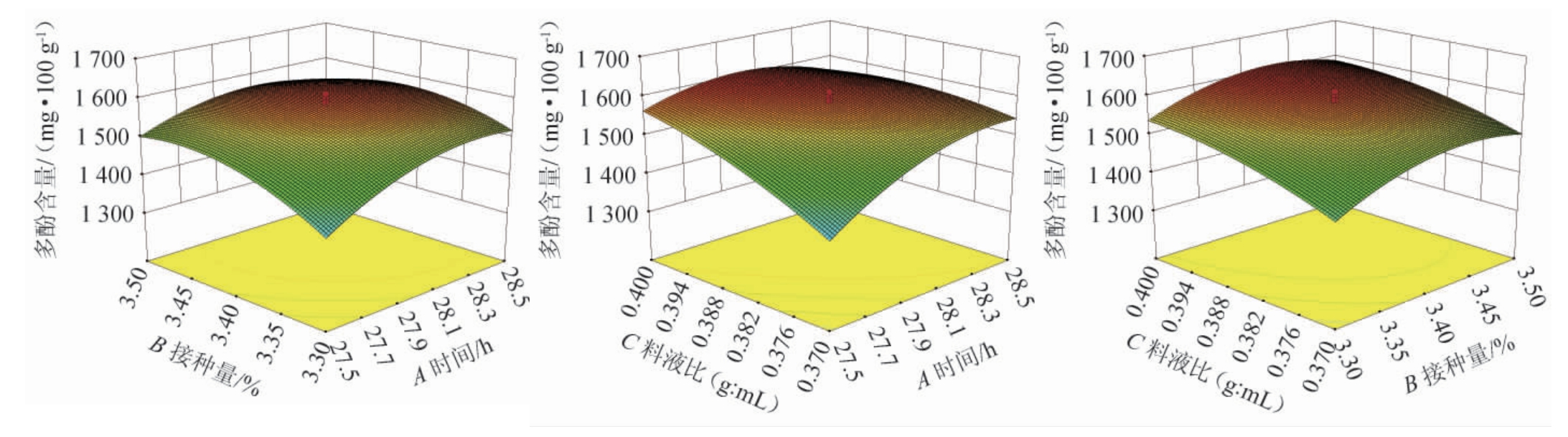
图2 发酵时间、接种量和料液比对游离多酚含量影响的等高线及响应曲面
Fig.2 Response surface plots and contour lines of effects of interaction between fermentation time,inoculum and material-liquid ratio on free polyphen production
2.5 验证试验
采用IBM SPSS Statistics 27软件对回归方程进行求解,得到最优发酵工艺条件为:发酵时间27.74 h、接种量3.43%、料液比1∶2.49(g∶mL),多酚含量的预测值为1 619.83 mg/100 g,为便于实际操作,将最优条件修整为发酵时间28 h、接种量3.4%和料液比1∶2.5(g∶mL),在此条件下进行5次验证试验,测得发酵液中的多酚含量为(1 622.54±16.71)mg/100 g,试验值与预测值接近,结果可靠。
3 结论
本研究以多酚含量为响应值,采用单因素试验结合响应面试验优化得到鼠李糖乳杆菌CICC6224发酵蓝靛果产多酚的最优发酵条件为发酵温度35 ℃、装液量70 mL、发酵时间28 h、接种量3.4%、料液比1∶2.5(g∶mL),在此条件下,多酚含量达到1 622.54 mg/100 g,是优化前(711.64 mg/100 g)的2.28倍。本试验证实通过鼠李糖乳杆菌CICC6224发酵是一种提高蓝靛果果浆中游离多酚含量的有效途径,这为微生物法大量富集游离多酚提供了理论依据,同时进一步为食品级开发蓝靛果生物活性物质成分与功能提供基础保障。
[1] FERNANDES A F,FARIAS D D P,IRAMAIA A N,et al.Polyphenols and their applications:An approach in food chemistry and innovation potential[J].Food Chem,2020,338:127535.
[2] VUOLO M M,LIMA V S,JUNIOR M,et al.Phenolic compounds:Structure,classification,and antioxidant power[J]. Bioact Comp,2019:33-50.
[3] 蓝蔚青,赵欣宇,刘嘉莉,等.植物多酚的主要抑菌机制及在水产品保鲜中的应用研究进展[J].食品与发酵工业,2021,47(10):259-264.
[4] STEINERT R E,FEINLE B C,ASARIAN L,et al.Ghrelin,CCK,GLP-1,and PYY(3-36):secretory controls and physiological roles in eating and glycemia in health,obesity,and after RYGB[J].Physiol Rev,2017,97(1):411-463.
[5] 张姝萍,王岳飞,徐平.茶多酚对动脉粥样硬化的预防作用与机理研究进展[J].茶叶科学,2019,39(3):231-246.
[6] WANG D X,ZHANG M,WANG T T,et al.Green tea polyphenols mitigate the plant lectins-induced liver inflammation and immunological reaction in C57BL/6 mice via NLRP3 and Nrf2 signaling pathways[J].Food Chem Toxicol,2020,144:111576.
[7] 杨聪颖,骆亚丽,郭时印.响应面优化金柑多酚的提取工艺[J].现代食品科技,2018,34(5):174-181.
[8] KUCHARSKA A Z,LETOWSKA S A,OSZMIANKI J,et al.Iridoids,phenolic compounds and antioxidant activity of edible honeysuckle berries[J].Molecules,2017,22(3):405.
[9] CELLI G B,GHANEM A,BROOKS M S L,et al.Haskap berries-A critical review of antioxidant capacity and health-related studies for potential value-added products[J].Food Bioproc Tech,2014,7(6):1541-1554.
[10] JURIKOVA T,ROP O,MLICEK J,et al.Phenolic profile of edible honeysuckle berries(genus Lonicera)and their biological effects[J].Molecules,2012,17(1):61-79.
[11] 乔锦莉,秦栋,郭良川.蓝果忍冬的生物活性物质及其功效研究进展[J].食品科学,2020,41(9):276-284.
[12] 李晨,张秀玲,李凤凤.五种小浆果抗氧化活性和相关营养物质的测定及主成分分析[J].食品与发酵工业,2021:1-12[2022-03-21].DOI:10.13995/j.cnki.11-1802/ts.027716.
[13] 潘妍.生物转化提取燕麦β-葡聚糖及其化妆品功效研究[D].北京:北京工商大学,2010.
[14] PI X,YANG Y,SUN Y,et al.Recent advances in alleviating food allergenicity through fermentation[J].Crit Rev Food Sci,2021(1):1-14.
[15] DIMITRIOS L,NATHALIE J.How sweet are our gut beneficial bacteria?A focus on protein glycosylation in Lactobacillus[J].Int J Mol Sci,2018,19(1):136.
[16] ZHANG Y,LIU W,WEI Z,et al.Enhancement of functional characteristics of blueberry juice fermented by Lactobacillus plantarum[J].LWTFood Sci Technol,2020,139:110590.
[17] OH B T,JEONG S Y,VELMURUGAN P,et al.Probiotic-mediated blueberry(Vaccinium corymbosum L.)fruit fermentation to yield functionalized products for augmented antibacterial and antioxidant activity[J]. J Biosci Bioeng,2017,124(5):542-550.
[18] CASES V E,JAUREGUI N N,FRUTOS M J.Influence of fermentation with different lactic acid bacteria and in vitro digestion on the changeof phenolic compounds in fermented kiwifruit pulps[J].Int J Food Sci Tech,2021,63(31):6488.
[19] LIN D,WU J J,YANG Y M,et al.The anti-lipidemic role of soluble dietary fiber extract from okara after fermentation and dynamic high-pressure microfluidization treatment to Kunming mice[J].J Agr Food Chem,2020,57(11):1-10.
[20] 张晶,左勇,谢光杰.发酵条件对猕猴桃果酒中多酚含量的影响[J].食品工业科技,2017,38(9):160-163.
[21] 贝琦.燕麦发酵多酚释放与转化及生物活性增强的研究[D].广州:华南理工大学,2018.
[22] WANG L,BEI Q,LIAO W Z,et al.Characterization of soluble and insoluble-bound polyphenols from Psidium guajava L.leaves co-fermented with Monascus anka and Bacillus sp.and their bio-activities[J].J Funct Foods,2017(32):149-159.
[23] 崔淼,李云成,孟凡冰.猕猴桃果汁乳酸菌发酵工艺优化及品质评价[J].食品科技,2021,46(9):66-72.
[24] 张晓宁,陈境,麻丽丽.优化培养基对冷冻干燥后植物乳杆菌LIP-1活性的影响[J].食品科技,2019,44(7):1-9.
[25] ZHENG Y,LIU S,XIE J,et al.Antioxidant,α-amylase and α-glucosidase inhibitory activities of bound polyphenols extracted from mung bean skin dietary fiber[J].LWT-Food Sci Technol,2020(132):109943.
[26] 李斌,雷月,孟宪军.响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J].食品科学,2015,36(22):33-39.
[27] 王储炎,张继刚,杨柳青.3种乳酸菌发酵对蓝莓多酚、原花青素含量及抗氧化活性的影响[J].食品科学,2020,41(24):87-94.
[28] 王瑶,李琪,李平兰.响应面法优化植物乳杆菌LPL-1产细菌素发酵条件及细菌素理化性质分析[J].食品科学,2018,39(22):101-109.
[29] 苟拥军,王雪,刘梁.植物乳杆菌发酵苹果浆的工艺优化及其抗氧化能力[J].农产品加工,2020(21):42-48.
[30] 李相禹,韦青海,彭佳丽.植物乳杆菌发酵富集猕猴桃多酚工艺优化及其对多酚生物可及性的影响[J].食品科技,2020,45(11):15-20.