咖啡(coffee)是咖啡豆经过烘焙而成的非酒精性饮料,与茶、可可同为流行于世界的三大饮品,每年咖啡的消耗量仅次于茶,同时也是仅次于石油的第二大贸易商品[1-4]。我国咖啡主要种植于云南、广西、海南等地,其中云南是全国咖啡种植面积最大、产量最高的区域[5-6]。咖啡豆的消耗量越大,产生的咖啡果皮果肉等副产物也越来越多,通常加工1 t小粒咖啡鲜果会产生0.5 t皮渣(包括果皮、果肉),云南小粒咖啡种植区每年鲜果处理皮渣约39.68万t[7-8]。虽然国外也有在饲料中加入一定量的咖啡皮渣的报道,但其消化利用率不高,且未实现规模化生产。咖啡果皮果肉容易腐烂变质,如果处理不及时就会造成严重的环境污染,同时还会增加企业的负担,严重阻碍了企业的发展。但咖啡果中含有丰富的生物活性物质,如绿原酸[9]、花青素[10]、咖啡酸[11]等多酚类物质,这些物质具有很好的抗氧化活性[12]、抑菌活性[13]、消炎[14]等功能。同时,咖啡果中还含有天然的咖啡因,咖啡因对神经系统、消化系统及偏头痛等具有一定的积极作用[15-18]。
咖啡果肉中营养物质丰富,将其加工成果醋可以很好地保留其中的营养成分,同时提高了资源利用率。目前,尚未有特定的咖啡果醋专用醋酸菌。因此,筛选和开发适合利用咖啡果发酵果醋的专用醋酸菌是目前亟需解决的问题。
为挖掘适用于咖啡果醋发酵的醋酸菌资源,本研究选用自然发酵的咖啡果醋为原料,采用钙透明圈初筛、产醋酸定性试验从中筛选醋酸菌,并通过形态观察、生理生化试验及分子生物学技术对其进行菌种鉴定。以期用于咖啡果醋的生产酿造工业中,为该菌株在生产上的应用打下理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
自然发酵的咖啡果醋:购于云南德宏。
1.1.2 培养基[19]液体培养基:葡萄糖1%,酵母粉1%,121 ℃高压蒸汽灭菌15 min,冷却到60 ℃,加入3%(V/V)体积分数为95%的乙醇。
选择培养基:葡萄糖1%,酵母粉1%,琼脂粉2%,碳酸钙1%,121 ℃高压蒸汽灭菌15 min,冷却到60 ℃,加入3%(V/V)体积分数为95%的乙醇。
半固体培养基:液体培养基中添加琼脂粉0.5%。
乙醇过氧化培养基:酵母膏1 g,0.04%溴酚蓝溶液2 mL、蒸馏水100 mL,pH调至6.8~7.0之间,121 ℃高压蒸汽灭菌15 min,冷却到60 ℃,加入3%(V/V)体积分数为95%的乙醇。
1.1.3 试剂
氢氧化钠、三氯化铁、结晶硫酸铜、酒石酸钾钠、无水碳酸钙、硫酸镁、硝酸钠(均为分析纯)、革兰氏染色液:生工生物工程(上海)有限公司;氢氧化钾(分析纯)、氯化钾(分析纯):西陇化工股份有限公司;一管式通用样品脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix:生工生物工程(上海)有限公司。
1.2 仪器与设备
TDL-5-A离心机:上海安亭科学仪器厂;XSP-2C显微镜:上海中恒仪器有限公司;SW-CJ-1C型双人单面净化工作台:苏州净化设备有限公司;HWS恒温培养箱:宁波东南仪器设备有限公司;YXQ-LS-50S11立式蒸汽灭菌锅:上海博迅实业有限公司;T-Gradient PCR仪:德国Biometra公司;DYY-6C恒流恒压电泳仪:北京市六一仪器厂;BIO-BEST 140E型凝胶图像分析系统:美国西盟公司。
1.3 方法
1.3.1 富集培养
取10 mL自然发酵的咖啡果醋于90 mL液体培养基中,30℃、150r/min条件下摇床培养2d,进行醋酸菌的富集培养。
1.3.2 产酸菌株的分离、纯化
采用平板涂布及划线分离法进行筛选。取富集培养液1 mL加入9 mL无菌生理盐水中,振荡摇匀,按10倍梯度稀释至10-7。取200 μL稀释液涂布于选择培养基中,每个稀释度做3个平行,30 ℃培养3~5 d,在培养的过程中观察菌落生长情况,挑取溶钙圈较大的单菌落进行分离纯化[20]。
1.3.3 产醋酸定性试验[21-22]
将初筛得到的菌株接种于液体培养基中,于30 ℃、150 r/min条件下摇床振荡培养3d,取10mL发酵液2 500 r/min条件下离心5 min,取上清液,用2.5 mol/L NaOH溶液调节调节pH至7.0,加热至煮沸,然后加入5%FeCl3溶液5~6滴,形成红褐色沉淀的菌株可以初步鉴定为醋酸菌。
1.3.4 形态特征观察
将初步鉴定得到的醋酸菌株接种于半固体培养基上,30 ℃培养2 d,在培养期间观察菌株的生长状况及形成的菌落形态特征,并进行革兰氏染色,观察菌株形态。
1.3.5 生理生化试验
按照文献[23-24]方法进行生理生化试验,主要包括接触酶、氧化酶、乙醇过氧化试验、明胶液化试验、生酮试验等。
1.3.6 产酸能力的测定
将筛选得到的单菌落接种于选择培养基上,30 ℃培养2 d,测量其溶钙圈直径和菌落直径,计算两者的比值(H/C值)。
将筛选得到的单菌落接种于液体培养基中,30 ℃、150 r/min条件下恒温摇床培养6 d作为种子液。将种子液按6%(V/V)的接种量接种到液体培养基中,于30 ℃、150 r/min条件下恒温摇床培养,每隔24 h取样,采用酸碱滴定法测定产酸量(以醋酸计)[25]。
1.3.7 分子生物学鉴定
基因组DNA的提取:取150 μL培养24 h的醋酸菌培养液,10000 r/min离心1 min,弃上清液,收集菌体。加入100 μL Qlysis-G Reagent和10 μL Proteinase K,振荡均匀,65 ℃水浴5 min。95 ℃水浴3 min,加入100 μL Buffer NST,振荡均匀,12 000 r/min离心5 min,取上清液作为模板直接用于PCR扩增。
PCR扩增条件:以提取的DNA为模板,利用引物799F(5'-AACAGGATTAGATACCCTG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16S rDNA基因序列。PCR扩增体系(50 μL):Taq PCR Master Mix(1×)25 μL,DNA模板(10 μg)1 μL,引物799F(10 μmol/L)2 μL;引物1492R(10 μmol/L)2 μL;双蒸水(ddH2O)补足到50 μL。
PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火1 min,72 ℃延伸1 min,循环30次;72 ℃再延伸5 min。将PCR扩增产物经0.4%的琼脂糖凝胶电泳检测后,采用PCR试剂盒回收,委托生工生物工程(上海)有限公司测序。
系统发育树的构建:将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)检索同源性,选取同源性较高的模式菌株的16S rDNA基因序列,利用clustal X2.0和Mega 4.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树,进而确定其种属地位。
1.3.8 数据处理
所有试验均平行做3次,采用Origin 8.5制图,SPSS 18.0统计软件分析数据。
2 结果与分析
2.1 产酸菌株的分离及纯化
在选择培养基上挑选出菌落大小一致,溶钙圈直径大且生长速度快的单菌落60个,并多次划线分离纯化直至出现独立分布的单个细胞,然后培养繁殖成单个菌落,于4 ℃条件下保存,备用。
2.2 产醋酸定性试验
将60株纯化菌株经液体培养后进行产酸定性试验,结果发现,部分菌株的发酵液能够产生明显红褐色沉淀,说明该发酵液中有醋酸产生;未产生红褐色沉淀的发酵液,说明无醋酸产生或该菌株活性太低。最终筛选得到16株产醋酸的菌株,依次编号为A1、A2、A3、…、A16,初步鉴定为醋酸菌。
2.3 形态观察
将16株菌株穿刺接种进行培养,发现所有的穿刺线的边缘向周围雾化,说明菌株均具有运动性。醋酸菌在半固体培养基上的菌落呈现淡黄色,边缘整齐为圆形,表面隆起光滑,菌落周围有明显的碳酸钙溶解圈,符合醋酸菌的菌落形态特征。16株菌的革兰氏染色镜检结果表明,各个菌株的形态呈现杆状或短杆状,单个、成对或成链排列,细胞被染成红色,为革兰氏阴性菌。
2.4 生理生化特征试验
16株菌株的生理生化试验结果见表1。由表1可知,菌株A1、A2、A10、A11、A13、A15、A16氧化酶试验、明胶液化试验及V-P试验结果均为阴性,其他试验结果均为阳性;菌株A3、A4、A5、A6、A7、A8、A9、A12、A14的接触酶试验、乙醇过氧化试验及吲哚试验结果均为阳性,其他试验结果呈阴性。对照《伯杰细菌鉴定手册》(第八版)和《常见细菌系统鉴定手册》中对醋酸菌生理生化特征的描述,可将16株醋酸菌归为两大类,初步鉴定菌株A1、A2、A10、A11、A13、A15、A16为葡糖醋酸杆菌属(Gluconacetobacter sp.),菌株A3、A4、A5、A6、A7、A8、A9、A12、A14为醋酸杆菌属(Acetobactersp.)。
表1 筛选菌株生理生化试验结果
Table 1 Results of the physiological and biochemical tests of screened strains
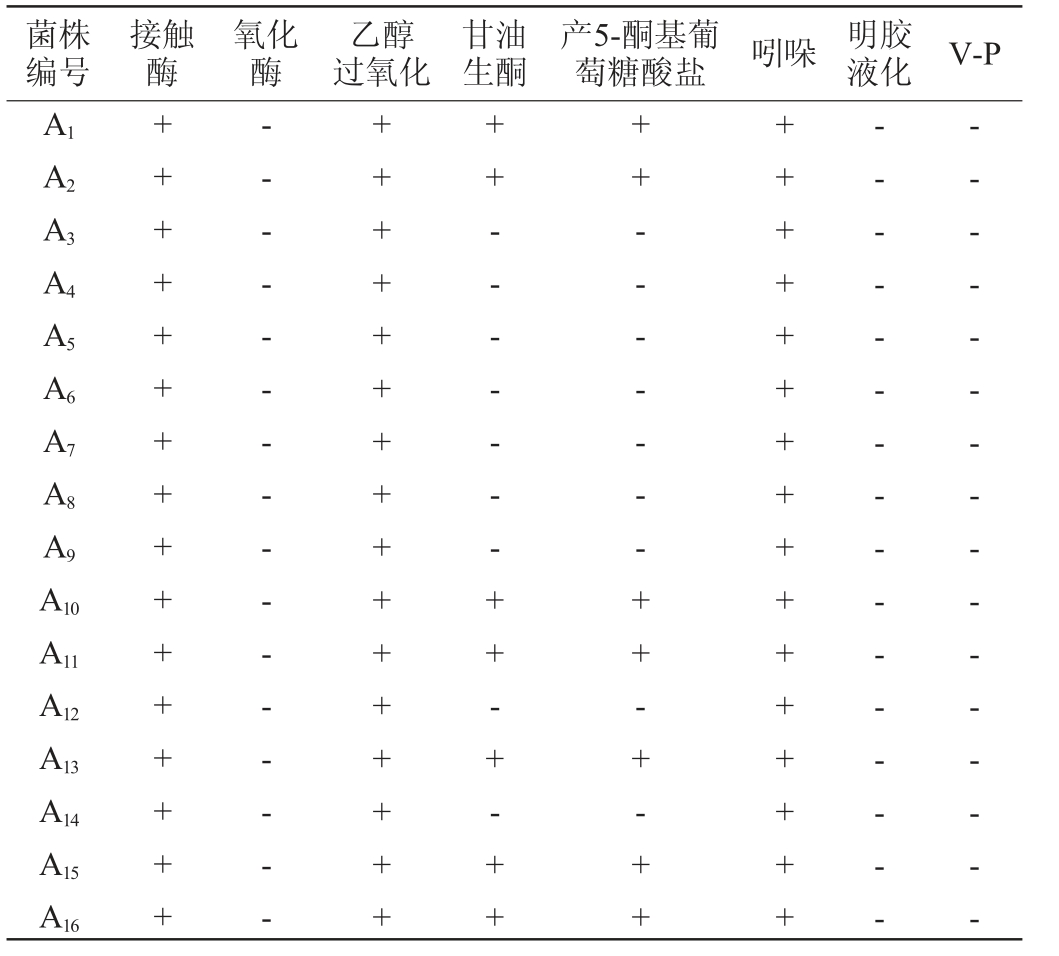
注:“+”代表结果呈阳性,“-”代表结果呈阴性。
2.5 产酸能力的测定
16株菌的H/C值见表2。由表2可知,筛选出的16株菌的H/C值均>2.00,其中菌株A4、A7、A9、A10、A14、A15、A16的H/C值均≥3.00,其余菌株的H/C值范围在2.25~2.89之间。根据各菌株的H/C值及产醋酸定性试验中颜色的深浅,选择菌种A9和A10为目标菌株,测定产酸量,结果见图1。
表2 筛选菌株的H/C值
Table 2 H/C value of screened strain
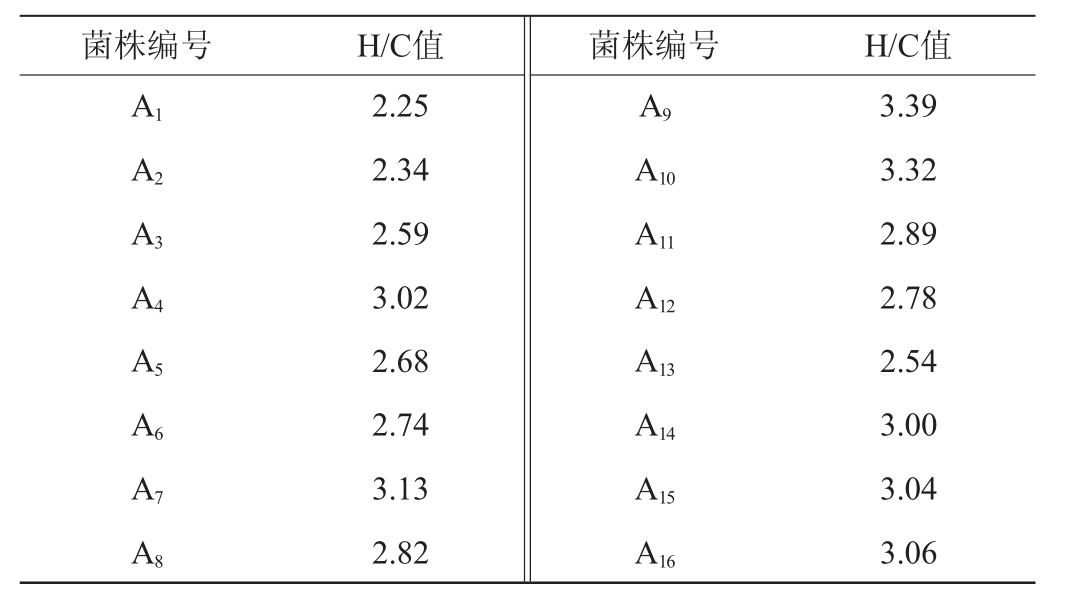
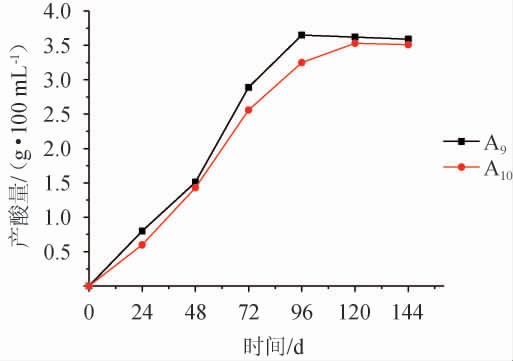
图1 菌株A9和A10的产酸量
Fig.1 Acid production of strain A9 and A10
由图1可知,菌株A9、A10的产酸量均随着发酵时间的增加而增加,在发酵0~96 h之间增加的幅度比较大,之后增加缓慢。在整个发酵过程中,菌株A9的产酸量一直高于菌株A10,最高值达到3.62 g/100 mL,并且比菌株A10达到最大值所用的时间要短。因此,确定A9菌株为产酸量高的优势菌株。
2.6 分子生物学鉴定
菌株A9和A10的系统发育树见图2。由图2可知,菌株A9与罗旺醋杆菌(Acetobacter lovaniensis)聚为一支,亲缘关系最近,菌株A10与木葡糖醋酸杆菌(Gluconacetobacter xylinus)聚为一支,亲缘关系最近。结合形态观察及生理生化试验结果,最终鉴定菌株A9为罗旺醋杆菌(Acetobacter lovaniensis),菌株A10确定为木葡糖醋酸杆菌(Gluconacetobacter xylinus)。
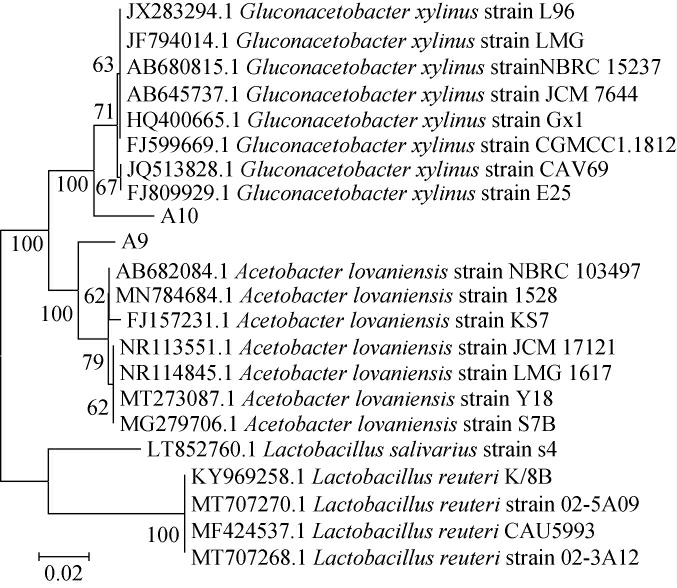
图2 基于16S rDNA基因序列菌株A9和A10的系统发育树
Fig.2 Phylogenetic tree of strain A9 and A10 based on 16S rDNA gene sequence
3 结论
通过富集培养、分离纯化,从自然发酵的咖啡果醋中筛选出60株产溶钙圈的菌,经过产醋酸定性试验初步筛选出16株醋酸菌。通过菌落形态观察、革兰氏染色试验及生理生化特征试验初步鉴定7株为葡糖醋酸杆菌属(Gluconacetobacter sp.),9株为葡糖醋酸杆菌(Gluconacetobacter sp.)。通过产酸能力测定,最终筛选得到两株产酸能力较好的菌株,分别为菌株A9和A10,其中,菌株A9的产酸量高于菌株A10,最高可达3.62 g/100 mL。结合形态观察、生理生化特征试验及分子生物学鉴定结果,最终鉴定菌株A9为罗旺醋杆菌(Acetobacter lovaniensis),菌株A10为木葡糖醋酸杆菌(Gluconacetobacter xylinus)。本试验从咖啡果醋中分离鉴定出了两株菌,丰富了咖啡果醋加工的醋酸菌来源,由于试验样品为自然发酵的果醋,筛选出的醋酸菌产酸能力有待提高。
[1] CHEN X M,MA Z L,KITTS D D.Effects of processing method and age of leaves on phytochemical profiles and bioactivity of coffee leaves[J].Food Chem,2018,249:143-153.
[2] BEHROUZIAN F,AMINI A M,ALGHOONEH A,et al.Characterization of dietary fiber from coffee silverskin:an optimization study using response surface methodology[J].Bioact Carbohydr Diet Fibre,2016,8(2):58-64.
[3] DUANGJAI A,SUPHROM N,WUNGRATH J,et al.Comparison-of-antioxidant,antimicrobial activities and chemical profiles of three coffee(Coffea arabica L.)pulp aqueous extracts[J].Integr Med Res,2016,5(4):324-331.
[4] 孙岳,周地娇,何飞飞,等.咖啡果皮茶冲泡条件研究[J].食品研究与开发,2021,42(12):97-101.
[5] 李维锐,周仕峥.我国咖啡产业发展现状及前景[J].热带农业科学,2011,31(10):105-108.
[6] 陈鸿志,曾晓鹏.中国咖啡产业现状及发展对策[J].热带农业工程,2011,35(6):23-25.
[7] 匡钰,肖兵,张洪波,等.云南咖啡初加工废弃物利用及排放情况调查[J].中国热带农业,2018,(5):31-36.
[8] 刘静,傅冰,刘苏瑶,等.云南咖啡果发酵型果酒的酿造[J].食品工业科技,2017,38(10):194-199.
[9] GEMECHU F G.Embracing nutritional qualities,biological activities and technological properties of coffee byproducts in functional food formulation[J].Trends Food Sci Technol,2020,104:235-261.
[10] 张云鹤,付晓萍,梁文娟,等.云南小粒种咖啡果皮粗提物花青素成分及抗氧化活性研究[J].食品科技,2016,41(5):219-223.
[11] MURTHY P S,MANJUNATHA M R,SULOCHANNAMA G,et al.Extraction,characterization and bioactivity of coffee anthocyanins[J].Eur J Biol Sci,2012,4(1):13-19.
[12] IRIONDO-DEHOND A,GARCÍA N A,FERNANDEZ-GOMEZ B,et al.Validation of coffee by-products as novel food ingredients[J].Innov Food Sci Emerg Technol,2019,51:194-204.
[13] COLLAZO-BIGLIARDI S,ORTEGA-TORO R,CHIRALT A.Improving properties of thermoplastic starch films by incorporating active extracts and cellulose fibres isolated from rice or coffee husk[J].Food Packag Shelf Life,2019,22:100383.
[14] REBOLLO-HERNANZ M,ZHANG Q Z,AGUILERA Y,et al.Phenolic compounds from coffee by-products modulate adipogenesis-related inflammation,mitochondrial dysfunction,and insulin resistance in adipocytes,via insulin/PI3K/AKT signaling pathways[J].Food Chem Toxicol,2019,132:110672.
[15] LI J W,FAN L P,DING S D,et al.Nutritional composition of five cultivars of Chinese jujube[J].Food Chem,2007,103(2):454-460.
[16] 黄锁义,覃成箭,余美科,等.益母草黄酮的提取及鉴别[J].时珍国医国药,2005,16(5):398-399.
[17] 李红,郅洁,马彦梅,等.沙枣黄酮的提取及其抗氧化作用的研究[J].时珍国医国药,2010,21(1):35-36.
[18] LOU Z X,WANG H X,ZHU S,et al.Antibacterial activity and mechanism of action of chlorogenic acid[J]. J Food Sci,2011,76(6): M398-M403.
[19] 李素燕.醋酸菌的分离鉴定及冬枣醋饮料的研制[D].天津:天津大学,2008.
[20] 孙一帆,梁新红,高莹莹.自然发酵的葡萄醋中醋酸菌的分离鉴定[J].中国酿造,2017,36(11):28-32.
[21] 吴越,张富县,艾乃吐拉·马合木提,等.杏皮渣醋酸发酵醋酸菌的分离筛选和鉴定[J].新疆农业科学,2013,50(7):1297-1303.
[22] 魏长庆,王海庆,张凌,等.葡萄果醋发酵用醋酸菌的分离及鉴定[J].中国酿造,2010,29(4):42-45.
[23] 何文兵,刘雪莲,马冬雪.自然发酵的葡萄皮醋中醋酸菌的分离鉴定[J].中国酿造,2012,31(4):79-81.
[24] 徐佳,刘明珠.优良醋酸菌的分离鉴定[J].江西化工,2014(1):90-93.
[25] 李大为,朱运平,张雪,等.自然发酵的苹果醋中醋酸菌的分离鉴定[J].中国食品添加剂,2018(8):165-173.