生物发酵饲料是利用微生物、复合酶为生物饲料发酵剂菌种,将饲料原料转化成微生物菌体蛋白、生物活性小肽类氨基酸、微生物活性益生菌、复合酶制剂为一体的生物发酵饲料。随着“禁抗”、“无抗”养殖模式的推进,发酵饲料越来越受到大众的关注。乳酸菌是指能够发酵糖类主要产物为乳酸的一类无芽孢、革兰氏染色为阳性的细菌的总称。目前,乳酸菌作为最重要的饲用益生菌之一,其中植物乳杆菌、发酵乳杆菌、罗伊氏乳杆菌、嗜酸乳杆菌、戊糖片球菌、粪肠球菌等都已被纳入饲料添加剂目录。部分乳酸菌在发酵过程中可以代谢乳糖产生乳酸以及其他有机酸,降低发酵产品pH值[1]。大量的有机酸不仅能够提高发酵饲料的风味,还直接参与机体的能量、结构代谢以及各种酶促反应。此外有机酸还可以抑制霉菌、大肠杆菌的生长以及毒素的产生;具有降低胃肠道的pH值,促进胃肠排空以及营养物质的吸收的作用[2]。
研究表明乳酸菌作为益生菌具有多种生理功能。在食品上应用可以改善食品风味延长保质期,在饲料中添加可以改善饲料品质,提高饲料抗菌性能。王雪洋等[3]研究发现,使用乳酸菌发酵豆渣可提高其乳酸含量及有氧稳定性。甜高粱青贮料中添加短乳杆菌、植物乳杆菌可以促进乳酸菌的增殖,降低青贮pH值,提高青贮饲料品质[4]。乳酸菌产生的有机酸主要包括乳酸、乙酸、草酸、柠檬酸、酒石酸等。乳酸是动物机体自身代谢产物,用于饲料中可直接参与机体新陈代谢,是三羧酸循环的燃料,同时还能够维持肠道菌群平衡,降低腹泻,促进钙磷的吸收[5]。乙酸可以促进肠粘膜紧密连接蛋白等相关蛋白的表达,降低肠道通透性,促进肠粘膜细胞增殖[6],也是一种很好的抑菌剂、酸味剂、酸度调节剂。酒石酸多存在于植物果实和叶子中,在葡萄酒的酿造中会产生大量酒石酸,具有抗氧化作用[7]。柠檬酸是饲料常用防腐剂,具有防霉抗氧化作用,还可以改善饲料风味、增加酸度、清除有害金属[8]。苹果酸是一款优良的稳定剂,具有较强的杀菌效果以及抗氧化作用,同时还能促进氨基酸的吸收。与柠檬酸相比具有高酸度、低热量、味道柔和的特点[9-10]。据报道,乳酸菌抑菌、促消化等功效与其产酸能力有极大相关性,因此对乳酸菌产酸能力的分析显得尤为重要。
本研究以6株乳酸菌为研究对象,对其发酵液及固态发酵豆粕产酸性能进行分析,揭示其在提高发酵饲料品质风味的潜在应用,为乳酸菌发酵饲料提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
发酵乳杆菌(Lactobacillus fermentium)BLCC2-0021、嗜酸乳杆菌(Lactobacillus acidophilus)BLCC2-0204、戊糖片球菌(Pediococcus pentosaceus)BLCC2-0026、0327、植物乳杆菌(Lactobacillus plantarum)BLCC2-0069、0410:宝来利来生物工程股份有限公司菌种保藏中心。
1.1.2 材料
国产大豆粕(初始水分10.25%),黄色、无霉变、无结块和异味,粉碎后过筛。
1.1.3 化学试剂
乙醇、甲醇(均为色谱纯):天津市永大化学试剂有限公司;磷酸二氢铵、磷酸(均为分析纯):天津市凯通化学试剂有限公司;草酸、苹果酸、酒石酸、乳酸、乙酸、柠檬酸、琥珀酸(均为色谱纯):上海源叶生物有限公司。
1.1.4 培养基
MRS液体培养基:葡萄糖20 g/L,蛋白胨10 g/L,牛肉膏8 g/L,酵母膏4 g/L,硫酸镁0.5 g/L,硫酸锰0.3 g/L,柠檬酸铵2 g/L,乙酸钠5 g/L,吐温-80 1 mL/L,pH值6.0,121 ℃灭菌20 min。固体培养基额外添加琼脂粉15 g/L。
1.2 仪器与设备
LC-20A高效液相色谱(high performance liquid chro matography,HPLC)仪、InertSustain AQ-C18(5 μm,4.6 mm×250 mm)色谱柱:日本岛津公司;AL204电子分析天平:瑞士梅特勒托利多有限公司;GL21M高速冷冻离心机:湖南凯达科学仪器有限公司;CLDC271509超纯水净化系统(超纯水仪):重庆潺林热能设备有限公司;PHS-3C雷磁精密酸碱度计:上海精密科学仪器有限公司;SB120D超声波清洗机:宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 有机酸标准曲线的建立
分别准确称取50 mg的草酸、苹果酸、酒石酸、乳酸、乙酸、柠檬酸、琥珀酸标准品,使用超纯水定容至50 mL,作为有机酸混合标准品工作液。经0.22 μm微孔滤膜过滤后,用流动相将混合标准品工作液逐级稀释得到质量浓度为0.5g/L、1.0 g/L、2.5 g/L、5.0 g/L、10.0 g/L的混合标准工作液,进行高效液相色谱检测。HPLC法测定有机酸条件:色谱柱InertSustain AQ-C18(5μm,4.6mm×250 mm),柱温箱28 ℃,进样量20μL,流速0.8 mL/min,流动相20 mmol/L磷酸盐溶液(pH值2.3),检测波长210 nm。
1.3.2 乳酸菌液态发酵[5]
将6株乳酸菌冻干粉分别接种于MRS固体斜面培养基上,37 ℃培养48 h。将培养好的斜面无菌接种至MRS液体培养基,100 mL盐水瓶装液量为95 mL,37 ℃培养24 h。取样检测乳酸菌活菌数、pH、总酸、有机酸。
1.3.3 乳酸菌固态发酵豆粕[5]
取6株乳酸菌冻干粉分别接种于MRS固体斜面培养基上,37 ℃培养48 h。将培养好的斜面无菌接种至MRS液体培养基,37 ℃培养24 h。按照2%的接种量分别发酵豆粕,1∶0.45(g∶mL)的料水比,装料量250 g/袋,压实。以不接种任何菌株的空白料为对照组,37 ℃发酵72 h。以上发酵试验均是生料发酵。取样检测发酵豆粕的pH、总酸、有机酸等。
1.3.4 理化指标和微生物指标的检测
pH检测:取混合均匀的发酵液10 mL直接采用玻璃电极pHS-3C型pH计测定。豆粕的检测则称取10.00 g,加90 mL蒸馏水,混合均匀后静置10 min后测定。
总酸:取混合均匀的发酵液10 mL(豆粕10.00 g),参照GB/T 12456—2021《食品安全国家标准食品中总酸的测定》进行测定。
酸溶蛋白:采用三氯乙酸(trichloroacetic acid,TCA)法测定。
粗蛋白的含量(以干物质计):按GB/T 6432—2018《饲料中粗蛋白的测定凯氏定氮法》测定。
粗灰分的含量(以干物质计):按照GB/T 6438—2007《饲料中粗灰分的测定》测定。
乳酸菌活菌数的检测:准确量取发酵液10 mL(发酵豆粕10.00 g)加入至90 mL无菌生理盐水中,参照GB 4789.35—2016《食品微生物学检验乳酸菌》检测乳酸菌活菌数。
1.3.5 有机酸检测
(1)发酵液有机酸检测:取混合均匀的发酵液1.5 mL,10 000 r/min离心5 min取上清,经0.22 μm滤膜两次过滤后作为待测样品。按照1.3.1中的色谱条件进行有机酸检测。
(2)固态发酵豆粕有机酸检测:准确称取3.000 g发酵料样品加入体积分数85%乙醇10 mL,将样品混合均匀后75 ℃水浴30 min,混匀后经4 000 r/min离心5 min,取上清至25 mL刻度试管,再加体积分数85%乙醇7 mL,混匀后经4 000 r/min离心5 min,再取上清至25 mL刻度试管,定容。取定容好的溶液10 mL至坩埚,蒸干,加2 mL超纯水溶解,回收液体,10 000 r/min,离心5 min取上清,经0.22 μm滤膜两次过滤后作为待测样品。按照1.3.1中色谱条件进行有机酸检测。
1.3.6 数据分析
试验数据用Excel 2019软件进行初步处理后,采用SPSS 13.0进行统计分析,采用One-way ANOVA进行方差分析,最小显著差异(leastsignificantdifference,LSD)法进行组间多重比较,结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 有机酸含量的测定
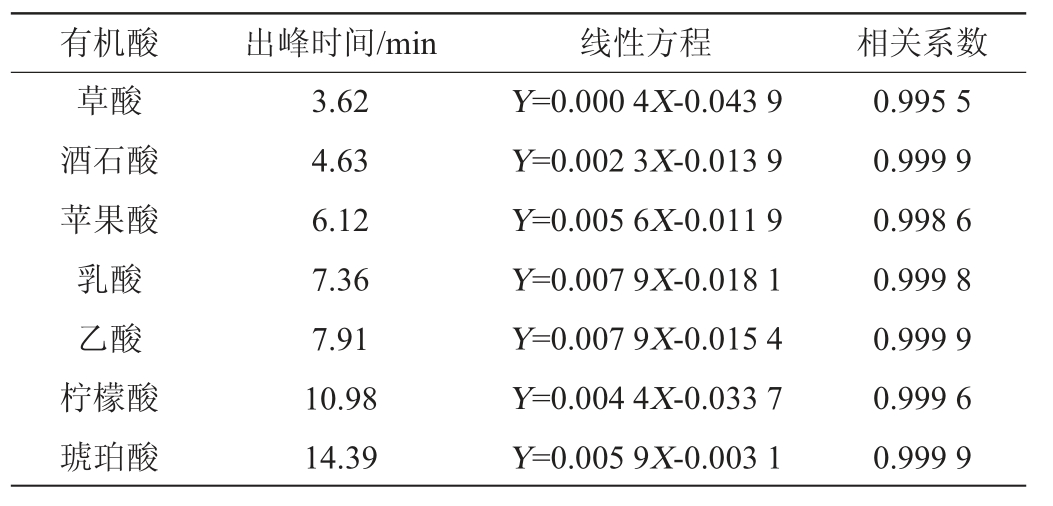
草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸7种有机酸的混标色谱图见图1。结果表明,7种有机酸分离效果较好,无拖尾现象。将混合标曲按照从低到高的顺序进样,以目标峰峰面积(Y)和对应有机酸质量浓度(X)进行线性分析,得到各有机酸标准曲线线性回归方程,结果见表1。由表1可知,7种目标峰峰面积与浓度线性关系良好,相关系数均>0.99,可用于后续发酵制品中有机酸的检测。
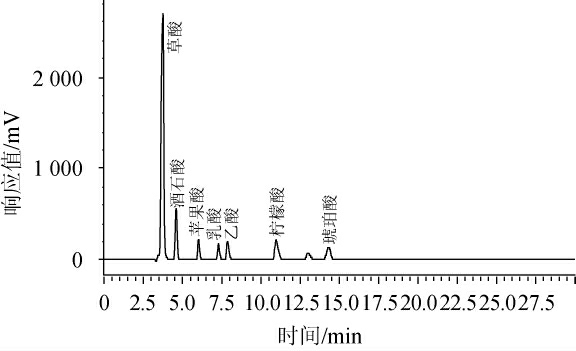
图1 7种有机酸混标HPLC色谱图
Fig.1 HPLC chromatograms of 7 kinds of organic acids mixed standards
表1 7种有机酸线性方程及相关系数
Table 1 Linear equations and correlation coefficients of 7 kinds of organic acids
2.2 不同乳酸菌活菌数及产酸性能分析
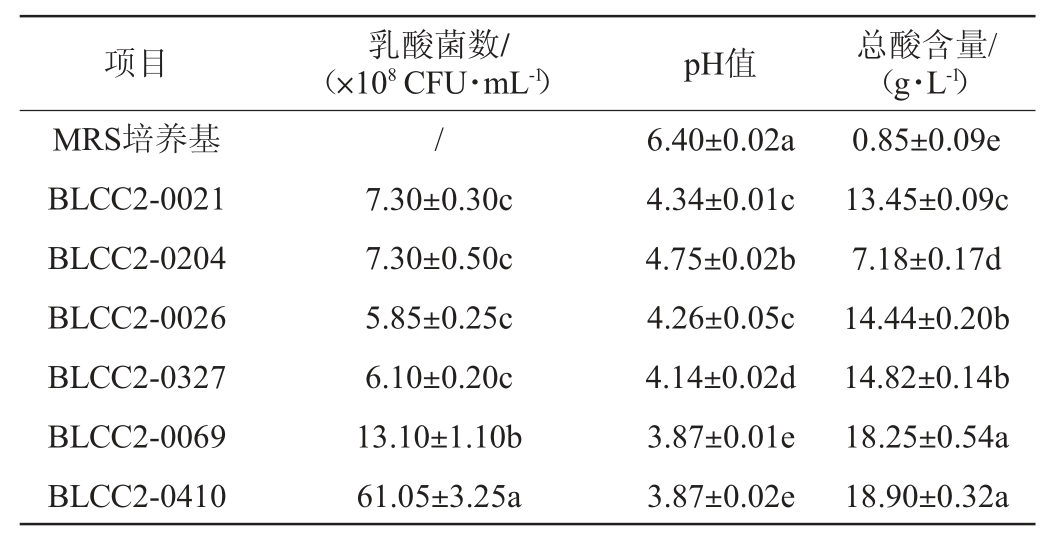
2.2.1 乳酸菌发酵液活菌数、pH及总酸含量
6株乳酸菌液体发酵24 h 后发酵液的乳酸菌数、pH值及总酸含量测定结果见表2。结果表明,6株菌经MRS培养基培养后活菌数均能达到108 CFU/mL。菌株BLCC2-0069、BLCC2-0410活菌数量显著高于其余4株菌(P<0.05),表明植物乳杆菌生长更迅速,戊糖片球菌菌株BLCC2-0026、BLCC2-0327生长较缓慢。检测6株菌发酵液的pH值及总酸含量发现,不同菌株产酸性能不同,菌株BLCC2-0069、BLCC2-0410总酸含量显著高于其余4种菌(P<0.05),pH值结果相类似,表明与发酵乳杆菌、嗜酸乳杆菌、戊糖片球菌相比,植物乳杆菌具有高的产酸性能。
表2 乳酸菌发酵液乳酸菌活菌数、pH值、总酸含量测定结果
Table 2 Determination results of the number of viable lactic acid bacteria,pH and total acid content of lactic acid bacteria fermentation broth
注:同列数据肩标不同小写字母表示差异显著(P<0.05),相同字母或无字母表示差异不显著(P>0.05)。下同。
2.2.2 乳酸菌发酵液有机酸含量分析
随后进一步对6株乳酸菌发酵液中有机酸进行分析,结果见表3。
由表3可知,不同菌株有机酸组成存在差异,发酵乳杆菌BLCC2-0021发酵液中乙酸产量为11.63 g/L,显著高于其余各菌株(P<0.05)。发酵乳杆菌属于异型乳酸菌,异型乳酸菌发酵可以产生乳酸、乙酸、CO2等,李凤姿等[11]也有相同发现,使用发酵乳杆菌、短乳杆菌发酵酸菜与同型乳酸菌发酵组相比乙酸含量明显提高。嗜酸乳杆菌BLCC2-0204发酵液苹果酸含量显著高于其余各菌株(P<0.05);乳酸菌BLCC2-0327发酵液柠檬酸产量高达2.55 g/L,显著高于其余各菌株(P<0.05),乳酸菌BLCC2-0026与BLCC2-0327产生的有机酸以乳酸为主,乳酸占总有机酸比例最高可达60%。
表3 乳酸菌发酵液有机酸含量测定结果
Table 3 Determination results of organic acid content in lactic acid bacteria fermentation broth g/L
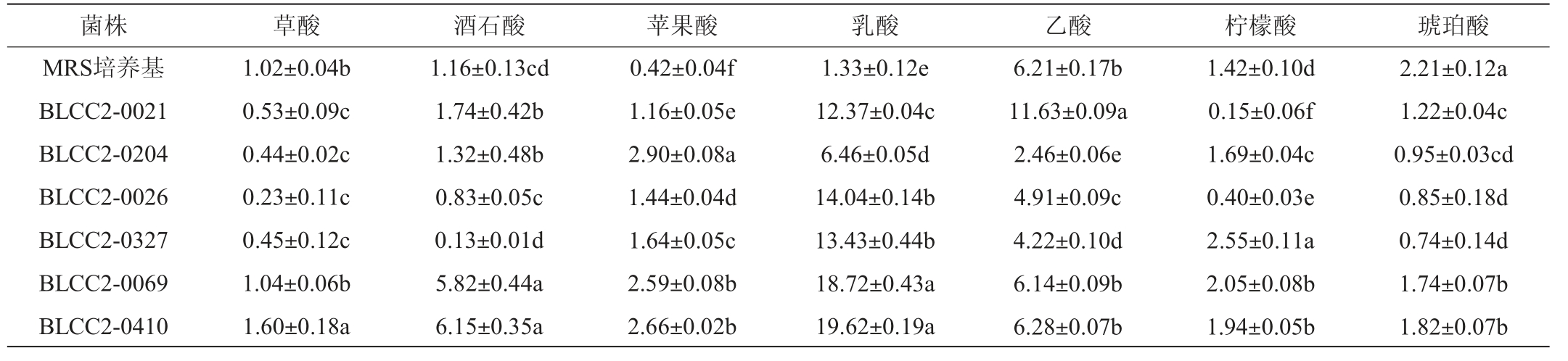
植物乳杆菌BLCC2-0410与BLCC2-0069发酵液中草酸、酒石酸、乳酸、琥珀酸产量均显著高于其余各菌株(P<0.05)。与董玲等[12]筛选到高产乳酸的乳杆菌使用MRS肉汤培养基发酵48 h乳酸含量可达17.45 g/L研究结果相似。植物乳杆菌产生大量乳酸可能与其能够合成大量β-半乳糖苷酶有关,乳糖通过乳酸菌产生的β-半乳糖苷酶分解成葡萄糖和半乳糖,半乳糖进一步代谢产生乳酸,其中前者为限速步骤[13]。酒石酸可以增加发酵料风味,本试验中不同乳酸菌发酵液酒石酸产量差异较大,植物乳杆菌产量显著高于其它菌株,可能是与菌株特性有关[14]。琥珀酸可以增加食品的鲜味[15],但经乳酸菌发酵后MRS培养基中的琥珀酸含量均显著降低,可能是培养基中的琥珀酸被乳酸菌利用[16]。
2.3 不同乳酸菌固态发酵豆粕性能分析
2.3.1 乳酸菌发酵豆粕产酸及理化指标分析
使用不同乳酸菌固态发酵豆粕,其乳酸菌数、pH值以及总酸含量等测定结果见表4。由表4可知,发酵豆粕72 h后乳酸菌活菌数均能达到109 CFU/g,显著高于空白未发酵组(P<0.05),表明乳酸菌可以很好地利用豆粕进行发酵;与发酵液活菌数结果相似,菌株BLCC2-0069、BLCC2-0410固体发酵豆粕活菌数量显著高于其余4株菌(P<0.05)。与未发酵组相比经乳酸菌发酵的豆粕pH值均显著降低(P<0.05),其中植物乳杆菌BLCC2-0410组下降幅度最大,下降33.89%。在产酸效果上,经乳酸菌发酵后的豆粕总酸含量均显著高于未发酵组(P<0.05),植物乳杆菌BLCC2-0410组产酸量最高,显著高于其他组(P<0.05)。此外,与未发酵组相比,乳酸菌发酵可以显著提高豆粕酸溶蛋白的含量(P<0.05),与乳酸菌代谢产生蛋白酶,降解大分子蛋白形成小肽有很大关系,但各种菌之间差异不大;发酵与否对豆粕粗蛋白、粗灰分影响不大(P>0.05)。
表4 不同菌株发酵豆粕乳酸菌活菌数、pH及营养成分测定结果
Table 4 Determination results of the number of viable bacteria,pH and nutritional compositions of fermented soybean meal with different strains
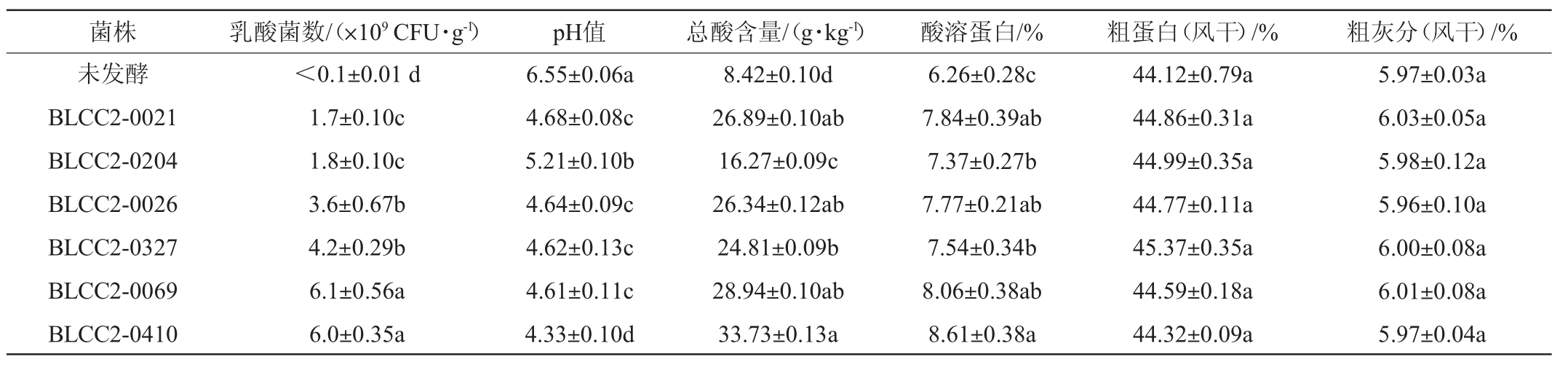
本研究发现经过乳酸菌发酵后的豆粕,富含丰富益生菌,有利于动物肠道健康;酸溶蛋白含量显著提高,更有利于豆粕的消化吸收。豆粕pH降低、豆粕总酸含量提高,增加了豆粕的适口性,李杰等[17-18]的研究也是相似结果。但各菌株之间发酵豆粕差异不是非常显著,随后又对发酵豆粕的有机酸组成进行了分析。
2.3.2 不同乳酸菌固态发酵豆粕产有机酸分析
发酵豆粕的核心是降解大分子的蛋白、消除抗营养因子等[19-21],但豆粕发酵提高有机酸的产量,增加饲料风味,同样受到广大研究者的关注[22-23]。不同乳酸菌发酵豆粕产有机酸的含量见表5。
由表5可知,不同乳酸菌固态发酵豆粕,其有机酸总含量均显著高于未发酵组(P<0.05),不同有机酸含量又各不相同。其中乳酸、乙酸比较一致,经乳酸菌发酵后豆粕中乳酸、乙酸的含量均显著高于未发酵组(P<0.05)。相反,草酸、酒石酸、苹果酸、柠檬酸、琥珀酸,发酵与否变化不一致,可能与豆粕本身会含有一定量草酸、酒石酸、苹果酸、柠檬酸、琥珀酸有关。乳酸菌在产生这些酸的同时,也会利用一部分,这与毛银等[24]的研究结果相似。
表5 不同菌株发酵豆粕有机酸含量测定结果
Table 5 Determination results of organic acid content in soybean meal fermented by different strain g/kg
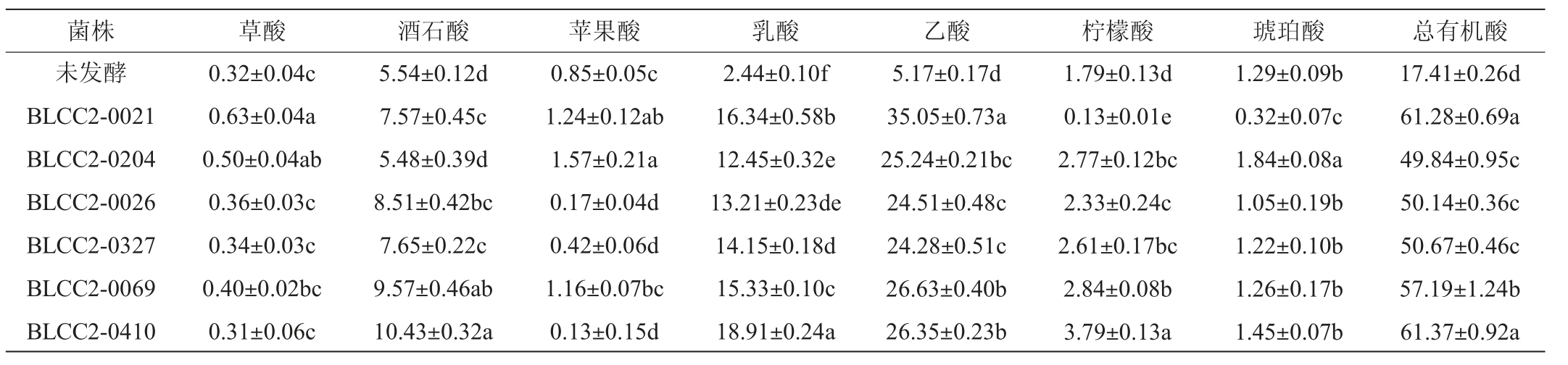
不同菌株固态发酵豆粕产生有机酸也存在差异。乳酸菌BLCC2-0021、BLCC2-0410产酸效果最佳,有机酸总含量分别可达61.28 g/kg、61.37 g/kg,与其他菌株相比差异显著(P<0.05);其次是乳酸菌BLCC2-0069,但与发酵液的产量结果稍有差异。乙酸、乳酸、酒石酸是发酵豆粕主要的三种有机酸,与发酵液中有机酸组成相似。植物乳杆菌BLCC2-0410固态发酵豆粕乳酸产量是18.91 g/kg,显著高于其他菌株发酵组(P<0.05),乳酸菌利用还原糖代谢产生大量乳酸,形成发酵豆粕主要风味。植物乳杆菌BLCC2-0410固体发酵豆粕还可以产生大量酒石酸、柠檬酸,产量分别为10.43 g/kg、3.79 g/kg;草酸、苹果酸、乙酸、琥珀酸含量优势不大,这与乳酸菌液态发酵结果也是相似的。以菌株BLCC2-0410为例的植物乳杆菌属于同型乳酸菌,同型菌发酵仅通过糖酵解途径产生乳酸;异型菌可以糖酵解途径产生乳酸,还可以磷酸戊糖酮解酶途径和磷酸己糖酮解酶途径产生乙醇和二氧化碳[25-27]。
本试验还发现,发酵豆粕乙酸的产量与乳酸菌的类型有关。菌株BLCC2-0021是发酵乳杆菌属于异型乳酸菌,固态发酵豆粕乙酸产量为35.05 g/kg,显著高于其他菌株发酵组(P<0.05)。微生物利用糖或淀粉等原料可以产生乙醇,进一步氧化可以产生大量乙酸,单纯的乙酸刺激性味道比较大,而发酵豆粕的芳香味道与其含大量乳酸、酒石酸等有关。李凤姿等[11]也有类似发现,使用不同乳酸杆菌对酸菜进行发酵,短乳杆菌和发酵乳杆菌接种处理的酸菜乙酸质量浓度最高;弯曲乳杆菌和植物乳杆菌接种处理酸菜发酵乳酸质量浓度最高。此外,菌株BLCC2-0021固体发酵豆粕草酸含量也显著高于其他菌株,但研究表明,草酸会降低钙、锌等矿物质元素的生物利用率,在体内与钙离子结合形成草酸钙,导致肾结石[16]。嗜酸乳杆菌BLCC2-0204固体发酵豆粕产酸效果最差,但其苹果酸、琥珀酸含量显著高于其他各菌株(P<0.05)。两株戊糖片球菌BLCC2-0026、0327产酸性能优势不显著。
2.4 讨论
研究发现6株乳酸菌产酸能力存在一定差异,相同条件下植物乳杆菌BLCC2-0410活菌数、总酸产量、有机酸含量均明显优于其他菌株,菌株性能优越产酸性能较好。随后又对乳酸菌固体发酵豆粕性能进行了研究。研究发现乳酸菌发酵豆粕可以显著提高豆粕酸溶蛋白、总酸含量,但对豆粕粗蛋白、粗灰分含量影响不大。酸溶蛋白含量的提高有利用豆粕的消化吸收,提高豆粕蛋白消化率。值得关注的是,不同乳酸菌发酵对豆粕酸溶蛋白、粗蛋白、粗灰分的影响差异均不显著,但在产酸性能上存在差异性。乳酸、酒石酸、苹果酸等有机酸可以使豆粕更具风味,提高动物采食量。植物乳杆菌BLCC2-0410发酵豆粕产酸性能较好。
3 结论
研究表明,6株乳酸菌液体发酵均能产生乳酸、乙酸等7种有机酸,其中乳酸菌BLCC2-0410、BLCC2-0069、BLCC2-0021产酸效果较好;使用6株乳酸菌发酵后的豆粕有机酸组成因菌株不同存在较大差异,主要含有乳酸、乙酸、酒石酸等。植物乳杆菌BLCC2-0410产酸量最高,同时还能产生大量乳酸、酒石酸、柠檬酸;发酵乳杆菌BLCC2-0021可以提高发酵豆粕乙酸含量,嗜酸乳杆菌BLCC2-0204可以提高发酵豆粕苹果酸、琥珀酸含量。综合分析产酸效果较好的是植物乳杆菌BLCC2-0410,发酵液乳酸含量高达19.62 g/L,发酵豆粕乳酸含量可达18.91 g/kg。
[1] 姚志芳,冯宇哲,王磊,等.酵母菌和乳酸菌在生物发酵饲料中的应用研究进展[J].饲料研究,2020,43(10):154-158.
[2] 李爱科,王薇薇,王永伟,等.生物饲料及其替代和减少抗生素使用技术研究进展[J].动物营养学报,2020,32(10):4793-4806.
[3] 王雪洋,韩淑敏,李雁冰,等.不同添加剂对豆渣型发酵饲料发酵品质及有氧稳定性的影响[J].中国饲料,2020(15):116-119.
[4] 付薇,陈伟,王小利,等.不同发酵乳酸菌剂及组合添加对甜高粱青贮营养价值、微生物数量及有氧稳定性的影响[J].动物营养学报,2021,33(11):6245-6256.
[5] 李慧芬,王文博,马成.一株乳酸片球菌的筛选、鉴定及其固态发酵饲料原料的产酸分析[J].中国饲料,2019(17):43-47.
[6] 薛永强,张辉华,王达,等.短链脂肪酸对肠道健康的调控机制及在动物生产中的应用[J].饲料工业,2020,41(19):18-22.
[7] 方冠宇,穆晓静,蒋予箭.浙江玫瑰醋发酵过程中细菌菌群结构变化与有机酸形成相关性分析[J].食品科学,2019,40(22):177-184.
[8] 宁亚维,苏丹,付浴男,等.抗菌肽brevilaterin与柠檬酸联用对大肠杆菌的协同抑菌机理[J].食品科学,2020,41(19):31-37.
[9] 周劝娥,杜小强,王玉.益生菌发酵对苹果汁主要营养成分及挥发性物质的影响[J].中国酿造,2021,40(9):37-42.
[10] 林杨,布丽根·加冷别克,孙建,等.乳酸菌的筛选及高产酸菌株的常压室温等离子体诱变选育[J].食品与发酵工业,2021,47(12):176-181.
[11] 李凤姿,张媛,王小垒,等.乳酸杆菌对东北酸菜发酵特性的影响解析[J].食品与生物技术学报,2020,39(5):104-111.
[12] 董玲,李露,郭云建,等.一株高产乳酸菌株的鉴定及其发酵特性研究[J].中国酿造,2021,40(2):128-132.
[13] 马春丽,张兰威.高产酸性能乳酸菌的筛选及产酸机理研究[J].食品工业科技,2010,31(1):189-193.
[14] 寇芳,李文杰,沈蒙,等.小米自然发酵菌株的鉴定及发酵菌株特性分析[J].中国生物制品学杂志,2017,30(9):931-935,942.
[15] 肖曼琳.米酒曲中乳酸菌的分离鉴定及米酒液态发酵工艺的研究[D].武汉:武汉轻工大学,2020.
[16] 罗松明.乳酸菌发酵对泡仔姜品质的影响[D].雅安:四川农业大学,2019.
[17] 李杰,张姣锦,杨红玲,等.3种益生菌发酵豆粕的营养品质研究[J].饲料研究,2021,44(22):56-59.
[18] 贾建英,段青平,贾朝阳,等.不同底物活化的乳酸菌对发酵豆粕中蛋白质、酸溶蛋白、pH值和菌落数的影响[J].畜禽业,2022,33(3):9-10.
[19] 辛娜,郭亮,邓露芳,等.固态发酵豆粕发酵工艺的优化[J].畜牧产业,2020(9):71-74.
[20] 郭萌萌,曹锡,张科,等.复合菌发酵豆粕的效果及代谢产物研究[J].动物营养学报,2022,34(1):659-670.
[21] 张梦媛.豆粕固态发酵及其蛋白乳化特性研究[D].武汉:湖北工业大学,2020.
[22] 张梦媛,张雨,丁常晟,等.总状毛霉与鲁氏酵母耦合发酵对豆粕营养和风味的增强效应[J].食品工业科技,2020,41(8):15-20.
[23] 刘星,赵荣,李波,等.几种不同菌种发酵豆粕发酵过程指标对比[J].饲料博览,2020(1):20-23.
[24] 毛银,邹宗胜,邓禹.1株植物乳杆菌发酵豆粕产有机酸的研究[J].食品与发酵工业,2017,43(10):43-48.
[25] 万学瑞,豆思远,李玉,等.复合乳酸菌对全株玉米青贮及有氧暴露后微生物及饲料品质的影响[J].草业学报,2020,29(11):83-90.
[26] 塔娜,魏日华,德庆哈拉,等.对禾草源同型发酵和/或异型发酵乳酸菌发酵无芒雀麦青贮有氧稳定性的评价[J].动物营养学报,2017,29(4):1301-1311.
[27] 樊振,马贵军,姚峻,等.不同发酵类型乳酸菌对玉米青贮发酵品质的影响[J].饲料研究,2014(1):43-45,70.