丹江镇位于贵州省黔东南苗族侗族自治州雷山县,年降雨量丰富,空气湿度大。日常食用“辣椒红酸汤”,可起到除湿祛寒、开胃等作用[1]。当地盛行传统手工制作辣椒红酸汤:挑选完好的当地红辣椒,去除头部,洗净,沥干水分;与事先洗好的姜一起剁碎,撒少许盐和酒,放入坛中腌制即可。坛内辣椒在腌制过程中,环境中的微生物附着生长,发酵成熟的辣椒呈现特殊的“酸”味,因此又称为“酸汤”。为与常见的凯里红酸汤(凯里地区的辣椒红酸汤主要原材料为辣椒和番茄)区别[2],这里称为辣椒酸或者辣椒红酸汤。目前,市场上流通的酸汤主要有两种类型:一种是工业化生产的酸汤成品;一种是民间传统手工制作而成的酸汤。酸汤成品会在出厂前进行灭菌(以增加其保质期),包装后进行销售;传统手工制作的酸汤经自然发酵完成后便可进入市场进行零售。传统手工制作的酸汤中蕴含着丰富的微生物(可称为活性酸汤),其在售卖和储藏期间基本处于开放环境中,品质易受环境影响、易产生腐败。目前研究主要集中于凯里酸汤的微生物菌群,对丹江辣椒红酸汤的研究较少,因丹江辣椒红酸汤与凯里酸汤原料的不同,受到了广泛的关注。
Illumina MiSeq高通量测序技术可对大量的脱氧核糖核酸(deoxyribonucleic acid,DNA)分子同时进行测序,利用基因序列分析特定微生物群体构成[3],广泛用于发酵食品中微生物多样性[4-6]、种类以及群落结构等研究[7]。有研究利用Illumina MiSeq高通量测序技术研究贵州酸汤中的微生物多样性,如王琪琪等[8]利用Illumina Miseq高通量测序技术研究发现,辣椒红酸汤中的优势细菌门为厚壁菌门(Firmicutes)、蓝藻细菌门(Cyanobacteria)和变形菌门(Proteobacteria),优势细菌属为乳酸杆菌属(Lactobacillus)、片球菌属(Pediococcus)和未分类属;李洁等[9]采用Illumina Miseq高通量测序技术研究发现,凯里辣椒红酸汤中的优势细菌门为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),优势细菌属为乳酸杆菌属(Lactobacillus);王若曦[10]采用Illumina Miseq高通量测序技术研究贵州各地区不同品种酸汤,发现其优势细菌门为厚壁菌门(Firmicutes),细菌属为乳酸杆菌属(Lactobacillus)。
食源性致病菌是一类以食品为传播媒介,引起食物中毒的一类致病性细菌[11]。蜡样芽孢杆菌(Bacillus cereus)[12]、阴沟肠杆菌(Enterobacter cloacae)[13]和大肠杆菌(Escherichia coli)[14]为常见的食源性致病菌,与人类健康及生命安全息息相关[15]。食品中致病菌存在着健康隐患,改善食品抗菌能力是延长食品保质期和提高食品安全的有效途径。有研究表明,发酵食品中分离的乳酸菌能够产生有机酸、细菌素等抑菌物质,能够杀灭脂环酸芽孢杆菌[16],对蜡样芽孢杆菌和大肠杆菌亦具有很好抑菌活性[17]。前期研究发现,酸汤中含有很多能产酸且具有抑制食源性致病菌的乳酸菌[10]。
由此,本研究从贵州省黔东南菌族侗族自治州雷山县丹江镇采集辣椒红酸汤样品,利用Illumina MiSeq高通量测序技术进行细菌多样性分析,结合微生物纯培养技术和双层平板法[18]从中分离优势乳酸菌,并筛选抗食源性致病菌乳酸菌,以期为提高人们对丹江镇辣椒红酸汤细菌多样性的认识以及促进乳酸菌在生物抑菌防腐方面的开发利用。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
从丹江镇雷山卫生局旁农贸市场、丹江镇西后街农贸市场、丹江镇羊场坝农贸市场以及丹江镇某农家共采集到辣椒红酸汤样品4份,分别编号为ST1、ST2、ST6和ST7。
1.1.2 菌种
食源性致病菌(蜡样芽孢杆菌(Bacillus cereus)ST2-1、阴沟肠杆菌(Enterobacter cloacae)ST2-6和大肠杆菌(Escherichia coli)ST1-0):从酸汤样品中分离,保存于本实验室。
1.1.3 试剂
乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、胰蛋白胨、琼脂糖:上海生工生物工程有限公司;Premix Ex TaqTM:日本TaKaRa公司;QIAquick gel Extraction Kit试剂盒:德国Qiangen公司;甘油:天津试剂三厂;酵母提取物:英国OXOID公司;溴甲酚紫、MgSO4·7H2O、K2HPO4、NaHCO3、葡萄糖:天津市风船化学试剂科技有限公司;CaCl2:天津市致远化学试剂有限公司;吐温80:上海源叶生物科技有限公司。本研究所用试剂均为分析纯或生化试剂。
1.1.4 培养基
葡萄糖产酸培养基:参考文献[10]配制;MRS液(固)体培养基:北京鼎国生物技术有限公司;LB培养基、脑心浸液(brain heart infusion,BHI)培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
GHP-9160恒温培养箱:上海一恒科学仪器有限公司;ABI 7200聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;罗氏GS-FLX测序仪:瑞士Roche公司;Labnet 230V EU涡旋仪:美国Labnet公司;SIGMA 3-18K高速离心机:德国Sigma公司;YP1002N电子天平:上海恒平科学仪器有限公司;GL-3250A磁力搅拌器:麒麟贝尔仪器制造有限公司;Ultrospec 2100 pro紫外分光光度计:安玛西亚(中国)有限公司。
1.3 实验方法
1.3.1 辣椒红酸汤样品微生物宏基因组DNA的提取
取少量红酸汤样品研磨,参考文献[19-20]提取细菌宏基因组DNA,置于-20 ℃冰箱中保存待用。
1.3.2 细菌16S rDNAV3-V4区基因PCR扩增和高通量测序
以提取的红酸汤基因组DNA为模板,使用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR扩增细菌16S rDNA V3-V4区域基因序列。PCR扩增体系:Premix Ex TaqTM聚合酶10 μL,模板基因组0.5 μL,引物338F和806R各1 μL,双蒸水(ddH2O)8 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火1 min,72 ℃延伸15 s,循环30次;72 ℃再延伸5 min。将PCR扩增产物稀释10倍,按原条件再进行5个循环,以减少非特异性扩增[21]。采用QIAquickgelExtraction Kit纯化回收PCR扩增产物,采用分光光度计定量后送上海生工生物工程有限公司进行Illumina Miseq测序[22]。
1.3.3 测序结果处理
根据引物中barcode序列将测序结果分配到相应样品中,去除barcode序列和引物序列,剩余序列使用mothur v1.43.1进行拼接,去除质量欠佳的序列,保留碱基长度>400bp的有效序列。运用classify.seqs命令进行分析,结合Silva的SSU rRNA序列数据库V138分类信息进行数据分析[23]。
1.3.4 α多样性指数分析
使用mothur 1.14.1软件对微生物α多样性指数进行分析。以0.03为cut off值,划分可操作分类单元(operational taxonomic unit,OTU)。计算Chao1指数、Shannon指数和Coverage值。
1.3.5 辣椒红酸汤样品中优势乳酸菌的分离与鉴定
参考文献[10]采用倍比稀释涂布法分离辣椒红酸汤中的乳酸菌。
以改良的十六烷基三乙基溴化铵(cetyl trimethyl ammonium bromide,CTAB)法提取分离菌株的基因组DNA[24-25]。以分离菌株的基因组DNA为模板,利用16S rRNA通用引物27F(5'-AGAGTATGATCATGGCTCAG-3')和1492R(5'-TACGGTTACCTTGTTACGACTT-3')进行PCR扩增。PCR扩增体系:Premix Ex TaqTM 25.0 μL,引物27F和1492R各1.0 μL,DNA模板2.0 μL,ddH2O 21.0 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃预变性30 s 60 ℃退火1 min,72 ℃延伸2 min 30 s,循环35次;72 ℃再延伸10 min。PCR扩增产物送上海生工生物工程有限公司进行序列测定,将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性搜索比对,当被检菌株的核苷酸序列与参考菌株的同源性>97%时,即将它们确定为同一个菌种[26]。
1.3.6 产酸及抗食源性致病菌乳酸菌的筛选
产酸乳酸菌的筛选:将分离鉴定的乳酸菌按照1×106CFU/mL的接种量接种至葡萄糖产酸培养基中,37 ℃静置培养,同时观察培养基颜色变化。当观察到培养基颜色由深变浅,最终变为黄色,且颜色不再变化时停止培养[10]。培养基中指示剂(溴甲酚紫)变黄表示产酸[27]。
抗食源性致病菌乳酸菌的筛选:将筛选的产酸菌株接种至MRS固体培养基中,利用双层平板法[18]考察产酸乳酸菌对蜡样芽孢杆菌ST2-1、阴沟肠杆菌ST2-6和大肠杆菌ST1-0的抑菌能力。
2 结果与分析
2.1 测序结果分析和α多样性分析
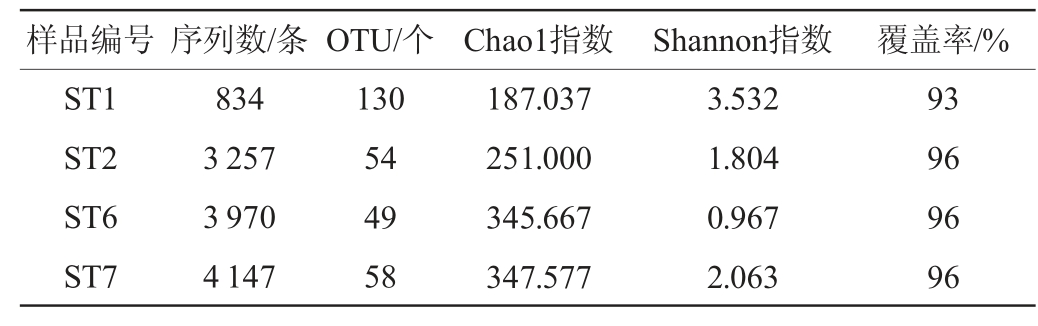
利用mothur v1.43.1软件对Illumina MiSeq高通量测序结果进行分析,结果见表1。由表1可知,通过Illumina MiSeq高通量测序从4个辣椒红酸汤样品中共得到12 208条有效序列,按照序列同源性的97%划分OTU,共得到291个OTU。样品的覆盖率(Coverage)均>93%,说明基于此次实验测序深度,尽管会忽略样品中含量较少的微生物,但在酸汤发酵过程中占优势的微生物均能得到分析。其中,样品ST1的Shannon指数最高,说明该样品具有最大的细菌菌群多样性;样品ST7的Chao1指数最高,说明该样品具有最大的细菌菌群物种丰度。
表1 不同辣椒红酸汤样品细菌菌群的α多样性分析结果
Table 1 Results of α diversity analysis of bacterial flora in different chili red sour soup samples
2.2 辣椒红酸汤样品细菌菌群结构分析
2.2.1 基于门水平细菌菌群结构分析
从门水平对辣椒红酸汤样品中的细菌菌群结构进行分析,结果见图1。由图1可知,4个辣椒红酸汤样品中共有的优势细菌门(相对含量>1%)为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),与王琪琪等[8]对辣椒红酸汤中微生物多样性分析的结果基本一致。此外,样品ST1中的优势细菌门还包括放线菌门(Actinomycetes)(3.24%)和类杆菌门(Bacteroides)(2.52%)。
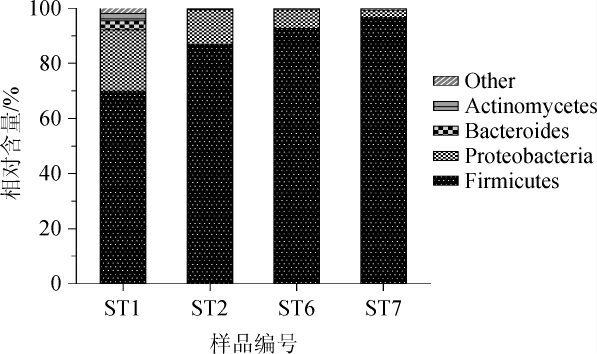
图1 基于门水平辣椒红酸汤样品中细菌菌群结构分析结果
Fig.1 Results of bacterial flora structure analysis in chili red sour soup samples based on phylum level
Other表示相对含量≤1%的其他门。
2.2.2 基于属水平细菌菌群结构分析
从属水平对辣椒红酸汤样品中的细菌菌群结构进行分析,结果见图2。由图2可知,样品ST1的优势细菌属(相对含量>1%)有13个,分别为芽孢杆菌属(Bacillus)、乳酸杆菌属(Lactobacillus)、不动杆菌属(Acinetobacter)、绿脓杆菌属(Aeribacillus)、葡萄球菌属(Staphylococcus)、依格纳季氏菌属(Ignatzschineria)、明串珠菌属(Leuconostoc)、嗜盐单胞菌属(Halomonas)、Anaeroslibacter、假单胞菌属(Pseudomonas)、根瘤菌属(Rhizobium)、中华芽孢杆菌属(Sinibacillus)和曲杆菌属(Curvibacter),相对含量分别为42.39%、14.44%、7.81%、6.62%、5.03%、3.58%、3.31%、1.46%、1.46%、1.32%、1.32%、1.19%和1.06%。样品ST2的优势细菌属有2个,分别为乳酸杆菌属(Lactobacillus)和弧菌属(Vibrio),相对含量分别为87.61%和7.45%。样品ST6的优势细菌属有4个,分别为乳酸杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)、Lelliottia和肠杆菌属(Enterobacter),相对含量分别为90.52%、1.74%、1.12%和1.08%。样品ST7的优势细菌属有2个,分别为乳酸杆菌属(Lactobacillus)和芽孢杆菌属(Bacillus),相对含量分别为90.54%和2.42%。在所有样品中,乳酸杆菌属(Lactobacillus)均为辣椒红酸汤样品中的优势细菌属。王琪琪等[8]对辣椒红酸汤样品中的优势细菌属进行分析,得到其优势细菌属为乳酸杆菌属(Lactobacillus)和片球菌属(Pediococcus);肖甜甜等[28]在白酸汤微生物多样性研究中发现,乳酸杆菌属(Lactobacillus)、醋酸杆菌属(Acetobacter)为其优势细菌属;李洁等[9]研究凯里地区辣椒红酸汤细菌菌群多样性发现其优势细菌属为乳杆菌属(Lactobacillus)。本研究与王琪琪等[8-9]研究的样品均以辣椒为主要原料发酵而成,且其主要优势菌属均为乳杆菌属(Lactobacillus)。肖甜甜等[28]研究的白酸汤以米汤为原料发酵而成,乳酸杆菌属(Lactobacillus)为其优势菌属之一。可见上述不同原材料发酵的红酸汤、白酸汤,乳酸杆菌属(Lactobacillus)均为优势细菌属。
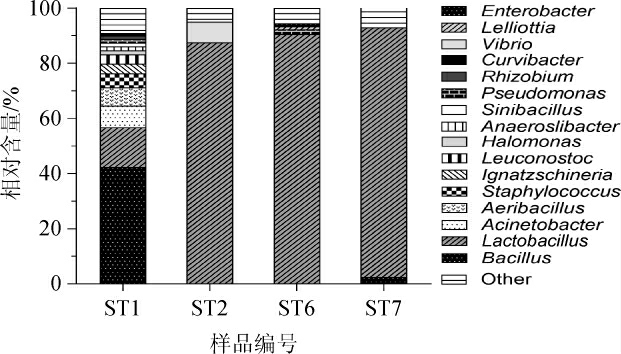
图2 基于属水平辣椒红酸汤样品中细菌菌群结构分析结果
Fig.2 Results of bacterial flora structure analysis in chili red sour soup samples based on genus level
Other表示相对含量≤1%的其他属。
2.3 辣椒红酸汤样品中优势乳酸菌的分离与鉴定结果
结合Illumina MiSeq高通量测序结果,利用MRS固体培养基对辣椒红酸汤样品中优势乳酸菌进行分离,结果从4个辣椒红酸汤样品中共分离到17株乳酸菌,通过分子生物学技术进行鉴定,结果见表2。由表2可知,经鉴定,11株干酪乳杆菌(Lactobacillus casei)、3株副干酪乳杆菌(Lac-tobacillus paracasei)、1株副干酪乳杆菌亚种(Lactobacillus paracasei subsp.)、1株乳酸杆菌(Lactobacillus sp.)和1株植物乳杆菌(Lactobacillus plantarum)。其中干酪乳杆菌(Lactobacillus casei)、副干酪乳杆菌(Lactobacillus paracasei)和副干酪乳杆菌亚种(Lactobacillus paracasei subsp.)共15株,占总分离菌株数的88.23%。干酪乳杆菌(Lactobacillus casei)和副干酪乳杆菌(Lactobacillus paracasei)广泛存在于发酵乳制品和泡菜等环境中[29],具有很好的益生作用[30-35],广泛应用于食品开发[36]。该研究从样品ST7筛选得到丰富的干酪乳杆菌(Lactobacillus casei),其对丹江镇辣椒红酸汤营养保健价值方面的作用值得进一步探索。
表2 辣椒红酸汤样品中乳酸菌的分离与鉴定结果
Table 2 Isolation and identification results of lactic acid bacteria in chili red sour soup

2.4 产酸乳酸菌的筛选及抗食源性致病菌能力的测定结果
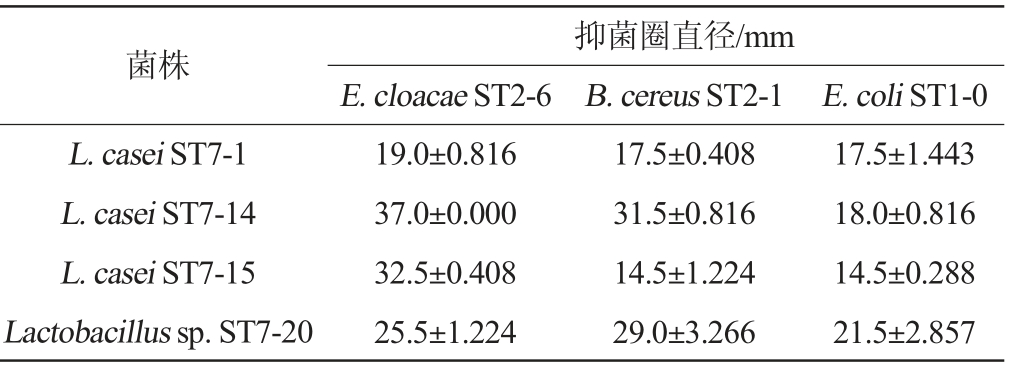
通过观察葡萄糖产酸培养基颜色的变化从17株乳酸菌株中筛选到4株颜色变化明显的乳酸菌,分别为干酪乳杆菌L.casei ST7-1、L.casei ST7-14、L.casei ST7-15和乳酸杆菌Lactobacillus sp.ST7-20。4株菌对食源性致病菌B.cereus ST2-1、E.cloacae ST2-6和E.coli ST1-0的抑菌能力见表3。由表3可知,4株产酸乳酸菌对B.cereus ST2-1、阴沟肠杆菌E.cloacae ST2-6和大肠杆菌E.coli ST1-0均具有抑制作用。其中干酪乳杆菌L.casei ST7-14对B.cereus ST2-1和E.cloacae ST2-6的抑菌效果最好,抑菌圈直径分别达到了31.5mm和37.0 mm。Lactobacillus sp.ST7-20对B.cereus ST2-1的抑菌效果最好,抑菌圈直径为29.0 mm。
表3 4株乳酸菌对食源性致病菌的抗菌活性
Table 3 Antibacterial activity of 4 strains of lactic acid bacteria against foodborne pathogens
发酵食品中分离的乳酸菌能够产生有机酸、细菌素等抑菌物质,能够杀灭脂环酸芽孢杆菌(Aliyclobacillus acidoterrestris)[16],对蜡样芽孢杆菌(Bacillus cereus)和大肠杆菌(Escherichia coli)亦具有很好抑菌活性[37]。干酪乳杆菌(Lactobacillus casei)能够有效抵抗食源性致病菌[38],调节肠道内平衡[39]。杨子燕等[40]从云南省各地区发酵样品中分离得到大量干酪乳杆菌,并从中筛选到4株能够抑制大肠杆菌、肠炎沙门氏菌(Salmonella enteritidis)等肠道致病菌菌株;CHEN H L等[41]研究发现,口服干酪乳杆菌可降低幽门螺杆菌(Helicobacter pylori)、大肠杆菌ATTC25922菌落数量,达到调节肠道菌群平衡作用;曾献春等[32]研究发现,干酪乳杆菌可提高便秘小鼠肠道中乳酸杆菌属丰度,降低条件致病菌普雷沃氏菌属(Prevotella)丰度,从而改善肠道菌群,达到缓解便秘的作用;迟珺曦等[42]研究发现,干酪乳杆菌可抑制念珠菌,用于生物治疗;在其进入肠道后可存活,从而调节肠内微生态平衡,抑制有害物质产生,显示了很好的益生特性。本研究中干酪乳杆菌的整体抑菌效果较好,为进一步开展抑菌特性研究奠定了基础。
3 结论
本研究采用Illumina MiSeq高通量测序技术对贵州丹江镇辣椒红酸汤样品中细菌群落多样性研究发现,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)为其优势细菌门;乳酸杆菌属(Lactobacillus)为其优势细菌属。采用微生物纯培养技术以及双层平板法从中分离得到17株乳酸菌,经分子生物学技术鉴定均为乳酸杆菌(Lactobacillus)。其中11株为干酪乳杆菌(Lactobacillus casei)、3株为副干酪乳杆菌(Lactobacillus paracasei)、1株副干酪乳杆菌亚种(Lactobacillus paracasei subsp.)、1株乳酸杆菌(Lactobacillus sp.)和1株植物乳杆菌(Lactobacillus plantarum)。干酪乳杆菌L.casei ST7-1、L.casei ST7-14、L.casei ST7-15和Lactobacillus sp.ST7-20具有较好的产酸和抗食源性致病菌性能,且L.caseiST7-14对B.cereusST2-1和E.cloacaeST2-6的抑菌效果最好,抑菌圈直径分别为37.0 mm、31.5 mm。后续将进一步开展抑菌特点和辣椒红酸汤纯菌种发酵研究,以期开发出具有优良抑菌特性的辣椒红酸汤产品;同时为丹江镇以及贵州省辣椒红酸汤推广做出贡献。
[1] 杨万虎,梁丽香.苗族与侗族饮食习惯比较研究[J].艺术科技,2017,30(1):23,121.
[2] 陈文莹,陈江碧,周吉发,等.四种调味蔬菜对红酸汤烹调中全反式番茄红素含量的影响[J].中国调味品,2020,45(1):67-71.
[3] SOON W W,HARIHRAN M,SNYDER M P.High-throughput sequencing for biology and medicine[J].Mol Syst Biol,2013,9(1):1-14.
[4] 夏梦雷,杨帆,陆锴,等.高通量测序技术在传统发酵食品微生物群落中的应用研究[J].中国酿造,2021,40(5):1-7.
[5] 布仁其其格,高雅罕,任秀娟,等.不同发酵时期酸马奶细菌群落结构[J].食品科学,2016,37(11):108-113.
[6] 赵馨馨,崔梦君,董蕴,等.应用Illumina MiSeq高通量测序技术分析巴东地区豆瓣酱中微生物多样性[J].现代食品科技,2019,35(9):297-303.
[7] CONG M Z,XIAO L Z,KE W,et al.Urban-rural construction land transition and its coupling relationship with population flow in China's urban agglomeration region[J].Cities,2020(2):101-110.
[8] 王琪琪,田界先,潘宗东,等.基于Illumina MiSeq分析贵州凯里酸汤独特风味的优势菌群[J].食品与发酵工业,2020,46(14):40-47.
[9] 李洁,崔霖芸,陈芳勇,等.凯里地区辣椒酸细菌群落多样性及其乳酸菌分离鉴定[J].中国酿造,2021,40(11):98-103.
[10] 王若曦.贵州省传统发酵酸汤中的微生物群落结构特征及功能微生物的发掘[D].昆明:昆明理工大学,2021.
[11] 康慎敏,武瑞赟,穆文强,等.乳酸菌拮抗食源性致病菌的研究及应用进展[J].食品科学,2022,43(1):250-259.
[12] 谭维维,安娜,孙华闽.2017—2020年南通市食源性致病菌监测结果分析[J].公共卫生与预防医学,2022,33(1):71-74.
[13] 赵伟,王扬眉,潘迎捷,等.人工模拟胃肠道模型在食源性致病菌异质性研究中的应用进展[J].食品科学,2021,42(23):268-274.
[14] 曹宁,申炳阳,喻梓瑄,等.用于3种食源性致病菌核酸提取的微流控芯片制备[J].食品与生物技术学报,2022,41(1):28-35.
[15] SCALLAN E,HOEKSTRA R M,MAHON B E,et al.An assessment of the human health impact of seven leading foodborne pathogens in the United States using disability adjusted life years[J]. Epidemiol Infect,2015,143(13):2795-2804.
[16] 徐志娇,韩晓江,宋子涵,等.一株植物乳杆菌对脂环酸芽孢杆菌的抑菌活性[J].西北农林科技大学学报(自然科学版),2019,47(6):124-131.
[17] 陈建东.云龙示范区商贸流通体系建设研究[J].科技和产业,2019,19(3):16-22.
[18] 王娜娜,于上富,杜金城,等.L.lactis KLDS4.0325细菌素理化性质的研究[J].现代食品科技,2016,32(12):133-138.
[19] GOEBEL B M,STACKEBRANDT E.Cultural and phylogenetic analysis of mixed microbial populations found in natural and commercial bioleaching environments[J]. Appl Environ Microbiol,1994,60(5): 1614-1621.
[20] 李晓然,刘晓峰,张海燕,等.利用高通量测序分析云南两个地区豆豉微生物群落的多样性[J].现代食品科技,2014,30(12):61-67.
[21] THOMPSON J R,MARCELINO L A,POLZ M F.Heteroduplexes in mixed-template amplifications:formation,consequence and elimination by'reconditioning PCR'[J].Nucleic Acids Res,2002,30(9):2083-2088.
[22] 尚云,柳陈坚,刘祥祥,等.基于高通量测序分析结肠息肉患者肠道细菌群落结构[J].昆明理工大学学报(自然科学版),2018,43(2):71-78.
[23] SCHLOSS P D,WESTCOTT S L,RYABIN T,et al.Introducing mothur:Open-source,platform-independent,community-supported software for describing and comparing microbial communities[J]. Appl Environ Microbiol,2009,75(23):7537-7541.
[24] 龚福明.云南传统发酵豆豉中乳酸菌多样性及高产γ-氨基丁酸乳酸菌研究[D].昆明:昆明理工大学,2010.
[25] YOSHITERU K,HIROSHI M,MAKOTO C,et al.Extraction and detection of endogenous soybean DNA from fermented foods[J]. Food Control,2005,17(10):808-813.
[26] SAMIDURAI K,SARAVANAKUMAR A,KATHIRESAN K.Spatial and temporal distribution of macrobenthos in different mangrove ecosystems of Tamil Nadu Coast,India[J].Environ Monit Assess,2012,184(7):4079-4096.
[27] 李俊霞.产细菌素乳酸菌的筛选、鉴定及培养基的优化[D].郑州:河南工业大学,2010.
[28] 肖甜甜,冯子娟,邱树毅,等.苗家白酸汤中微生物群落多样性研究及其优势微生物的筛选[J].食品与发酵科技,2021,57(1):1-11.
[29] 耿文超,关今韬,程申,等.副干酪乳杆菌的功能特性及其应用研究进展[J].生物加工过程,2018,16(4):1-7.
[30] 余萍,曹蓝,矫艳平,等.副干酪乳杆菌HCS17-040的筛选鉴定及其益生特性[J].食品与机械,2021,37(11):28-33.
[31] 陈善斌,邢寒竹,王然,等.副干酪乳杆菌L9缓解抑郁大鼠腹泻的作用机制[J].中国食品学报,2021,21(12):98-105.
[32] 曾献春,朱雅琴,王明明,等.干酪乳杆菌对便秘小鼠肠道菌群的影响[J].食品与发酵工业,2021,48(6):67-70.
[33] 徐小轻.食源性干酪乳杆菌NA-2抑菌特性及其胞外多糖功效研究[D].北京:中国农业科学院,2021.
[34] BENDALI F,MADI N,SADOUN D.BENEFICIAL effects of a strain of Lactobacillus paracasei subsp.paracasei in Staphylococcus aureus-induced intestinal and colonic injury[J]. Int J Infect Dis,2011,15(11):e787-e794.
[35] ZHANG H,WANG Y,SUN J,et al.Safety evaluation of Lactobacillus paracasei subsp.paracasei LC-01,a probiotic bacterium[J].J Microbiol,2013,51(5):633-638.
[36] 刘凯龙,康小红,张哲,等.副干酪乳杆菌PC-01益生特性和安全性研究[J].中国食品学报,2021,21(11):47-52.
[37] 吕蕾,杨晓萍,王阿利,等.酱油渣中具有抑菌活性的乳酸菌的筛选及其抑菌特性[J].食品工业科技,2022,43(18):137-144.
[38] 马佳歌,于微,李佳君,等.干酪乳杆菌细菌素的抗菌机制分析[J].食品科学,2018,39(10):193-198.
[39] 陆文伟,胡文兵,曹文金,等.干酪乳杆菌LC01对小鼠肠道菌群和肠道转运调节作用的剂量效应[J].食品科学,2019,40(15):211-217.
[40] 杨子燕,赵世伟,马万平,等.干酪乳杆菌的筛选及其在活性乳酸菌饮料中的应用[J].食品工业科技,2018,39(3):106-111.
[41] CHEN H L,LAI Y W,CHEN C S,et al.Probiotic Lactobacillus casei expressing human lactoferrin elevates antibacterial activity in the gastrointestinal tract[J].Biometals,2010,23(3):543-554.
[42] 迟珺曦,刘孝芳,雷文平,等.干酪乳杆菌的益生特性及在食品中应用研究进展[J].农产品加工,2020(18):70-74.