四甲基吡嗪(tetramethylpyrazine,TTMP)又名川芎嗪,是酱香型白酒中重要的香气成分,具有发酵、烘烤、可可等气味[1-3],其作为川穹的有效药用成分,在治愈呼吸系统疾病、缺血性血管疾病、肾小球疾病等临床疾病上有显著的效果,同时作为香料广泛应用于食品调香中[4-9]。目前,四甲基吡嗪的合成方法有直接提取法、化学合成法和微生物发酵法[10]。与其他方法相比,微生物发酵法产生四甲基吡嗪具有原料广泛、反应条件温和、对环境污染小等优点。虽然价格昂贵,但消费者更倾向于这种天然的四甲基吡嗪[11]。
微生物以淀粉质原料为底物生成乙偶姻,在发酵过程中蛋白质被分解成氨基酸,氨基酸在谷氨酸脱氢酶作用下生成氨,乙偶姻和氨在高温条件下生成四甲基吡嗪[12-14]。目前,产生四甲基吡嗪的菌种有芽孢杆菌(Bacillus)[15]、谷氨酸棒状杆菌(Corynebacterium glutamicum)[16]和醋酸杆菌(Acetobacter aceti)[17]等。其中,以芽孢杆菌液态发酵相关研究最多,但微生物发酵法产四甲基吡嗪存在产量低的问题。有研究表明,通过诱变处理[18]、基因工程手段[19]及发酵过程优化[20]的方式均能进一步提高四甲基吡嗪的产量,但是作为应用于食品的风味物质,通过基因工程的方式获得高产四甲基吡嗪菌的应用还存在争议。因此,筛选高产四甲基吡嗪的天然菌株具有重要的意义。
有研究表明,芽孢杆菌为产四甲基吡嗪的主要菌株,且在高温大曲中含有大量的芽孢杆菌属微生物[21]。基于此,本研究以高温大曲为材料,采用传统培养分离及高效液相色谱(high performance liquid chromatography,HPLC)法分离筛选高产四甲基吡嗪的芽孢杆菌菌株,通过分子生物学技术对其进行菌种鉴定,并通过单因素试验和响应面试验对其产四甲基吡嗪的发酵工艺进行优化,以期为进一步提高四甲基吡嗪的生产提供菌种来源,并为其应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲:2019年7月采集自内蒙古某浓香型白酒企业,分别取五块大曲粉碎后混匀作为实验样品,室温保存。
1.1.2 试剂
葡萄糖、磷酸氢二铵、氯化钠(均为分析纯):天津市智远化学试剂有限公司;胰蛋白胨、酵母提取粉、琼脂(均为生化试剂):广东桓凯微生物科技有限公司;甲醇、三氟乙酸(均为色谱纯):天津市广大化学试剂有限公司;四甲基吡嗪(色谱纯)、乙偶姻(分析纯):阿拉丁试剂(上海)有限公司;细菌基因组提取试剂盒:天根生化科技(北京)有限公司。
1.1.3 培养基
LB固态培养基[22]:NaCL 10.0 g/L、胰蛋白胨10.0 g/L、酵母提取粉5.0 g/L,琼脂20 g/L,pH 7.0,121 ℃高压蒸汽灭菌20 min。
发酵培养基[23]:胰蛋白胨30.0 g/L、磷酸氢二铵30.0 g/L、酵母提取粉10.0 g/L、葡萄糖50.0 g/L,pH 7.0,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
HCB-1300V洁净工作台、THZ-98C恒温振荡器、DHG-9053A电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;SX-500全自动高压灭菌锅:上海新普仪器设备有限公司;GM-2真空抽滤系统:天津津腾实验设备有限公司;3-18KS高速离心机:上海成贯仪器有限公司;U3000高效液相色谱仪、Veriti96聚合酶链式反应(polymerase chain reaction,PCR)仪:上海赛默飞世尔科技有限公司。
1.3 方法
1.3.1 芽孢杆菌菌株的分离及纯化
称研磨后的高温大曲10.0 g,加90 mL无菌生理盐水于三角瓶中,在37 ℃、180 r/min条件下振荡培养1 h,于80 ℃条件下水浴30 min[21]。将菌悬液稀释后涂布于LB固体培养基上,37 ℃条件下培养24 h。挑取单菌落接种于LB固体培养基上进行纯化,将纯化后的菌株4 ℃保存备用。
1.3.2 产四甲基吡嗪菌株的筛选
挑取分离得到的单菌落接种于装有50 mL发酵培养基的250 mL三角瓶中,在37 ℃、180 r/min条件下振荡培养72 h。发酵结束后将发酵液用体积分数70%的甲醇稀释并提取,10 000 r/min离心10 min,上清液过0.22 μm有机滤膜后,采用HPLC法对上清液中四甲基吡嗪含量进行检测。
1.3.3 分析检测
四甲基吡嗪含量的测定:采用高效液相色谱法[24]。
残糖含量的测定:采用3,5-二硝基水杨酸比色法[8]。
乙偶姻含量的测定:采用高效液相色谱法[25]。
OD600nm值的测定:以蒸馏水为空白对照,在波长600 nm处测定发酵液的吸光度值,用OD600nm值表示菌体量。
1.3.4 产四甲基吡嗪菌株的分子生物学鉴定
利用细菌基因组提取试剂盒提取产TTMP菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用细菌通用引物1492R(5'-TACGGCTACCTTGTTACGACTT-3')和27F(5'-AGAGTTTGATCCTGGCTCAG-3')对菌株的16S rDNA基因序列进行PCR扩增。PCR扩增体系(25 μL):引物1492R和27F各1.0 μL,Mix 12.5 μL,DNA模板1.0 μL,双蒸水(ddH2O)9.5 μL。PCR扩增程序:94 ℃预变性10 min;95 ℃变性30 s,55 ℃退火50 s,72 ℃延伸1.5 min,共30个循环;72 ℃再延伸10 min。PCR扩增结束后,取1 μLPCR扩增产物,采用1%琼脂糖凝胶电泳检测,检测合格后委托测序生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)对测序结果进行同源检索,选取同源性高的模式菌株的16S rDNA基因序列,采用MEGA10.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树,对菌株进行菌种鉴定。
1.3.5 菌株产四甲基吡嗪发酵工艺优化
(1)单因素试验
固定初始发酵条件为初始pH值7.0、接种量5%、发酵温度37 ℃、装液量20%、转速180 r/min、无铵盐添加、发酵时间10 d。结合文献[26-28],采用单因素轮换法依次考察初始pH值(6.0、6.5、7.0、7.5、8.0)、发酵温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃)和铵盐(磷酸氢二铵)添加量(20 g/L、30 g/L、40 g/L、50 g/L、60 g/L,在发酵第6天时添加)对四甲基吡嗪、乙偶姻、残糖含量及OD600nm值的影响。
(2)响应面试验
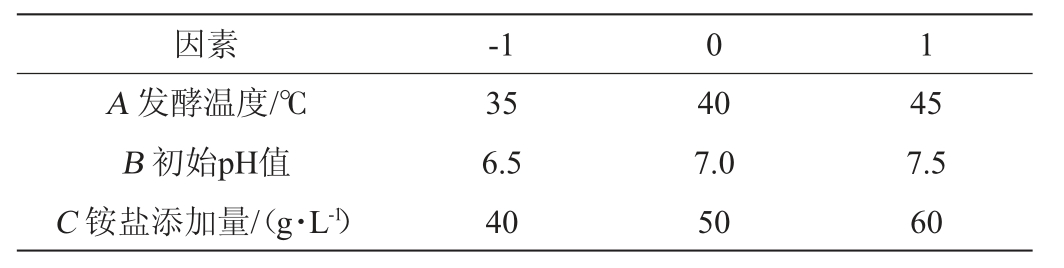
在单因素试验结果基础上,以发酵温度(A)、初始pH值(B)、铵盐添加量(C)为自变量,四甲基吡嗪含量(Y)为响应值,采用Box-Behnken 试验设计,响应面试验因素及水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design
1.3.6 数据处理
实验数据利用Microsoft office Excel 2016进行统计分析,利用Origin 2018进行绘图。
2 结果与分析
2.1 产四甲基吡嗪菌株的分离及筛选
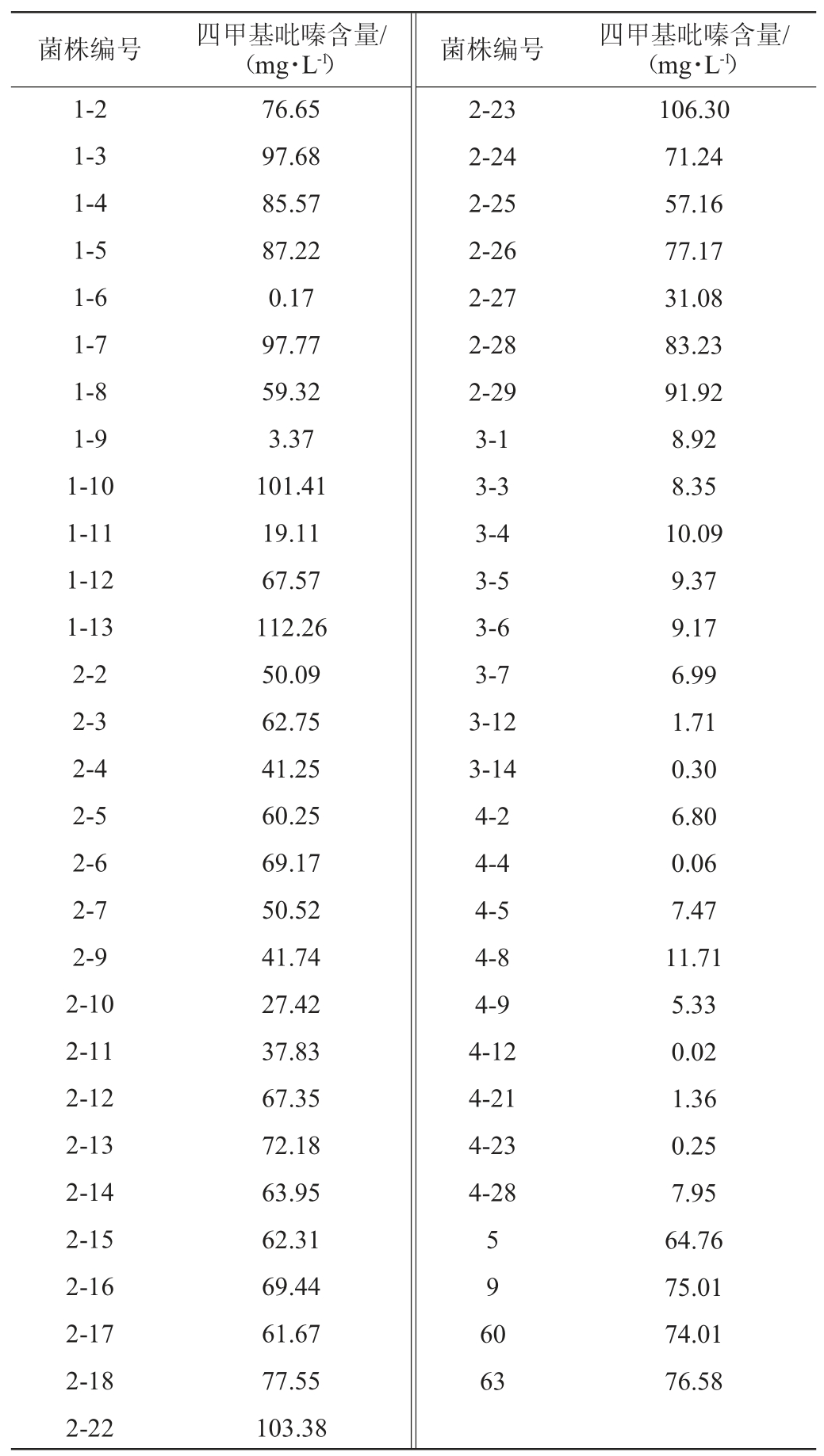
从高温大曲中共分离获得103株疑似芽孢杆菌,利用HPLC法测定各菌株发酵上清液中的四甲基吡嗪含量,结果发现其中59株菌可以以葡萄糖为底物发酵产四甲基吡嗪,结果见表2。由表2可知,菌株1-13的四甲基吡嗪含量最高,为112.26 mg/L,因此确定其为后续的试验菌株。
表2 筛选菌株发酵液中四甲基吡嗪含量的检测结果
Table 2 Determination results of tetramethylpyrazine contents in fermentation broth of screening strains
2.2 菌株1-13的分子生物学鉴定
基于16S rDNA基因序列,构建菌株1-13的系统发育树,结果见图1。由图1可知,菌株1-13与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)聚于一支,亲缘关系最近。因此,将菌株1-13鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens)。

图1 基于16S rDNA基因序列菌株1-13的系统发育树
Fig.1 Phylogenetic tree of strain 1-13 based on 16S rDNA gene sequences
2.3 菌株1-13产四甲基吡嗪发酵条件优化单因素试验
2.3.1 初始pH值对菌株1-13产四甲基吡嗪的影响
pH在发酵过程中影响着微生物的生长及四甲基吡嗪的含量,初始pH值对菌株1-13产四甲基吡嗪的影响见图2。由图2可知,随着初始pH值的升高,四甲基吡嗪及乙偶姻产量整体呈先升高后下降的趋势,当初始pH值为7.0时,四甲基吡嗪及乙偶姻产量均达到最高,分别为125.48 mg/L、854.12 mg/L。菌株1-13的OD600nm值受初始pH值的影响较小。当初始pH值为8.0时,发酵液中的残糖含量较高,这可能是因为较为极端的pH影响菌株1-13糖代谢所致。结果表明,中性条件下,乙偶姻与铵离子反应生成四甲基吡嗪的转化率和产量最高。ZHU B等[26]研究发现,当pH值为5.5时枯草芽孢杆菌(Bacillus subtilis)发酵获得最大乙偶姻积累量,再调节pH值至7.0时,实现了乙偶姻向四甲基吡嗪的含量的转化,与本研究结果略有不同,分析原因可能是不同微生物代谢产生四甲基吡嗪的最适生长pH不同。因此,确定最优初始pH值为7.0。
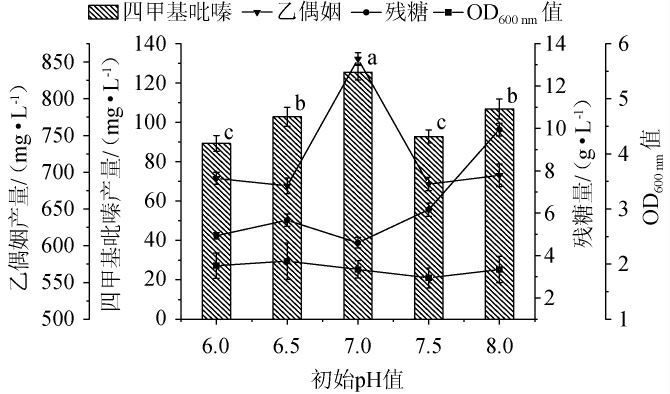
图2 初始pH值对菌株1-13发酵产四甲基吡嗪的影响
Fig.2 Effect of initial pH on tetramethylpyrazines produced by strain 1-13 fermentation
不同小写字母表示四甲基吡嗪产量差异显著(P<0.05)。下同。
2.3.2 发酵温度对菌株1-13产四甲基吡嗪的影响
发酵温度对菌株1-13产四甲基吡嗪的影响见图3。由图3可知,四甲基吡嗪及乙偶姻产量均随着发酵温度的升高呈先升高后下降的趋势,OD600nm值呈下降的趋势,残糖量呈先升高后下降而后上升的趋势。当发酵温度为40 ℃时,四甲基吡嗪及乙偶姻含量均达到最大值,分别为132.06 mg/L、794.12 mg/L,OD600nm值为1.74,残糖量为7.63 g/L。有研究表明,从乙偶姻到四甲基吡嗪的反应是自发的非酶催化反应,高温有利于乙偶姻和氨生成四甲基吡嗪。因此,利用温度二阶段调控能够有效提高四甲基吡嗪的产量[27]。综上,确定最优的发酵温度为40 ℃。
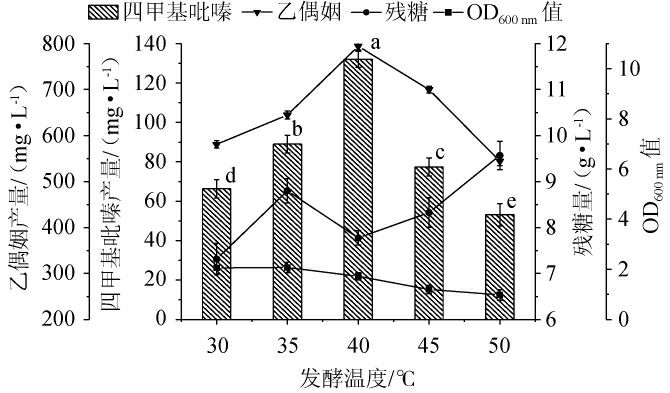
图3 发酵温度对菌株1-13发酵产四甲基吡嗪的影响
Fig.3 Effect of fermentation temperature on tetramethylpyrazines produced by strain 1-13 fermentation
2.3.3 铵盐添加量对菌株1-13产四甲基吡嗪的影响
研究表明添加铵盐对四甲基吡嗪生成速率和产量有重要影响[27]。经预试验发现菌株1-13在发酵第6天时乙偶姻的含量最高,因此,选择在发酵第6天时添加铵盐。铵盐添加量对菌株1-13产四甲基吡嗪的影响见图4。
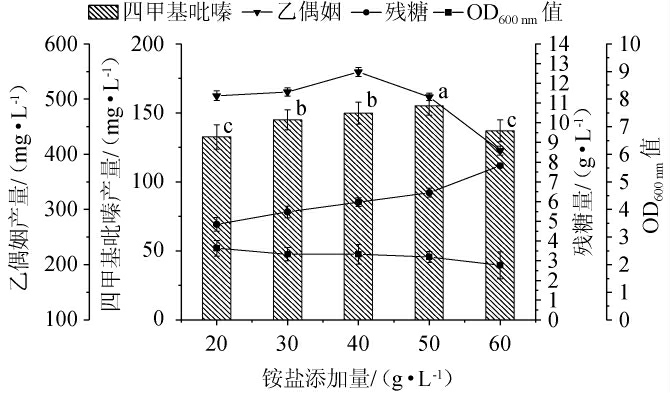
图4 铵盐对菌株1-13发酵产四甲基吡嗪的影响
Fig.4 Effect of ammonium salt on tetramethylpyrazines produced by strain 1-13 fermentation
由图4可知,随着铵盐添加量的增加,四甲基吡嗪及乙偶姻产量均呈先增加后减少的趋势。当铵盐添加量为50.0g/L时,四甲基吡嗪含量达到最大值为155.08 mg/L。当铵盐添加量为40g/L时,乙偶姻含量达到最大值为548.92 mg/L。分析原因可能是,当铵盐添加量为20~40 g/L时,磷酸氢二铵作为缓冲溶液,使得发酵液的pH值趋于稳定,负责合成乙偶姻的乙酰乳酸合成酶被激活,乙偶姻的含量增加。当铵盐添加量>50.0 g/L之后,四甲基吡嗪产量不再增加,这是因为前体物质乙偶姻含量不足以支持四甲基吡嗪合成。OD600nm值随着铵盐添加量的增加而减少,残糖量随着铵盐添加量的增加而增加,原因可能是高浓度的铵盐抑制了细胞的生长代谢[28]。综上,确定最优的铵盐添加量为50 g/L。
2.4 菌株1-13产四甲基吡嗪发酵工艺优化响应面试验
2.4.1 响应面试验设计及结果
在单因素试验结果基础上,以影响菌株1-13发酵产四甲基吡嗪含量最主要的三个因素发酵温度(A)、初始pH值(B)、铵盐添加量(C)为响应变量,四甲基吡嗪含量(Y)为响应值,采用Box-Behnken设计进行响应面试验,试验设计及结果见表3,方差分析结果见表4。
表3 Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken experiments
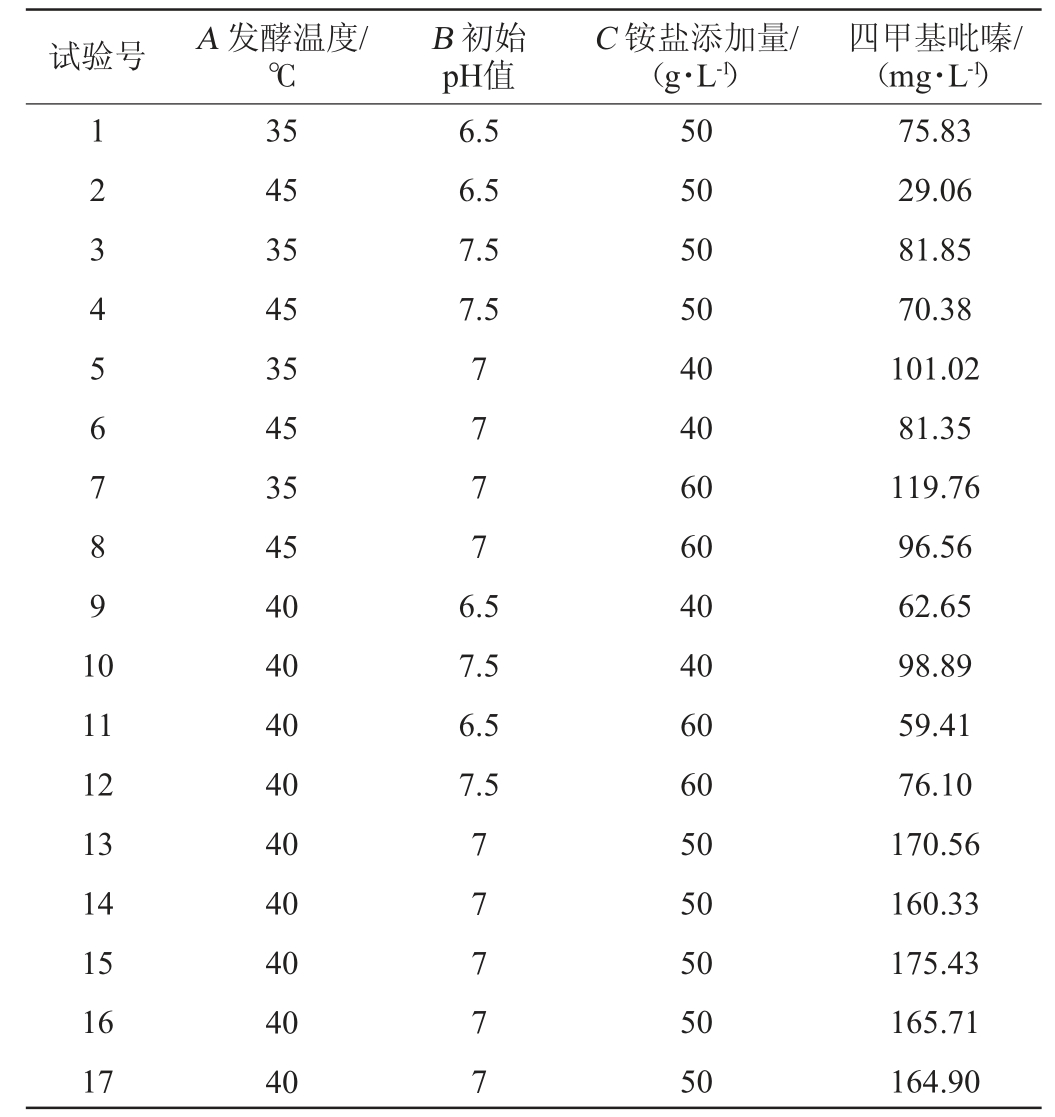
表4 回归模型的方差分析结果
Table 4 Results of variance analysis of the regression model
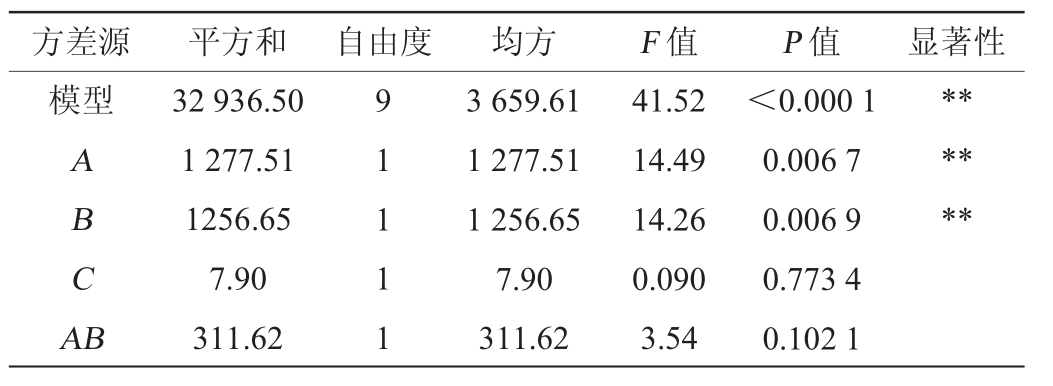
续表
注:“**”表示对结果影响极显著(P<0.01)。
采用Design-ExpertV8.0.6软件对表3试验结果进行多元回归拟合分析,得到四甲基吡嗪含量对各因素的二次回归方程:Y=167.39-12.64A+12.53B+0.99C+8.83AB-0.89AC-4.89BC-38.85A2-64.26B2-28.87C2。
由表4可知,该模型的P<0.01,极显著,失拟项P=0.081 2>0.05,不显著,表明模型可较好地拟合试验情况。决定系数R2=0.981 6,拟合性良好,说明98.16%的四甲基吡嗪产量变化可以用此回归模型解释,可较好反映出四甲基吡嗪与发酵温度、初始pH值、铵盐添加量之间的关系。调整决定系数R2Adj=0.958 0,说明四甲基吡嗪产量有95.80%受试验因素影响。综上所述,以四甲基吡嗪为响应值建立的四甲基吡嗪最佳发酵工艺模型,可对四甲基吡嗪产量进行分析和预测。由表中P值可知,初始pH值和发酵温度对四甲基吡嗪产量的影响极显著(P<0.01),铵盐添加量对四甲基吡嗪产量的影响不显著(P>0.05),二次项对结果影响极显著(P<0.01),交互项对结果影响不显著(P>0.05);由F值可知,各因素对四甲基吡嗪产量的影响程度为A>B>C,即发酵温度>初始pH值>铵盐添加量。
2.4.2 响应面交互效应分析
根据回归方程绘制响应面和等高线,发酵温度、初始pH值、铵盐添加量的两两交互作用对四甲基吡嗪产量的影响见图5。

图5 各因素间交互作用对菌株1-13产四甲基吡嗪影响的响应面及等高线
Fig.5 Response surface plots and contour lines of interaction between each factor on tetramethylpyrazine production by strain 1-13 fermentation
由图5可知,响应面开口向下,等高线为椭圆形,表明各因素间有交互作用,但交互作用不显著,与方差分析结果一致。
2.4.3 响应面验证试验
根据试验结果和模型分析,得到菌株1-13发酵产四甲基吡嗪的最佳工艺参数为:发酵温度39.23 ℃、初始pH值7.04、铵盐添加量50.12 g/L(发酵第6天时添加)。在此条件下四甲基吡嗪产量预测值为168.90 mg/L。为了便于实际操作,将发酵条件调整为发酵温度39.0 ℃、初始pH值7.0、铵盐添加量50.0 g/L(发酵第6天时添加),在此条件下发酵10 d,四甲基吡嗪产量实际值为(166.19±2.79)mg/L,与理论值偏差为1.60%,说明此模型能够用于本研究中,四甲基吡嗪产量比优化前提高48%。
3 结论
本研究以高温大曲为试验样品,筛选获得以葡萄糖为发酵底物高产四甲基吡嗪的菌株1-13,经鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens)。通过单因素试验及响应面试验优化确定其产四甲基吡嗪的最优发酵工艺为初始pH值7.0、发酵温度39.0 ℃、接种量5.0%、装液量20.0%、摇床转速180 r/min、铵盐添加量50.0 g/L(发酵第6天时添加),在此优化条件下,四甲基吡嗪产量可达(166.19±2.79)mg/L,较优化前提高48%。此研究为解淀粉芽孢杆菌产四甲基吡嗪的应用提供理论基础,促进微生物产四甲基吡嗪生产实现工业化应用。
[1] 梅明明,朱婧,李妍,等.气相色谱-质谱法测定白酒中3种吡嗪类化合物[J].现代预防医学,2015,42(14):2597-2599,2614.
[2] 葛向阳,李晓欢,周庆伍,等.利用现代生物技术提高大曲中四甲基吡嗪含量的研究[J].酿酒,2018,45(5):32-34.
[3] 张治刚,王永亮.白酒健康与健康白酒综述[J].中国酿造,2017,36(5):13-16.
[4] 蔡平太,牟长霖.丹参川穹嗪治疗眩晕的疗效观察[J].临床合理用药杂志,2015,8(35):30-31.
[5] 马琳,王秀杰,张坚,等.中药川芎中川芎嗪提取工艺优化的探索[J].时珍国医国药,2007(12):3057-3058.
[6] 饶丽华,赵诗云,尹小明.川芎嗪抗血小板聚集的实验研究[J].检验医学,2014,29(9):976-977.
[7] 中华人民共和国国家卫生和计划生育委员会.GB 1886.295—2016 食品安全国家标准食品添加剂2,3,5,6-四甲基吡嗪[S].北京:中国标准出版社,2016.
[8] 刘巨源,陈永凤.川芎嗪对鼠肺纤维化组织钙含量及钙调素活性的影响[J].中国临床药理学与治疗学,2002(2):138-140.
[9] CAO H,CHENG Y,ZHANG J,et al.The effect of umbilical cord mesenchymal stem cells combined with tetramethylpyrazine therapy on ischemic brain injury:a histological study[J]. J Stroke Cerebrovasc Dis,2020,29(12):105298-105298.
[10] 郭维伟.地衣芽孢杆菌发酵四甲基吡嗪条件研究[D].济南:齐鲁工业大学,2017.
[11] 侯孝元,顾如林,梁文龙,等.利用发酵法生产四甲基吡嗪研究进展[J].生物技术通报,2016,32(1):58-64.
[12] BESSON I,CREULY C,GROS J B,et al.Pyrazine production by Bacillus subtilis in solid-state fermentation on soybeans[J].Appl Microbiol Biot,1997,47(5):489-495.
[13] 吴建峰,徐岩.白酒细菌酒曲固态培养条件下B.subtilis S12产四甲基吡嗪的合成机制[J].食品与生物技术学报,2014,33(1):8-15.
[14] 吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[15] ZHU B,XU Y,FAN W.High-yield fermentative preparation of tetramethylpyrazine by Bacillus sp.using an endogenous precursor approach[J].J Ind Microbiol Biot,2010,37:179-186.
[16] DEMAIN A L,JACKSON M,TRENNER N R.Thiamine-dependent accumulation of tetramethylpyrazine accompanying a mutation in theisoleucine-valine pathway[J].J Bacteriol,1967,94(2):323.
[17] 赵洪源.凉州熏醋传统酿造过程高产四甲基吡嗪微生物筛选及其代谢机理初探[D].兰州:甘肃农业大学,2015.
[18] XIAO Z,XIE N,LIU P.et al.Tetramethylpyrazine production from glucose by a newly isolated Bacillus mutant[J].Appl Microbiol Biot,2006,73:512-518.
[19] MENG W,D XIAO,WANG R.Enhanced production of tetramethylpyrazine in Bacillus licheniformis BL1 by bdhA disruption and 2,3-butanediol supplementation[J].World J Microb Biot,2016,32(3):46.
[20] HAO F,WU Q,XU Y.Precursor supply strategy for tetramethylpyrazine production by Bacillus subtilis on solid-state fermentation of wheat bran[J].Appl Biochem Biotech,2013,169:1346-1352.
[21] 蒋倩儿,陈文浩,孙金沅,等.酱香型白酒大曲微生物研究进展[J].中国酿造,2021,40(12):1-5.
[22] 钟桂芳,张帆,郭辉祥,等.高温大曲中产四甲基吡嗪细菌的筛选及鉴定[J].中国酿造,2020,39(8):107-111.
[23] 张荣.产酱香功能细菌的筛选及其特征风味化合物的研究[D].无锡:江南大学,2009.
[24] 陈梦圆,李志军,罗爱民.高温大曲中高产四甲基吡嗪菌株的筛选及鉴定[J].酿酒科技,2018(8):24-29.
[25] 汤丹丹.枯草芽孢杆菌产吡嗪发酵条件的研究[D].济南:齐鲁工业大学,2015.
[26] ZHU B,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J]. J Ind Microbiol Biot,2010,37(8):815-821.
[27] XIAO Z,HOU X,LYU X,et al.Accelerated green process of tetramethylpyrazine production from glucose and diammonium phosphate[J].Biotech Biofuels,2014,7(1):106.
[28] 张温清.芝麻香型白酒四甲基吡嗪形成及其高产TTMP酿造工艺研究[D].合肥:合肥工业大学,2020.