中国白酒作为世界六大蒸馏酒之一,复杂的酿造工艺造就了其独特风味口感。白酒中含有大量丰富的挥发性物质,如醇、酸、酯、酚、吡嗪和萜烯等,它们构成了白酒风味的主体成分,除此之外白酒中还含有诸多非挥发性物质,如氨基酸、维生素、活性肽等[1-3],这些风味物质组合赋予白酒不同的色香味风格。愈创木酚类物质是一类存在于酱香、浓香、芝麻香和清香型等白酒中的呈香风味因子,其中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚和4-乙烯基愈创木酚具有独特发酵香味(烟熏、酱香、丁香和辛香味等),且呈现味阈值低,对白酒香气风味具有重要的贡献[4-5]。
国内研究对中国各大香型白酒中风味物质成分进行检测分析,发现愈创木酚类物质含量在酱香型白酒中最高,其次是浓香型白酒,而清香型白酒中愈创木酚类物质较少[6]。孙啸涛等[7]采用气质联用(gas chromatographymass spectrometer,GC-MS)技术对53种白酒中愈创木酚类物质进行了定量检测,其中,4-甲基愈创木酚含量为2.8~1 709 μg/L,4-乙基愈创木酚含量为1.3~1 167 μg/L。愈创木酚类物质不仅在白酒中具有较高的香气活性值(odor activity value,OAV),而且可作为天然自由基清除剂,能够抗氧化消除细胞中活性氧和自由基,促进微循环,增强人体免疫力,预防心血管等多种疾病的发生,具有抗衰老、促进人体健康的作用[8-9]。小鼠实验研究表明,在白酒中添加4-甲基愈创木酚能有效减轻酒精肝损伤,缓解酒精所带来的肝功能紊乱和失调[10]。
随着中国社会稳步发展以及新冠疫情预防常态化,人们对于健康食品的需求也与日俱增。作为中国白酒主要香型之一的清香型白酒,在不断改善风味和提高品质同时,也需要提升酒体中健康因子含量,为消费者提供品质更好更健康的产品。微生物的生物转化是中国白酒中风味功能因子的重要来源,因此筛选产健康因子的功能菌株用于提升白酒中风味功能因子已成为当前白酒微生物研究领域的热点之一。目前关于产愈创木酚类物质菌株筛选应用集中于酱香型、芝麻型和浓香型白酒生产中[11-14]。且筛选获得的菌株多以芽孢杆菌为主,芽孢杆菌作为中国白酒发酵过程中优势的细菌类群[15-17],可以代谢产愈创木酚类因子,极大地丰富中国白酒的风味和健康内涵[18]。该研究以清香型小曲为原料进行高产愈创木酚类物质的菌株筛选,通过显色初筛和发酵复筛获得菌株,并利用车间中试酿造实验探究菌株的应用前景,以期用于生产中增加清香型小曲白酒中愈创木酚类物质含量,提升酒体健康内涵。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
分离菌株:取自于湖北黄石大冶劲牌有限公司。
1.1.2 培养基
Luria-Bertani(LB)液体培养基:氯化钠10g,蛋白胨10g,酵母浸粉5 g,水1 000 mL,pH=7.0,置于灭菌锅121 ℃灭菌30 min,备用。固体培养基加琼脂20 g。
酵母浸粉葡萄糖淀粉(yeastextractglucose starch,YGS)培养基:葡萄糖2 g,酵母浸粉1 g,淀粉1 g,香草酸0.1 g,加入1 000 mL水加热溶解,置于灭菌锅121 ℃灭菌30 min,备用。
高粱汁发酵培养基:取1 kg高粱,将其破碎成粉状,与5 L水混合,加入5 g淀粉酶60 ℃条件下作用1~2 h,然后105 ℃、30 min处理,冷却后加入5 g糖化酶和5 g淀粉酶,60 ℃处理24 h。用离心机和抽滤机过滤,糖度调节到8°Bx,装瓶置于灭菌锅121 ℃灭菌30 min,备用。
1.1.3 主要试剂
淀粉酶(5万U/g)、糖化酶(10万U/g):无锡雪梅酶制剂科技有限公司;辣根过氧化物酶(250 U/mg):武汉白浩天生物科技有限公司;TIANGEN 土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司;愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚、4-乙烯基愈创木酚(均为色谱纯):美国Sigma公司;乙酸乙酯、正丙醇、异丁醇、异戊醇(均为色谱纯):美国SAFC Biosciences公司。其他试剂均为国产分析纯。
土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司;愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚、4-乙烯基愈创木酚(均为色谱纯):美国Sigma公司;乙酸乙酯、正丙醇、异丁醇、异戊醇(均为色谱纯):美国SAFC Biosciences公司。其他试剂均为国产分析纯。
1.2 仪器与设备
AL204电子分析天平:梅特勒-托利多仪器(上海)有限公司;全温空气摇床QYC-200:上海福玛实验设备有限公司;生化培养箱SPX-100B-Z:上海博讯实业有限公司;Nikon Eclipse E200显微镜:日本Nikon公司;ABI 2720聚合酶链式反应(polymerase chain reaction,PCR)热循环仪:美国ABI公司;7890B-5977B气相色谱-质谱联用仪、DB-FFAP毛细管色谱柱(60 m×0.25 mm,0.25 μm)、CP-WAX毛细管色谱柱(50 m×0.25 mm,0.2 μm):美国安捷伦科技有限公司;顶空固相微萃取(headspace solid phase micro-extraction,SPME)手动进样手柄、DVB/CAR/PDMS固相微萃取头(50/30 μm):美国色谱科公司。
1.3 实验方法
1.3.1 酒曲中细菌分离
取10 g酒曲加入90 mL的无菌水中37 ℃振荡20 min,之后依次进行梯度稀释(10-1、10-2、10-3、10-4和10-5),选取梯度为10-4和10-5的稀释液涂布于含有0.05 mg/mL制霉菌素的LB培养基平板上,放入37 ℃培养箱中,观察菌株生长情况。根据菌株的菌落形态、大小、颜色等特征,挑取细菌菌株于LB培养基平板上划线纯化,37 ℃培养24 h获得纯化菌株,备用。
1.3.2 高产愈创木酚类物质菌株的筛选
(1)产愈创木酚类物质菌株的初筛
初筛选用显色方法,即愈创木酚在过氧化物酶的催化下与过氧化氢反应,生成四愈创醌(红褐色),在波长470 nm处有较强的吸收峰。将反应产色的菌株接种于YGS培养基中,于37 ℃培养24 h。取2 mL菌液加入反应体系(2 mL 0.2 mol/L磷酸缓冲液(pH=6.0)+20 μL辣根过氧化物酶(5 U)+300 μL 0.5%H2O2)。将反应液常温静置5 min后观察反应体系颜色变化。根据是否产生红褐色来判断各菌株是否可以代谢产生愈创木酚[19]。
(2)产愈创木酚类物质菌株的复筛
从平板上挑取细菌菌落接种到10 mL LB液体培养基中,37 ℃160 r/min培养24 h后转接于50 mL LB液体培养基中,37 ℃继续培养24 h后用于后续发酵接种。将所分离各菌的种子液按2%(V/V)接种量接入高粱汁发酵培养基50 mL中,瓶口用发酵栓密封于30 ℃静置培养7 d。
将标准化合物(愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚和4-乙烯基愈创木酚)溶解在无水乙醇溶液中,稀释成不同梯度工作标准液,取8 mL于顶空进样瓶中,加入3 g氯化钠和80 μL内标溶液(2,6-二甲基苯酚,100 mg/L),混匀后进行GC-MS分析。
1.3.3 检测条件
将顶空固相微萃取头插入样品瓶顶空部分,70 ℃保温萃取50 min。萃取结束后进样,250 ℃解吸5 min。气相色谱条件:色谱柱为DB-FFAP毛细管柱(60 m×0.25 mm,0.25 μm);升温程序:起始温度50 ℃,保持2 min,以5 ℃/min升温至240 ℃,保留1 min;进样口温度250 ℃;载气为氦气(He)(纯度>99.99%)。质谱条件:电子能量70 eV,离子源温度230 ℃,扫描范围40~550 amu。先确定愈创木酚类物质的保留时间,对质谱图解析进行分组后,采用选择离子模式定量分析。以质量浓度比为横坐标,愈创木酚类物质与内标物的峰面积比为纵坐标,建立愈创木酚类物质标准曲线。其标准曲线的回归方程分别为y=0.166 8x+0.010 3,R2=0.999 4(愈创木酚);y=0.452 3x+0.046 4,R2=0.998 8(4-甲基愈创木酚);y=1.646 8x+0.099 4,R2=0.999 8(4-乙基愈创木酚);y=0.202 6x-0.015 8,R2=0.998 9(4-乙烯基愈创木酚)。
使用气相色谱-质谱联用技术对发酵上清液中愈创木酚类物质进行定量检测。取8 mL待测样品于20 mL顶空瓶中,加入3 g氯化钠和80 μL内标溶液,混合均匀后进行分析。样品进样萃取、分析和色谱条件参照标准曲线条件进行。采用愈创木酚类物质标准曲线计算样品中愈创木酚类物质的含量。
1.3.4 菌株的鉴定
(1)显微形态观察
观察37 ℃培养条件下LB培养基上细菌菌落形态;用接种针或者灭菌牙签挑取少量菌体放于载玻片中,于显微镜(10×100)下进行菌体显微观察。
(2)生理生化实验
参照《常见细菌系统鉴定手册》[20]对菌株B257进行生理生化实验。
(3)分子序列分析鉴定
菌株B257的DNA提取:收集菌体,用TIANGEN 土壤基因组DNA提取试剂盒进行DNA提取,具体方法参照其说明书。
土壤基因组DNA提取试剂盒进行DNA提取,具体方法参照其说明书。
16S rRNA基因片段PCR扩增反应:以所提取的菌株B257的DNA为模板,利用细菌16S rRNA通用引物27F(5'-AGAGTTTGGATCMTGGCTCAG-3')和1492R(5'-TACGGTTACCTTGTTACGACTT-3')进行16S rRNA片段扩增。扩增体系为30 μL,其中Premix TaqTM15 μL,双蒸水(ddH2O)13 μL,引物27F和1492R各为0.5 μL,DNA模板1 μL。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火50 s,72 ℃延伸30 s,32个循环;72 ℃再延伸10 mim,4 ℃保存。
16S rRNA序列分析和系统发育树的构建:将扩增的16S rRNA片段送往武汉华大基因生物医学工程有限公司进行测序,获得菌株B257的16S rRNA序列信息。通过美国国家生物技术信息中心网站(national center for biotechnology information,NCBI)的基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比较,获取其同源性序列。并进一步利用MEGA-X软件邻接法(neighbor-joining,NJ)对所获得同源性菌株序列构建系统发育树,确定菌株B257分类学地位。
1.3.5 菌株B257的耐受性实验
参照1.3.2步骤制备成菌株B257种子液,将种子液按照5%(V/V)的接种量[12]分别接种于不同pH(2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5)、不同NaCl含量(1%、3%、5%、7%、9%、11%、13%、15%、17%)、不同乙醇体积分数(3%、6%、9%、12%、15%、18%)的LB液体培养基。37 ℃、160 r/min培养24 h后,取细菌培养液于波长600 nm处测定吸光度值。
1.3.6 产愈创木酚类物质菌株在清香型小曲白酒酿造中的应用
(1)实验用曲制备
以5%的比例将菌株B257的种子液添加到灭菌麸皮中,培养3 d后烘干。按照2%比例添加至生产所用清香型小曲中用于菌株中试效果验证。
(2)高粱发酵中试试验
将所配制的实验曲30 g与蒸煮两次的高粱3 kg混合均匀,30 ℃条件下糖化24 h,后与6 kg酒糟混合拌匀放入发酵桶中,30 ℃恒温车间发酵14 d(对照为不添加菌株B257的小曲)。待发酵完毕,将酒醅装入酒甑进行蒸汽馏酒,蒸馏出酒样取500 mL,对其中关键风味物质和愈创木酚类健康因子进行定量检测。
(3)风味成分检测
采用气相色谱技术对白酒中风味成分(乙酸乙酯、正丙醇、异丁醇、异戊醇)进行定量检测。样品前处理、进样分析和色谱条件参照文献[21]的条件。酒样中愈创木酚类物质含量采用GC-MS检测,色谱条件如1.3.3所示。
1.3.7 数据处理
采用安捷伦MSD ChemStation软件处理气相色谱-质谱数据;菌株吸光度值和发酵风味色谱数据经IBM SPSS 19统计分析软件进行整理统计,由Origin 2019作图。
2 结果与分析
2.1 产愈创木酚类物质菌株筛选
2.1.1 菌株的初筛
采用显色法对从清香型小曲中所分离出细菌菌株进行了产愈创木酚类物质筛选,结果显示共有10株菌(B73、B79、B81、B99、B109、B167、B172、B209、B213、B257)在显色反应体系中产生红褐色物质,表明这些菌具有代谢产愈创木酚的能力,因此将这10株菌用于下一步的液体发酵复筛。
2.1.2 菌株的复筛
为进一步探究这些菌株在清香型小曲白酒发酵体系中产愈创木酚类物质(愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚和4-乙烯基愈创木酚)能力,选取高粱汁培养基作为复筛培养基模拟清香型小曲白酒的密闭发酵环境,并采用GC-MS对10株芽孢杆菌发酵液中愈创木酚类物质含量进行定量分析,结果见图1。
由图1可知,菌株B73、B79、B81和B257产生愈创木酚类物质含量较高,总量在0.41~9.70 mg/L,主要为愈创木酚和4-乙烯基愈创木酚。其中菌株B257代谢产愈创木酚和4-乙烯基愈创木酚的含量较高,为1.04 mg/L和8.65 mg/L,分别比其他3株菌高出了132%~1 205%以及381%~2 269%;而4株菌的4-甲基愈创木酚和4-乙基愈创木酚含量较低,分别在0.001~0.008 mg/L和0.001~0.012 mg/L之间。其余6株芽孢杆菌高粱汁发酵液中愈创木酚含量极低,未检测出,因此在图1中未展示。综上可以看出,菌株B257具有较好的产愈创木酚类物质的能力。
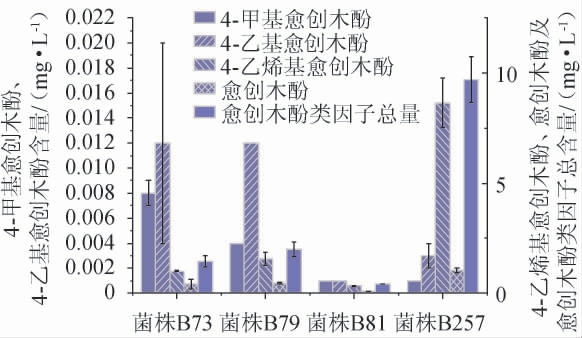
图1 四株细菌高粱汁发酵培养基中产愈创木酚类物质含量
Fig.1 Contents of guaiacols in fermentation medium of sorghum juice from 4 bacterial strains
2.2 菌株B257的鉴定
2.2.1 菌株B257的菌落和细胞显微形态
为确定菌株B257的系统发育学地位,对其菌落形态和显微形态进行观察,结果见图2。由图2可知,菌株B257在LB培养基平板上菌落呈乳白色、不透明,表面褶皱不光滑,菌落边缘粗糙扩散;在10×100倍光学显微镜下菌体呈短杆状,长度1.5~3 μm,宽度0.6~0.9 μm,无荚膜,中生芽孢,革兰氏染色阳性。对照《常见细菌系统鉴定手册》描述,菌株B257与芽孢杆菌形态特征相似,故菌株B257被初步鉴定为芽孢杆菌(Bacillus sp.)[20]。
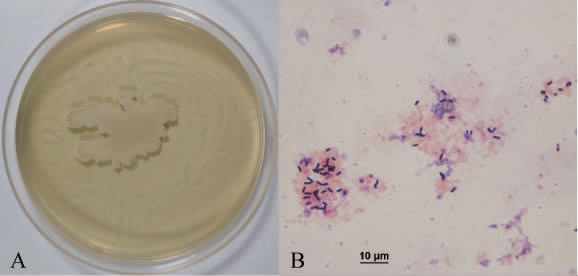
图2 菌株B257的菌落形态(A)和细胞显微结构(B)
Fig.2 Colony morphology (A) and cell microstructure (B) of strain B257
2.2.2 菌株B257生理生化特征分析
对菌株B257的生理生化特性进行了检测,结果见表1。由表1可知,该菌株过氧化酶实验、V-P实验、甲基红实验阳性,可水解明胶和淀粉,可利用柠檬酸盐代谢葡萄糖产生丙酮酸。与此同时,糖发酵实验显示该菌株可以代谢葡萄糖、蔗糖、麦芽糖、果糖、甘露糖、海藻糖、山梨醇和阿拉伯糖产酸,但无法利用乳糖。
表1 菌株B257生理生化特性实验结果
Table 1 Experimental results of physiological and biochemical properties of strain B257
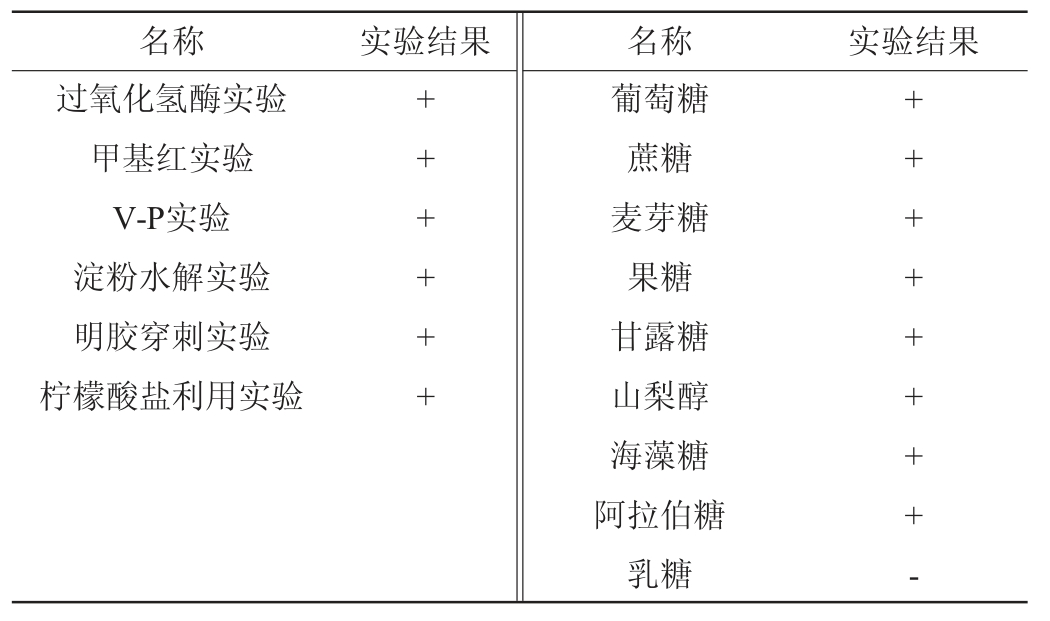
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
2.2.3 菌株B257的系统发育学分析
为了进一步明确菌株B257的分类学地位,对其16SrRNA序列进行分析,通过测序和同源性比对,构建了分子系统进化树,结果见图3。由图3可知,菌株B257与枯草芽孢杆菌(Bacillus subtilis)聚类在分类进化树的一支,因此将菌株B257鉴定为枯草芽孢杆菌(Bacillus subtilis)。
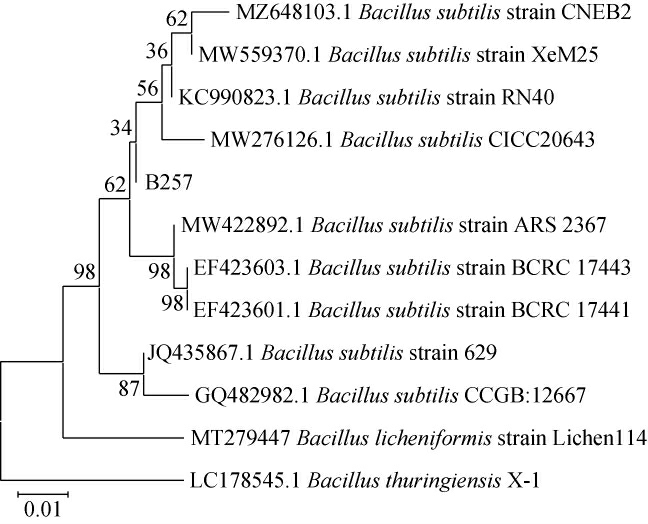
图3 基于16S rRNA基因序列菌株B257的系统发育树
Fig.3 Phylogenetic tree based on 16S rRNA gene sequence of strain B257
2.3 枯草芽孢杆菌B257的耐受性实验
为探究菌株B257的酸、盐、乙醇耐受性,对菌株B257在不同培养环境下的细胞生长活性进行了检测,结果见图4。由图4可知,菌株B257在不同pH、NaCl含量和乙醇体积分数条件下呈现出不同生长活性,其中pH在4.5~6.5、NaCl含量在1%~9%以及乙醇体积分数为3%~6%条件下,菌株B257的生长活性较好,而pH在2.5~4.0、NaCl含量在11%~17%以及乙醇体积分数为9%~18%条件下,细胞生长受到抑制。可见菌株B257可以在低酒精度、偏酸性和低盐条件下具有较好细胞生长活性。清香型小曲白酒发酵初期,相关功能微生物类群会在弱酸、低酒精度环境下增殖代谢产生风味物质[22],而菌株B257的耐酸和耐酒精特性有益于其在小曲白酒发酵过程中发挥其产功能因子特性,提升酒体中愈创木酚类物质含量。

图4 菌株B257在不同培养条件下的生长情况
Fig.4 Growth situation of strain B257 with different culture conditions
2.4 菌株B257在清香型小曲白酒酿造中的应用
为进一步探究枯草芽孢杆菌B257在清香型小曲白酒酿造中应用潜力,将其麸皮种按2%比例与清香型小曲混合(即2%B257麸皮种加98%清香型小曲)作为发酵剂与高粱混合进行白酒酿造实验,对照组则以不添加B257的清香型小曲进行粮食发酵,发酵完后获取基酒样品采用气相色谱-质谱技术检测其中愈创木酚类物质和出酒率、主体风味成分(乙酸乙酯、正丙醇、异丁醇和异丙醇)含量,结果分别见图5和图6。
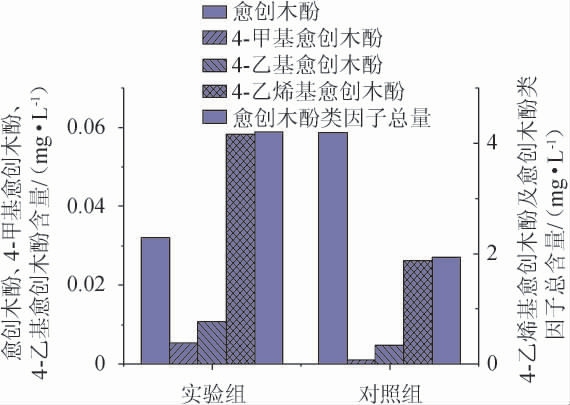
图5 菌株B257对清香型小曲白酒中愈创木酚类物质含量的影响
Fig.5 Effects of strain B257 on guaiacols contents in light-flavor Xiaoqu Baijiu
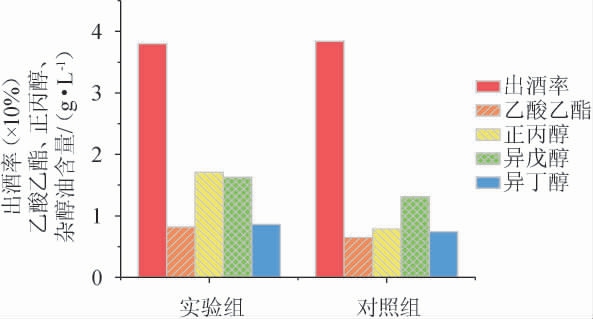
图6 菌株B257对清香型小曲白酒出酒率和主体风味物质含量的影响
Fig.6 Effects of strain B257 on liquor yield and main flavor substances contents in light-flavor Xiaoqu Baijiu
由图5可知,在愈创木酚类物质方面,添加了枯草芽孢杆菌B257所酿造的白酒中愈创木酚类物质总含量为4.21mg/L,与对照组未添加菌株B257的1.94 mg/L相比提升了117%。其中4-乙烯基愈创木酚提升量最高,增长了2.29 mg/L,4-乙烯基愈创木酚作为白酒中的特殊健康因子,可以有效抑制癌症细胞生长,具有较高的医疗保健价值[23-24]。巩园园等[25]从浓香型酒醅中筛选出一株高产4-乙烯基愈创木酚的枯草芽孢杆菌NF-1(0.3 mg/g),并进一步验证了酚酸脱羧酶是4-乙烯基愈创木酚代谢途径关键酶。与此同时,酒样中愈创木酚、4-甲基愈创木酚和4-乙基愈创木酚含量也有所增加,分别提升了400%、122%和122%。可见功能菌B257极大地提升了清香型小曲白酒中愈创木酚类物质含量。
由图6可知,从基酒出酒率数据上看,添加了健康功能菌B257的酒曲未对出酒率造成明显的影响,这可能是由于菌株B257与酿酒酵母之间并不存在有效种间竞争。在主体风味物质方面,实验组酒体的主要风味酯-乙酸乙酯的含量提升了26.1%。而正丙醇、异丁醇和异戊醇也出现了增长,分别增长了116%、16%和23.7%。芽孢杆菌的添加可以在保证出酒率和主体风味成分的基础上,在一定程度上提升发酵粮食中产酯酵母活性,促进酯类物质和多元醇的代谢合成[26]。
3 结论
愈创木酚类物质是中国白酒中一类重要的风味健康成分,它不仅能提升酒体香气口感,还能赋予白酒健康内涵。因此提升清香型小曲白酒中愈创木酚类物质含量具有重要意义。本研究从清香型小曲中分离出一株高产愈创木酚类物质的菌株B257,经过形态学分析和16S rRNA序列同源性比对鉴定为枯草芽孢杆菌(Bacillus subtilis),且高粱汁发酵实验发现菌株B257具有较好代谢合成愈创木酚类物质的能力。菌株B257可以耐受低盐、低pH、偏酸性的环境,可以适应清香型小曲白酒发酵环境,产生微量风味物质。
对该菌株在小曲酒发酵中代谢合成愈创木酚类物质能力开展了进一步验证,将菌株B257加入小曲中进行小曲白酒发酵(中试规模),结果显示B257的添加可以极大提升原酒中愈创木酚类物质的含量,相比对照提升了117%,其中4-乙烯基愈创木酚的含量最高。由此可见枯草芽孢杆菌B257在提升清香型小曲白酒风味和健康上具有极大的应用潜力。因此下面将进一步开展大生产实验,有效调控B257的生长代谢来提升清香型小曲白酒中愈创木酚类物质含量。
[1] 王震,叶宏,朱婷婷,等.清香型白酒风味成分的研究进展[J].食品科学,2022,43(7):232-244.
[2] 郭世鑫,姚孟琦,马文瑞,等.酱香型白酒的研究现状[J].中国酿造,2021,40(11):1-6.
[3] 罗晶,祝水兰,王丽,等.浓香型白酒酿造微生物与风味物质组成的研究进展[J].中国酿造,2020,39(4):1-6.
[4] 范文来,徐岩.白酒79个风味化合物嗅觉阈值测定[J].酿酒,2011,38(4):80-84.
[5] 耿平兰,黄卫红,程化鹏.白酒中酚类物质及检测方法的研究进展[J].酿酒科技,2020(8):83-88.
[6] 史冬梅,王松,赵东瑞,等.GC-MS/SIM法检测103种白酒中6种酚类化合物[J].中国食品学报,2019,19(4):235-248.
[7] 孙啸涛,王宗元,刘淼,等.涡旋辅助液液微萃取结合GC-MS法检测67种白酒中四甲基吡嗪、4-甲基愈创木酚和4-乙基愈创木酚[J].食品科学,2017,38(18):73-79.
[8] 赵东瑞.古井贡酒风味物质及酚类风味物质的抗氧化性和抗炎性的研究[D].广州:华南理工大学,2019.
[9] 李露,单义民.白酒中各种风味物质对健康的影响[J].酿酒科技,2020(6):30-36.
[10] 张瞭飞,姜欣,李一澍,等.4-甲基愈创木酚对酒精性肝损伤小鼠的保护作用[J].食品与发酵工业,2021,47(18):92-98.
[11] 王西,沈毅,张亚东,等.产香枯草芽孢杆菌在酱香型白酒生产中的应用[J].酿酒科技,2018(7):70-75.
[12] 张颖,李霄霄,李景辉,等.高产四甲基吡嗪芽孢杆菌的筛选及其对酱香型白酒堆积过程的影响[J].食品工业科技,2022,43(2):142-149.
[13] 周金虎,李良,方尚玲,等.窖泥中高产愈创木酚类功能菌的筛选与鉴定[J].食品与发酵工业,2019,45(3):64-70.
[14] 张温清,司冠儒,梅婕,等.江南小窖宣酒酿造微生态系统中高产四甲基吡嗪功能微生物的筛选与鉴定[J].酿酒科技,2020(2):55-64.
[15] 唐洁,杨强,刘源才,等.白酒中产风味微生物研究进展[J].中国酿造,2021,40(11):15-20.
[16] 程伟,吴丽华,徐亚磊,等.浓香型白酒酿造微生物研究进展[J].中国酿造,2014,33(3):4.
[17] 郭学武,范恩帝,马冰涛,等.中国固态发酵白酒中功能细菌研究进展[J].食品与发酵工业,2020,46(1):7.
[18] 赵兴秀,何义国,赵长青,等.产酱香功能菌的筛选及其风味物质研究[J].食品工业科技,2016,37(6):196-200.
[19] 王天娇,庞文渌.提高愈创木酚染色法检测稻谷新陈度准确性的研究[J].粮食加工,2020,45(5):33-35.
[20] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:419.
[21] 孙细珍,杜佳炜,黄盼,等.现代工艺和传统工艺酿造小曲清香型白酒感官表征及风味成分分析[J].食品科学,2021,42(6):282-290.
[22] HU Y L,YANG Q,CHEN D,et al.Study on microbial communities and higher alcohol formations in the fermentation of Chinese Xiaoqu Baijiu produced by traditional and new mechanical technologies[J]. Food Res Int,2021,140:109876.
[23] LUO Y,WANG C Z,SAWADOGO R,et al.4-vinylguaiacol,an active metabolite of ferulic acid by enteric microbiota and probiotics,possesses significant activities against drug-resistant human colorectal cancer cells[J].ACS Omega,2021,6(7):4551-4561.
[24] 李青卓,王嘉瑞,张小龙,等.风味物质4-乙烯基愈创木酚的研究进展[J].中国酿造,2021,40(4):15-19.
[25] 巩园园,毛豪,晋湘宜,等.产4-乙烯基愈创木酚细菌的筛选及酚酸脱羧酶基因的克隆与表达[J].中国酿造,2021,40(7):160-164.
[26] 丁雪琴.酒曲中高产四甲基吡嗪菌株的选育及发酵优化[D].天津:天津科技大学,2015.