葡萄酒的颜色不仅能够反映其酿造工艺水平,也是消费者评价葡萄酒质量的最重要的感官指标之一[1]。红葡萄酒的呈色物质主要为花色苷及其衍生物,花色苷的含量、组成比例及其与其他酚类物质的聚合作用都会影响红葡萄酒的颜色品质[2]。一方面,花色苷为葡萄酒带来红色色调、黄色色调以及蓝色色调;另一方面,酚类物质在葡萄酒陈酿过程中相互作用形成结构稳定的色素分子。由于每个葡萄品种都有自身独特的酚类物质组成特征,因此,很难酿造出具有完全平衡感官特征的单一品种葡萄酒,一些葡萄酒在酿造完成后表现出酚类物质水平较低,颜色表现不足的问题,严重影响了红葡萄酒的质量。因此,在干红葡萄酒生产过程中,很多葡萄酒企业常通过添加颜色表现好的葡萄酒进行调配,常用的调色品种为染色葡萄,但也使用花色苷含量相对较高的非染色品种,如‘丹菲特’等[3]。
发酵后调配是指将发酵结束后的不同品种或不同年份的葡萄酒进行不同比例的混合,有选择地改善葡萄酒酚类物质组成和稳定颜色[3],以达到弥补单一品种葡萄酒缺陷和改善其整体品质的技术。目前为止,关于葡萄酒发酵后调配的理论研究在中国还相对较少,葡萄酒调配仍然是一种基于酿酒师经验的操作,且这些经验和结果很难被其他研究人员参考,不能变成更为准确的调配方案,葡萄酒风格无法保持稳定[4]。
‘赤霞珠’是中国大部分酿酒葡萄产区的主栽品种,但不同产区的‘赤霞珠’葡萄酒在颜色上存在着很大的提升空间[5]。‘丹菲特’是近年来引进的酿酒葡萄品种,所酿造的干红葡萄酒果味浓郁,具有极深的紫红颜色[6],极具调色潜力,但国内关于‘丹菲特’调配的相关报道较少。为了优化‘赤霞珠’葡萄酒的颜色品质,更好地发挥不同品种的优势,本研究以‘赤霞珠’单品种干红葡萄酒为基酒,利用‘丹菲特’单品种干红葡萄酒以5%、10%、15%、20%、25%的添加比例进行调配,测定调配葡萄酒的颜色参数和酚类物质含量,以期为葡萄酒调配工艺的科学化设计提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
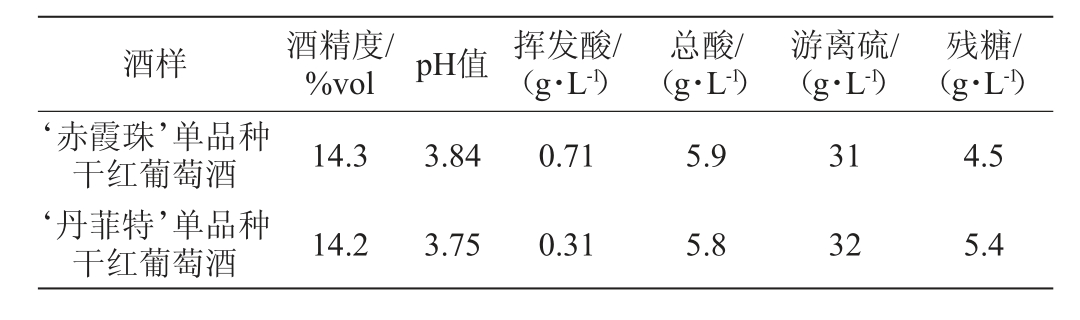
实验样品选自新疆玛纳斯县中信国安葡萄酒业有限公司(44°14'N,86°15'E)2020年采收酿造的‘赤霞珠’(Cabernet Sauvignon)和‘丹菲特’(Dornfelder)单品种干红葡萄酒。两款葡萄酒的原料均为充分成熟的单品种葡萄,原料采收后按照公司生产工艺进行酿造,发酵规模为20 t。两款单品种干红葡萄酒苹-乳发酵(malo-lactic fermentation,MLF)结束后一个月的基本理化指标见表1。
表1 单品种葡萄酒基本理化指标
Table 1 Basic physical and chemical indexes of monovarietal wine samples
1.1.2 试剂
类黄酮标准品(二甲花翠素-3-O-葡萄糖苷、槲皮素、儿茶素、表儿茶素、表棓儿茶素、表儿茶素没食子酸酯)、甲酸、甲醇、乙腈(均为色谱纯):德国Sigma-Aldrich公司。其他试剂均为国产分析纯。
1.2 仪器与设备
Agilent1200系列超高效液相色谱-三重四极杆串联质谱联用(ultraperformanceliquidchromatography-triple quadrupole tandem mass spectrometry,UPLC-MS/MS)仪、Poroshell 120 EC-C18色谱柱(150 mm×3.0 mm,2.7 μm):美国Agilent科技有限公司;T6紫外分光光度计:上海普析通用仪器公司。
1.3 方法
1.3.1 葡萄酒的调配
以‘赤霞珠’单品种干红葡萄酒(CS)为基酒,‘丹菲特’单品种干红葡萄酒(DFT)作为配体,在苹-乳发酵结束后一个月,以5%(CD1)、10%(CD2)、15%(CD3)、20%(CD4)、25%(CD5)的比例进行调配,每个调配比例重复3次,每次重复的总体积为20 L,调配后装入750 mL标准葡萄酒瓶,木塞封口,在酒窖瓶储一个月后用于酚类物质分析。
1.3.2 酚类物质的检测
样品经0.22 μm水系滤膜过滤后,参照卢浩成等[7-8]的高效液相色谱-三重四级杆质谱联用法测定葡萄酒中的类黄酮类物质。
气相色谱条件:Poroshell 120 EC-C18(150 mm×3.0 mm,2.7 μm)色谱柱,柱温55 ℃,进样量5 μL,洗脱采用的流动相A相为0.1%的甲酸水溶液,B相为含0.1%甲酸乙腈∶甲醇=50∶50(V/V)溶液,流动相流速0.4 mL/min。花色苷的洗脱程序为10%~100%B持续15 min,后运行程序5 min。非花色苷采用梯度洗脱程序,0~28 min,10%~46%B;28~29 min,46%~10%B,后运行程序5 min。
质谱条件:电喷雾(electron spray ionization,ESI)离子源,喷雾电压4 kV,离子源温度150 ℃,干燥气温度350 ℃,流量为12 L/h,雾化器压力35 psi。检测器为多反应监测(multireaction monitoring,MRM)模式。花色苷的检测采取正离子模式,非花色苷采取负离子模式。
定性、定量:依据本实验室所建立的葡萄与葡萄酒酚类物质指纹谱库进行定性[8]。采用外标法定量,黄酮醇以槲皮素为外标物进行定量,标准曲线回归方程为:Y=0.000 002 6x+0.11,相关系数为0.998;黄烷醇以儿茶素、表儿茶素、表儿茶素没食子酸酯和表棓儿茶素为外标物进行定量,标准曲线回归方程为:Y(儿茶素)=0.000 023 4x-1.50,相关系数为0.998;Y(表儿茶素)=0.000 022 5x-1.86,相关系数为0.993;Y(表棓儿茶素)=0.000 059 1x+3.37,相关系数为1.000;Y(表儿茶素没食子酸酯)=0.000 003 7x-1.01,相关系数为0.997。花色苷以二甲花翠素-3-O-葡萄糖苷为外标物进行定量,标准曲线回归方程为:Y=0.000 004 6x-1.14,相关系数为0.998。
1.3.3 颜色参数的检测
酒样色度-色调的检测采用CIELAB法[9]。酒样经0.22 μm水系滤膜过滤后,选择2 mm光径石英比色皿,以蒸馏水为空白对照,用紫外分光光度计测定酒样在波长440 nm、530 nm、600 nm处的吸光度值,计算样品的CIELAB参数,包括L*值(明亮度)、a*值(a*>0,红色色调;a*<0,绿色色调)、b*值(b*>0,黄色色调;b*<0,蓝色色调)。
1.3.4 数据处理及统计分析
采用SPSS26.0进行统计分析,采用Excel2016制表,采用SIMCA 14.1进行主成分分析(principal component analysis,PCA),使用Excel 2016绘制色板图。
2 结果与分析
2.1 调配葡萄酒颜色参数的分析结果
由于葡萄酒的色调、色度和CIELAB颜色评价体系的结果有着良好的相关性[10],因此本试验采用CIELAB法对各组葡萄酒样品的颜色参数进行测定,结果见表2。由表2可知,‘赤霞珠’单品种干红葡萄酒的颜色较浅(L*值最高),红色色调低且黄色色调高(a*值最低,b*值最高),颜色表现并不突出。相反,‘丹菲特’单品种干红葡萄酒的颜色表现好。
表2 调配葡萄酒的颜色参数
Table 2 Color parameters of blending wine
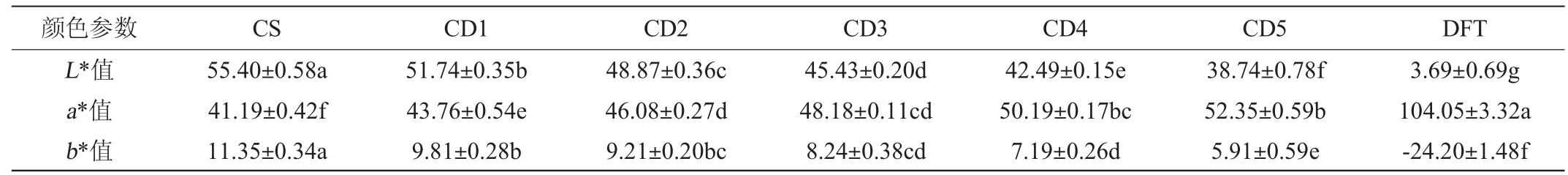
注:同一行不同小写字母表示样品间差异显著(P<0.05)。下同。
2.2 花色苷酚类物质差异分析
2.2.1 单体花色苷
葡萄酒颜色的差异主要受到酚类物质的影响,其中单体花色苷是葡萄酒颜色的主要贡献物[11]。不同酒样中单体花色苷的含量见表3。由表3可知,各组样品均检测出了包括花青素类、甲基花青素类、花翠素类、甲基花翠素类、二甲花翠素类的葡萄糖苷。其中,花青素类和甲基花青素类花色苷呈现橙红色;花翠素类、甲基花翠素类和二甲花翠素类呈现蓝色[12]。各类单体花色苷的含量均随着配体‘丹菲特’单品种干红葡萄酒比例的增加而增大,二甲花翠素类花色苷含量最高,是葡萄酒呈现蓝色色调的最主要的花色苷。
表3 调配葡萄酒中单体花色苷含量的测定结果
Table 3 Determination results of mono-anthocyanins contents in blending wine mg/L

由表3亦可知,在各类单体花色苷中均检测到了乙酰化和香豆酰化葡萄糖苷。酰化作为酚类物质最常见的修饰方式之一,不仅能够使花色苷的颜色加深,还能对花色苷颜色的稳定起到促进作用,未经酰化的花色苷由于没有酰基保护很容易在弱酸性或中性条件下脱色[13]。随着配体‘丹菲特’单品种干红葡萄酒比例的上升,酰化花色苷的含量显著增大(P<0.05),提高了葡萄酒颜色的稳定性及其陈酿潜力。
2.2.2 聚合花色苷
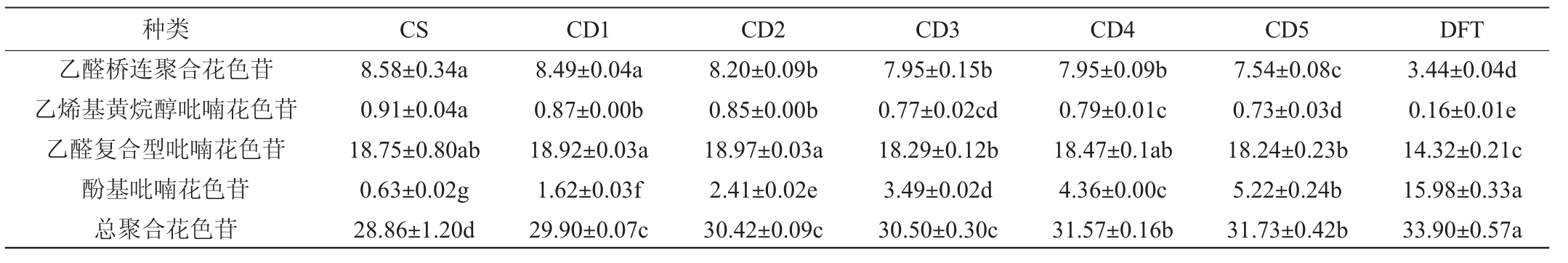
聚合花色苷是由单体花色苷经过聚合或加成反应生成的花色苷衍生物,能够使单体花色苷的最大吸收波长发生偏移,从而在一定程度上影响葡萄酒的颜色[14]。不同酒样中聚合花色苷的含量见表4。由表4可知,从样品中共检测出4种聚合花色苷,包括乙醛桥连聚合花色苷、乙烯基黄烷醇吡喃花色苷、乙醛复合型吡喃花色苷和酚基吡喃花色苷[15]。二甲花翠素能够通过乙醛介导与黄烷醇聚合形成乙醛桥连聚合花色苷,引起最大吸收波长红移,增强葡萄酒的颜色[16-17]。此外,也有研究表明,乙烯基黄烷醇吡喃花色苷也能够引起最大吸收波长发生红移[18],显示出红紫色和深蓝色[16]。由于‘丹菲特’单品种干红葡萄酒中乙醛桥连聚合花色苷和乙烯基黄烷醇吡喃花色苷的含量显著低于‘赤霞珠’单品种干红葡萄酒(P<0.05),显著降低了这两种聚合花色苷在调配葡萄酒中的含量。酰化花色苷与丙酮酸和乙醛聚合形成的乙醛复合型花色苷能引起明显的蓝移,在葡萄酒中呈现出橙黄色[19]。‘丹菲特’单品种葡萄酒中的乙烯基黄烷醇吡喃花色苷含量显著低于‘赤霞珠’单品种干红葡萄酒(P<0.05),但在调配酒样中的含量无明显下降(P>0.05)。酚基吡喃花色苷是花色苷与乙烯基愈创木酚、4-乙烯基儿茶酚和4-乙烯基酚聚合形成的花色苷衍生物,能引起最大吸收波长蓝移[20],在葡萄酒中呈现出橙红色[21]。‘丹菲特’单品种葡萄酒中有较高含量的酚基吡喃花色苷,在调配过程中显著增加了调配酒样中的酚基花色苷含量,对‘赤霞珠’单品种干红葡萄酒显示出的红紫色有影响。聚合花色苷的总含量随‘丹菲特’单品种葡萄酒添加比例的上升而增大,能够增强调配葡萄酒的颜色表现和稳定性。
表4 调配葡萄酒中聚合花色苷含量的测定结果
Table 4 Determination results of poly-anthocyanins contents in blending wine
mg/L
2.3 非花色苷酚类物质差异分析
2.3.1 黄酮醇
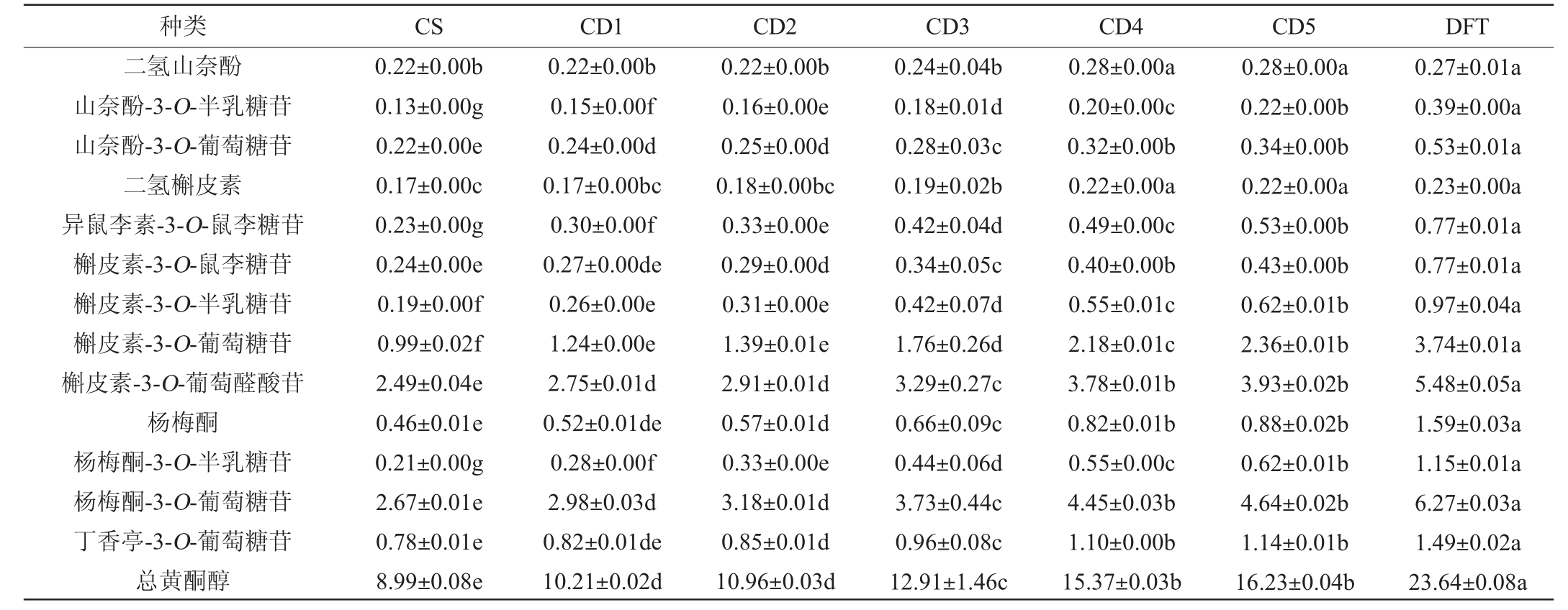
对于干红葡萄酒而言,黄酮醇类化合物是一种很好的辅色素因子[22]。黄酮醇主要以糖苷结合的形式存在于葡萄酒中,可以与花色苷形成更稳定的色素复合体,引起最大吸收波长红移,改善干红葡萄酒的颜色表现[23]。不同酒样中黄酮醇的含量见表5。
由表5可知,从酒样中共检测到13种黄酮醇类物质,包括山奈酚类、槲皮素类、杨梅酮类、异鼠李素类和丁香亭类化合物,其中槲皮素类黄酮醇在各组酒样中的含量是5类黄酮醇中最高的。在pH为3.5的条件下,槲皮素是各类黄酮醇中较为有效的辅色素因子,能够形成稳定性较高的色素复合体[24]。在调配过程中,槲皮素类黄酮醇的含量随‘丹菲特’单品种葡萄酒的添加比例增高而增大,其余各类黄酮醇含量均表现出与槲皮素一致的上升趋势。由表6亦可知,黄酮醇总含量随着‘丹菲特’单品种干红葡萄酒添加比例的增高而增大,在一定程度上提高了‘赤霞珠’单品种干红葡萄酒的颜色品质。
表5 调配葡萄酒中黄酮醇含量的测定结果
Table 5 Determination results of flavonols contents in blending wine mg/L
2.3.2 黄烷醇
黄烷醇的辅色效果相对有限,但其在数量上占有优势,因此,黄烷醇类物质仍然能够成为一种较为理想的辅色素因子[25]。由表6可知,在各组酒样中共测得5种黄烷醇类物质,分别为儿茶素、表儿茶素、表棓儿茶素、原花青素二聚体B1和原花青素二聚体B2,其中儿茶素分子的空间结构易造成位阻效应,阻碍了与花色苷的组合,从而影响了辅色作用的发生[26]。儿茶素在‘赤霞珠’单品种干红葡萄酒中的含量随着‘丹菲特’单品种葡萄酒的添加而下降,有利于干红葡萄酒颜色的表现。表儿茶素与儿茶素相比,其结构中的异构化可以与花色苷分子较好的结合在一起,具有很好的辅色化表现[27]。此外,二聚体的花青素分子也被证实具有一定的辅色能力[25]。但由于表儿茶素及原花青素二聚体B2在‘丹菲特’单品种葡萄酒中的含量较低,调配过程并没有显著增加这两种物质在‘赤霞珠’单品种干红葡萄酒中的含量。而原花青素二聚体B1的含量随‘丹菲特’单品种干红葡萄酒的添加而逐渐增高,对于‘赤霞珠’干红葡萄酒的颜色是一种良性的变化。
表6 调配葡萄酒中黄烷醇含量的测定结果
Table 6 Determination results of flavanols contents in blending wine mg/L
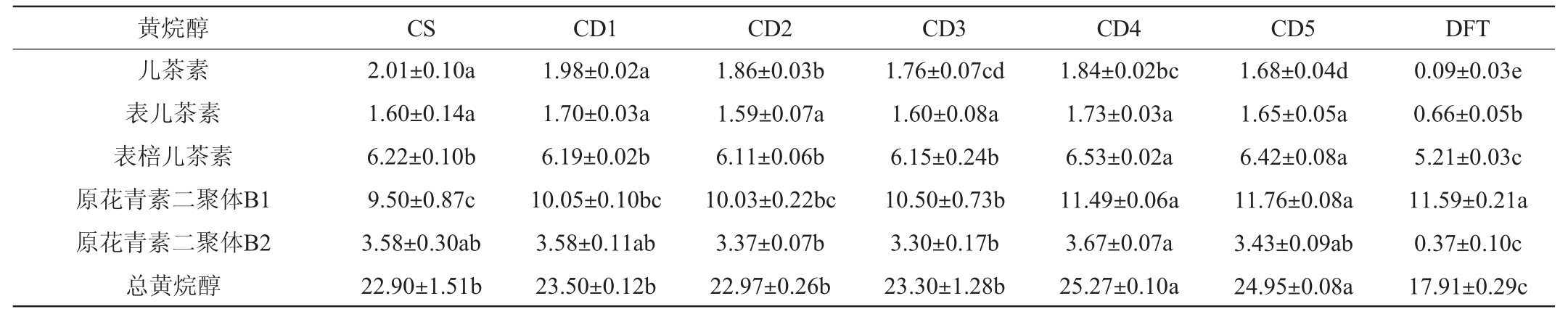
2.4 基于葡萄酒酚类物质含量调配萄葡酒样品的主成分分析
葡萄酒中酚类物质间复杂的聚合或辅色反应为预测调配葡萄酒的颜色品质提高了难度[28]。本研究对‘赤霞珠’、‘丹菲特’两款单品种干红葡萄酒和5组调配葡萄酒的酚类物质含量进行主成分分析,结果见图1。由图1可知,主成分1的方差贡献率为90.8%,主成分2的方差贡献率为7.73%,说明前两个主成分共解释了98.53%的变量。主成分1能将基酒、配体酒和调配酒区分开,黄酮醇类、单体花色苷类物质位于x轴的正半轴,说明随着‘丹菲特’单品种干红葡萄酒添加比例的提高,这些物质的含量逐渐增大。而大部分黄烷醇类、聚合花色苷类物质位于x轴的负半轴,说明调配降低了部分黄烷醇类和聚合花色苷类物质含量。主成分2将添加20%和25%的‘丹菲特’单品种干红葡萄酒的调配葡萄酒(CD4和CD5)与其余葡萄酒区分开,主要贡献物质是黄烷醇类和黄酮醇类物质。大部分的黄烷醇类和黄酮醇类物质位于y轴的正半轴,说明CD4和CD5葡萄酒样品中含有较高含量的黄烷醇和黄酮醇。结合两个主成分来看,本试验所设计的‘丹菲特’单品种干红葡萄酒添加比例对‘赤霞珠’单品种干红葡萄酒的酚类物质均有积极的作用,其中‘丹菲特’葡萄酒占比在20%和25%时的调配效果较好。
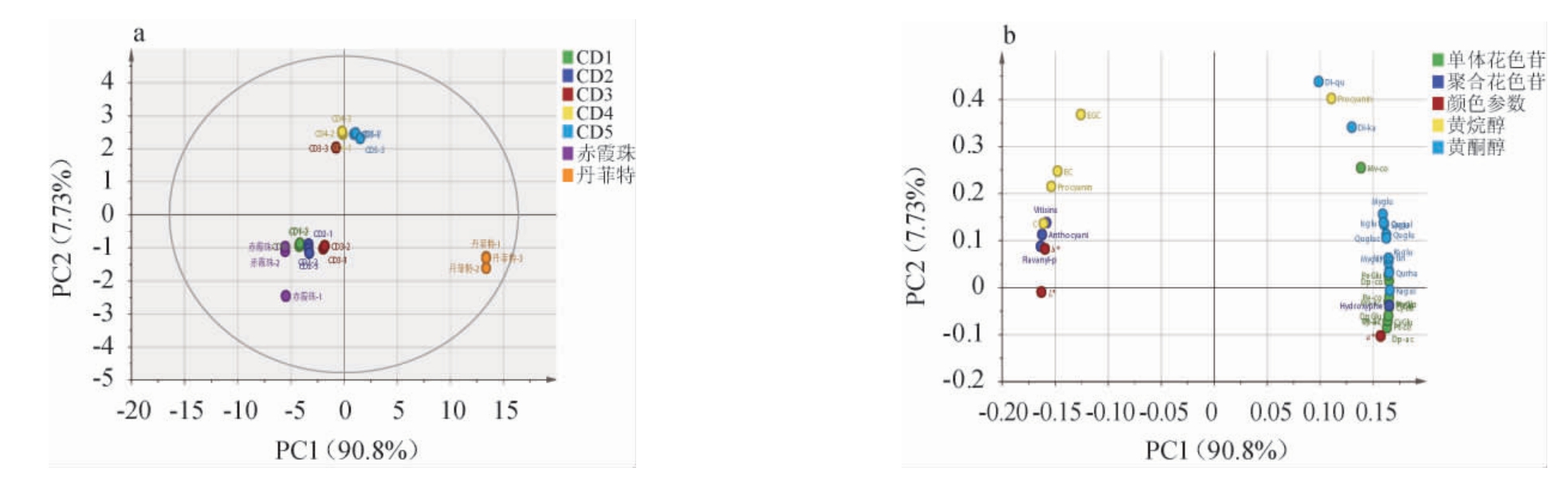
图1 基于葡萄酒酚类物质含量调配萄葡酒样品的主成分分析得分图(a)和载荷图(b)
Fig.1 Principal component analysis score plot (a) and loading plot (b) of blending wine samples based on phenols contents in wine
3 结论
本研究将‘丹菲特’单品种干红葡萄酒作为配体,与‘赤霞珠’单品种干红葡萄酒在发酵后按5种比例进行二元调配。结果表明,在调配过程中,‘丹菲特’单品种干红葡萄酒能够提高‘赤霞珠’干红葡萄酒的红色色调,降低黄色色调,加强其颜色表现。此外,‘丹菲特’单品种干红葡萄酒能够赋予‘赤霞珠’干红葡萄酒更高的花色苷类和黄酮醇类物质含量,提高其酚类物质水平。结合酚类物质含量进行主成分分析,发现‘丹菲特’单品种干红葡萄酒占比在20%和25%时对‘赤霞珠’干红葡萄酒均有较好的效果,本研究结果能够为解决新疆产区‘赤霞珠’干红葡萄酒的颜色品质问题提供基本参考。
[1] GORDILLO B,RODRÍGUEZ-PULIDO F J,ESCUDERO-GILETE M L,et al.Comprehensive colorimetric study of anthocyanic copigmentation in model solutions.Effects of pH and molar ratio[J].J Agr Food Chem,2012,60(11):2896-2905.
[2] 张欣珂,赵旭,成池芳,等.葡萄酒中的酚类物质I:种类、结构及其检测方法研究进展[J].食品科学,2019,40(15):255-268.
[3] LI S Y,ZHAO P R,LING M Q,et al.Blending strategies for wine color modification I:color improvement by blending wines of different phenolic profiles testified under extreme oxygen exposures[J].Food Res Int,2020,130:108885.
[4] 凌梦琪,邹文文,吴广枫,等.发酵后混酿调控‘赤霞珠’葡萄酒的香气和色泽[J].现代食品科技,2021,37(4):234-241.
[5] 武运,田歌,陈新军,等.新疆葡萄酒产业发展趋势新视角探析[J].中国酿造,2018,37(10):200-204.
[6] 何玉云,李华,李洋,等.酿酒葡萄“丹菲德”的品种特性研究[J].北方园艺,2015(24):1-4.
[7] 卢浩成,魏巍,成池芳,等.5个调色葡萄品种酚类物质轮廓分析[J].食品科学,2021,42(16):145-154.
[8] LIANG N N,PAN Q H,HE F,et al.Phenolic profiles of Vitis davidii and Vitis quinquangularis species native to China[J].J Agr Food Chem,2013,61(25):6016-6027.
[9] AYALA F,ECHÁVARRI J F,NEGUERUELA A I.A new simplified method for measuring the color of wines.III.All wines and brandies[J].Am J Enol Viticult,1999,50(3):359-363.
[10] GONNET J F.Colour effects of co-pigmentation of anthocyanins revisited-1.A colorimetric definition using the CIELAB scale[J].Food Chem,1998,63(3):409-415.
[11] CÁNDIDA L,FRANCISCO P,AMAYA Z,et al.Effect of red grapes cowinemaking in polyphenols and color of wines[J]. J Agr Food Chem,2005,53(19):7609-7611.
[12] CASTILLO M N,FERNANDEZ G M,GOMEZ A S.Red-color related phenolic composition of Garnacha Tintorera(Vitis vinifera L.)grapes and red wines[J]. J Agr Food Chem,2009,57(17):7883-7891.
[13] FLINT S D,JORDAN P W,CALDWELL M M.Plant protective response to enhanced UV-B radiation under field conditions: leaf optical properties and photosynthesis[J].Photoch Photobio,1985,41:95-99.
[14] BAKKER J,TIMBERLAKE C F.Isolation,identification,and charac-terization of new color-stable anthocyanins occurring in some red wines[J].J Agr Food Chem,1997,45(1):35-43.
[15] 赵培汝.品种间调配对干红葡萄酒色泽的影响[D].北京:中国农业大学,2019.
[16] ESCRIBANO-BAILON T,ALVAREZ-GARCIA M,RIVAS-GONZALO J C,et al.Color and stability of pigments derived from the acetaldehyde-mediated condensation between malvidin-3-O-glucoside and (+)-catechin[J].J Agr Food Chem,2001,49(3):1213-1217.
[17] ATANASOVA V,FULCRAND H,CHEYNIER W,et al.Effect of oxygenation on polyphenol changes occurring in the course of wine-making[J].Anal Chim Acta,2002,458:15-27.
[18] SANTOS-BUELGA C,FRANCIA-ARICHA E M,DE PASCUALTERESA S,et al.Contribution to the identification of the pigments responsible for the browning of anthocyanin-flavanol solutions[J]. Eur Food Res Technol,1999,209(6):411-415.
[19] BAKKER J,BRIDLE P,HONDA T,et al.Identification of an anthocyanin occurring in some red wines[J]. Phytochemistry,1997,44(7):1375-1382.
[20] SANTOS P J C D,BRILLOUET J M,CHEYNIER V,et al.Detection and partial characterisation of new anthocyanin-derived pigments in wine[J]. J Sci Food Agr,2015,70(2):204-208.
[21] DE FREITAS V,MATEUS N.Formation of pyranoanthocyanins in red wines:anewanddiverseclassofanthocyaninderivatives[J].Anal Bioanal Chem,2011,401(5):1463-1473.
[22] FULVIO M,RAFFAELE G,URSKA V,et al.Metabolite profiling of grape:Flavonols and anthocyanins[J]. J Agr Food Chem,2006,54(20):7692-7702.
[23] CHEN L J,RAZDINA G.Structural aspects of anthocyanin-flavonoid complex formation and its role in plant color[J].Phytochemistry,1981,20(2):297-303.
[24] TEIXEIRA N,CRUZ L,BRAS N F,et al.Structural features of copigmentation of oenin with different polyphenol copigments[J].J Agr Food Chem,2013,61(28):6942-6948.
[25] ANDRÉ S,PAULA A,LUÍS C,et al.Evidence for copigmentation interactions between deoxyanthocyanidin derivatives (oaklins) and common copigments in wine model solutions[J].J Agr Food Chem,2014,62(29):6995-7001.
[26] MANUELA G M,SUSANA G M,M TERESA E B,et al.Influence of different phenolic copigments on the color of malvidin-3-O-glucoside[J].J Agr Food Chem,2006,54(15):5422-9.
[27] LAMBERT S G,ASENSTORFER R E,WILLIAMSON N M,et al.Copigmentation between malvidin-3-O-glucoside and some wine constituentsanditsimportancetocolourexpressioninred wine[J].Food Chem,2011,125(1):106-115.
[28] 赵旭,张欣珂,陈新军,等.葡萄酒中的酚类物质II:辅色效应与生物活性研究进展[J].食品科学,2019,40(17):284-294.