发酵茶一般指在茶叶制作中经过生物酶氧化发酵或者微生物发酵的茶[1],是我国的特色资源[2]。发酵过程中蛋白质水解、淀粉递减、青气物质以及芳香物质不断增加,最终构成发酵茶特有的风味及香气。茶多酚约占茶叶干燥后质量的14%~24%[3-4],其主要成分儿茶素可以调节细胞、抗衰老及抗氧化[5],可以通过作用于酶体系达到抗癌、抗突变的作用。茶多酚的含量对茶叶品质本身有较大影响,也是茶叶独特风味形成不可缺少的一种物质[6]。
自由基是具有非偶电子的基团或原子,自由基过量会导致机体正常机能损伤,诱发各种疾病,如神经变性和癌症[7-8]。很多非天然的抗氧化剂在某种程度上对机体都存在毒副作用[9],而天然的抗氧化活性物质毒性小且抗氧化效果显著,对过氧化氢、超氧自由基、羟自由基等有良好的清除效果。亚硝酸盐是一种常用的食品添加剂,可作为发色剂或抗菌剂使用,但过量摄入亚硝酸盐可导致机体缺氧和急性中毒,此外亚硝酸盐可以转变为致癌物亚硝胺,清除食品中过量的亚硝酸盐是一条有效保健措施[10-12]。目前,国内研究人员对茶叶的各项研究主要集中在红茶、普洱茶、绿茶等[13]。绿茶收敛性物质较多,虽然抗氧化性以及亚硝酸盐清除效果较好,但对胃部有较强的刺激性,而发酵茶的部分收敛性物质已经被氧化酶氧化,相比较之下更温和,对胃的刺激较小,且这些氧化产物对人体消化吸收也有帮助。普洱茶、滇红茶、茯砖茶、青砖茶等是发酵茶著名种类,试验选取上述4种发酵茶,研究其茶多酚含量及抗氧化性活性,为发酵茶的保健功能提供实验依据,为发酵茶的进一步开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
普洱茶样品(2种)、滇红茶样品(2种)、茯砖茶样品(2种)、青砖茶样品(2种):市售。
柠檬酸、酒石酸铁、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、氨基苯磺酸、磷酸氢二钠、亚硝胺等(均为分析纯):国药集团化学试剂公司。其他试剂均为国产分析纯。
1.2 仪器与设备
UV2150紫外可见分光光度计:尤尼柯(上海)仪器有限公司;FA1004B分析天平:上海佑科仪器仪表有限公司。
1.3 方法
1.3.1 茶浸提液的制备
分别称取8种发酵茶样品各3 g于三角瓶中,加入30 mL沸水,于80 ℃恒温浸提20 min,过滤,共浸提3次,合并浸提液,冷却,定容于100 mL容量瓶中。将8种发酵茶进行编号,分别为普洱茶样品1(T1)、普洱茶样品2(T2)、滇红茶样品1(T3)、滇红茶样品2(T4)、茯砖茶样品1(T5)、茯砖茶样品2(T6)、青砖茶样品1(T7)、青砖茶样品2(T8)。
1.3.2 茶多酚含量测定
参考文献[14],采取酒石酸铁比色法,于波长540 nm处测定茶浸提液反应体系的吸光度值,并计算茶多酚含量,其计算公式如下:
式中:A1为浸提液的吸光度值;A2为空白对照的吸光度值;M为发酵茶质量,g;V为浸提液稀释倍数;1.957为吸光度值等于0.50时,相当于每毫升浸提液中含有1.957 mg茶多酚。
1.3.3 DPPH自由基清除率的测定
参考文献[15-16]并进行修改:取10支10 mL比色管,各加入0、1 mL、2 mL、3 mL、4 mL、5 mL、6 mL、7 mL、8 mL、9 mL发酵茶浸提液,蒸馏水稀释至刻度线即为不同浓度浸提液,待用。再取10支10mL的比色管分别吸取3mL0.1mmol/L的DPPH溶液置于其中,再加入1 mL不同含量的发酵茶浸提液,充分混匀,室温避光反应30 min后,测定吸光度值,并计算DPPH自由基清除率,其计算公式如下:
式中:A1为DPPH溶液加发酵茶浸提液的吸光度值;A2为发酵茶浸提液的吸光度值;A0为未加浸提液时DPPH溶液的吸光度值。
1.3.4 亚硝酸盐清除率的测定
参考文献[17]并稍作修改:在10支25 mL比色管中分别加入2.0 mL质量浓度为5.0 μg/mL的NaNO2标准液,再分别加入0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL的发酵茶浸提液,于37 ℃恒温水浴反应20 min,依次加入氨基苯磺酸等试剂,于最大吸收波长处测定吸光度值,并计算亚硝酸盐清除率,其计算公式如下:
式中:A0为未加浸提液时NaNO2标准液的吸光度值;A1为NaNO2标准液加发酵茶浸提液的吸光度值。
1.3.5 亚硝胺合成阻断率的测定
参考文献[17]并稍作修改:模拟人体胃液生理条件下(37 ℃,pH约为3.0)亚硝胺合成阻断率测定。分别吸取最初制取的发酵茶浸提液0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL于10支25 mL比色管中,依次加入柠檬酸-磷酸氢二钠缓冲溶液等试剂,最后于37 ℃条件下恒温水浴反应1 h,即得亚硝胺溶液,备用。
取10支10 mL比色管,分别吸取1.0 mL亚硝胺溶液置于比色管中,依次加入Na2CO3溶液等,于最大吸收波长处测定其吸光度值,并计算亚硝胺合成阻断率,其计算公式如下:
式中:A0为以蒸馏水代替浸提液时亚硝胺溶液的吸光度值;A1为发酵茶浸提液加亚硝胺溶液的吸光度值。
1.3.6 数据处理
所有数据平行测定3次,结果以平均值±标准偏差表示。利用Origin 8.0作图,利用Excel对数据进行方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 发酵茶茶多酚含量测定
由图1可知,8种发酵茶样品中T4(滇红茶样品2)茶多酚含量最高,为10%;T7(青砖茶样品2)最低,为3.4%。茶多酚含量从高到低依次为滇红茶>普洱茶>茯砖茶>青砖茶。由于发酵过程中茶多酚会被氧化,故发酵茶茶多酚含量较低,而青砖茶、茯砖茶、普洱茶属于后发酵茶,发酵时间较滇红茶长,故茶多酚含量比滇红茶要低。
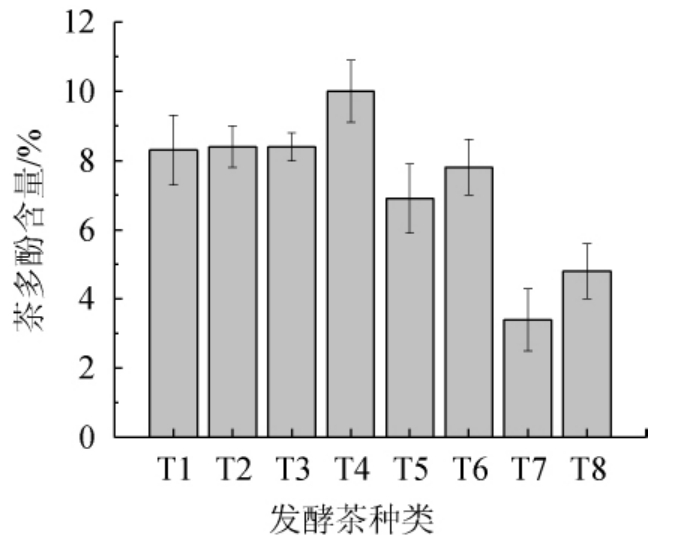
图1 8种发酵茶的茶多酚含量
Fig. 1 Tea polyphenols contents of 8 fermented teas
2.2 发酵茶抗氧化活性测定
DPPH自由基是一种化学活性不高的自由基,溶于无水乙醇后溶液体系呈紫色,还原剂(或称自由基清除剂)能够清除单电子[19],使体系颜色变化。
由表1可知,T1(普洱茶样品1)的DPPH自由基清除率随添加量的增加呈先增大后减少再增大的趋势;当加入0.9 mL/mL T1时,DPPH自由基清除率达80.5%。T2(普洱茶样品2)的DPPH自由基清除率随浸提液的增加而增加;当加入0.9 mL/mL T2(普洱茶样品2)时,DPPH自由基清除率为72.9%,清除能力较好。T3(滇红茶样品1)和T4(滇红茶样品2)的DPPH自由基清除率均随浸提液的增加而增加,但变化趋势较平缓;当加入0.9 mL/mL T3、T4时,DPPH自由基清除率分别为70.8%、77.1%,自由基清除能力较好;浸提液含量相同时,T4对DPPH自由基的清除率显著高于T3(P<0.05)。T5(茯砖茶样品1)和T6(茯砖茶样品2)的DPPH自由基清除率均随浸提液的增加而增加;当加入0.9 mL/mL T5时,自由基清除率为64.2%;当加入0.8 mL/mLT6时,DPPH自由基清除率达78.4%,当加入茶浸提液>0.8 mL/mL后,自由基清除率基本不变;浸提液含量相同时,T5对DPPH自由基的清除率显著高于T3(P<0.05)。T7(青砖茶样品1)和T8(青砖茶样品2)的DPPH自由基清除率随浸提液的增加而增加。当加入0.7 mL/mL T7时,DPPH自由基清除率达74.9%,加入茶浸提液>0.7 mL/mL后清除率变化趋于平缓;当加入0.9 mL/mL T8时,DPPH自由基清除率达71.1%。
表1 8种发酵茶浸提液对DPPH自由基清除率的影响
Table 1 Effects of extracts of 8 fermented teas on DPPH radical scavenging rate
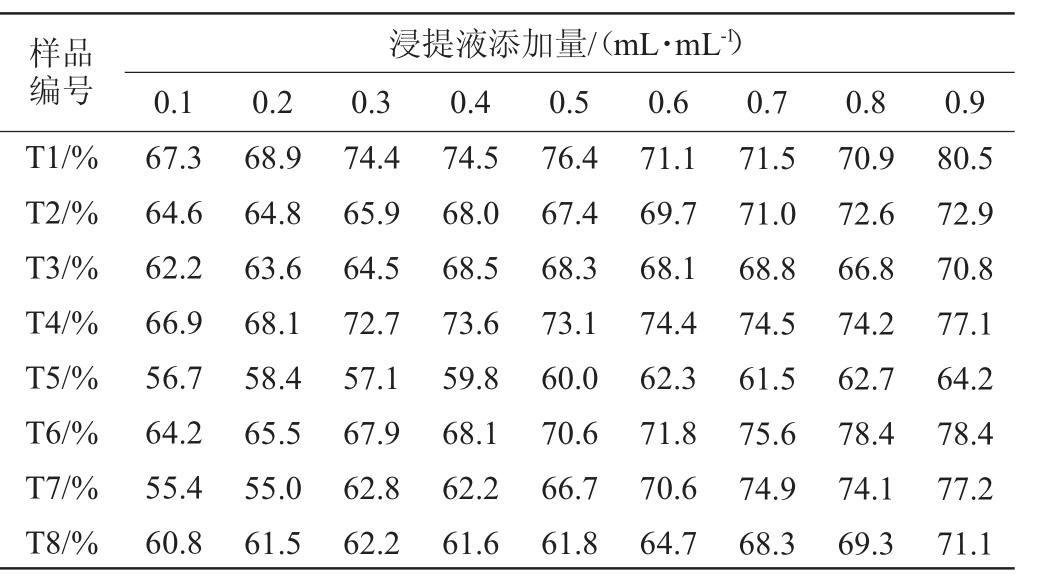
比较表1中T1~T8对DPPH自由基清除率的影响可知,0.1 mL/mL发酵茶浸提液对DPPH自由基的清除率均>50%,且随浸提液含量的增加而增加,但变化趋势较平缓,不呈线性关系。
2.3 发酵茶亚硝酸盐清除率的测定
NaNO2中的N元素处于中间价态,既可以被氧化也可以被还原,在一定条件下,可以生成具有致癌作用的N-亚硝基化合物[20],对人体健康具有潜在威胁。目前,常用于检测亚硝酸盐含量的方法主要有固相萃取光谱法、离子色谱法以及分光光度法等[21]。
2.3.1 普洱茶亚硝酸盐清除率的测定
由图2可知,随着普洱茶浸提液的增加,亚硝酸盐清除率逐渐增加。当加入0.9 mL/mL T1时,亚硝酸盐清除率为33.4%;当加入0.9 mL/mL T2时,亚硝酸盐清除率为71.0%,具有较好的亚硝酸盐清除能力。
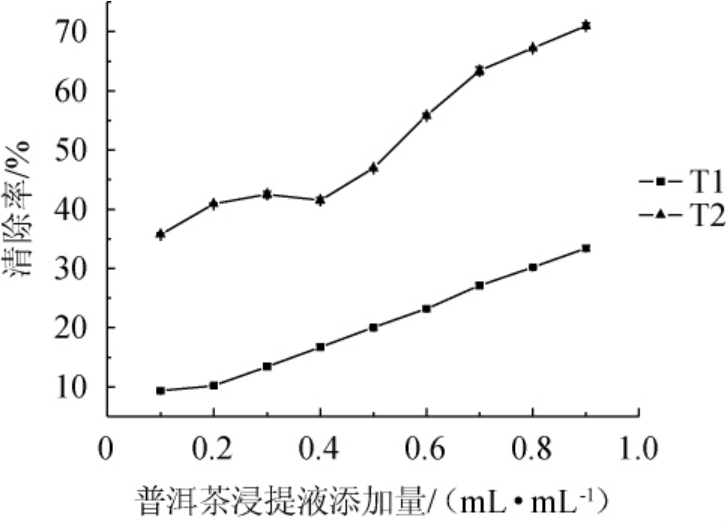
图2 普洱茶浸提液对亚硝酸盐清除率的影响
Fig. 2 Effect of extract of Pu'er tea on nitrite scavenging rate
2.3.2 滇红茶亚硝酸盐清除率的测定
由图3可知,随着滇红茶浸提液的增加,亚硝酸盐清除率逐渐增加,当加入0.9 mL/mL T3时,亚硝酸盐清除率为38%;当加入0.9 mL/mL T4时,亚硝酸盐清除率为58.2%,具有较好的亚硝酸清除能力。
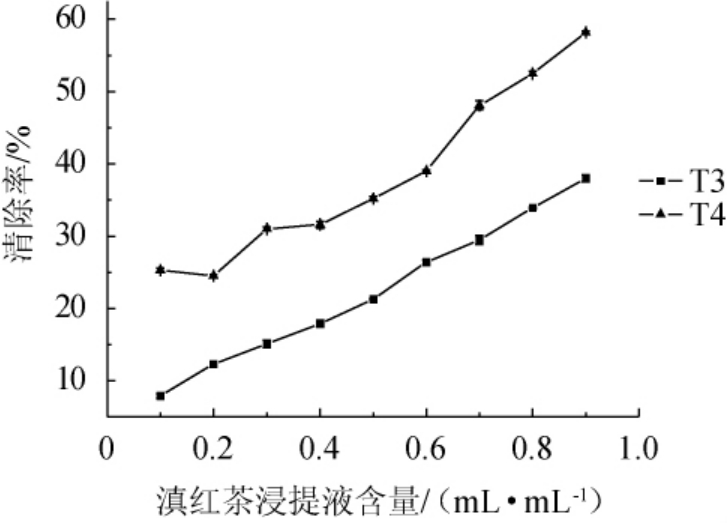
图3 滇红茶浸提液对亚硝酸盐清除率的影响
Fig. 3 Effect of extract of Yunnan black tea on nitrite scavenging rate
2.3.3 茯砖茶亚硝酸盐清除率的测定
由图4可知,随着茯砖茶浸提液的增加,亚硝酸盐清除率逐渐增加。当加入0.9 mL/mL T5、T6时,亚硝酸盐清除率分别为38.9%、56.2%。
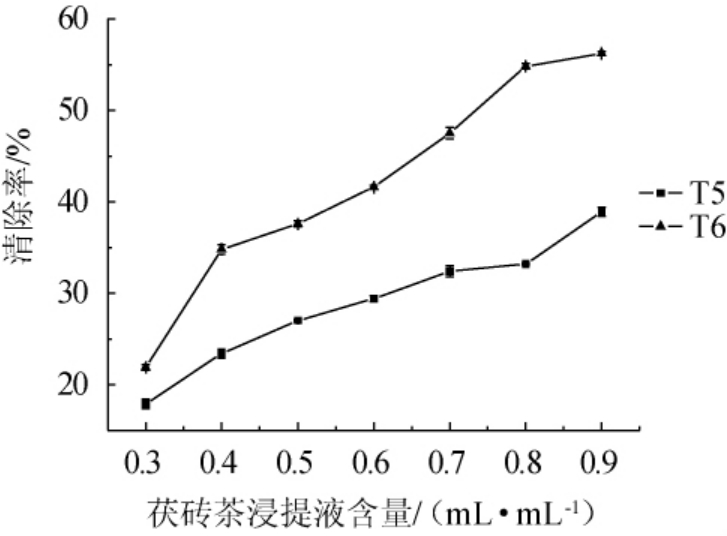
图4 茯砖茶浸提液对亚硝酸盐清除率的影响
Fig. 4 Effect of extract of Fuzhuan tea on nitrite scavenging rate
2.3.4 青砖茶亚硝酸盐清除率的测定
由图5可知,随着青砖茶浸提液的增加,亚硝酸盐清除率逐渐增加。当加入0.9 mL/mL T7时,亚硝酸盐清除率为31.3%;当茶浸提液含量到0.8 mL/mL后,清除率变化趋于平缓。在加入T8浸提液体积>0.3 mL/mL之后,亚硝酸盐清除率增加趋势较快,当加入0.9 mL/mL T8时,亚硝酸盐清除率为53.2%。
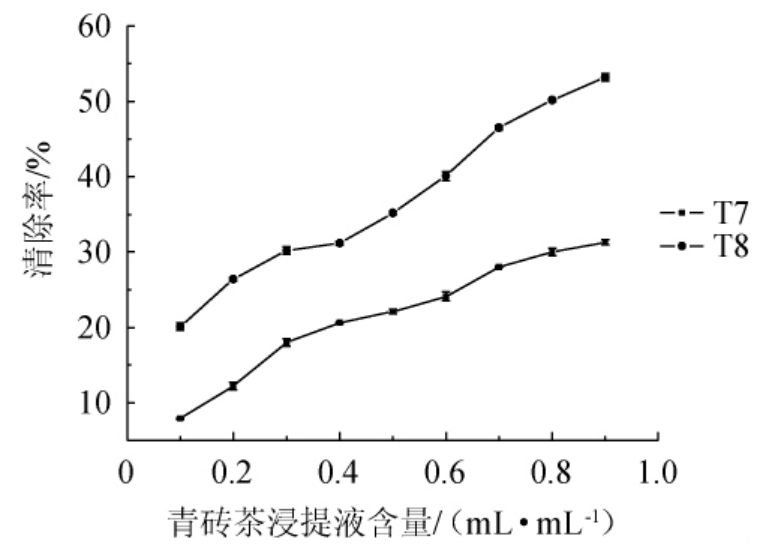
图5 青砖茶浸提液对亚硝酸盐清除率的影响
Fig. 5 Effect of extract of Qingzhuan tea on nitrite scavenging rate
综上可知,亚硝酸盐清除率随茶浸提液含量的增加而增加,且线性关系较好,但当加入茶浸提液含量一定时,亚硝酸盐清除率变化趋势逐渐趋于平缓,这与梁婧瑶等[22]研究结果相同。
2.4 发酵茶亚硝胺合成阻断率测定
2.4.1 普洱茶亚硝胺合成阻断率测定
由图6可知,随着普洱茶浸提液含量增加,亚硝胺合成阻断率逐渐增加。当加入T1、T2含量>0.4 mL/mL之后,亚硝胺合成阻断率增加趋势较快,当加入0.9 mL/mL T1、T2时,亚硝胺合成阻断率分别为94.9%、85%。
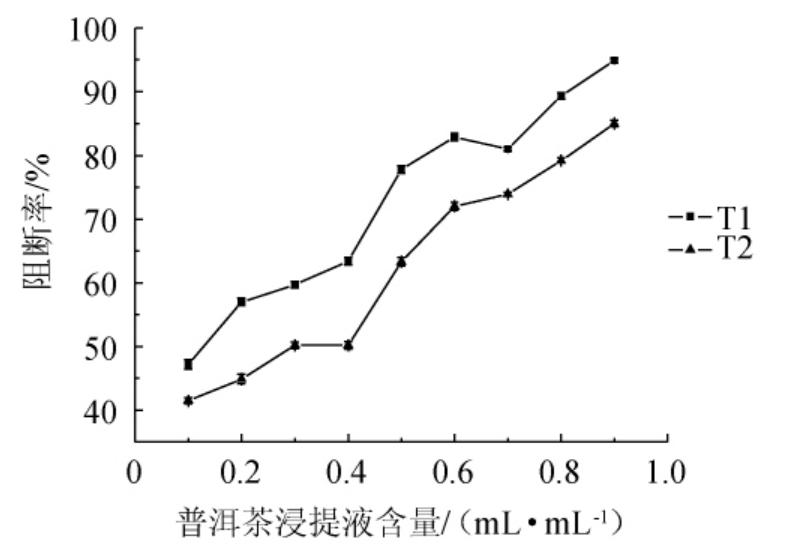
图6 普洱茶浸提液对亚硝胺合成阻断率的影响
Fig. 6 Effect of extract of Pu'er tea on blocking rate of nitrosamine synthesis
2.4.2 滇红茶亚硝胺合成阻断率测定
由图7可知,随着滇红茶浸提液含量增加,亚硝胺合成阻断率逐渐增加;前期亚硝胺合成阻断率增加趋势较快,在加入茶浸提液含量>0.4 mL/mL之后,变化趋势趋于平缓,当加入0.8 mL/mL T3时,亚硝胺合成阻断率为94.5%,可有效阻断了亚硝胺合成,超过0.8 mL/mL后,阻断率变化较平缓。当加入0.7 mL/mL T4时,亚硝胺合成阻断率为70.4%,超过0.7 mL/mL之后,变化趋势趋于平缓。
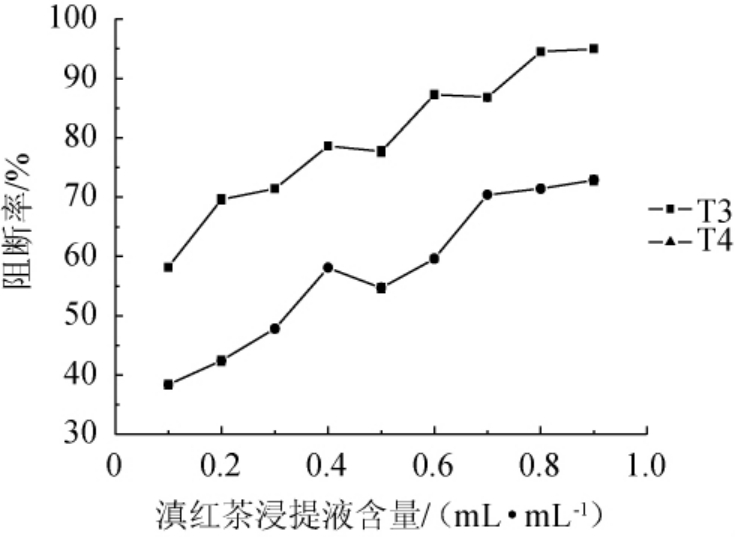
图7 滇红茶浸提液对亚硝胺合成阻断率的影响
Fig. 7 Effect of extract of Yunnan black tea on blocking rate of nitrosamine synthesis
2.4.3 茯砖茶亚硝胺合成阻断率测定
由图8可知,随着茯砖茶浸提液含量增加,亚硝胺合成阻断率逐渐增加。在加入0.3 mL/mL T5前,亚硝胺合成阻断率增加趋势较快,当加入0.7 mL/mL T5时,亚硝胺合成阻断率为90%,说明T5有效地阻断率了亚硝胺合成,超过0.7 mL/mL之后变化趋于平缓。在加入0.3 mL/mL T6后,亚硝胺合成阻断率变化最快,在超过0.7 mL/mL之后,变化趋势趋于平缓,当加入0.9 mL/mL茶浸提液时,亚硝胺合成阻断率为72.9%。

图8 茯砖茶浸提液对亚硝胺合成阻断率的影响
Fig. 8 Effect of extract of Fuzhuan tea on blocking rate of nitrosamine synthesis
2.4.4 青砖茶亚硝胺合成阻断率测定
由图9可知,随着青砖茶浸提液含量增加,亚硝胺合成阻断率逐渐增加。在加入0.3 mL/mL T7前,亚硝胺合成阻断率变化趋势较快,当加入0.7 mL/mL T7时,亚硝胺合成阻断率为81.1%,亚硝胺合成阻断能力良好,超过0.7 mL/mL后阻断率变化趋于平缓。在加入0.5 mL/mL T8后,亚硝胺合成阻断率变化趋势最快,超过0.6 mL/mL后变化趋势趋于平缓,当加入0.6 mL/mL T8时,亚硝胺合成阻断率为69.9%。
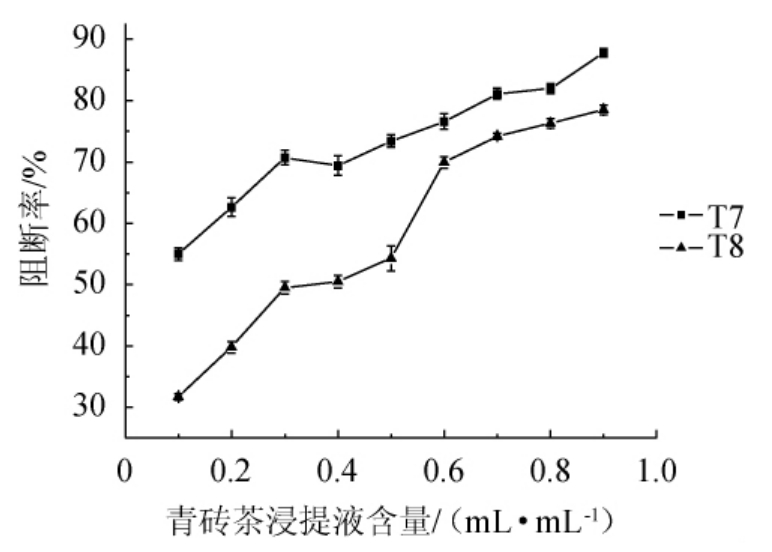
图9 青砖茶浸提液对亚硝胺合成阻断率的影响
Fig. 9 Effect of extract of Qingzhuan tea on blocking rate of nitrosamine synthesis
3 讨论
发酵茶是根据发酵程度不同来进行分类[23]。发酵茶在其制作过程中叶绿素、茶多酚等受到一定程度的破坏,主要有效成分为咖啡因和没食子酸,故较未经发酵的茶而言,发酵茶茶多酚含量略低,这与吴警[24]研究结果相同。由结果分析可知,发酵茶的抗氧化活性与茶多酚含量有一定的相关性,但并不是完全呈正相关,如实验中茶多酚含量最高的是滇红茶,但DPPH自由基清除率最高的却是普洱茶,这可能是由于茶叶中富含多种抗氧化活性成分,其总抗氧化活性与活性成分之间的协同作用密切相关。
发酵茶具有良好的亚硝酸盐清除能力以及亚硝胺合成阻断能力,具有潜在抗癌能力。发酵茶亚硝酸盐清除能力及亚硝胺合成阻断能力与加入茶浸提液体积呈线性相关,且这两种能力与茶多酚含量也有一定的相关性,也有研究表明抗氧化剂对亚硝酸盐清除能力较好[25]。
4 结论
实验结果表明,8种发酵茶中滇红茶样品2浸提液的茶多酚含量最高,为10%,青砖茶样品2最低,为3.4%。8种发酵茶浸提液含量为0.9 mL/mL时,普洱茶样品1的DPPH自由基清除率较高,为80.5%,茯砖茶样品1清除率较低,为64.2%;普洱茶样品2亚硝酸盐清除率较高,为71.0%,青砖样品1清除率较低,为31.3%;滇红茶样品1亚硝胺合成阻断率较高,为95%,青砖茶样品2阻断率较低,为69.9%;4种发酵茶的抗氧化活性、亚硝酸盐清除能力及亚硝胺合成阻断能力与茶多酚含量有关但并不完全呈正相关。
综上可知,4种发酵茶中茶多酚含量较高且抗氧化能力、亚硝酸盐清除能力及阻断亚硝胺合成能力最好的是普洱茶和滇红茶,在保健食品开发方面具有较大的潜力。实验综合分析了发酵茶抗氧化活性及潜在抗癌能力,为后续开发功能性茶饮料及发酵茶的深入研究提供了实验依据。
[1] 徐正刚,吴良,刘石泉,等.黑茶发酵过程中微生物多样性研究进展[J].生物学杂志,2019,36(3):92-95.
[2] 王姗姗.茶多酚植物甾醇酯的制备及其抗氧化和降胆固醇活性研究[D].杭州:浙江大学,2020.
[3] 曹雪文.大孔树脂对茶多酚提取纯化及茶多酚抗氧化性能研究[D].赣州:江西理工大学,2020.
[4] 王凝,张宇佳,兰朝华,等.不同等级藏茶抗氧化活性及抑菌能力对比研究[J].四川轻化工大学学报(自然科学版),2021,34(6):40-46.
[5] 沈玫.茶多酚的分析方法及其质量标准研究[D].上海:上海交通大学,2014.
[6] 辛董董,李东霄,张浩.不同茶类制茶过程中的化学变化[J].食品研究与开发,2020,41(2):216-224.
[7] 樊岫珊.羟基自由基诱导DNA损伤机理研究进展[J].生物学杂志,2017,34(1):80-84.
[8] 韦献雅,殷丽琴,钟成,等.DPPH法评价抗氧化活性研究进展[J].食品科学,2014,35(9):317-322.
[9] 邱妍川,韦丽佳,李琳,等.基于1,1-二苯基-2-三硝基苯肼检测中药抗氧化成分的方法及其原理研究进展[J].中国药房,2016,27(19):2718-2721.
[10] AMARARATHNA M,HOSKIN D W,VASANTHA RUPASINGHE H P V.Anthocyanin-rich haskap(Lonicera caerulea L.)berry extracts reduce nitrosamine-induced DNA damage in human normal lung epithelial cells in vitro[J].Food ChemToxicol,2020,141(24):111404.
[11] 边丽.危险的致癌物质——亚硝胺[J].兵团教育学院学报,2001(1):55-58.
[12] 李欣,孔保华,马俪珍.肉制品中亚硝胺的形成及影响因素的研究进展[J].食品工业科技,2012,33(10):353-357.
[13] 钟希琼.几种茶叶冲泡液对亚硝化反应抑制作用比较[J].食品科学,2014,39(3):45-48.
[14] 曹博.茶多酚、茶多糖和茶氨酸的综合提纯研究[D].济南:山东大学,2012.
[15] 樊伟伟,陈洁,黄纯,等.海南苦丁茶提取液抗氧化作用的研究[J].农产品加工,2017(24):26-28.
[16] 赵慧芳,马丽,刘洪霞,等.树莓叶茶和嫩尖茶抗氧化活性成分研究[J].食品安全质量检测学报,2019,10(23):7921-7925.
[17] 孙永梅.山药加工副产物中多糖的提取及活性研究[D].南昌:南昌大学,2016.
[18] 党法斌,高峰,郭磊,等.茶多酚含量测定方法研究综述[J].食品工业科技,2012,33(5):410-412,417.
[19] TZANKOVA D,VLADIMIROVA S,ALUANI D,et al.Synthesis, in vitro safety and antioxidant activity of new pyrrole hydrazones[J]. Acta Pharmaceut,2020,70(3):303-324.
[20] 刘星.山楂、洋葱提取物清除亚硝酸盐作用条件及机理初探[D].泰安:山东农业大学,2013.
[21] 刘广福,王硕,孙蕊,等.分光光度法同时测定肉制品中的硝酸盐和亚硝酸盐[J].安徽农业科学,2013,41(20):8706-8707,8781.
[22] 梁婧瑶,谢宇荀,赖成泽,等.莞香茶对亚硝酸盐的清除效率研究[J].广州化工,2019,47(14):89-91.
[23] 张小娜.茯砖茶化学成分及抗氧化活性研究[D].北京:北京中医药大学,2014.
[24] 吴警.普洱茶发酵微生物的研究[D].大连:大连工业大学,2011.
[25] 侯钟令,周才琼.茶多酚和维生素C清除亚硝酸盐反应的简化模型的构建[J].食品工业科技,2017,38(6):119-123.