香兰素(vanillin)又名香草醛,最早发现于墨西哥兰科植物香荚兰的豆荚中[1]。其是世界上产量最大的香料,具有抗菌作用[2],能够较好的赋予产品特殊的奶香风味[3],广泛应用于食品、日用化工、医药、烟草及农业生产中[4-8]。目前市售的香兰素绝大部分通过亚硝基法和乙醛酸法化学合成[4-6],香兰素不仅有天然提取和化学合成途径,还可以通过微生物转化法合成。研究发现,粘质沙雷氏菌(Serratia marcescens)转化异丁香酚和丁香酚产香兰素[9],诺卡氏自养菌(Nocardia sp.)DSM 43100和菌株B2共同作用下将阿魏酸转化为香兰素[10]。微生物转化法生产香兰素主要通过在发酵过程中添加适宜底物促进香兰素的生产,如异丁香酚、丁香酚和阿魏酸等,但利用葡萄糖转化生产香兰素的菌株少见报道。
利用香气成分提高产品的感官品质是一种常用的技术手段。我国名贵中药材冬虫夏草虽具有补而不峻、温而不火、滋而不腻的药效[11],且其含有的虫草多糖[13],具有清除羟基、超氧阴离子、脂质过氧自由基及过氧化氢的能力[12],但因其具有特殊的气味需进行赋香来增加其应用范围。
本研究期望筛选能够利用冬虫夏草中的葡萄糖产香兰素的微生物,制备含香兰素的冬虫夏草料液,赋予冬虫夏草相关产品特殊的奶香味,旨在扩大冬虫夏草应用领域。
1 材料与方法
1.1 材料与试剂
1.1.1 试验样品
高温大曲、酒醅、酱醅及土壤:分别采自内蒙古地区的酒厂、农家和校园;冬虫夏草:青海三神牛贸易公司。
1.1.2 试剂
葡萄糖、磷酸氢二铵、氯化钠(均为分析纯):天津市智远化学试剂有限公司;胰蛋白胨、酵母提取粉、琼脂(均为生化试剂)、乙二胺四乙酸二钠(ethylene diamine tetraacetic acid-2Na,EDTA-2Na)、结晶紫、三羟甲基氨基甲烷(均为分析纯):广东桓凯微生物科技有限公司;甲醇、三氟乙酸(均为色谱纯):天津市广大化学试剂有限公司;香兰素、香草酸(均为色谱纯):上海麦克林生化科技有限公司;琼脂粉(生化试剂):北京康倍斯科技有限公司;天根DP302-02试剂盒:天根生化科技(北京)有限公司。
1.1.3 培养基
富集液体培养基:胰蛋白胨10 g/L,氯化钠5 g/L,酵母提取物3 g/L,琼脂17 g/L。120 ℃灭菌20 min。
固体平板分离培养基:胰蛋白胨10 g/L,氯化钠10 g/L,酵母提取物5 g/L,琼脂17 g/L。120 ℃灭菌20 min。
种子液体培养基:胰蛋白胨10 g/L,氯化钠10 g/L,酵母提取物5 g/L。120 ℃灭菌20 min。
葡萄糖发酵液体培养基:胰蛋白胨10 g/L,氯化钠5 g/L,酵母提取物3 g/L,葡萄糖30 g/L。120 ℃灭菌20 min。
1.2 仪器与设备
HCB-1300V洁净工作台、THZ-98C恒温振荡器、DHG-9053A电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;SX-500全自动高压灭菌锅:上海新普仪器设备有限公司;真空抽滤装置:天津津腾实验设备有限公司;3-18KS Sigma高速离心机:上海成贯仪器有限公司;U3000高效液相色谱(high performance liquid chromatography,HPLC)仪、Veriti96聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技(中国)有限公司;7890气相色谱质谱联用仪:美国安捷伦科技有限公司;Synergy H1酶标仪:美国伯腾仪器有限公司。
1.3 方法
1.3.1 高产香兰素微生物的筛选
根据文献报道和数据库检索,发现芽孢杆菌属可能利用葡萄糖转化产生香兰素。因此,本研究先筛选芽孢杆菌,再以葡萄糖为底物,筛选高产香兰素的菌株。称取样品20 g,研磨后,用180 mL生理盐水洗涤,150 r/min振荡混匀30 min,混匀后在80 ℃水浴锅中恒温30 min。水浴后吸取5 mL液体接种于50 mL富集液体培养基中,于37 ℃、150 r/min摇床富集培养24 h。富集培养结束后,用移液枪吸取1 mL菌悬液至9 mL生理盐水的试管中稀释,然后依次稀释成10-2、10-3、10-4、10-5、10-6菌悬液。吸取10-6的菌悬液涂布于固体平板分离培养基中,于37 ℃培养箱中培养24 h。观察菌落形态,挑取单一菌落接种于固体平板分离培养基中37 ℃再培养24 h,将纯化后的单一菌落保藏于固体培养基中,于4 ℃冰箱保存备用。
1.3.2 高产香兰素微生物的鉴定
取纯化后的单菌落于5 mL试管种子培养基中,于37 ℃、180 r/min培养16 h。采用天根DP302-02试剂盒提取菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)。选择25 μL聚合酶链反应体系,利用通用引物(27F、1492R)扩增菌种的16S rDNA,扩增产物取1 μL进行1%琼脂糖凝胶电泳,根据电泳结果,送测序公司进行测序。
根据测序得到的16S rDNA序列,利用美国国家标准技术研究所(national institute of standards and technology,NIST)在线数据库中进行同源序列检索。作最大同源性比对分析,使用软件MEGA-X中的邻接法(neighbor-joining,NJ)构建系统发育树,同时进行重复次数为1 000次的Bootstrap测试,确定目标菌株的分类地位。
1.3.3 冬虫夏草发酵液制备工艺优化单因素试验
发酵时间对香兰素含量的影响:配制冬虫夏草与葡萄糖发酵液体培养基的料液比为1∶40(g∶mL)、装液量为20%,调pH7.0后121 ℃灭菌15 min,接种10%的种子液,200 r/min、43 ℃振荡培养10 d,每天取样测定发酵液中香兰素的产量。
接种量对香兰素含量的影响:配制冬虫夏草与葡萄糖发酵液体培养基的料液比为1∶40、装液量为20%,调pH7.0后121 ℃灭菌15 min,分别接种5.0%、7.5%、10.0%、12.5%、15.0%的种子液,200 r/min、43 ℃振荡培养9 d后测定发酵液中香兰素的产量。
料液比对香兰素含量的影响:分别配制冬虫夏草与葡萄糖发酵液体培养基料液比为1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL),装液量为20%,调pH7.0后121 ℃灭菌15 min,接种10%的种子液,200 r/min、43 ℃振荡培养9 d后测定发酵液中香兰素的产量。
1.3.4 冬虫夏草发酵液制备工艺优化响应面试验
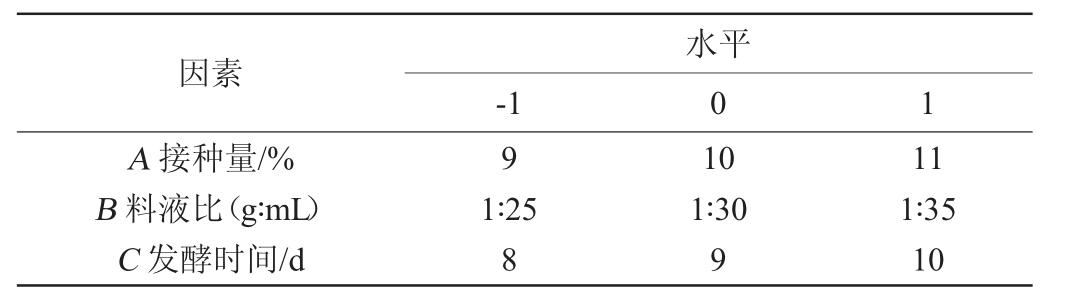
在单因素试验的基础上,利用Box-Behnken设计影响发酵液中香兰素含量的3个因素接种量(A)、料液比(B)、发酵时间(C)进行优化,分别以-1、0、+1进行水平编码,以发酵液中香兰素产量为响应值(Y)设计3因素3水平响应面试验,响应曲面试验因素与水平见表1。
表1 冬虫夏草发酵液制备工艺优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for optimization of preparation process of Cordyceps sinensis fermentation broth
1.3.5 测定方法
生长量测定:取发酵液1 mL,加入2 mL蒸馏水稀释3倍,以不含菌液的发酵培养基作为空白参比,在波长600 nm处用紫外可见分光光度计测定发酵液的吸光度值(OD600nm值)。
香兰素含量测定:参照赵建芬等[14]的方法,利用高效液相色谱法测定发酵液中香兰素的含量。香兰素标准溶液:称取香兰素标品,加入体积分数40%甲醇溶液配制成质量浓度分别为100 mg/L、80 mg/L、60 mg/L、40 mg/L、20 mg/L、2 mg/L的标准溶液。样品前处理:取0.5 mL发酵液使用甲醇稀释3倍,摇床中200 r/min振荡1 h萃取,10 000 r/min离心5 min后,收集上清备用。HPLC条件:Thermo Scientific Hypersil GOLD HPLC色谱柱(250 mm×4.6 mm,5 μm),流动相为0.5%冰乙酸∶无水甲醇=60∶40(V/V),流速0.5 mL/min,柱温30 ℃,进样量10 μL,检测波长280 nm。
2 结果与分析
2.1 产香兰素微生物的筛选及鉴定
本研究从大曲、酒醅、酱醅和土壤中初筛获得102株芽孢杆菌,以葡萄糖为底物复筛后,发现菌株B4-9产香兰素含量最高,香兰素产量为3.54 mg/L。经过扩增和测序后,构建菌株B4-9的16S rDNA系统进化树发现,菌株B4-9与Bacillus subtilis IISI-4(MK367797.1)和B.subtilis DK15(MT534533.1)处在同一分支上,置信水平为99.7%。基于以上,鉴定菌株B4-9为芽孢杆菌属中的枯草芽孢杆菌(Bacillus subtilis)。

图1 基于16S rDNA基因序列高产香兰素菌株B4-9的系统发育树
Fig. 1 Phylogenetic tree of vanillin-producing strain B4-9 based on 16S rDNA gene sequences
2.2 含香兰素冬虫夏草发酵液的制备工艺优化单因素试验
2.2.1 发酵时间对菌株B4-9产香兰素的影响
由图2可知,随着发酵时间的延长,冬虫夏草发酵液的菌体生长量及香兰素产量均呈先增加后减少的趋势。当发酵到第9天时,香兰素产量达到最大,为4.3 mg/L;菌体生长量达到最大,OD600nm值为1.24。继续延长发酵时间,香兰素产量及菌体生长量均降低。因此选择适宜的发酵时间为9 d。
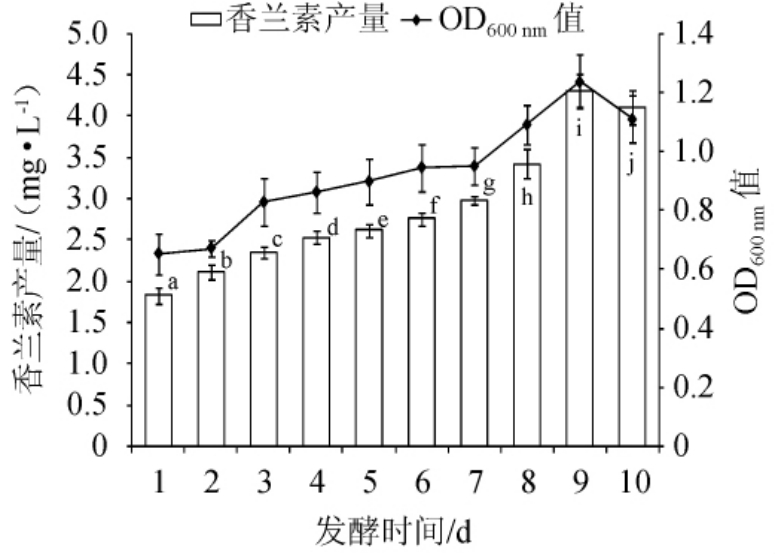
图2 发酵时间对菌株B4-9生长及香兰素产量的影响
Fig. 2 Effect of fermentation time on growth and vanillin yield of strain B4-9
2.2.2 接种量对菌株B4-9产香兰素的影响
由图3可知,随着接种量的增加,发酵液中的香兰素产量也不断升高,当接种量为10%时,香兰素产量达到最大为3.9 mg/L。当接种量>10%后,发酵液中的香兰素产量逐渐降低。菌体生长量也随着接种量的增加呈现先增加减小的趋势,在接种量为10%时达到最大的OD600nm值(1.15)。因此,选择10%为最佳接种量。
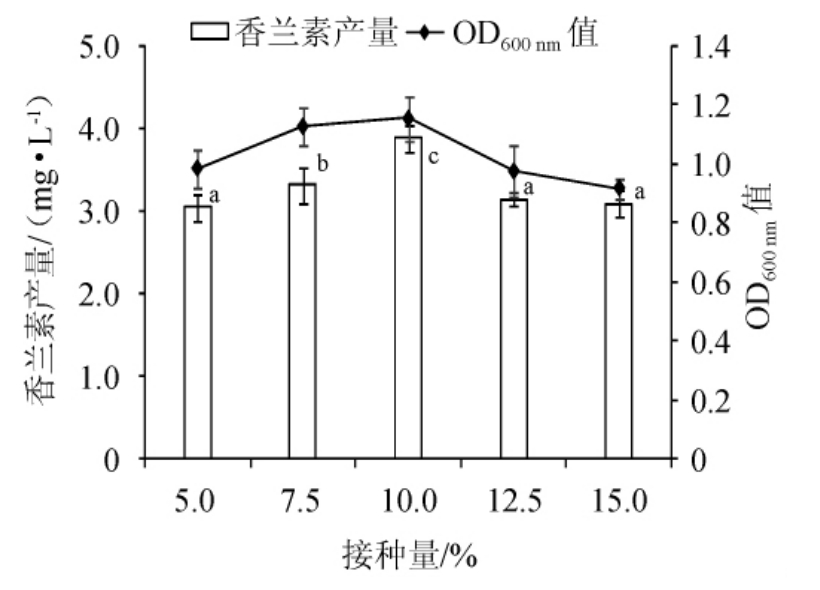
图3 接种量对菌株B4-9生长及香兰素产量的影响
Fig. 3 Effect of inoculum on growth and vanillin yield of strain B4-9
2.2.3 料液比对菌株B4-9产香兰素的影响
冬虫夏草中含有多种活性抑菌物质,如虫草素、虫草酸。一定浓度的虫草素对枯草芽孢杆菌和大肠杆菌具有明显的抑制作用[8]。因此,适宜的料液比是制备含香兰素的冬虫夏草发酵液的关键因素之一。由图4可知,高料液比对菌株B4-9的生长具有一定抑制,发酵液中香兰素产量较低。当料液比为1∶30(g∶mL)时,菌株B4-9生长较旺盛(OD600nm值为1.02),发酵液中的香兰素产量最高,为4.2 mg/L。当料液比<1∶30(g∶mL)时,发酵液中的香兰素产量逐渐降低。高浓度的冬虫夏草对菌株B4-9具有抑制作用。低浓度的冬虫夏草由于所含的葡萄糖和营养物质低,导致菌株生长缓慢,生成香兰素产量降低。因此,选择料液比1∶30(g∶mL)为菌株B4-9产香兰素的最适料液比。
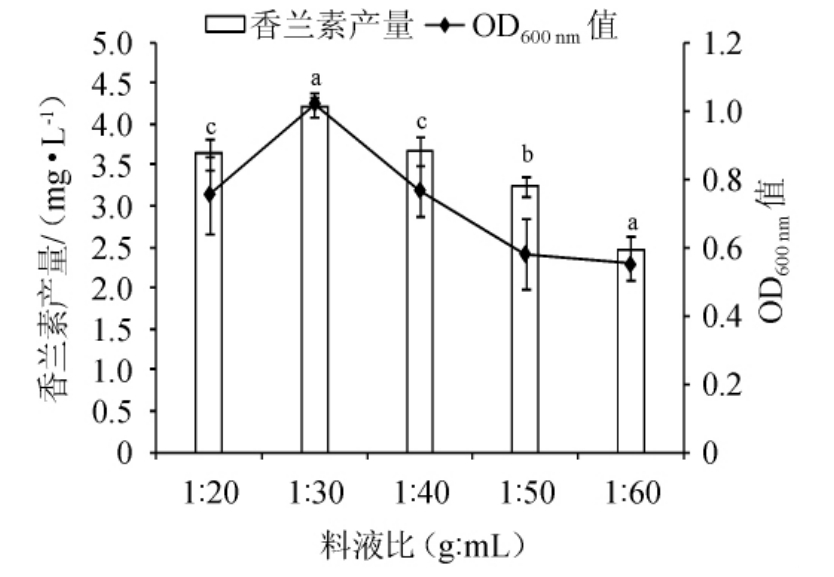
图4 料液比对菌株B4-9生长及香兰素产量的影响
Fig. 4 Effect of solid-liquid ratio on growth and vanillin yield of strain B4-9
2.3 含香兰素冬虫夏草发酵液制备工艺优化响应面试验
在单因素试验的基础上,利用Box-Behnken试验设计,以影响香兰素的3个因素接种量(A)、料液比(B)和发酵时间(C)为自变量,以冬虫夏草发酵液中的香兰素含量为响应值,设计3因素3水平的Box-Behnken试验,考察各因素对菌株B4-9产香兰素的影响。响应面试验设计方案和结果见表2,回归模型方差分析见表3。
表2 冬虫夏草发酵液制备工艺优化Box-Behnken试验结果与分析
Table 2 Results and analysis of Box-Behnken experiments for optimization of preparation process of Cordyceps sinensis fermentation broth
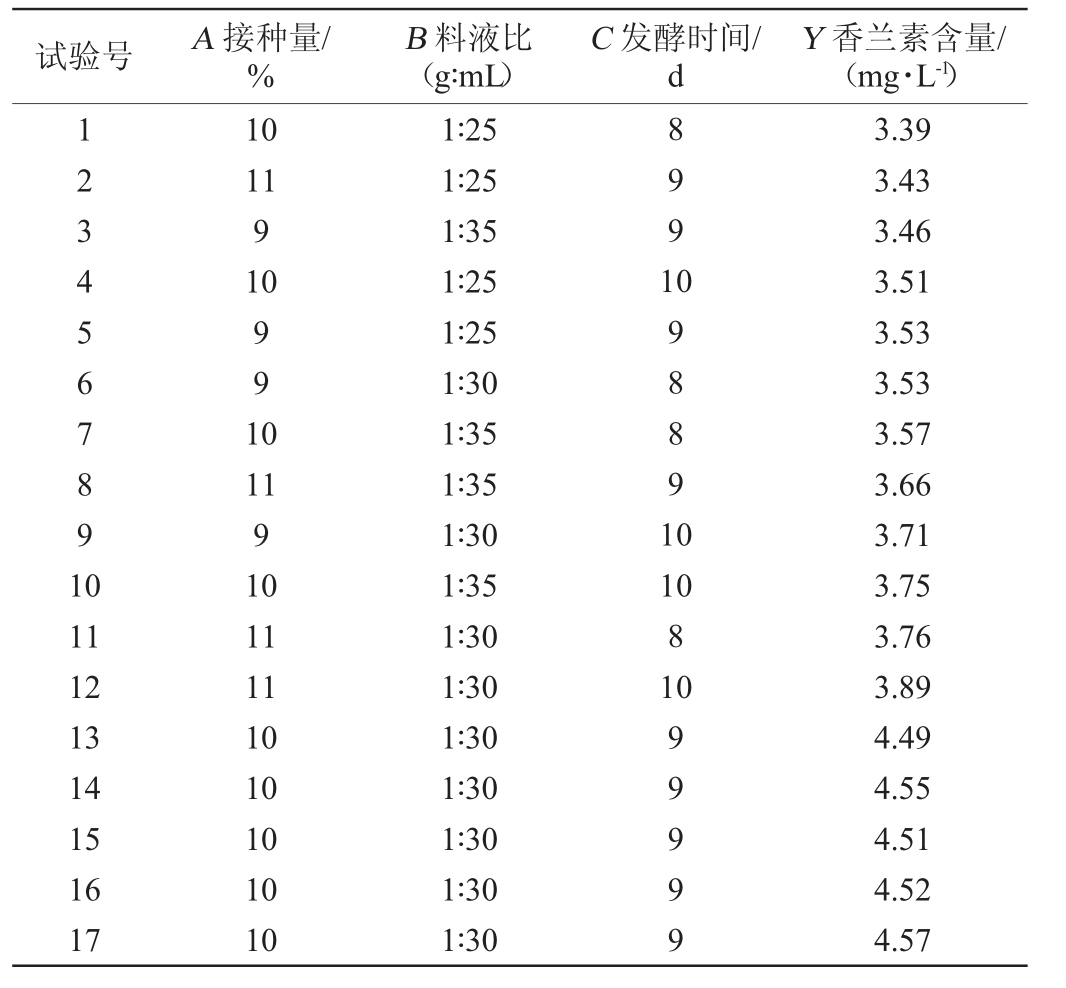
表3 回归模型方差分析
Table 3 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
利用Design-Expert 10.0.3软件对Box-Behnken设计结果进行分析后得出,3种因素与菌株B4-9产香兰素含量的二次多项回归模拟方程为:Y=4.58+0.064A+0.073B+0.076C+0.075AB-0.012AC+0.015BC-0.45A2-0.61B2-0.41C2。通过对模型分析发现,模型显著(P<0.05),失拟项不显著(P>0.05),能够拟合试验结果。模型决定系数R2=0.991 7与校正决定系数R2Adj=0.9810,能正确反映98.10%香兰素产量的变化。因此,模型可用于优化菌株B4-9产香兰素的工艺优化。
发酵时间、料液比和接种量间交互作用对菌株B4-9产香兰素影响的响应面及等高线见图5。
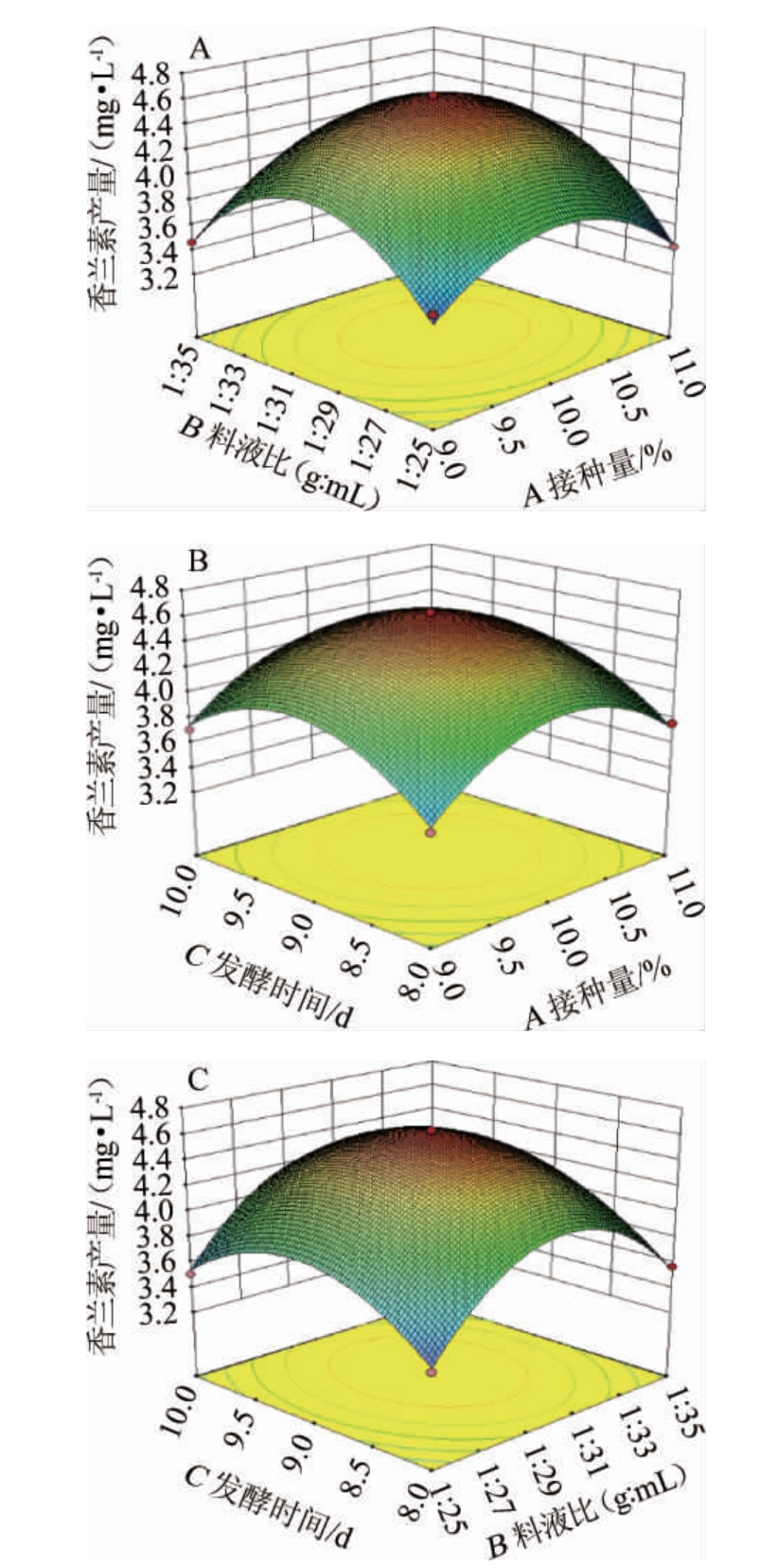
图5 料液比、发酵时间及接种量间交互作用对菌株B4-9产香兰素影响的响应曲面及等高线
Fig. 5 Response surface plots and contour lines of effects of interaction between solid-liquid ratio,fermentation time and inoculum on vanillin yield by strain B4-9
由图5可知,在发酵时间为9 d、冬虫夏草料液比为1∶30(g∶mL)的条件下,冬虫夏草发酵液中香兰素的产量随接种量的增大而先增大后减小,且接种量在9.6%~10.7%范围内,香兰素的产量均>4.4 mg/L。在发酵时间为9 d、接种量为10%的条件下,冬虫夏草发酵液中香兰素的产量随着料液比的不断变化而先增大后减小。在冬虫夏草料液比为1∶30(g∶mL)、接种量为10%的条件下,发酵时间为8.5~9.7 d时,冬虫夏草发酵液中香兰素含量均>4.4 mg/L。发酵时间过短,发酵液中香兰素积累较少,发酵时间过长,香兰素可能被进一步转化。
利用Design-Expert 10.0.3软件对模型的最高值进行预测后,得到发酵的最佳工艺为接种量10.07%,料液比1∶30.3(g∶mL),发酵时间9.1 d,在此工艺条件下,冬虫夏草发酵液中香兰素的理论预测值为(4.588±0.181)mg/L。为了满足实际发酵工艺,将最优发酵条件调整成接种量10%,料液比1∶30(g∶mL),发酵时间9 d。在此条件下进行5组平行试验,得到发酵液中香兰素平均含量为4.6 mg/L。
3 讨论
微生物转化生产香兰素最关键的是菌种的选育,优质、高产、稳定的菌种是生产效率的决定性因素。目前通过微生物法合成香兰素的底物主要有丁香酚、异丁香酚和阿魏酸[15]。以丁香酚或异丁香酚为底物合成香兰素的菌株有恶臭假单胞菌(Pseudomonas putida)[16]、芽孢杆菌(Bacillus sp.)[17]、纺锤芽孢杆菌(Bacillus fusiformis)[18]等,但丁香酚对于微生物的生长具有抑制作用[19]。阿魏酸转化香兰素最为常见的底物,主要菌株有黑曲霉(Aspergillus niger)[20]、食酸假单胞菌(Pseudomonas acidovorans)[21]、枯草芽孢杆菌(Bacillus subtilis)[22]等,通过一步法或两步法合成香兰素,但高浓度的阿魏酸在发酵中会降低香兰素的含量[23]。
微生物合成香兰素的途径从最基础的糖酵解和磷酸戊糖途径开始,经过莽草酸代谢途径、苯丙氨酸代谢途径和阿魏酸代谢途径,最后经过香兰素次生代谢产物的生物合成途径合成香兰素。所以作为最常见的发酵原料葡萄糖也是香兰素合成的底物之一。目前有关利用葡萄糖为碳源,微生物一步合成香兰素的研究鲜有报道,仅限于基因工程大肠杆菌中通过补料发酵法。利用重组大肠杆菌将葡萄糖先转化成香兰素酸,再经粗脉胞菌中分离的芳醛脱氢酶催化还原成香兰素[24]。
冬虫夏草含有多种成分,在众多领域得到了应用。如在固相双发酵中可以提高发酵人参的稳定性[25],在与烟叶的发酵中可以改善烟叶感官质量[26]。本研究中,筛选的菌株具以葡萄糖为底物产香兰素的能力,可利用冬虫夏草本身含有的葡萄糖制备天然香兰素,这为进一步开发奶香型冬虫夏草产品奠定了基础。
4 结论
本研究筛选获得一株能够在冬虫夏草发酵液中合成香兰素的菌株B4-9,经鉴定为枯草芽孢杆菌(Bacillus subtilis)。在单因素试验的研究基础上,通过响应面优化得到菌株B4-9发酵冬虫夏草产香兰素的工艺为料液比1∶30(g∶mL)、装液量20%、pH 7、接种量10%、培养温度43 ℃、摇床转速200 r/min,发酵时间9 d时,在此条件下,香兰素产量为4.6 mg/L。
[1] FURUYA T,KUROIWA M,KINO K.Biotechnological production ofvanillin using immobilized enzymes[J].J Biotechnol,2017,243:25-28.
[2] 吴方宁,丁兴梅,丁敏,等.香兰素的合成及技术展望[J].化工技术与开发,2006,35(2):6-11.
[3] 官燕燕,陈海生,皮阳雪,等.基于香兰素的UV抗菌油墨的研制[J].包装工程,2021,42(23):7.
[4] 郑立稳,高永超,张强,等.香兰素的化学合成方法研究[J].化工时刊,2012,26(6):43-46.
[5] 杨超鹏.愈创木酚和香兰素合成工艺研究[D].南京:南京理工大学,2010.
[6] 薛岳.乙醛酸法合成香兰素工艺研究[D].上海:华东理工大学,2011.
[7] 赵元,丁绍民,宋华付.香兰素生产工艺研究进展[J].化工进展,2001(3):13-16,28.
[8] 韩勇.香兰素国际市场竞争激烈采用新工艺可望路转峰回[J].医药化工,2004(5):24-25.
[9] RABENHORST J,HOPP R.Process for the preparation of vanillin:USA,5017388[P].1991-05-21.
[10] SHIMONI E,SHOHAM,RAVID U.Isolation of a Bacillus sp.capable of transforming isoeugenol to vanillin[J].J Biotechnol,2000,78(1):1-9.
[11] 徐方云.冬虫夏草及发酵虫草菌丝体的临床应用[J].药品评价,2005,2(4):255-265.
[12] JUN P,JONG L,KI L,et al.Cordyceps militaris extract protects human dermal fibroblasts against oxidative stress-induced apoptosis and Premature senescence[J].Nutrients,2014,6(9):3711-3726.
[13] 李楠,宋健国.蛹虫草与冬虫夏草化学成分比较[J].吉林农业大学学报,1995,17(A01):80-83.
[14] 赵建芬,韦寿莲,张素斌.HPLC法监测香兰素的发酵合成[J].食品工业科技,2009,30(5):332-333,345.
[15] HAN Z C,LONG L K,DING S J.Expression and characterization of carotenoid cleavage oxygenases from Herbaspirillum seropedicae and Rhodobacteraceae bacterium capable of biotransforming isoeugenol and 4-vinylguaiacol to vanillin[J].Front Microbiol,2019,10:1869-1869.
[16] FURUKAWA H,MORITA H,YOSHIDA T,et al.Conversion of isoeugenol into vanillic acid by Pseudomonas putida I58 cells exhibiting high isoeugenol-degrading activity[J].J Biosci Bioeng,2003,96(4):401-403.
[17] HUA D,CUIQING M,LIN S,et al.Biotransformation of isoeugenol to vanillin by a newly isolated Bacillus pumilus strain: Identification of major metabolites[J].J Biotechnol,2007,130(4):463-470.
[18] 赵丽青,肖向东,孙志浩,等.纺锤芽孢杆菌CGMCC1347发酵生产异丁香酚单加氧酶的条件优化[J].工业微生物,2012,42(4):60-64.
[19] 党玥,陈雪峰,刘欢,等.香兰素生物合成的研究进展[J].微生物学通报,2020,47(11):3678-3688.
[20] LAURENCE L,MICHEL D,MIREILLE H,et al.A two-step bioconversion process for vanillin production from ferulic acid combining Aspergillus niger and Pycnoporus cinnabarinus[J].J Biotechnol,1996,50(2-3):107-113.
[21] TOMS A,WOOD J M.Degradation of trans-ferulic acid by Pseudomonas acidovorans[J].Biochemistry,1970,9(2):337-343.
[22] 严晓娟,宋勇强,牛犇,等.一株转化阿魏酸产香兰素菌株的筛选与鉴定[J].中国酿造,2015,34(10):47-52.
[23] 高锐,杨威,宋鹏飞,等.微生物制备烟用香料的研究进展[J].安徽农业科学,2017,45(2):92-96.
[24] LI K,FROST J W.Synthesis of vanillin from glucose[J].J Am Chem Soc,1998,120(40):10545-10546.
[25] 辛宇,邱智东,陈天丽,等.冬虫夏草菌固体发酵人参的工艺优化[J].吉林中医药,2021,41(12):1673-1676.
[26] 张倩颖,耿宗泽,邓羽翔,等.冬虫夏草菌株发酵对非主料区烟叶感官品质和化学成分的影响[J].中国烟草学报,2021,27(4):1-9.