苹果是世界第三大水果,富含维生素、矿物质、多酚等营养物质。中国是苹果生产大国,果品总产量稳居世界第一[1],2019年中国苹果产量4 242.54万t。一些低质量的苹果不能满足市场鲜销需求,造成严重的资源浪费。因此,以苹果为原材料制备蒸馏酒,既可以减少苹果浪费,又可以增加苹果加工新产品、延长苹果产业链,大幅度提高经济、社会效益。苹果果实中富含果胶[2],在苹果汁发酵过程中,植物源与微生物源的果胶甲酯酶(pectin methyl ester,PME)催化半乳糖醛酸中甲基酯键[3]水解,形成甲醇。甲醇在人体中积累至10 g时引起失明,30 g时引起死亡[4]。GB 2757—2012《食品安全国家标准蒸馏酒及其配制酒》规定以水果为原料的蒸馏酒中甲醇含量应<2.0 g/L(以酒精度100%vol计算)。苹果蒸馏酒中甲醇的含量受到很多因素的影响,如苹果果胶含量、PME活性[5]、发酵条件和酿酒酵母[6]等。有研究表明,对苹果汁进行85 ℃高温处理[7]可以有效降低苹果酒中甲醇含量,猕猴桃中提取的果胶甲酯酶抑制剂[8]、绿茶中提取的儿茶素[9]均能有效降低胡萝卜、柑橘中的PME活性。此外,有研究表明,可以通过微波处理、超高压处理降低PME活性[10],从而降低甲醇含量。但是,由于提取方法复杂,设备费用高昂等问题,目前还没有有效降低苹果蒸馏酒甲醇含量的方法。
皂土是一种天然粘土基矿物,可以在水中膨胀、凝结,因此具有稳定的吸附作用,可以去除蛋白质、氨基酸等物质[11-12],是国内外酿造果酒常用的澄清剂。有研究表明,发酵前对果汁进行皂土处理可以有效降低李子酒[13]、苹果酒[14]中的甲醇含量,而目前还没有研究皂土对苹果蒸馏酒的影响。PME活性受到pH值的影响,HOU C Y等[15]通过添加酚酸调节pH值来降低PME活性从而减少葡萄酒中的甲醇含量。硫酸是一种非挥发性的无机酸,根据GB 2760—2014《食品安全国家标准食品添加剂使用标准》规定,硫酸可以应用于发酵工艺中。此外,由于硫酸的非挥发性,在蒸馏过程中不会随着蒸馏进入到蒸馏酒中,因此可以使用硫酸调节苹果汁pH值进行发酵。目前,国内外关于苹果酒的研究主要集中在抗氧化活性[16]、苹果品种和酿酒酵母对苹果酒品质的影响[17-20]等,而对降低苹果蒸馏酒中甲醇含量的研究相对较少。
本研究从控制苹果PME活性以降低苹果蒸馏酒中甲醇含量的角度出发,在发酵前的苹果汁中添加皂土、硫酸,经酿酒酵母(Saccharomyces cerevisiae)发酵获得苹果基酒,经二次蒸馏制备苹果蒸馏酒。对苹果汁发酵过程中果胶甲酯酶(PME)活性及甲醇含量的变化进行研究,探究皂土、硫酸处理对苹果蒸馏酒中甲醇含量、挥发性成分与感官品质的影响,以期为低甲醇、高品质苹果蒸馏酒的研究与生产提供参考。
1 材料与方法
1.1 材料与试剂
“红富士”(Malus pumila Mill)苹果:当地水果批发市场;皂土、酿酒酵母(Saccharomyces cerevisiae)CY3079:潍坊凯泽化工有限公司;硫酸(分析纯):莱阳市康德化工有限公司。甲醇(色谱醇):山东禹王和天下新材料有限公司;叔戊醇、乙酸正丁酯、2-乙基丁酸(均为色谱纯):中国食品发酵工业研究院;果胶甲酯酶试剂盒:上海恒远生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Five Easy Plus FE28 pH计:梅特勒-托利多仪器上海有限公司;Spectra Max M5-多功能酶标仪:美国美谷分子仪器有限公司;2010 Plus气相色谱(gas chromatography,GC)仪(配有火焰离子检测器(flame ionization detector,FID)和GC solution 2.3处理软件):日本岛津公司;PEG-20M毛细管色谱柱(30 m×0.5 mm×0.25 μm):大连中汇达科学仪器有限公司;CD-QZ20L薛氏蒸馏器:烟台诚达蒸馏设备有限公司。
1.3 试验方法
1.3.1 苹果蒸馏酒的加工工艺流程及操作要点
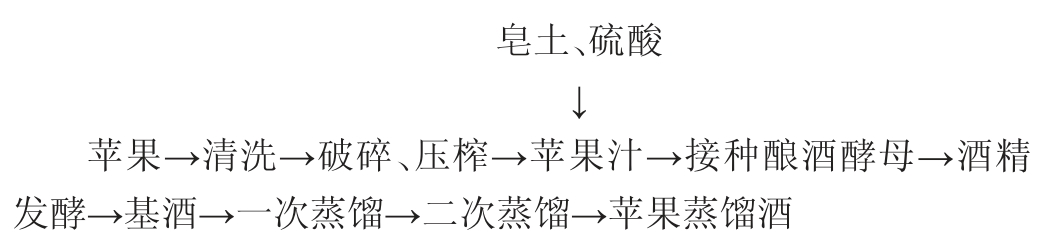
操作要点:
苹果汁制备:选用健康、无病虫害苹果,清水冲洗干净,晾干表面水分,破碎、榨汁,苹果汁(总糖140.0 g/L,总酸2.8 g/L,pH值3.95)装入50 L桶中,每个桶中苹果汁在40 L左右。
苹果汁处理:苹果汁分为3组:对照组、皂土处理组和硫酸处理组,对照组不做任何处理。皂土处理组:按照1.5 g/L比例将皂土放入烧杯中,用60~70 ℃的纯净水将皂土搅成均匀的糊状,封口膜封口,静置24 h后缓慢倒入苹果汁后,边倒边搅拌,使皂土均匀地悬浮在苹果汁中。硫酸处理组:添加10%的硫酸调节苹果汁中的pH,添加硫酸后搅拌混匀苹果汁,直到苹果汁中的pH为3.0。
接种酵母:以0.2g/L苹果汁的比例接种酿酒酵母CY3079,酿酒酵母CY3079先用30 ℃温水活化15 min,每隔数分钟搅拌一次使酵母颗粒充分溶解。将活化后的酵母分别加到苹果汁中混匀。
发酵:于13~15 ℃发酵,每天检测室温以及发酵液温度,根据NY/T 1508—2017《绿色食品 果酒》中规定,发酵苹果汁总糖含量降到4.0 g/L以下,停止发酵。其中,对照组、硫酸处理组、皂土处理组分别在第15天、第13天、第17天总糖含量降低至4.0 g/L以下。
蒸馏:所有处理组酒液总糖都降到4.0 g/L以下,并且统一放置3 d后,同时蒸馏。第一次蒸馏采用CD-QZ20L薛氏蒸馏器进行蒸馏,不去酒头酒尾,蒸馏至酒精完全蒸出,一次蒸馏馏出液酒精度约30%vol。第二次蒸馏参考SATORA P等[21],并进行适当的修改。用5 L的锥形瓶进行蒸馏,按照1%比例截取酒头,控制馏出液酒精度为66%vol,即得苹果蒸馏酒。
1.3.2 分析方法
(1)基本理化指标的测定
pH值、总酸(以酒石酸计)、总糖和还原糖的测定:分别参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》的pH计法、电位滴定法、费林试剂滴定法。酒精度的测定:参照GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》的密度瓶法。
(2)果胶甲酯酶活性的测定
发酵过程酒样于3 000 r/min离心10 min后,用酶标仪在波长450 nm处测定光密度(optical density,OD)值,以标准品质量浓度为横坐标(X),以OD450nm值为纵坐标(Y),绘制PME标准品的标准曲线,得到标准曲线回归方程为Y=0.004X+0.070 7,相关系数R2=0.991 4,通过标准曲线回归方程计算样品中PME活性,具体操作步骤和计算方法参照果胶甲酯酶分析检测试剂盒说明书。
(3)甲醇含量的测定
参照GB 5009.266—2016《食品安全国家标准食品中甲醇的测定》的气相色谱法进行测定。
甲醇标准溶液的配制:配制质量浓度为200 mg/L的甲醇标准溶液母液,分别稀释成质量浓度为20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L的甲醇标准溶液。分别移取10 mL的甲醇标准溶液,加入0.1 mL内标(叔戊醇质量浓度162 mg/L),混匀待测。
样品预处理:发酵过程酒样于3 000 r/min离心10 min后取上层清液参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》酒精度测定方法蒸馏收集馏出液;二次蒸馏酒样不做处理。移取10 mL馏出液,加入0.1 mL内标(叔戊醇162 mg/L),混匀待测。
色谱条件:PEG-20M毛细管色谱柱(30 m×0.5 mm×0.25 μm);检测器为FID;采用程序升温,初始温度40 ℃,恒温4 min后以3.5 ℃/min升至200 ℃,恒温10 min;载气为高纯氮气(N2),流速1 mL/min,分流比50∶1;检测器温度为220 ℃;进样器温度为220 ℃;进样量为1 μL。
定性、定量方法:采用保留时间定性,外标法定量。
(4)挥发性成分的测定
挥发性成分的测定采用气相色谱法[22]。
1.3.3 感官评价
苹果蒸馏酒感官评价标准参照GB/T 11856—2008《白兰地》。在感官品评之前将所有样品均稀释至酒精度40%vol左右,由9位评定人员从外观、香气、口感、典型性方面对3种苹果蒸馏酒样品进行感官评价,满分100分,具体评分标准见表1。
表1 苹果蒸馏酒感官评价标准
Table 1 Sensory evaluation standards of apple distilled liquor

1.3.4 数据处理
实验重复3次,所有结果均以“平均值±标准差”表示。采用SPSS 22.0对实验数据进行统计分析。
2 结果与分析
2.1 苹果汁发酵过程中果胶甲酯酶活性变化
苹果汁发酵过程中果胶甲酯酶活性的变化见图1。由图1可知,对照组、皂土处理组和硫酸处理组的苹果汁初始PME活性分别为3 635 U/L、3 772.5 U/L、3 816.25 U/L,从开始发酵到发酵第1天,对照组和皂土处理组的苹果汁PME活性均达到最大值,分别为4 910 U/L、4 578.75 U/L,而硫酸处理组的PME活性下降至3 541.25 U/L,PME活性较其他处理显著性降低;发酵时间在1~4 d时,3个处理组的PME活性均大幅下降,对照组、皂土和硫酸处理组的苹果汁PME活性在发酵前4 d分别降低88.43%、90.48%和91.75%;当发酵时间>4 d后,PME活性逐渐平稳。苹果PME活性最适pH在6.5~7.5之间[23],苹果汁经硫酸处理后,酸性升高,pH下降至3.0,抑制了果胶甲酯酶的活性。皂土处理后果汁中PME活性也低于对照组,原因可能是皂土在水中膨胀,形成稳定的胶体悬浮液,呈负电荷并且有强大的吸附能力,可以吸附酶类[24],因此,推测皂土可以吸附PME,从而使其活性降低,降低甲醇的含量。
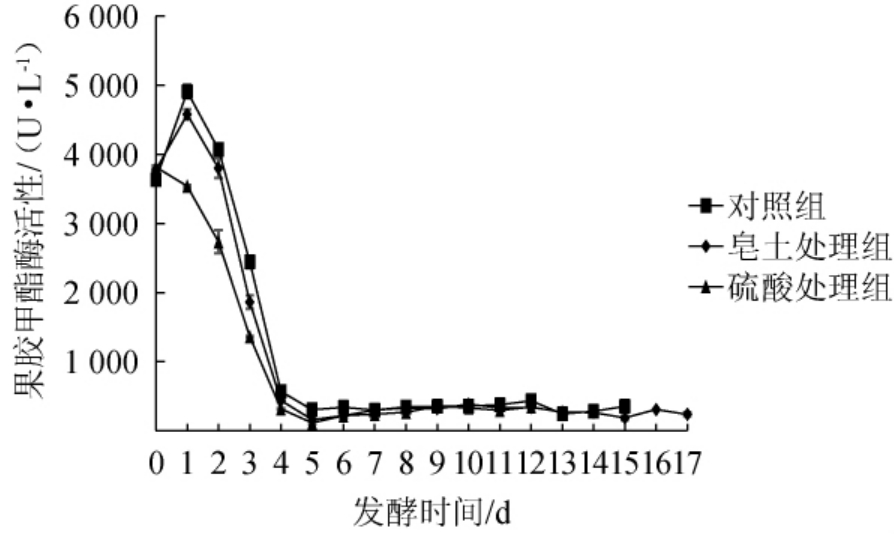
图1 苹果汁发酵过程中果胶甲酯酶活性变化
Fig. 1 Changes of pectin methylesterase activity during apple juice fermentation
2.2 苹果汁发酵过程中甲醇含量变化
苹果汁发酵过程中甲醇含量的变化见图2。由图2可知,自发酵第5天开始,对照组首先可以检测出甲醇,含量为0.17 mg/L,发酵第6天,皂土处理组与硫酸处理组均检测出甲醇,且含量分别为0.17 mg/L、0.07 mg/L,随着发酵的进行,甲醇含量逐渐增加,且皂土与硫酸处理的苹果汁产生的甲醇含量均低于对照组,这与发酵过程中PME的活性受到抑制相对应。
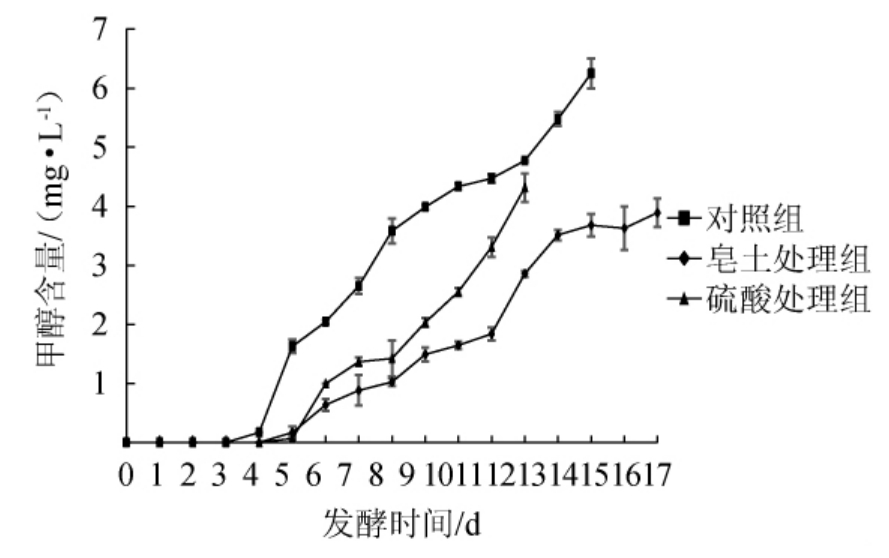
图2 苹果汁发酵过程中甲醇含量的变化
Fig. 2 Changes of methanol content during apple juice fermentation
但由图1可知,在发酵前期(0~4 d)硫酸处理组的PME活性受到抑制的程度要明显高于皂土处理组,但是硫酸处理组在发酵过程中产生的甲醇含量高于皂土处理组,推测其原因可能是,皂土可以吸附果胶,从而减少果汁中果胶含量,而甲醇产生的主要途径是PME对果胶的水解[25]。因此,皂土、硫酸处理均可以降低苹果汁发酵过程中甲醇的含量,皂土降低效果更为明显。
2.3 苹果基酒理化指标、甲醇含量与果胶甲酯酶活性分析结果
2.3.1 基本理化指标
苹果基酒基本理化指标测定结果见表2。由表2可知,对照组、硫酸处理组、皂土处理组的苹果基酒酒精度分别为9.4%vol、9.5%vol、9.3%vol,总糖含量均<4.0 g/L,根据NY/T 1508—2017《绿色食品果酒》规定属于干型果酒。3种处理的基酒总糖含量具有显著性差异(P<0.05),皂土处理的基酒总糖含量最高,为3.7 g/L;硫酸处理的基酒总糖含量最低,为2.7 g/L;对照组的基酒总糖含量为3.0 g/L。皂土处理的基酒还原糖含量最高(3.0 g/L),说明皂土处理影响酵母的发酵性能。3种处理的基酒总酸、pH值具有显著差异(P<0.05),硫酸处理的基酒总酸含量最高,为5.4 g/L;皂土处理的基酒总酸含量最低,为3.9 g/L。
表2 苹果基酒理化指标测定结果
Table 2 Determination results of physiochemical indexes of apple base wine
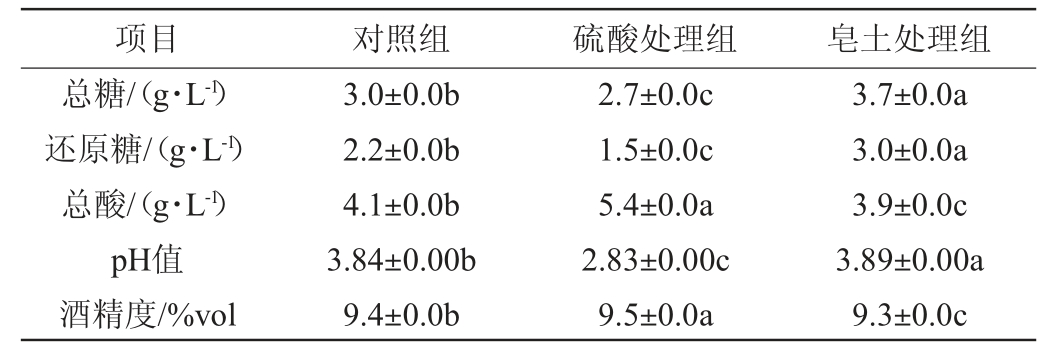
注:同行不同小写字母表示差异显著(P<0.05)。
2.3.2 甲醇含量与果胶甲酯酶活性
基酒中甲醇含量与果胶甲酯酶活性结果见图3。由图3A可知,基酒中甲醇含量有显著性差异(P<0.05),对照组的基酒甲醇含量为6.25 mg/L,硫酸处理与皂土处理的基酒甲醇含量分别为4.32 mg/L、3.89 mg/L。对照组基酒甲醇含量显著高于皂土处理组和硫酸处理组(P<0.05),皂土处理组基酒中甲醇含量最低,与对照组相比降低了37.76%,硫酸处理组基酒中甲醇含量与对照组相比降低了30.88%。总之,皂土处理与硫酸处理均可以降低基酒中甲醇含量,皂土处理降低效果最好。由图3B可知,苹果基酒中PME活性有显著性差异(P<0.05),对照组基酒PME活性为354.125 U/L,显著高于硫酸处理与皂土处理的基酒中PME活性(P<0.05)。硫酸处理组的PME活性为266.625 U/L,与对照组相比降低了24.71%,皂土处理组PME活性最低,为236.63 U/L,与对照组相比降低了33.18%。硫酸处理与皂土处理均能显著影响基酒中PME活性(P<0.05),两者相比而言,皂土处理对基酒PME活性降低效果更显著。
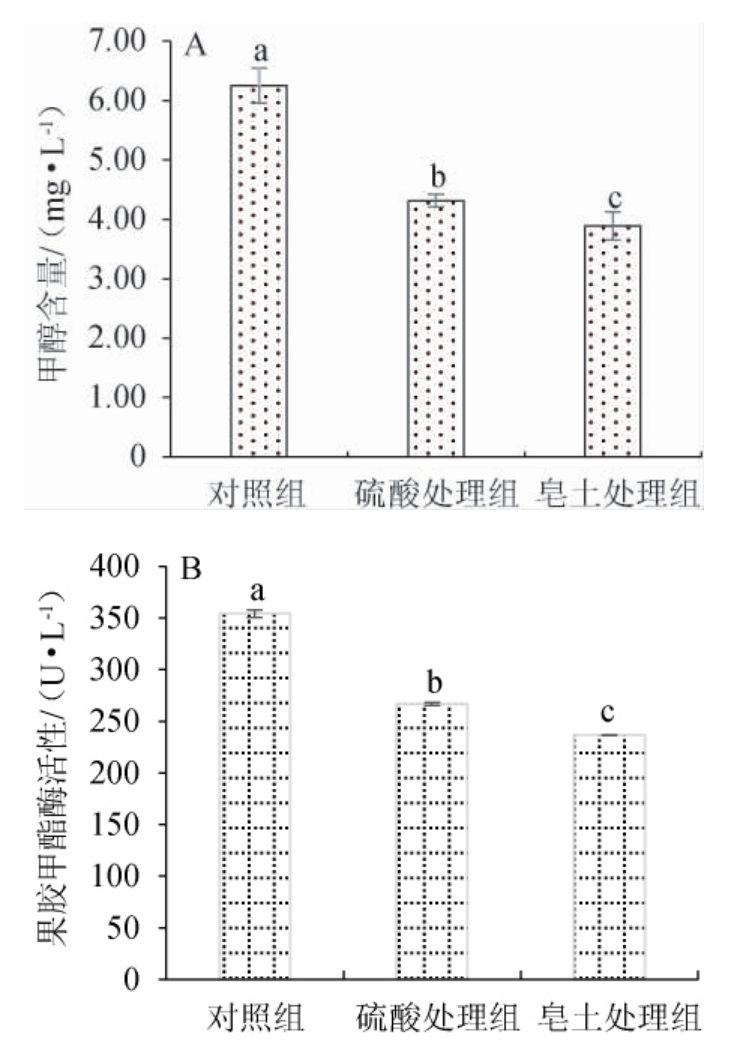
图3 苹果基酒中甲醇含量(A)与果胶甲酯酶活性(B)测定结果
Fig. 3 Determination results of methanol content (A) and pectin methylesterase activity (B) in apple base wine
不同字母表示差异显著(P<0.05)。
2.4 苹果蒸馏酒理化指标及挥发性成分分析
2.4.1 苹果蒸馏酒理化指标
苹果蒸馏酒理化指标见表3。由表3可知,3种处理组的苹果蒸馏酒甲醇含量有显著性差异(P<0.05)。与对照组相比,皂土处理组与硫酸处理的苹果蒸馏酒样品中甲醇含量明显降低,皂土处理组的蒸馏酒样品中甲醇含量最低,为43.95 mg/L,与对照组相比降低了47.46 mg/L,硫酸处理组的蒸馏酒样品中甲醇含量为56.55 mg/L,与对照组相比降低了34.86 mg/L,说明在发酵前对苹果汁进行皂土、硫酸处理可以显著降低苹果蒸馏酒中甲醇含量,皂土处理降低甲醇含量的效果最为显著。
表3 苹果蒸馏酒的理化指标
Table 3 Physiochemical indexes of apple distilled liquor
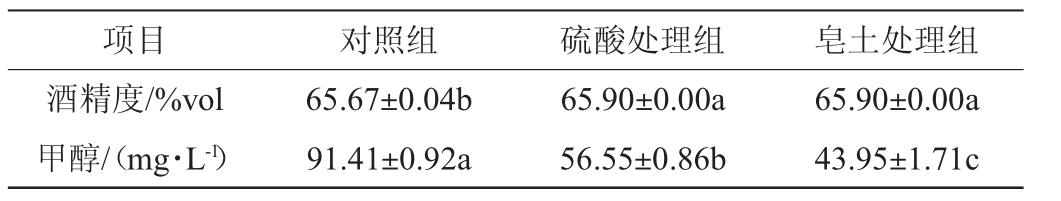
注:同行不同字母表示差异显著(P<0.05),3种处理甲醇含量均已折算酒精度为100%vol。
2.4.2 苹果蒸馏酒挥发性成分分析
苹果蒸馏酒的挥发性成分见表4。由表4可知,3种处理的苹果蒸馏酒样品均检测出28种挥发性成分,其中,酯类物质9种,高级醇类8种,醛酮类物质5种,挥发酸类物质6种。对照组、皂土处理组、硫酸处理组的酯类物质总含量分别为296.25 mg/L、441.98 mg/L、334.76 mg/L。3种处理的苹果蒸馏酒中的酯类物质中乙酸乙酯、乙酸异戊酯、辛酸乙酯、月桂酸乙酯均在风味阈值之上,对苹果蒸馏酒香气影响较大,这与VERSINI G等[30]的研究结果基本一致。由表4可知,乙酸乙酯是苹果蒸馏酒中主要酯类物质。对照组的苹果蒸馏酒乙酸乙酯的含量为125.18 mg/L,皂土、硫酸处理组的苹果蒸馏酒样品中乙酸乙酯的含量分别较对照组提高116.35 mg/L、降低27.43 mg/L。3种处理组的苹果蒸馏酒中乙酸异戊酯、月桂酸乙酯的含量具有显著性差异(P<0.05),皂土处理组的蒸馏酒样品中其含量均为最高,硫酸处理组含量最低。值得一提的是,经过硫酸处理的蒸馏酒样品中甲酸乙酯的含量最高,为194.71 mg/L;而对照组以及皂土处理组蒸馏酒的含量分别为113.29 mg/L、132.11 mg/L。乙酸乙酯可以赋予苹果酒令人愉悦的水果香气,乙酸异戊酯为酒带来“香蕉味”果香,甲酸乙酯可以赋予酒“菠萝味”的果香,月桂酸乙酯具有花香香气[31]。总而言之,经过皂土、硫酸处理后的蒸馏酒可以通过提高酯类物质含量而赋予苹果蒸馏酒水果香的风味特征。
表4 苹果蒸馏酒挥发性成分含量测定结果
Table 4 Determination results of contents of volatile components of apple distilled liquor
mg/L

注:“-”表示未查到相关文献,同行不同小写字母表示差异性显著(P<0.05)。
对照组、皂土处理组、硫酸处理组蒸馏酒的高级醇类物质总含量分别为2 149.19 mg/L、2 293.23 mg/L、1 618.40 mg/L。其中,正丙醇、异丁醇、正丁醇、异戊醇、正己醇均在风味阈值之上,且风味强度高,对苹果蒸馏酒的香气有很大影响。其中,异戊醇是苹果蒸馏酒中最主要的高级醇,具有丰富的水果香[32],在3种处理中,硫酸处理组的苹果蒸馏酒中异戊醇含量最高,为817.67 mg/L;其次是皂土处理组蒸馏酒,含量为703.47 mg/L;对照组蒸馏酒的含量最低,为649.38 mg/L。正丙醇可以赋予苹果蒸馏酒辛辣味道[33],在3种处理中正丙醇含量具有显著性差异,硫酸处理组蒸馏酒的含量最低,为147.69 mg/L;皂土处理组蒸馏酒含量最高,为1 002.5 mg/L;对照组蒸馏酒的含量为973.86 mg/L。除此之外,经过皂土、硫酸处理的苹果蒸馏酒中异丁醇、正己醇含量均较对照组显著提高(P<0.05)。
对照组、皂土处理组、硫酸处理组蒸馏酒的醛类物质总含量分别为671.29 mg/L、346.89 mg/L、369.7 mg/L。其中,乙醛、异丁醛、乙缩醛、糠醛均在风味阈值之上。乙醛是苹果酒中最重要的醛类物质,是酒精发酵的副产物,一般由丙酮酸还原而成。乙醛可以赋予酒中坚果的香气,但是高浓度的乙醛(>100 mg/L)就可能产生刺激性气味[34]。在3种处理中,经过皂土、硫酸处理的苹果蒸馏酒乙醛含量显著降低(P<0.05),皂土处理组蒸馏酒的乙醛含量最低,为315.98 mg/L;硫酸处理组蒸馏酒为324.41 mg/L;对照组蒸馏酒的含量最高,为595.98 mg/L。
此外,在酮类物质中,3种处理的苹果蒸馏酒样品中3-羟基-2-丁酮含量均在风味阈值以上,且风味强度高。3-羟基-2-丁酮具有令人愉悦的奶香味,不同处理组的苹果蒸馏酒其含量具有显著性差异(P<0.05),硫酸处理组蒸馏酒的含量最低,为0.8 mg/L;对照组蒸馏酒的含量最高,为7.49 mg/L;皂土处理组的含量为6.55 mg/L。
对照组、皂土处理组、硫酸处理组蒸馏酒的总挥发酸含量分别为124.52 mg/L、74.34 mg/L、62.62 mg/L。3种处理蒸馏酒的异丁酸、丁酸、己酸、辛酸均在风味阈值之上。挥发性酸可以丰富苹果酒香气的复杂性,赋予苹果酒醋酸味。在挥发性酸中,乙酸是苹果酒中最常见的挥发酸,可以与醇反应生成数种具有水果香且对果酒酒香有重要意义的乙酸酯。在3种处理的苹果蒸馏酒样品中,经过皂土、硫酸处理的苹果蒸馏酒乙酸含量显著降低(P<0.05)。对照组蒸馏酒的乙酸含量最高,为20.61 mg/L;硫酸处理组蒸馏酒的乙酸含量最低,为5.76 mg/L;皂土处理组蒸馏酒的乙酸含量为12.19 mg/L。综上,皂土处理可以显著提高苹果蒸馏酒的风味化合物含量。
2.5 苹果蒸馏酒感官评价
不同处理对苹果蒸馏酒感官评分的影响见表5。由表5可知,3种处理的苹果蒸馏酒的酒体均澄清透明,具有苹果蒸馏酒的典型特征。与对照组的苹果蒸馏酒相比,皂土处理组苹果蒸馏酒的酒香气增强,口感更加丰满,感官品评得分最高(91.3分);而硫酸处理组苹果蒸馏酒的酒香气、口感并无明显提升改善,感官品评得分最低(83.4分),推测其原因可能是,经过硫酸处理的苹果蒸馏酒样品中,重要的风味物质例如乙酸乙酯、乙酸异戊酯、正丙醇等含量显著降低(P<0.05)。综合感官评价可知,皂土处理组可以显著的提高苹果蒸馏酒的感官品质。
表5 不同处理对苹果蒸馏酒感官评分的影响
Table 5 Effect of different treatments on sensory scores of apple distilled liquor

3 结论
对照组、皂土和硫酸处理组的苹果汁PME活性在发酵前4天均显著下降,分别下降4 342.13 U/L、4 142.75 U/L和3 226.50 U/L。皂土、硫酸处理苹果汁都可以显著降低苹果汁PME活性,从而降低基酒中甲醇含量,进一步降低蒸馏酒中甲醇含量。对照组苹果蒸馏酒中甲醇含量为91.41mg/L,皂土、硫酸处理组的甲醇含量分别为43.95 mg/L和56.55 mg/L,较对照组分别降低51.92%和40.10%。皂土、硫酸处理组的蒸馏酒样品中乙酸乙酯、乙酸异戊酯、月桂酸乙酯、正丙醇、异丁醇、异戊醇、正己醇的含量均超过阈值,皂土处理组蒸馏酒中这些物质的含量均较对照组显著升高(P<0.05),硫酸处理组中的甲酸乙酯、异丁醇、异戊醇、正己醇的含量显著升高(P<0.05),乙酸乙酯、乙酸异戊酯、月桂酸乙酯、正丙醇的含量显著降低(P<0.05)。皂土处理的苹果蒸馏酒感官评分最高(91.3分),酒香浓郁,口感醇厚,具有苹果蒸馏酒的典型特征。综合对比,在发酵前对苹果汁进行皂土处理,是降低苹果蒸馏酒中甲醇含量,提高风味物质含量的有效方法。
[1] 张放.近十年全球苹果生产变化简析[J].中国果业信息,2021,38(1):24-33.
[2] CALVETE-TORRE I,MUÑOZ-ALMAGRO N,PACHECO M T,et al.Apple pomaces derived from mono-varietal Asturian ciders production are potential source of pectins with appealing functional properties[J].Carbohyd Polym,2021,264:117980.
[3] JOLIE R P,DUVETTER T,LOEY A M V,et al.Pectin methyl esterase and its proteinaceous inhibitor:a review[J].Carbohyd Res,2010,345(18):2583-2595.
[4] 杜金华,金玉红.果酒生产技术[M].化学工业出版社,2010:20-21.
[5] OHIMAIN E I.Methanol contamination in traditionally fermented alcoholic beverages:the microbial dimension[J].Springerplus,2016,5(1):1607.
[6] RICHTER C L,DUNN B,SHERLOCK G,et al.Comparative metabolic footprinting of a large number of commercial wine yeast strains in Chardonnay fermentations[J].FEMS Yeast Res,2013,13(4):394-410.
[7] HANG Y D,WOODAMS E E.Influence of apple cultivar and juice pasteurization on hard cider and eau-de-vie methanol content[J].Bioresource Technol,2010,101(4):1396-1398.
[8] MEI X,SHPIGELMAN A,VERRIJSSEN T A J,et al.Recombinant kiwi pectin methyl esterase inhibitor: purification and characterization of the interaction with plant pectin methyl esterase during thermal and high-pressure processing[J].Innov Food Sci Emerg Technol,2015,29:295-301.
[9] LEWIS K C,SELZER T,SHAHAR C,et al.Inhibition of pectin methyl esterase activity by green tea catechins[J].Phytochemistry,2008,69(14):2586-2592.
[10] TEREFE N S,GAMAGE M,VILKHU K,et al.The kinetics of inactivation of pectin methyl esterase and polygalacturonase in tomato juice by thermosonication[J].Food Chem,2009,117(1):20-27.
[11] SAUVAGE F X,BACH B,MOUTOUNET M,et al.Proteins in white wines: Thermo-sensitivity and differential adsorbtion by bentonite[J].Food Chem,2010,118(1):26-34.
[12] LAMBRI M,DORDONI R,SILVA A,et al.Comparing the impact of bentonite addition for both must clarification and wine fining on the chemical profile of wine from Chambave Muscat grapes[J].Int J Food Sci Technol,2012,47(1):1-12.
[13] MILJIĆ U,PUŠKAŠ V,VUČUROVIC′ V.Investigation of technological approaches for reduction of methanol formation in plum wines[J].J I Brewing,2016,122(4):635-643.
[14] HAN Y Y,DU J H,WANG Y.Effect of bentonite and calcium chloride on apple wine[J].J Sci Food Agr,2021,102(1):425-433.
[15] HOU C Y,LIN Y S,WANG Y T,et al.Addition of phenolic acids on the reduction of methanol content in wine[J].J Food Sci,2008,73(5):C432-C437.
[16] ZURIARRAIN-OCIO A,ZURIARRAIN J,VIDAL M,et al.Antioxidant activity and phenolic profiles of ciders from the Basque Country[J].Food Biosci,2021,41:100887.
[17] HE W J,LIU S X,HEPONIEMI P,et al.Effect of Saccharomyces cerevisiae and Schizosaccharomyces pombe strains on chemical composition and sensory quality of ciders made from Finnish apple cultivars[J].Food Chem,2021,345:128833.
[18] BEDRIÑANA R P,PICINELLI-LOBO A,MADRERA R R,et al.Characteristics of ice juices and ciders made by cryo-extraction with different cider apple varieties and yeast strains[J]. Food Chem,2020,310(25):125831.
[19] ROSEND J,KULDJÄRV R,ROSENVALD S,et al.The effects of apple variety,ripening stage,and yeast strain on the volatile composition of apple cider[J].Heliyon,2019,5(6):e01953.
[20] LORENZINI M,SIMONATO B,SLAGHENAUFI D,et al.Assessment of yeasts for apple juice fermentation and production of cider volatile compounds[J].LWT-Food Sci Technol,2019,99:224-230.
[21] SATORA P,TUSZYN′ SKI T.Influence of indigenous yeasts on the fermentation and volatile profile of plum brandies[J]. Food Microbiol,2010,27(3):418-424.
[22] ZHANG Q X,DU J H,JIN Y H,et al.SO2 reduction in distilled grape spirits by three methods[J].J I Brewing,2013,119(4):314-320.
[23] CASTALDO D,QUAGLIUOLO L,SERVILLO L,et al.Isolation and characterization of pectin methylesterase from apple fruit[J].J Food Sci,1989,54(3):653-655.
[24] JAECKELS N,TENZER S,ROSCH A,et al.β-glucosidase removal due to bentonite fining during wine making[J].Eur Food Res Technol,2015,241:253-262.
[25] MARIA G C.Evaluation of methanol concentration in hellenic traditional alcoholic beverages after grape pomace fermentation at different conditions[J].J Food Technol,2008,6(5):196-202.
[26] WANG X X,FAN W L,XU Y.Comparison on aroma compounds in Chinese soy sauce and strong aroma type liquors by gas chromatographyolfactometry,chemical quantitative and odor activity values analysis[J].Eur Food Res Technol,2014,239(5):813-825.
[27] GAO W,FAN W,XU Y.Characterization of the key odorants in light aroma type Chinese liquor by gas chromatography-olfactometry,quantitative measurements,aroma recombination,and omission studies[J].J Agr Food Chem,2014,62(25):5796-5804.
[28] YOSHIZAKI Y,TAKAMINE K,SHIMADA S,et al.The formation of β-damascenone in sweet potato shochu[J].J I Brewing,2011,117(2):217-223.
[29] 王鑫,梁艳英,李娜娜,等.杨凌地区主要葡萄蒸馏酒的香气成分分析[J].中国酿造,2018,37(7):161-167.
[30] VERSINI G,FRANCO M A,MOSER S,et al.Characterisation of apple distillates from native varieties of Sardinia island and comparison with other Italian products[J].Food Chem,2009,113(4):1176-1183.
[31] PENG B Z,LI F L,CUI L,et al.Effects of fermentation temperature on key aroma compounds and sensory properties of apple wine[J].J Food Sci,2016,80(12):S2937-S2943.
[32] YE M Q,YUE T L,YUAN Y H.Changes in the profile of volatile compounds and amino acids during cider fermentation using dessert variety of apples[J].Eur Food Res Technol,2014,239(1):67-77.
[33] PICINELLI A,SUÁREZ B,MORENO J,et al.Chemical characterization of Asturian cider[J].J Agr Food Chem,2000,48(9):3997-4002.
[34] QIN Z H,PETERSEN M A,BREDIE W L P.Flavor profiling of apple ciders from the UK and Scandinavian region[J]. Food Res Int,2018,105:713-723.