中国白酒种类繁多,质量差异大,除了自然生态环境和生产工艺的不同外,最大的原因是不同特点糖化发酵剂的使用。因此,中国白酒糖化发酵剂的研究一直是历代发酵技术人员的重要课题[1]。酱香型白酒酿造过程中,酱香大曲的制作是一个非常重要的过程[2]。酱香型白酒使用的是高温大曲,其以粉碎后的小麦为制曲原料,在其中拌入水和母曲,人工或机械制成龟背形块状,收汗后码放在曲仓内,进行40 d的培菌发酵。发酵过程中,温度达65 ℃,也因此被称为酱香高温大曲[3-4]。酱香高温大曲为酱香型白酒提供了丰富的酱香物质和酱香前体物质,而这些物质的形成与微生物发酵及其所代谢的酶系、美拉德反应有着密切的联系[5]。微生物学方面的研究在国内外皆进展迅速,其中对放线菌的研究成为了一个重要的支系[6]。放线菌同时是一类有着广泛实际用途的微生物资源[7],在酿酒生产过程中也存在着大量的放线菌菌群,并且大量研究表明,放线菌具有产生耐高温酶类的能力,这也为筛选功能性高温放线菌用以高温制曲提供了理论支持。
高温放线菌属由TSIKLINSKY于1899年首次发现[8]。该属菌株最适生长温度为45~55 ℃,最适生长pH为7.0 左右,好氧,化能异养型,革兰氏染色阳性,可产生大量的气生菌丝和基内菌丝,在气生菌丝和基内菌丝上着生有单个孢子,在自然界分布广泛,常见于霉变饲料、稻草、堆肥和白酒高温大曲等环境[9-10]。高温放线菌作为一类分布广泛的嗜热微生物,可代谢产生多种耐高温酶系,如α-淀粉酶、丝氨酸蛋白酶、脂肪酶等[11],在酱香型大曲风味形成的过程中具有重要的作用。
本研究从茅台产区酱香大曲中分离筛选产蛋白酶的高温放线菌,对其进行分类学鉴定和产酶条件优化,以期为后续功能性强化大曲的制作奠定基础,为酱香调味酒的制作、麸曲酱香酒的生产奠定基础,拓宽高温菌的应用范围,对促进我国白酒产业的健康发展具有十分重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
酱香大曲:取自茅台镇某酒厂陈放6个月酱香大曲。
1.1.2 试剂
溶菌酶(20 000 U/mg):盖云天(武汉)生物技术有限公司;脱氧核糖核苷三磷酸(deoxy-ribonucleosidetriphosphate,dNTP)、脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、聚合酶链式反应(polymerase chain reaction,PCR)引物、Ezup柱式细菌基因组DNA抽提试剂盒:生工生物工程(上海)股份有限公司;PowerSoil DNA Isolation Kit:美国Mobio公司;制霉菌素、新生霉素(均为分析纯):北京索莱宝科技有限公司;酵母提取物、胰蛋白胨、干酪素(均为生化试剂):北京奥博星生物技术有限责任公司;其余试剂均为国产分析纯。
1.1.3 培养基
ISP2培养基[12]:麦芽汁10.0 g/L、酵母膏4.0 g/L、葡萄糖4.0 g/L、琼脂20.0 g/L、蒸馏水1 000 mL、pH7.0~7.2。
GTY培养基[12]:葡萄糖5.0 g/L、胰蛋白胨0.25 g/L、酵母浸粉1.0 g/L、CaCO3 0.5 g/L、琼脂10.0 g/L、蒸馏水1 000 mL,自然pH。
麸皮培养基:麸皮15.0 g,麸皮和水的质量比为1∶1,拌和均匀。
奶粉培养基:牛肉膏5.0g/L、蛋白陈10.0g/L、NaCl5.0g/L、琼脂10.0 g/L、脱脂奶粉10.0 g/L、蒸馏水1 000 mL,自然pH。
以上培养基均在121 ℃灭菌15 min。
1.2 仪器与设备
UV-5100紫外可见分光光度计:上海元析仪器有限公司;DK-98-I电子调温万用电炉:天津市泰斯特仪器有限公司;SHD-250生化培养箱:上海森信实验仪器有限公司;YXQ-LS-100SII立式压力蒸汽灭菌器、BSD-YX3200立式智能精密摇床:上海博迅医疗生物仪器股份有限公司;HH-6电子恒温水浴锅、DHG-9140A电热恒温鼓风干燥箱:常州润华电器有限公司;FA1204N电子天平:上海菁海仪器有限公司;SW-CJ-2D双人单面垂直送风净化工作台:上海乔跃电子有限公司;BM2000显微镜:宁波永新光学股份有限公司。
1.3 试验方法
1.3.1 高产蛋白酶高温放线菌的分离、筛选[13]
将10 g样品和1 g CaCO3在无菌三角瓶中混合均匀,添加适量的无菌水使其润湿,在28 ℃、相对湿度30%的培养箱中培养3 d,然后向三角瓶中加入90 mL无菌水和适量的玻璃珠,50 ℃、200 r/min振荡30 min制成样品悬浊液,将样品悬浊液用羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)溶液稀释成10-1和10-2两个梯度,在GTY培养基中加入40 mg/L制霉菌素和60 mg/L新生霉素[14],倒平板,每个平板接种0.25 mL样品悬浊液在55 ℃条件下培养3~4 d,待观察。
将已经筛选出的高温放线菌接种于GTY培养基进行培育。再接种于奶粉培养基中,在45 ℃的培养箱中观察高温放线菌的生长情况。若该菌产生蛋白酶,酶解脱脂奶粉中的蛋白质,会在奶粉培养基的菌落周围形成大小不等的水解圈。观察水解圈直径(H)和菌落直径(C),并用游标卡尺测量后计算其比例(H/C)[15]。
将初筛产蛋白酶高温放线菌接种于麸皮培养基中进行复筛,在45 ℃条件下培养4 d,通过福林酚法测定其菌种蛋白酶活力[16],根据酶活力大小判断是否为高产蛋白酶菌株。
1.3.2 产蛋白酶高温放线菌的鉴定
(1)产蛋白酶高温放线菌的生理生化试验
对初步筛选出的高温放线菌进行明胶液化、淀粉水解、纤维素分解、牛奶凝固与胨化、硝酸盐还原、碳源利用、硫化氢生成试验。将所用到的生理生化试验培养基配制好,将菌种接入培养基中,观察并记录现象[17-18]。
(2)分子生物学鉴定
采用细菌基因组DNA提取试剂盒提取DNA,以F(5'-AGTTTGATCMTGGCTCAG-3')及R(5'-GGTTACCTTGTTACGACTT-3')为引物进行PCR扩增,PCR扩增程序为95 ℃预变性5 min;然后94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,共30个循环;最后72 ℃延伸9 min;取2 μL PCR产物用1%琼脂糖凝胶检测DNA提取效果;PCR产物在上海立菲生物工程技术服务有限公司进行测序;将测序结果在美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行同源序列搜索,用MEGA5.05软件进行多序列比对,然后用邻接法(neighbor-joining,NJ)构建系统发育树[19-20]。
1.3.3 高温放线菌产蛋白酶条件优化
(1)单因素试验
将已筛出的高温放线菌制作成菌悬液,然后按麸皮培养基与菌悬液10∶1(g∶mL)的比例接入250 mL三角瓶中培养。分别考察初始pH值(6.0、6.5、7.0、7.5、8.0)、培养温度(37 ℃、41 ℃、45 ℃、49 ℃、60 ℃)、培养时间(3 d、4 d、5 d、6 d、7 d)对产酶的影响。
(2)正交试验[21-22]
在单因素试验的基础上,以蛋白酶活力为考察指标,设计3因素3水平L9(33)正交试验,考察初始pH值(A)、培养温度(B)及培养时间(C)对高温放线菌产蛋白酶的影响,正交试验因素与水平见表1。
表1 高温放线菌产蛋白酶条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for optimization of protease production conditions of high temperature actinomycetes

1.3.4 测定方法
蛋白酶活力:按照国标GB/T 28715—2012《饲料添加剂酸性、中性蛋白酶活力的测定分光光度法》进行测定[23]。
酶活定义:在40 ℃、pH7.2条件下,1 min内水解酪蛋白产生相当于1 μg酚基氨基酸(以酪氨酸等同物表示)的酶量,为一个酶活单位,U。
2 结果与分析
2.1 高温放线菌的分离
从酱香大曲中分离纯化出2株具有放线菌菌落形态特征的菌株,分别编号为GW1、GW2。对其进行产蛋白酶特性分析,结果见图1。由图1可知,菌株GW1透明圈直径为8.2 mm,菌落直径为3.1 mm,H/C值为2.6;菌株GW2透明圈直径为16.6 mm,菌落直径为4.2 mm,H/C值为3.95。再通过麸皮培养基复筛得到菌株GW1、GW2产蛋白酶活力分别为138.08 U/g、179.04 U/g。因此可以看出,菌株GW2产蛋白酶活力较高。
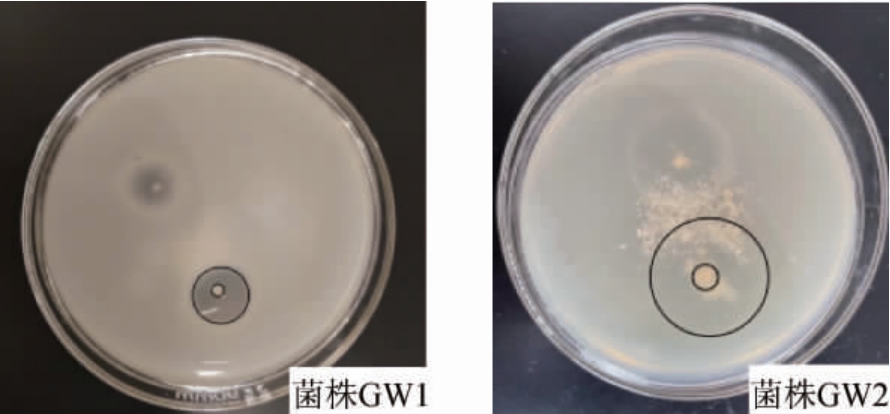
图1 筛选菌株的水解透明圈
Fig. 1 Hydrolytic transparent zone of the screened strains
2.2 产蛋白酶高温放线菌的鉴定
2.2.1 生理生化试验结果
由表2可知,该菌株能使明胶液化,能使牛奶凝固和固化,不能使淀粉发生水解,能进行纤维素的分解,能利用葡萄糖,不能利用麦芽糖和D-甘露醇。
表2 菌株GW2的生理生化试验结果
Table 2 Physiological and biochemical test results of strain GW2

注:“+”表示可利用或该反应为阳性;“-”表示不利用或该反应为阴性。
2.2.2 分子生物学鉴定结果
将测序结果在NCBI的GenBank数据库中进行同源序列搜索,用MEGA7.0软件进行多序列比对,用邻接法构建系统发育树[24],结果见图2。
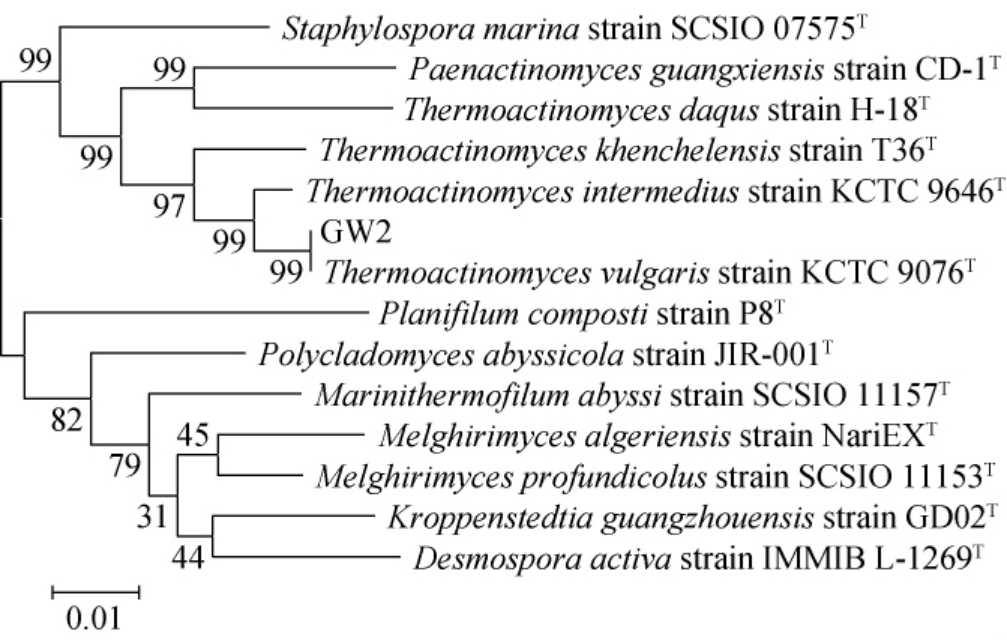
图2 基于16S rDNA基因序列菌株GW2的系统发育树
Fig. 2 Phylogenetic tree of strain GW2 based on 16S rDNA gene sequences
由图2可知,菌株GW2与Thermoactinomyces vulgaris菌株KCTC 9076聚类在一个系统发育分支上,序列同源性为99%。根据《伯杰氏细菌鉴定手册》,结合生理生化特征分析,确定该菌株属于普通高温放线菌(Thermoactinomyces vulgaris)。
2.3 普通高温放线菌产蛋白酶条件优化单因素试验结果及分析
2.3.1 初始pH值对普通高温放线菌产蛋白酶的影响
由图3可知,随着培养基初始pH值在6.0~6.5范围内的增加,蛋白酶活力增加;初始pH值为6.5时蛋白酶活力最高,为179.41 U/g;初始pH值为6.5~8.0时,随着初始pH值增加,蛋白酶活力逐渐降低。可能是在偏碱性环境中对该菌产蛋白酶有一定的抑制作用[25]。pH可以改变培养基成分的离子化程度,影响菌株的代谢过程。因此,选择最佳初始pH值为6.5。
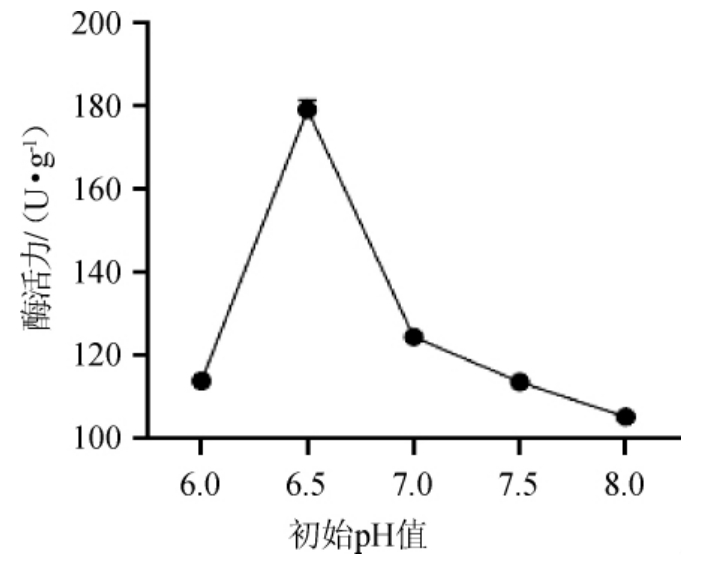
图3 初始pH值对普通高温放线菌GW2产蛋白酶活力的影响
Fig. 3 Effect of initial pH on protease activity produced by Thermoactinomyces vulgaris GW2
2.3.2 培养温度普通高温放线菌产蛋白酶的影响
由图4可知,随着培养温度从37 ℃升高到45 ℃,蛋白酶活力增加;在培养温度为45 ℃时酶活力最高,为189.42 U/g;培养温度高于45 ℃时,蛋白酶活力随温度的升高而减小。可能是温度不仅影响微生物的生长速率、细胞组成以及营养需求,同时还影响离子的运输和扩散、细胞膜的渗透压及表面张力[26];在一定范围内,微生物生长速率随温度升高而增加,同时产酶也增加;但温度过高时,菌体虽生长旺盛,但培养基中的营养物质被过多用于菌体自身生长繁殖,产酶速率会相对降低,且酶活性丧失较快[27]。因此,选择最佳培养温度为45 ℃。
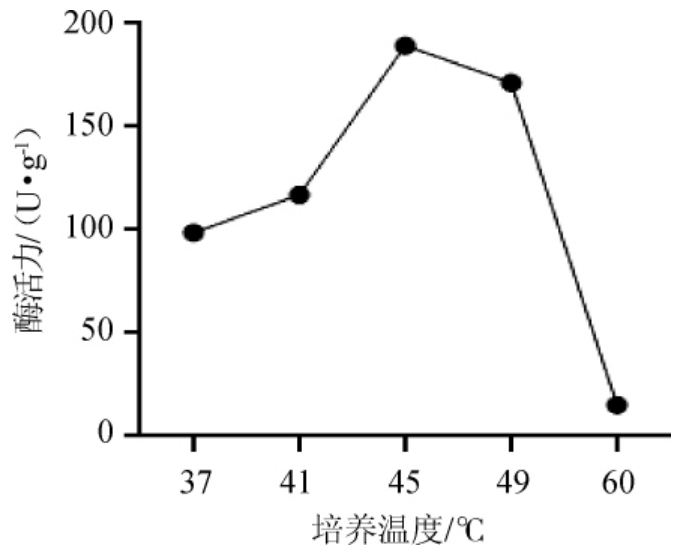
图4 培养温度对普通高温放线菌GW2产蛋白酶活力的影响
Fig. 4 Effect of culture temperature on protease activity produced by Thermoactinomyces vulgaris GW2
2.3.3 培养时间对普通高温放线菌产蛋白酶活力的影响
由图5可知,培养时间3~4 d,蛋白酶活力随培养时间的延长而增加;培养4 d时蛋白酶活力最高,为203.86 U/g;继续延长培养时间,蛋白酶活力随培养时间的延长而减小。可能是因为在培养的前4天,基质中的营养物质尚未耗尽,随着微生物不断繁殖,产酶逐渐增加,之后基质内营养物质耗尽,微生物开始死亡,产酶趋于平缓,同时随着时间延长,所产蛋白酶开始失活,酶活力有下降趋势。因此,选择最佳培养时间为4 d。
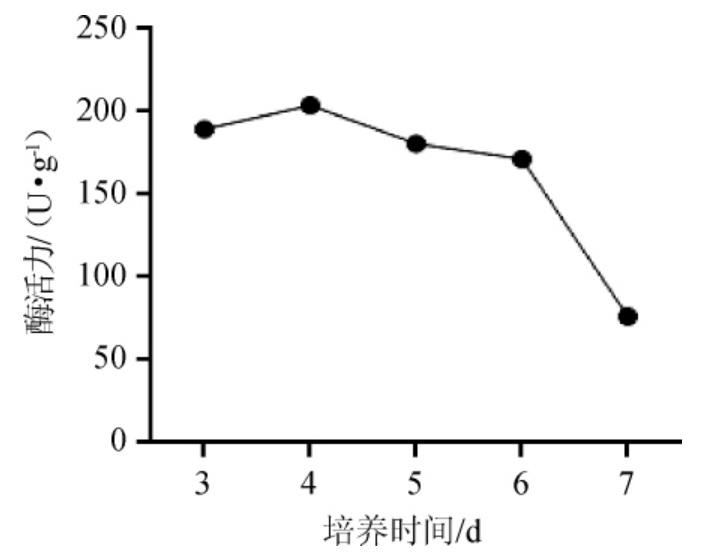
图5 培养时间对普通高温放线菌GW2产蛋白酶活力的影响
Fig. 5 Effect of culture time on protease activity produced by Thermoactinomyces vulgaris GW2
2.4 普通高温放线菌产蛋白酶条件优化正交试验结果及分析
由表3及表4可知,极差由高到低依次为培养时间>培养温度>初始pH值,方差分析结果表明,因素C对产酶活力有显著影响(P<0.05),因素A、因素B对产酶活力影响不显著(P>0.05)。所以从直观分析及方差分析的试验结果可得出,该菌产蛋白酶活力最优的条件为A2B2C3,即初始pH值为6.5,培养温度为45 ℃,培养时间为5 d,在此条件下,普通高温放线菌GW2产蛋白酶活力为214.99 U/g。
表3 普通高温放线菌GW2产蛋白酶条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal experiment for protease production conditions optimization by Thermoactinomyces vulgaris GW2
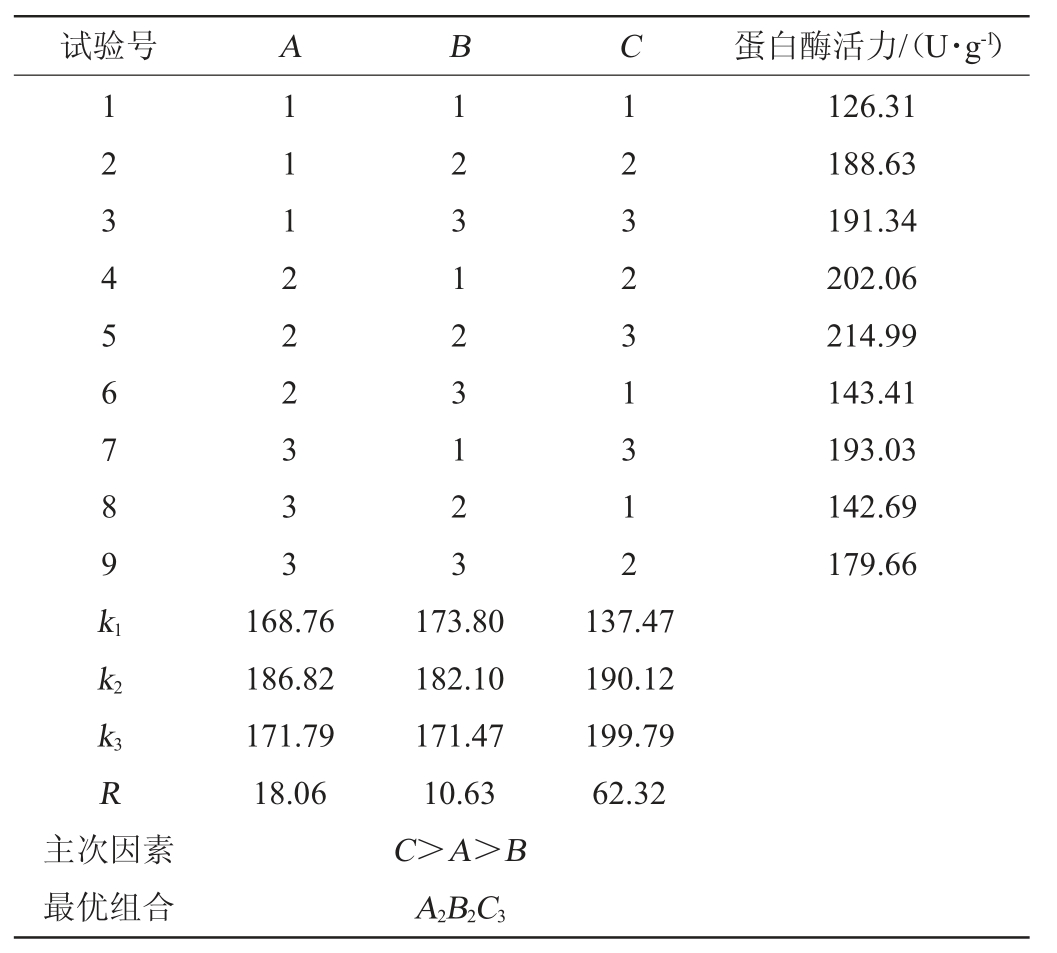
表4 正交试验结果方差分析
Table 4 Variance analysis of orthogonal tests results
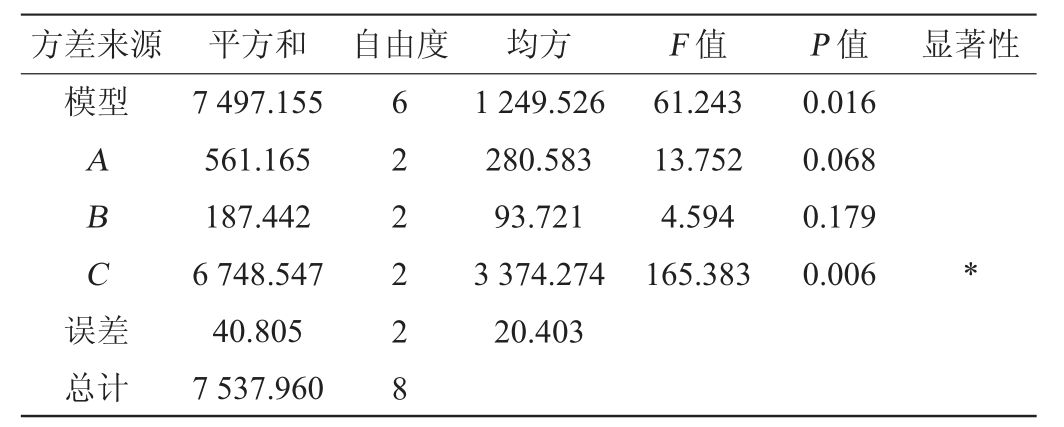
注:“*”表示对结果影响显著(P<0.05)。
3 结论
本研究首先从酱香型高温大曲中分离得到一株高温放线菌GW2,通过对其进行形态学观察、生理生化试验、分子生物学鉴定,得到该菌株为普通高温放线菌(Thermoactinomyces vulgaris)。再以蛋白酶活力为评价指标,对该菌产蛋白酶的条件进行优化,旨在确定该高温放线菌的的最佳产酶条件,为后续高温功能菌的生产应用提供理论基础。研究结果表明,在初始pH值为6.5,培养温度为45 ℃,培养时间为5 d的条件下,该菌产蛋白酶活力高达214.99 U/g,是优化前的1.2倍。
高温放线菌是酱香型高温大曲中的重要功能菌,发达的菌丝体可以很好的疏松大曲的内部结构。但目前高温放线菌在蛋白酶分解方面研究还比较少。本试验筛选出的高温放线菌,能在较高温度下生长产蛋白酶,结合酱香型大曲高温发酵这一工艺特点,不难得到高温放线菌分泌的高温蛋白酶对大曲原料的降解及大曲特征风味前体物质的形成等方面具有潜在的应用价值。本研究通过对高温放线菌产蛋白酶性能的初步研究,确定了该菌株的最优产蛋白酶条件,这为深入研究菌株产酶特性提供参考价值,也为挖掘该菌株在酱香型白酒高温大曲中的应用方面奠定了一定基础。
[1] 张国豪,武振业,蔡玉波.中国白酒文化的剖析[J].酿酒科技,2008(2):121-124.
[2] 肖冬光,赵树欣,陈叶福,等.白酒生产技术[M].北京:化学工业出版社,2011:70-73.
[3] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2013:89-112.
[4] 唐玉明,任道群,姚万春,等.酱香型酒糟醅酵母菌的初步分类及选育[J].酿酒,2017,34(6):44-46.
[5] 张建敏.酱香白酒酿造过程放线菌的筛选与风味研究[D].贵阳:贵州大学,2015.
[6] 关统伟,张小平.放线菌系统分类技术[M].北京:化学工业出版社,2016:1-2.
[7] 经朱宏建,易图永.土壤放线菌生防活性物质的研究进展[J].作物研究,2007(2):149-151.
[8] ALAN C W,NAGAMANI B.Diversity and biogeography of marine actinobacteria[J].Curr Opin Microbiol,2006(9):279-286.
[9] 尤小龙,黄永光,黄蕴利,等.一株酱香白酒放线菌代谢产物活性及其对酿造环境中功能菌的作用[J].酿酒科技,2018(8):17-23.
[10] 王海雁,刘健.海洋放线菌多样性及其代谢产物研究进展[J].中国海洋药物杂志,2010(2):33-34.
[11] 崔福来,王振羽.酒酷及大曲微生物分离报告[J].微生物学杂志,1981(2):13-19.
[12] 司美茹,薛泉宏,来航线.放线菌分离培养基筛选及杂菌抑制方法研究[J].微生物学通报,2004,31(2):61-65.
[13] 孙惠兰.对窖泥中放线菌的分离研究[J].中国酿造,1987,6(6):51-53.
[14] 段淑蓉.几种培养基选择性分离稀有放线菌的方法[J].安徽农学通报,2009,15(21):47-49.
[15] 于华,黄丹,陈卓,等.酱香型大曲中产蛋白酶放线菌的分离及产酶条件研究[J].中国酿造,2017,36(2):64-68.
[16] 高亦豹,王海燕,徐岩.利用PCR-DGGE 未培养技术对中国白酒高温和中温大曲细菌群落结构的分析[J].微生物学通报,2010,37(7):999-1004.
[17] 王晓丹,罗小叶,邱树毅.茅台大曲中一株嗜热放线菌的分离筛选及特性研究[J].中国酿造,2018,37(4):51-56.
[18] 质量技术监督行业职业技能鉴定指导中心组编.食品微生物检验(第二版)[M].北京:中国质检出版社,2013:96-99.
[19] 刘洋,赵婷,姚粟.一株芝麻香型白酒高温大曲嗜热放线菌的分离与鉴定[J].生物技术通报,2012(10):210-216.
[20] 马校卫,颜林春,汤二将.高温大曲中产耐热性蛋白酶芽孢杆菌的筛选和鉴定[J].食品工业科技,2012,33(15):169-173.
[21] 査宇.一株产蛋白酶K工程菌发酵工艺的优化[D].武汉:华中农业大学,2015.
[22] 向双全,黄应予,刘丽娟,等.大曲蛋白酶对固态酿酒发酵的影响[J].中国酿造,2016,35(6):101-104.
[23] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 28715—2012 饲料添加剂酸性、中性蛋白酶活力的测定分光光度法[S].北京:中国标准出版社,2012.
[24] 罗小叶.酱香型大曲高温放线菌的特性研究[D].贵阳:贵州大学,2017.
[25] 吴琛,陈旭,李馨宁.米曲霉奶酪发酵剂培养条件优化[J].沈阳农业大学学报,2020,51(6):696-704.
[26] 张文芝,郭坚华.微生物发酵工艺优化研究进展[J].广东农业科学,2013,40(6):114-117.
[27] 王中月,滕超,汤回花,等.产高分子量木聚糖酶细菌的筛选及产酶条件优化[J].食品与发酵工业,2017,43(10):88-95.