小曲清香型白酒是我国清香型白酒的一大分支,酒体具有无色透明、清香纯正、酒体柔和、回甜爽净、糟香突出、纯净怡然的特点,主要风味物质成分为乙酸乙酯、乳酸乙酯等[1-2]。但与大曲酒相比,小曲酒存在酒体淡薄、苦涩等缺点[3]。小曲中菌种较为单一,主要为糖化发酵菌[4],酿酒周期短,出酒率高;大曲中的微生物种类极其复杂,霉菌、酵母菌及其他微生物种类繁多,并且曲块中富含氨基酸和各种微生物生长代谢的各种酶类,能产生多种风味成分,成为酿造白酒独特香味及口感的重要原因,但其发酵周期较长[5-6]。
在酿酒发酵过程中,酒曲为酒醅中微生物的主要来源,除此之外,发酵环境中的微生物也会带入发酵中去,因此,不管是小曲酒还是大曲酒,都是多种微生物共同作用的结果,相对而言,大曲为大曲酒发酵带入的微生物体系更为复杂[7]。在发酵过程中微生物之间也存在竞争与依存关系[8],某些微生物会成为优势菌,某些微生物则可能数量减少,因此微生物在酒醅中是以微生态系统存在[9-10]。微生物群落的差异,最终会影响酒的产量与品质[11]。左乾程[12]研究发现,不同季节酱香型白酒酒醅中微生物群落及挥发性风味物质含量均存在差异,且发酵过程主要微生物演替与挥发性风味物质变化存在较强相关性;梁振[13]对豉香型白酒发酵过程中微生物和风味物质进行研究,发现微生物与风味物质之间呈现较好的相关性。
为改善小曲酒的品质,本研究在安琪小曲酒发酵过程中加入浓香型大曲复配发酵酿酒,探究浓香大曲对小曲酒出酒率、主要风味物质及微生物群落的影响,并探讨他们之间的相关性,以期为小曲酒质量提升提供技术改进依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
安琪小曲:安琪酵母股份有限公司;浓香型大曲:四川泸州老窖股份有限公司;糯高粱:泸州;配糟:泸州某酒厂。
1.1.2 主要试剂
氢氧化钠(分析纯):成都市科隆化学品有限公司;硫酸铜、葡萄糖(均为分析纯):天津市科密欧化学试剂有限公司;酒石酸钾钠(分析纯):成都金山化学试剂有限公司;盐酸(分析纯):重庆博艺化学试剂有限公司;叔戊醇、乙酸正戊酯、2-乙基正丁酸、乙酸乙酯、乳酸乙酯、异戊醇、异丁醇标准品(均为色谱纯):美国Sigma公司。其他试剂均为国产分析纯。
1.2 仪器与设备
40型酿酒蒸酒器:毅盛原酿酒设备厂;7890A气相色谱(gas chromatography,GC)仪:美国安捷伦科技有限公司;SPX-250B恒温培养箱:上海博讯实业有限公司医疗设备厂;Applied Biosystems GeneAmp 9700系列聚合酶链式反应(polymerase chain reaction,PCR)仪:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 小曲清香型白酒酿造工艺流程[14]
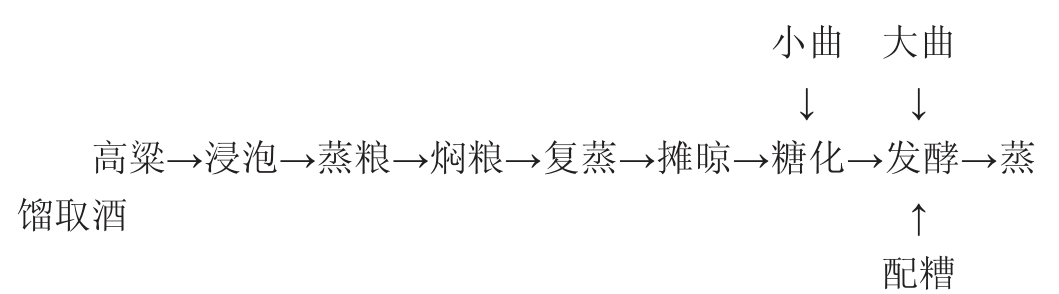
操作要点:
浸泡:将水加热至85~95 ℃,将高粱倒入水中浸泡20~24 h。在浸泡过程中不可搅拌,以免产酸,要求透心率>90%。
蒸粮、焖粮、复蒸:把泡好的高粱装入高压蒸锅内初蒸40 min,开口率要达到75%以上;初蒸完成后,焖粮10~25 min,开口率要达到85%以上;最后复蒸10~30 min,粮食开口率在95%~98%,用手指压高粱粒,柔软、有弹性。
摊晾、糖化:熟粮温度降温到30 ℃左右,撒入小曲,小曲用量为0.5%,进床温度25~27 ℃,根据天气情况适当调节。糖化时间24 h左右,糖化出箱要求有清淡的蜜甜香气,手指压粮食柔软,口尝微酸甜。
发酵:向糖化后的酒醅中添加原粮质量3倍的配糟后,将酒醅分为5组,每组设置3个平行,接着向各组添加大曲,各组大曲添加量分别为0、5%、10%、20%、30%,拌匀,置于恒温培养箱28 ℃密封发酵14 d。
蒸馏:当发酵结束后,对酒醅进行蒸馏。要求截头去尾,摘酒温度控制在25 ℃以下。
1.3.2 出酒率的测定与计算
将各组出窖酒醅上甑蒸馏取酒(至酒精度为0%vol),大曲添加量为0、5%、10%、20%及30%的酒醅所取酒样分别编号为酒样1#、2#、3#、4#、5#,计算出酒率,其计算公式如下:
1.3.3 基酒的感官品评
邀请10位白酒品评专业人员,依据GB/T 33404—2016《白酒感官品评导则》及文献[14]的感官评价标准从色泽、香气、口感及风格4个方面进行评分,满分100分,其中色泽5分、香气25分、口感60分、风格10分。90~100分为特级酒,80~90分为优级酒,70~80分为较好酒,60~70分为一般产品,60分以下为劣质酒。
1.3.4 基酒中挥发性风味物质的测定
采用气相色谱法测定各组基酒中的挥发性风味物质[15]。色谱柱条件:安捷伦DB-WAX(UI)色谱柱(0.18 mm×20 m×0.18 μm),进样口温度250 ℃,升温程序为起始温度50 ℃,保留3 min,以5 ℃/min升至220 ℃,保留30 min,载气为高纯氦气(He),检测器温度250 ℃。
定性定量:根据标准品的保留时间进行定性,以叔戊醇(0.385 g/L)、乙酸正戊酯(0.421 g/L)和2-乙基正丁酸(0.450 g/L)为内标,采用内标法进行定量。
1.3.5 酒醅样品中微生物群落的高通量测序
选取各组发酵结束的酒醅,对各组发酵糟醅上、中、下3层的四周4点和中心点进行取样,混合均匀后为一个混合酒醅样品。大曲添加量为0、5%、10%、20%及30%的酒醅样品分别编号为样品1#、2#、3#、4#、5#。
基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取:按OMEGA试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit提取试剂盒操作说明进行酒醅中微生物DNA的提取。
PCR扩增:以提取的基因组DNA为模板,采用引物341F(5'-CCTACGGGNGGCWGCAG-3')与805R(5'-GACTACHVGGGTATCTAATCC-3')对细菌的16S rDNA V3-V4区基因序列进行PCR扩增,采用引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')与ITS2(5'-GCTGCGTTCTTCATCGATGC-3)'对真菌的ITS区基因序列进行PCR扩增。PCR扩增体系:2×Hieff R Robust PCR Master Mix 15 μL,引物各1 μL,基因组DNA 20~30 ng,双蒸水(ddH2O)9~12 μL。细菌第一轮PCR扩增条件:95 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5个循环;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,20个循环;72 ℃延伸5 min;10 ℃保存。真菌第一轮PCR扩增条件:95 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5个循环;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,25个循环;72 ℃延伸5 min;10 ℃保存。细菌与真菌第二轮PCR扩增条件相同,以第一轮PCR扩增产物为模板进行扩增,PCR扩增条件:95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火20 s,72 ℃延伸30 s,5个循环;72 ℃延伸5 min;10 ℃保存。
高通量测序与分析:PCR扩增结束后,用2%琼脂糖凝胶电泳检测扩增产物。PCR扩增产物委托上海生工生物工程股份有限公司进行测序。根据原始序列双端序列之间的相互重复关系,使用PEAR软件将所有成对的单个序列拼接成一条序列,再根据barcode标签序列区分酒醅样品中真菌及细菌的各序列数据。利用PRINSEQ软件对各序列数据进行质量控制和过滤,得到各序列的有效数据。运用Usearch软件对非重复序列进行操作分类单元(operational taxonomic unit,OTU)聚类分析和物种分类学分析。通过Mothur软件包,对酒醅样品微生物群落进行多样性指数分析。
1.3.6 数据处理
利用QIIME软件计算样品的α多样性指数;采用Origin软件绘制微生物群落结构图;采用SPSS19.0软件对微生物相对丰度与发酵产物进行Pearson相关性分析。
2 结果与分析
2.1 基酒产质量分析
2.1.1 出酒率
在安琪小曲酒发酵过程中添加浓香型大曲对原料出酒率的影响见图1。
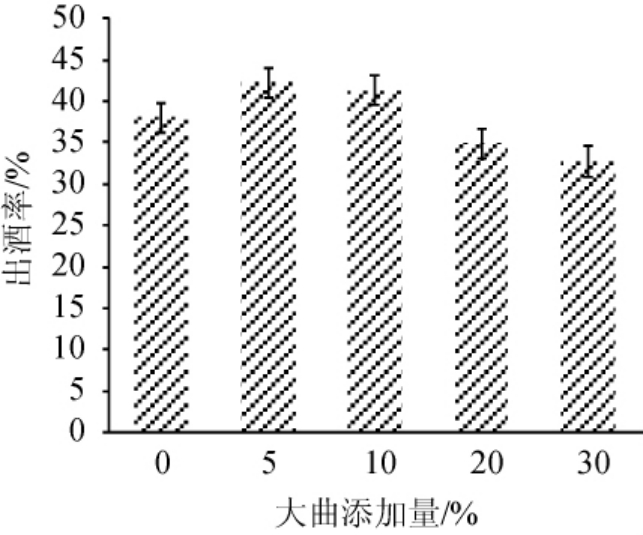
图1 不同添加量的浓香型大曲复配安琪小曲酿造白酒出酒率
Fig. 1 Baijiu yield brewed by different addition of strong-flavor Daqu mixed with Angel Xiaoqu
由图1可知,随着大曲添加量的增加,出酒率呈先升高后下降的趋势。当大曲添加量为5%时,出酒率最高,为42.31%,较纯安琪小曲酿酒提高4.23%。说明在安琪小曲酒发酵过程中添加浓香型大曲对原料出酒率具有一定的影响,合适的浓香型大曲添加比例可以提高小曲酒出酒率,添加过多会导致出酒率降低。
2.1.2 感官评价
不同浓香型大曲添加量复配安琪小曲酿造白酒基酒的感官评价结果见表1。
表1 不同添加量的浓香型大曲复配安琪小曲酿造白酒基酒感官品评结果
Table 1 Sensory evaluation results of Baijiu base brewed by different addition of strong-flavor Daqu mixed with Angel Xiaoqu

由表1可知,随着大曲添加量的增加,基酒的感官评分呈先升高后下降的趋势,其中酒样4#(大曲添加量20%)的感官评分最高,为(94.5±2.88)分,说明在小曲酒发酵过程中添加适当比例大曲有利于小曲酒品质的提升。
2.1.3 主要挥发性风味物质的测定
各组试验的出酒率及基酒样品中主要挥发性风味物质的测定结果见图2。
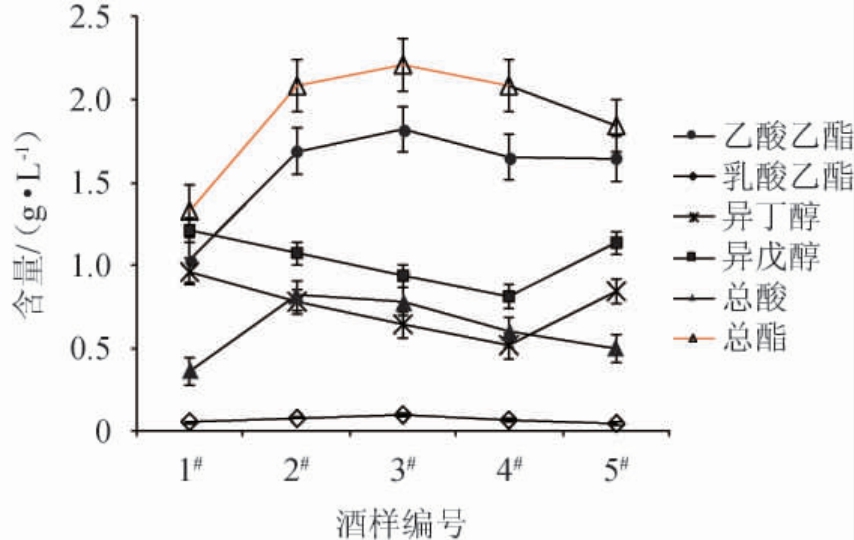
图2 各组酒样中主要挥发性风味物质的测定结果
Fig. 2 Determination results of main volatile flavor components in each Baijiu samples
在主要呈香物质方面,总酸、总酯及乙酸乙酯、乳酸乙酯等均是影响清香型白酒品质的主要指标[16],由图2可知,随着浓香型大曲添加量的增加,所产基酒中的总酸、总酯及主要香味物质成分乙酸乙酯与乳酸乙酯的含量均呈现先升高后降低的趋势,当大曲添加量为10%时,基酒中的总酯、乙酸乙酯及乳酸乙酯含量最多,分别为2.21 g/L、1.82 g/L、0.10 g/L,较纯安琪小曲酿酒分别增加0.88 g/L、0.78 g/L、0.04 g/L。当大曲添加量为5%和10%时,基酒中总酸含量较多,分别为0.82 g/L、0.78 g/L。说明在安琪小曲酿酒过程中添加适当比例的浓香型大曲,有利于酒中总酸、总酯以及主要香味物质成分的增加,有利于提高酒体的品质。此外,白酒中的杂醇类物质既是白酒的色谱骨架成分,也通常是导致白酒苦味的主要原因[17]。通常认为,杂醇类物质中酪醇的苦味极重且持久,异丁醇苦味极重,正丁醇苦味小,异戊醇微带甜苦味[17-19]。由图1可知,基酒中苦味物质异丁醇和异戊醇的含量随着浓香型大曲添加量的增加呈现先减少后增加的趋势,说明适当添加浓香型大曲能够降低酒体中苦味物质的含量。当浓香型大曲添加量为20%时,基酒中异丁醇与异戊醇含量均最低,分别为0.52 g/L、0.81g/L,比纯安琪小曲所酿基酒中分别降低0.44g/L、0.40g/L。
2.2 发酵酒醅微生物群落高通量测序结果分析
2.2.1 α多样性分析
在97%相似水平下对OTU进行聚类,并对不同浓香型大曲添加量复配安琪小曲发酵酒醅样品中细菌与真菌群落的α多样性进行生物信息统计分析[20-24],结果分别见表2和表3。
表2 不同添加量浓香型大曲复配安琪小曲发酵酒醅样品中细菌群落的α多样性分析结果
Table 2 Results of α-diversity analysis of bacterial community in fermented grains fermented by different addition of strong-flavor Daqu mixed with Angel Xiaoqu
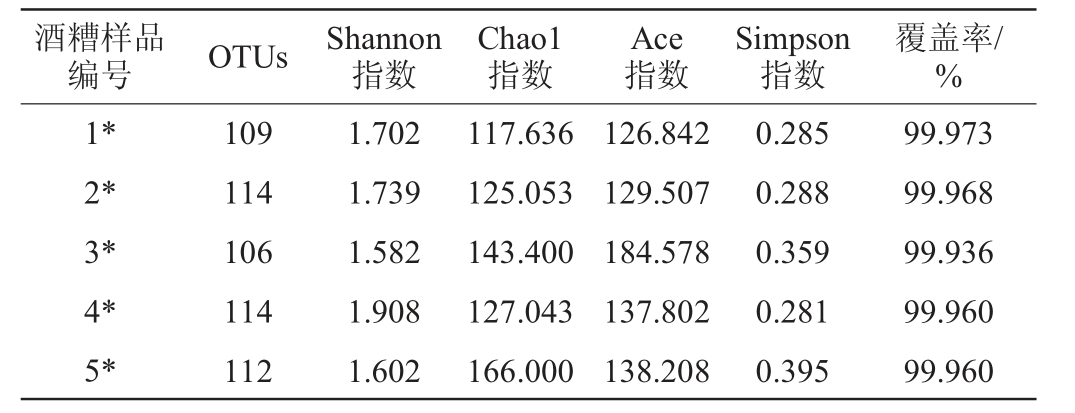
表3 不同浓香型大曲添加量复配安琪小曲发酵酒醅样品中真菌群落的α多样性分析结果
Table 3 Results of α-diversity analysis of fungal community in fermented grains fermented by different addition of strong-flavor Daqu mixed with Angel Xiaoqu
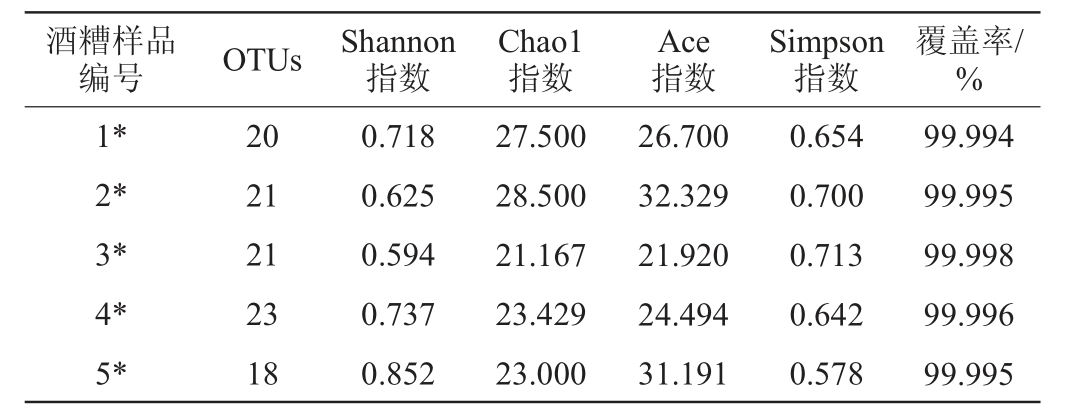
由表2及表3可知,各个样本的覆盖率都>99.99%,说明各样品中绝大部分的微生物都可以被检测到,检测结果能够体现各样品细菌及真菌群落多样性的真实情况。当浓香型大曲添加量为20%时,发酵酒醅样品中细菌与真菌OTU数均最多,分别为114个与23个。根据Shannon指数与Simpson指数发现,当浓香型大曲添加量为20%时,酒醅样品中细菌多样性最高;当浓香型大曲添加量为30%时,酒醅中真菌群落多样性最高。Ace指数与Chao1指数显示,当浓香型大曲添加量为5%时,酒醅样品中真菌群落丰富度最高。因此,在安琪小曲酒发酵过程中添加浓香型大曲对发酵过程中微生物群落具有影响。
2.2.2 菌群结构分析
基于门水平对不同发酵酒醅中细菌与真菌的菌群结构进行分析,结果见图3。
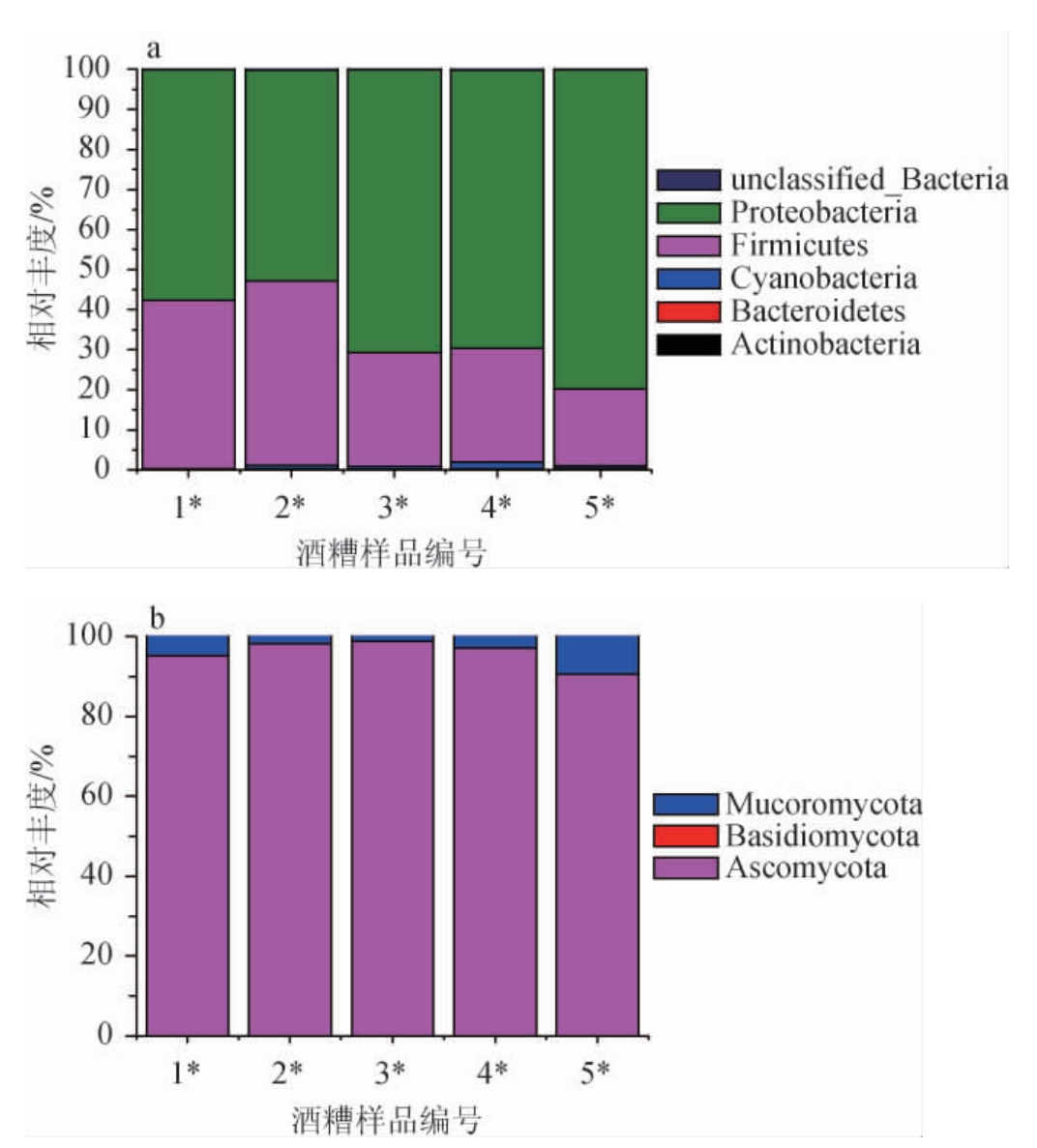
图3 基于门水平不同添加量浓香型大曲复配安琪小曲发酵酒醅样品中细菌(a)与真菌(b)菌群结构分析结果
Fig. 3 Community structure analysis results of bacteria (a) and fungi(b)in fermented grains samples fermented by different addition of strong-flavor Daqu mixed with Angel Xiaoqu based on phylum level
由图3a可知,从5个发酵酒醅样品中共检测到6个细菌门,分别为放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、未分类-细菌门(unclassified-Bacteria),其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)在不同发酵酒醅样品中相对丰度总和均>97%。当浓香型大曲添加量为5%时,酒醅样品中厚壁菌门(Firmicutes)的相对丰度最高,为46.01%;当浓香型大曲添加量为30%时,酒醅样品中变形菌门(Proteobacteria)的相对丰度最高,为79.65%。此外,添加浓香型大曲后,酒醅样品中的Cyanobacteria明显增加。由图3b可知,从5个发酵酒醅样品中共检测到3个真菌门,分别为子囊菌门(Ascomycota)、毛霉门(Mucoromycota)、担子菌门(Basidiomycota),其中子囊菌门(Ascomycota)、毛霉门(Mucoromycota)在不同酒醅样品中均占有绝对优势,相对丰度总和均>99%。
进一步基于属水平对不同酒醅样品中的细菌及真菌菌群结构进行分析,结果发现,从不同发酵酒醅样品中依次检出70、74、65、76和72个细菌属,共检测出88个不同的细菌属;从不同发酵酒醅样品中依次检出13、14、14、15和12个真菌属,共检测出21个不同的真菌属,具体结果见图4。
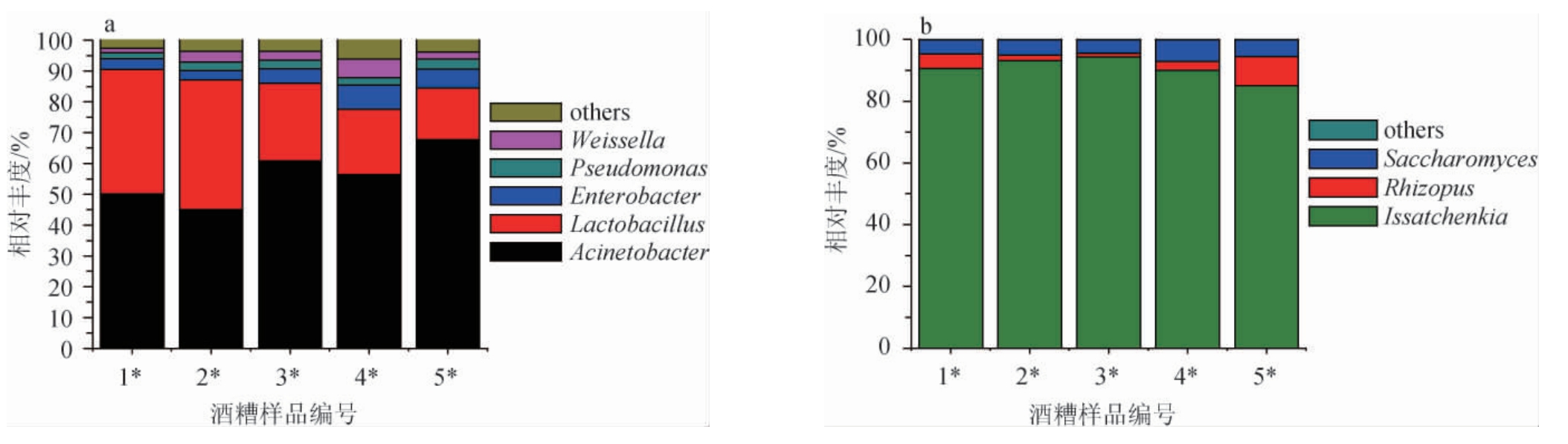
图4 基于属水平不同浓香型大曲添加量复配安琪小曲发酵酒醅样品中细菌(a)与真菌(b)菌群结构分析结果
Fig. 4 Community structure analysis results of bacteria (a) and fungi (b)in fermented grains samples fermented by different addition of strong-flavor Daqu mixed with Angel Xiaoqu based on genus level
others:相对丰度<1%细菌或真菌属。
由图4a可知,5个不同酒醅样品中,有5个优势细菌属(相对丰度≥1%),分别为不动杆菌属(Acinetobacter)、乳酸杆菌属(Lactobacillus)、肠杆菌属(Enterobacter)、假单孢菌属(Pseudomonas)、魏斯氏菌属(Weissella),特别是不动杆菌属(Acinetobacter)与乳酸杆菌属(Lactobacillus),这2类细菌属的相对丰度总和均>80%。就总体趋势而言,浓香型大曲的添加会导致酒醅中不动杆菌属(Acinetobacter)更占有优势。当大曲添加量为30%时,酒醅中不动杆菌属(Acinetobacter)相对丰度最大,为67.76%;酒醅中乳酸杆菌属(Lactobacillus)随大曲添加量的增加先增加后降低,当大曲添加量为5%时,其相对丰度最大为42.10%。由图4b可知,5个不同酒醅样品中,有3个优势真菌属(相对丰度≥1%),分别为伊萨酵母属(Issatchenkia)、根霉属(Rhizopus)、酵母属(Saccharomyces)。其中伊萨酵母属(Issatchenkia)的相对丰度>85%。随着浓香型大曲添加量的增加,伊萨酵母属(Issatchenkia)的相对丰度先增加后降低,当浓香型大曲添加量为10%时,其相对丰度最大为94.33%,根霉属(Rhizopus)的相对丰度先降低后增加,当浓香大曲添加量为30%时,其相对丰度最大为9.41%。当浓香大曲添加量为20%时,酵母属(Saccharomyces)相对丰度最大为6.99%。因此,大曲的添加使小曲酒酒醅中优势微生物种类及丰度发生了不同程度的变化。
2.3 出酒率、主要香味物质与微生物群落的相关性分析
中国白酒中的乙醇及大部分香味物质成分与微生物代谢有关[25-27]。为分析微生物种类与发酵产物间的关系,采用SPSS19.0将出酒率、主要香味物质(乙酸乙酯、乳酸乙酯、异戊醇、异丁醇)与各酒醅样本中主要微生物属进行Pearson相关性分析,结果见表4。
表4 出酒率、主要香味物质及主要微生物属间相关性分析结果
Table 4 Correlation analysis results between Baijiu yield,main flavor substance and main microbial genus
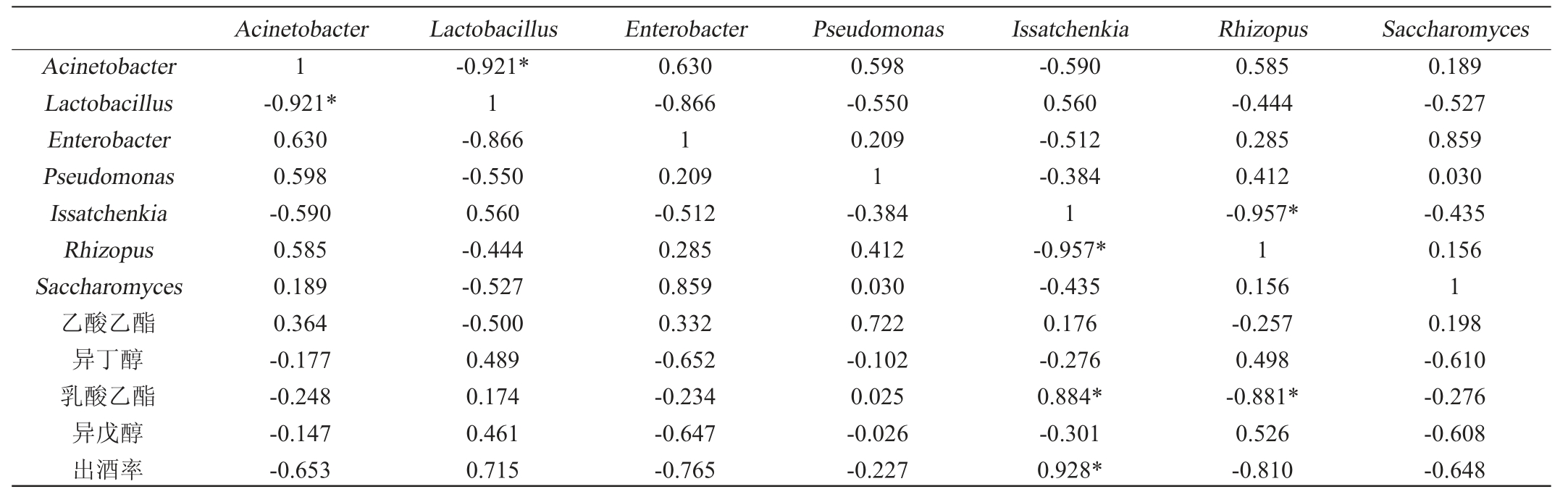
注:“*”表示显著相关(P<0.05);“**”表示极显著相关(P<0.01)。
由表4可知,不同微生物属的相对丰度间存在一定的相关性,不动杆菌属(Acinetobacter)与乳酸杆菌属(Lactobacillus)、伊萨酵母属(Issatchenkia)与根霉属(Rhizopus)间呈显著负相关(P<0.05),说明这两组微生物在发酵过程中可能存在一定竞争关系。由表4亦可知,出酒率及基酒中乳酸乙酯含量与发酵过程中Issatchenkia的相对丰度呈显著正相关(P<0.05),说明Issatchenkia是产酒以及产乳酸乙酯的主要优势微生物。基酒中乳酸乙酯含量与Rhizopus的相对丰度呈显著负相关(P<0.05),说明发酵过程中Rhizopus相对丰度过多可能会导致基酒中乳酸乙酯含量的降低,但是Rhizopus又是糖化的主要微生物,因此,在生产中需要对其使用方法等进行进一步优化。
3 结论
为改善小曲酒产质量,采用安琪曲复配不同比例浓香型大曲酿酒,结果发现,浓香型大曲的添加能提升安琪小曲酒产质量。与纯安琪小曲酿酒对比,在大曲添加比例为20%时,所产基酒感官品质最佳,异丁醇及异戊醇含量分别降低0.44 g/L、0.40 g/L;大曲添加量为10%时,基酒中乙酸乙酯及乳酸乙酯含量分别增加0.78 g/L、0.04 g/L。通过对发酵过程中酒醅中微生物进行高通量测序分析发现,大曲的添加使小曲酒酒醅中微生物多样性提高,优势微生物种类及丰度发生了不同程度的变化。通过对出酒率、主要风味物质含量及优势微生物属相对丰度进行相关性分析发现,微生物间及微生物与产物之间存在相关性关系,其中,不动杆菌属(Acinetobacter)与乳酸杆菌属(Lactobacillus)、伊萨酵母属(Issatchenkia)与根霉属(Rhizopus)间呈显著负相关(P<0.05),出酒率及乳酸乙酯含量与Issatchenkia相对丰度呈显著正相关(P<0.05),乳酸乙酯含量与Rhizopus相对丰度呈显著负相关(P<0.05)
[1] 王喆,张梦思,孙细珍,等.小曲清香型白酒中关键风味成分分析[J/OL].食品科学:1-14.http://kns.cnki.net/kcms/detail/11.2206.TS.20220224.0942.002.html.
[2] 王震,叶宏,朱婷婷,等.清香型白酒风味成分的研究进展[J].食品科学,2022,43(7):232-244.
[3] 曲冠颐,唐洁,姜健,等.小曲清香型白酒发酵过程微生物菌群合成高级醇代谢特征[J].食品与发酵工业,2021,47(11):32-37.
[4] 王柏文.小曲糖化酶谱形成机制及其对白酒发酵过程的影响[D].无锡:江南大学,2020.
[5] 成林,成坚,王琴,等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造,2020,39(10):1-4.
[6] 陈果忠,李世锋,任列华,等.浓香型基础酒和酿造用粮食及大曲的香味成分研究[J].食品工业科技,2018,39(3):250-258.
[7] FU G M,DENG M F,CHEN Y,et al.Analysis of microbial community physiochemical indices and volatile compounds of Chinese Te-flavour Baijiu Daqu produced in different seasons[J].J Sci Food Agr,2021,101(15):6525-6532.
[8] 周袁璐,师苑,陆跃乐,等.传统发酵过程微生物互作研究进展[J].中国食品学报,2021,21(11):349-358.
[9] 赵龙飞,周文和.传统白酒发酵过程中微生物种类及功能研究进展[J].食品研究与开发,2017,38(19):195-198.
[10] MU Y,HUANG J,ZHOU R Q,et al.Exploring the response patterns of strong-flavor Baijiu brewing microecosystem to fortified Daqu under different pit ages[J].Food Res Int,2022,155:111062.
[11] 申登晋.中国小曲清香型白酒酿造功能微生物群落演替模式解析[D].武汉:华中农业大学,2021.
[12] 左乾程.不同季节清酱香型白酒发酵微生物菌群结构多样性特征解析[D].贵阳:贵州大学,2021.
[13] 梁振.豉香型白酒发酵过程中微生物和风味物质的研究[D].广州:仲恺农业工程学院,2020.
[14] 涂飞勇,杨平,王孝荣,等.机械上甑对浓香型白酒蒸馏效果的影响[J].酿酒科技,2017(11):26-30,37.
[15] 熊燕飞,马卓,彭远松,等.中国白酒风味成分的色谱分析方法研究进展[J].中国酿造,2019,38(11):1-5.
[16] 潘天全,程伟,张杰,等.安琪小粬对清香型白酒固态发酵挥发性风味物质的影响[J].酿酒科技,2021(10):124-132.
[17] 王尹叶.白酒中挥发性呈苦和/或涩味物质研究[D].无锡:江南大学,2018.
[18] 王尹叶,范文来,徐岩.白酒中挥发性苦涩味物质的提取和分离[J].食品与发酵工业,2018,44(6):240-244.
[19] LUO Y,KONG L H,XUE R Q,et al.Bitterness in alcoholic beverages:The profiles of perception,constituents,and contributors[J].Trends Food Sci Technol,2020,96:222-232.
[20] 蔡凤娇,蒋燕明,饶建军,等.白酒酿造微生物分析方法研究进展[J].食品研究与开发,2021,42(18):211-218.
[21] 吕丽茹,王晓平,文静,等.浓香型白酒生产区土壤微生物群落结构的季节性变化[J].中国酿造,2022,41(2):60-68.
[22] 王小玲,马琨,伏云珍,等.免耕覆盖及有机肥施用对土壤真菌群落组成及多样性的影响[J].应用生态学报,2020,31(3):890-898.
[23] 唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲细菌群落结构与理化特性研究[J].中国酿造,2022,41(1):138-142.
[24] 刘雪婷,王子媛,刘继明,等.清香型白酒酒醅发酵菌株分离鉴定及细菌群落结构分析[J].中国酿造,2021,40(1):39-43.
[25] 戴奕杰.酱香型白酒酿造过程中微生物群落组成及其与酒品质的关系[D].长沙:湖南农业大学,2019.
[26] REN Q,SUN L P,WU H J,et al.The changes of microbial community and flavor compound in the fermentation process of Chinese rice wine using Fagopyrum tataricum grain as feedstock[J].Sci Rep,2019,9(1):1-12.
[27] 张娇娇,梁明锋,雷显仲,等.贵州迎宾酒绵柔酱香型白酒酒体感官特征与特征风味的相关性分析[J].中国酿造,2022,41(2):69-75.