几丁质是由N-乙酰基-D-葡萄糖胺(N-acetyl-D-glucosamine,GlcNAc)通过β-1,4键组成的一种高结晶、不溶于水的含氮多糖。几丁质广泛存在于真菌细胞壁和节肢动物等的外骨骼中,是仅次于纤维素的第二大天然生物高分子化合物[1-2]。几丁质及其降解产物氨基葡萄糖、几丁寡糖等在医药、食品、材料、农业等领域具有巨大的应用前景。氨基葡萄糖、几丁寡糖的制备方法主要包括化学法、物理法以及酶解法[3-4]。化学和物理法生产使用的原料绝大部分为虾蟹壳提取的几丁质。而酶解法所使用的原料,则为几丁质加工处理后的胶体几丁质、溶胀几丁质等非晶体态几丁质材料。因此,几丁质生产及加工过程中,存在的高污染、低收率及产品品质等问题,在几丁寡糖制备中更加突出。虽然,酶法转化几丁质生物质中的多糖是生物炼制的关键技术之一[5-7]。尽管几丁质酶能有效地降解几丁质的无定形区域,但它们降解结晶几丁质的效率很低[8]。但几丁质的高结晶度使其具有难降解性和难加工性,限制其大规模的开发利用。实现结晶几丁质的高效低成本酶法转化已成为当前研究的热点。
裂解多糖单加氧酶(lytic polysaccharide monooxygenase,LPMO)的发现为几丁质等结晶态多糖的降解带来了曙光[9]。作为一种具有氧化还原活性的酶,LPMO是能够作用于晶体多糖的氧化酶,它通过氧化作用来断裂几丁质(或纤维素)的糖苷键,生成氧化的糖链末端和新的非还原糖链端,使底物的晶体结构趋于松散,为糖苷水解酶的进一步作用提供底物[10-11]。由LPMO与几丁质酶、壳聚糖酶等组成的多酶降解体系,对晶体几丁质的降解过程,如图1所示,LPMO将单链几丁质从晶体结构中剥离出来,并阻止其晶体形态的恢复,为几丁质酶提供了充足的底物。内切几丁质酶破坏几丁质的多糖链结构,产生寡糖和新的非还原端。壳聚糖酶可识别脱乙酰位点并具有和内切几丁质酶相似的功能[12]。几丁二糖酶则协同地从几丁质多糖链的非还原端水解并生成几丁二糖,N-乙酰葡萄糖胺酶又把几丁二糖切割为几丁质单体GlcNAc[13]。施贤卫等[14]的研究表明,LPMO与几丁质酶协同降解几丁质时可提高几丁质酶60%的水解效率。李志敏等[15]的研究表明,LPMO能使粘质沙雷菌(Serratia marcescens)几丁质酶活力提高1.85倍。此外,来源于灰色链霉菌(Streptomyces griseus)的四种不同LPMO显示出对多种几丁质酶的催化促进作用[16]。来源于贵州木霉菌(Trichoderma guizhouense)的LPMO协同几丁质酶可使α型和β型几丁质的降解效率分别提高39.9%和288.2%[17]。此外,来源于杀鲑气单胞菌(Aeromonas salmonicida)的几丁质酶和LPMO基因在大肠杆菌中分别表达纯化后,复配混合酶对粉粒几丁质的降解效率可提高两倍以上[18]。LPMO协同几丁质酶对晶体几丁质的高效作用已引起国内外研究者的高度重视,LPMO协作下的多酶降解体系的研究,现已成为几丁质资源开发研究的新方向[19]。
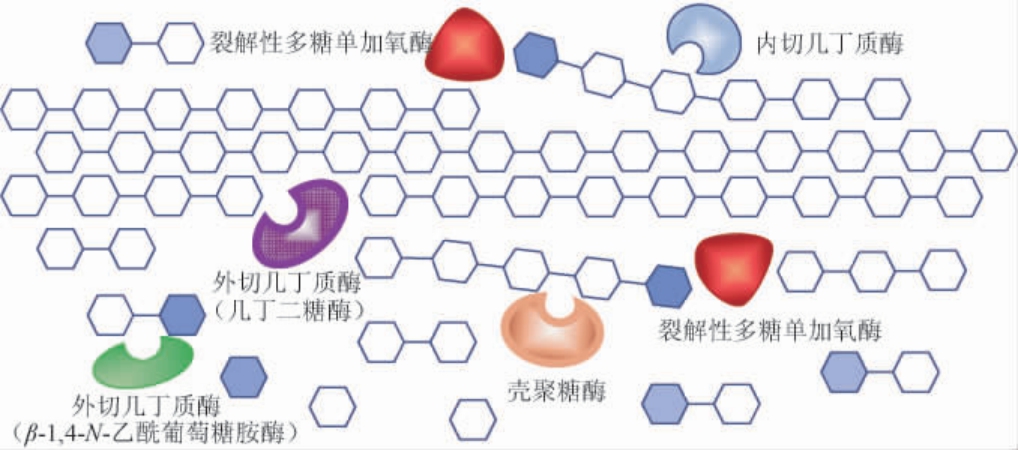
图1 几丁质裂解性多糖单加氧酶辅助下的多酶协同降解几丁质示意图
Fig. 1 Schematic diagram of multi-enzyme synergistic degradation of chitin assisted by chitin lytic polysaccharide monooxygenase
本研究从几丁质高效降解菌株Chitiniphilus sp.LY72中筛选并克隆几丁质裂解性多糖单加氧酶(lytic polysaccharide monooxygenase from Chitiniphilus sp.LY72,CsLPMO)基因,在进行生物信息学分析的基础上利用pET-28a,pET-22b和pCold三种质粒构建CsLPMO的异源表达菌株,重组CsLPMO蛋白及采用含镍元并偶联螯合配体氮川三乙酸(Nickel-containing and coupled chelating ligand azotriacetic acid,Ni-NTA)亲和层析柱纯化的蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)鉴定,筛选最佳表达质粒,对重组酶表达条件进行优化,并考察重组酶与几丁质酶的协同作用。以期为LPMO与几丁质降解酶类协同作用机制的研究奠定基础,对实现晶体几丁质资源的大规模、高值化利用具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和引物
Chitiniphilus sp.LY72:由聊城大学生命科学学院保藏,具有较强的降解晶体几丁质的能力。大肠杆菌(Escherichia coli)DH5α用于质粒的构建和保存,E.coli BL21(DE3)用于重组质粒的诱导表达。表达型质粒pET-22b、pET-28a和pCold用于CsLPMO基因的表达。本研究所使用的菌株及质粒均保藏于聊城大学生命科学学院生物工程实验室。本研究所使用的引物序列见表1。
表1 DNA扩增的引物及序列
Table 1 Primer and sequence of DNA amplification

1.1.2 试剂
蛋白胨、酵母粉:英国Oxoid公司;粉粒几丁质、2,6-二甲氧基苯酚(2,6-dimethylphenol,2,6-DMP):上海麦克林生化科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;TransStartR Taq DNA polymerase:北京全式金生物技术有限公司;抗生素、DNA Marker、限制性核酸内切酶(Xho I、Nde I、Xba I、Nco I、EcoR I)、异丙基-β-D-硫代异乳糖苷(iisopropylthio-β-D-galactoside,IPTG)、改良型考马斯亮蓝法(Bradford法)蛋白浓度测定试剂盒、Ni-NTA的琼脂糖亲和树脂层析柱、即用型无缝克隆试剂盒、即用型氨苄青霉素溶液和即用型卡那霉素溶液:生物工程(上海)股份有限公司;DNA连接试剂盒、超滤离心管:北京索莱宝科技有限公司;质粒提取试剂盒、胶回收试剂盒:美国OMEGA公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid colorimetric,DNS):国药集团化学试剂有限公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
Chitiniphilus sp.LY72种子培养基:2 g/L 蛋白胨,5 g/L葡萄糖,0.7 g/L K2HPO4,0.3 g/L KH2PO4,0.5 g/L MgSO4,pH 7.0,121 ℃高压灭菌15 min。
发酵培养基参考文献[20]并稍作改进:5 g/L粉粒几丁质,1g/L蛋白胨,1g/L葡萄糖,0.7g/LK2HPO4,0.3g/LKH2PO4,0.5g/LMgSO4,pH7.0,121℃高压灭菌15min。
氨苄青霉素LB培养基:5 g/L蛋白胨,10 g/L酵母粉,10 g/L NaCl,121 ℃高压灭菌20 min,冷却至室温后加入即用型氨苄青霉素使其终质量浓度为50 μg/mL。
卡那霉素LB培养基:5 g/L蛋白胨,10 g/L酵母粉,10 g/L NaCl,121 ℃高压灭菌20 min,冷却至室温后加入即用型卡那霉素使其终质量浓度为50 μg/mL。
1.2 仪器与设备
T100型梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;ZF-388型全自动凝胶成像分析系统:上海嘉鹏科技有限公司;UV752N型紫外可见分光光度计:上海佑科仪器仪表有限公司;SCIENTZ-950E型超声波细胞粉碎机:宁波新芝生物科技股份有限公司;Infinite M200型多功能酶标仪:奥地利TECAN公司。
1.3 方法
1.3.1 CsLPMO基因克隆
利用C.sp.LY72的16S rDNA信息通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行比对及对数据库、文献检索等分析发现,与C.sp.LY72同源性较高的Chitinolyticbacter meiyuanensis SYBC-H1已完成基因组测序。ZHANG A L等[21]报道C.meiyuanensis SYBC-H1中存在唯一的多糖单加氧酶10家族蛋白Cm3403。根据其基因序列设计引物(Cs-F,Cs-R),以C.sp.LY72基因组为模板进行PCR扩增,PCR扩增体系:10×PCR Buffer 2.5 μL;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)(2.5 mmol/L)2 μL;上游引物(10 μmol/L)1.0 μL;下游引物(10 μmol/L)1.0 μL;基因组模板:1.0 μL;DNA聚合酶:1 μL;双蒸水(ddH2O)补充至25 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min。将获得CsLPMO基因片段,连接到T载体上转化到E.coli DH5α后筛选阳性克隆,重组质粒经酶切和PCR产物大小验证后随机挑选5个,送上海生工测序以获得CsLPMO基因序列。
1.3.2 CsLPMO基因生物信息学分析
使用SignaIP-5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)进行CsLPMO信号肽预测分析;使用TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)对跨膜区域进行预测分析;采用PSORTB(http://psort1.hgc.jp/form.html)进行亚细胞定位分析;理化性质采用ProtParam在线工具进行预测理化性质(https://web.expasy.org/protparam/);CsLPMO功能结构域及功能分析采用美国国家生物技术信息中心(national center for biotechnologyinformation,NCBI)的保守结构域数据库(conserved domain database,CDD)(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行预测;利用SWISS-MODEL完成蛋白质同源性建模,并在Visual Molecular Dynamics分子可视化软件(version 1.9.4a53)中进行查看和绘图。
1.3.3 重组表达质粒构建
提取质粒pET-22b、pET-28a和pCold分别使用对应的限制性内切酶进行双酶切,胶回收载体片段,保存备用。根据CsLPMO去除信号肽后的基因序列,针对不同载体设计扩增引物对。以C.sp.LY72基因组为模板利用引物对Cs22-F/Cs22-R、Cs28-F/Cs28-R 及CsC-F/CsC-R 分别扩增CsLPMO基因。PCR扩增体系:10×PCR Buffer 2.5 μL;dNTPs(2.5 mmol/L)2 μL;上游引物(10 μmol/L)1.0 μL;下游引物(10 μmol/L)1.0 μL;基因组模板:1.0 μL;DNA聚合酶:1 μL;双蒸水(ddH2O)补充至25 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min。将获得的目的片段切胶回收后,按照即用型无缝克隆试剂盒说明书,进行目的基因片段与相应质粒的连接。将连接产物分别化转到E.coli DH5α感受态细胞中,经抗性筛选获得的阳性克隆。提取阳性克隆质粒经双酶切、PCR及测序验证后即为构建成功的重组表达质粒,命名为pET-22b-CsLPMO、pET-28a-CsLPMO和pCold-CsLPMO。
1.3.4 CsLPMO重组酶的表达及分离纯化
将三种重组质粒分别转化到E.coli BL21(DE3)中,经抗性筛选、质粒酶切及测序验证后获得CsLPMO表达菌株EBL-22、EBL-28和EBL-Co。将构建好的菌株EBL-28甘油菌接种于含卡那霉素的LB培养基中,37 ℃、200 r/min培养6~8 h进行活化。将活化好的菌转接到新的含卡那霉素的LB培养基,于37 ℃、200 r/min振荡培养至波长600 nm处的菌体光密度(optical density,OD)值到0.6时,加入IPTG至终浓度为0.5 mmol/L,并在15 ℃继续培养12 h后于4 ℃、8 000 r/min离心10 min,收集菌体。EBL-22和EBL-Co采用同样的方法进行活化,所使用的抗生素为氨苄青霉素。将活化好的菌转接到新的含氨苄青霉素的LB培养基中,37 ℃、200 r/min培养至OD600nm值为0.6,立即将培养物冷却到15 ℃,并静置30 min,加入IPTG至终浓度0.5 mmol/L后,在15 ℃继续培养24 h,8 000 r/min,4 ℃离心10 min收集菌体。
将收集到的菌体用pH 8.0的Tris-HCI缓冲液中洗涤3次并重悬。在冰浴中进行超声(功率400 W,时间3 s,间隔5 s)破碎至澄清,4 ℃下12 000 r/min离心30 min,收集上清液即为菌株的可溶性蛋白。使用Ni-NTA亲和层析柱并按照说明书纯化融合蛋白。纯化获得的样品使用超滤离心管(截留分子质量3 kDa)进行浓缩除盐。菌株的可溶性蛋白和处理后的纯酶用SDS-PAGE检测纯度,并用Bradford法测定蛋白浓度。
1.3.5 重组酶活力测定
CsLPMO重组酶的活力参照BRESLMAYR E等[22-23]的方法,以聚2,6-二甲基苯醚(2,6-dimethylphenol,2,6-DMP)为底物进行测定,并稍作修改。200 μL反应体系中含有50 mmol/L磷酸盐(pH=6.0),10 mg/mL β-几丁质,5 mmol/L 2,6-DMP,100μmol/LH2O2,30 ℃避光孵育15 min,加入50 μL重组酶液(5 μmol/L)后置酶标仪中振荡混匀并在30 ℃条件下反应300 s,测定反应产物木醋醌(3,3',5,5'-四甲氧联对苯醌)在波长469 nm处的吸光度值增量。根据木醋醌的摩尔吸收系数(ε469=53 200 mol/(L·cm)计算木醋醌的生成量。
A为反应产物木醋醌在波长469 nm处的吸光度值增量;ε为木醋醌的摩尔吸收系数,L/(mol·cm);d为反应液在酶标板孔中的厚度,cm。
CsLPMO重组酶酶活单位定义:在200 μL反应体系中,30 ℃反应条件下,1 min转化底物生成1 μmol木醋醌所需的酶量定义为一个酶活单位(U)。
1.3.6 菌株EBL-22的IPTG诱导表达条件优化
以可溶性重组酶的蛋白含量和比酶活力为评价指标,分别考察不同的诱导温度(15 ℃、20 ℃、25 ℃、30 ℃)和诱导时间(8 h、12 h、16 h、20 h)、IPTG添加时间(生物量(OD600nm值)分别为0.2、0.4、0.6、0.8、1.0)、IPTG添加量(0.1 mmol/L、0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L)对诱导表达的影响。
1.3.7 CsLPMO重组酶对几丁质的协同降解作用
按照ZHANG Y等[20]的方法培养Chitiniphilus sp.LY72,以获得几丁质水解酶(chitinolytic enzymes,ChiMix),ChiMix的酶活为2.32 U/mL。以几丁质细粉为底物建立600 μL磷酸盐(50 mmol/L,pH=6.0)反应体系,其中包括10 mg/mL几丁质,100 μL ChiMix,100 μmol/L H2O2以及不同浓度(0、0.2 μmol/L、0.5 μmol/L、1.0 μmol/L、2.0 μmol/L)的CsLPMO重组酶120 μL。在37 ℃,300 r/min条件下振荡孵育48 h,期间按设计时间(1 h、2 h、4 h、8 h、12 h、18 h、24 h、36 h、48 h)取样,计算还原糖含量。
以GlcNAc为标准品,其质量浓度分别为0.1 mg/mL、0.2 mg/mL、0.4 mg/mL、0.6 mg/mL、0.8 mg/mL、1.0 mg/mL、1.2 mg/mL、1.5 mg/mL,利用3,5-二硝基水杨酸(DNS)法检测样品中还原糖的含量。以GlcNAc溶液的质量浓度为横坐标(X),以波长540 nm处吸光度值为纵坐标(Y),绘制GlcNAc标准曲线,其线性回归方程为Y=0.001X-0.061 4,相关系数R2=0.991 8,根据线性回归方程计算还原糖含量。
2 结果与分析
2.1 CsLPMO基因克隆及生物信息学分析
以Chitiniphilus sp.LY72基因组为模板,经PCR扩增,经1%琼脂糖凝胶电泳检测后的电泳图谱见图2。
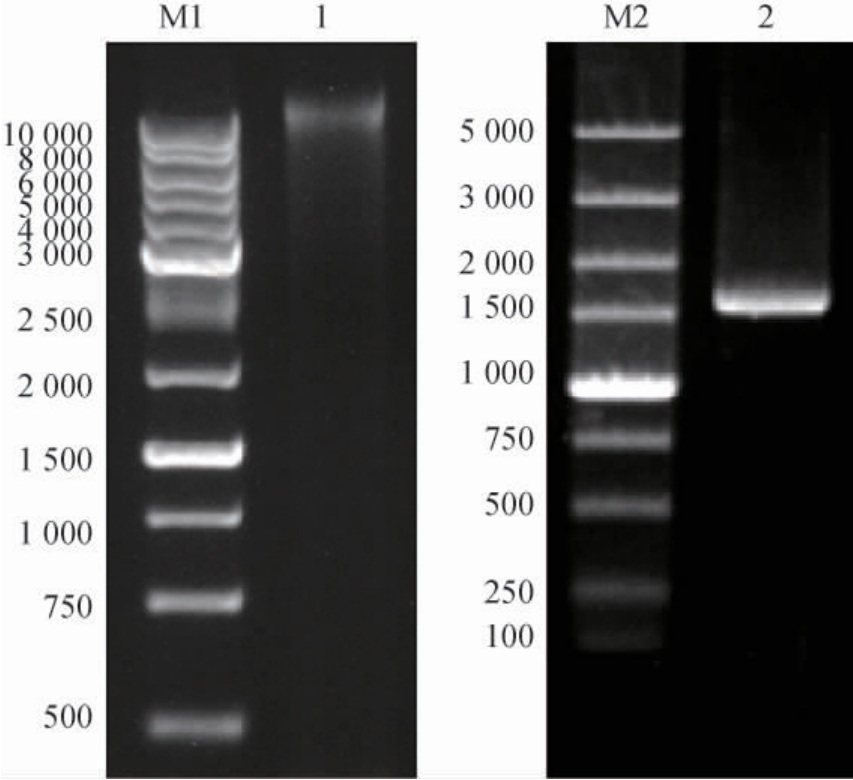
图2 基因组DNA及PCR产物的琼脂糖凝胶电泳图
Fig. 2 Agarose gel eleetrophoresis of genomic DNA and PCR products
M1为分子质量10 000 DNA Marker;1为C.sp.LY72基因组;M2为分子质量5 000 DNA Marker;2为以C.sp.LY72基因组为模板获得的PCR产物。
由图2可知,获得大小约为1 600 bp的DNA片段。测序结果表明,所获得的DNA片段大小为1 578 bp。经BLAST比对结果显示,CsLPMO基因与C.meiyuanensis SYBC-H1基因组中注释为Lytic polysaccharide monooxygenase基因的序列相似度为98.2%。氨基酸序列比对结果表明,CsLPMO基因与Lytic polysaccharide monooxygenase(Cm3403;蛋白ID:WP 148716734.1)相似度为99.6%,Cm3403多肽序列中385位氨基酸为酪氨酸(tyrosine,Y),CsLPMO为苯丙氨酸(phenylalanine,F)。
2.2 CsLPMO基因生物信息学分析
CsLPMO基因的信号肽分析、跨膜区域、亚细胞定位及理化性质分析预测结果表明,CsLPMO具有24个氨基酸组成的信号肽,不具有明显的跨膜结构域,主要分布在细胞外膜和周质空间。去除信号肽的CsLPMO分子质量为53 602.57 Da,等电点为6.65,在E.coli中的半衰期>10 h。
通过NCBI保守结构域数据库(CDD)比对分析发现,CsLPMO多肽序列的第21~308位属于COG3397超家族为典型的LPMO10保守结构域;第378~424位属于chitinase A1的几丁质结合域(ChiA1_BD),第476~520位属于chitinase C的几丁质结合域(ChiC_BD),CsLPMO所具有的两个几丁质酶结合域均属于ChtBD3超家族。
利 用SWISS-MODEL(https://swissmodel.expasy.org/)以蛋白质数据库(protein data bank,PDB)ID:6IF7为模板,对CsLPMO所具有的LPMO10保守结构域的蛋白结构进行建模预测,结果见图3。由图3可知,CsLPMO的LPMO10部分由4个α螺旋和9个β折叠组成,形成表面平坦的球蛋白,其上没有明显的裂缝形态的催化位点。所有的β折叠形成紧密的夹层结构。预测结果表明,铜离子结合位点为H25和H127,P198是主要的底物结合位点,H25-H127-P198构成LPMO10的活性中心,这与典型的LPMO10蛋白CBP21相一致[24]。
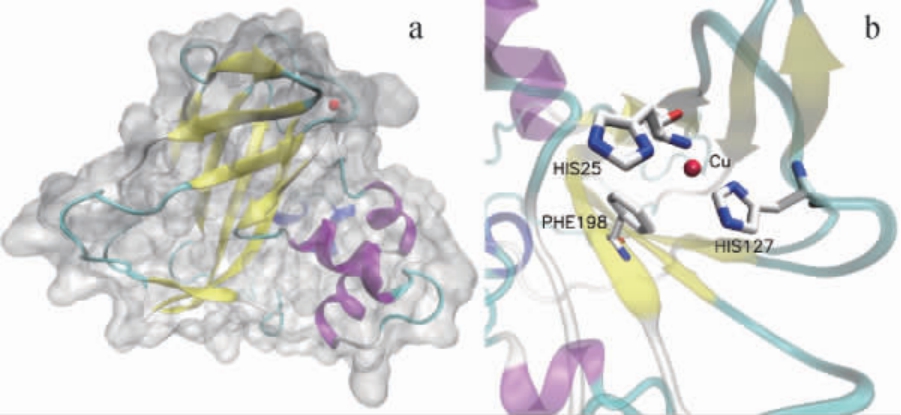
图3 CsLPMO的三维结构图(a)和活性中心(b)预测模型
Fig. 3 Three-dimensional structure diagram (a) and active center (b)prediction model of CsLPMO
目前来源于粘质沙雷氏菌(Serratia marcescens)和粪肠球菌(Enterococcus faecalis)等属于辅助10家族(auxiliary activityfamily10,AA10)典型LPMOs蛋白CBP21和EfCBM33A已被表征[24-25]。为进一研究CsLPMO与AA10家族典型蛋白的进化关系,利用数据库中注释为LPMO的13条序列构建进化树,见图4。

图4 基于氨基酸序列的CsLPMO系统进化树
Fig. 4 Phylogenetic tree of CsLPMO based on amino acid sequences
由图4可知,CsLPMO与CBP21和EfCBM33A处于不同的进化分枝上,进化关系相对较远。CsLPMO与同属的Chitiniphilus shinanonensis和Chitiniphilus eburneus汇集为一个分支,继而和Jeongeupia属的Jeongeupia naejangsanensis、Jeongeupia sp.USM3和Jeongeupia sp.HS-3汇聚为一支,但有关Chitiniphilus和Jeongeupia属的LPMOs鲜有报道。CsLPMO与CBP21和EfCBM33A的序列一致性都在30%以下。
上述生物信息学分析结果表明CsLPMO是一种隶属于AA10家族的裂解性多糖单加氧酶,其序列具有一定的新颖性。
2.3 重组菌构建及验证
按照1.3.3中的方法构建三种重组质粒,并分别化转到E.coli BL21(DE3)中,经抗性筛选后的阳性克隆接种到LB中培养过夜后提质粒,以三种重组质粒为模板,使用相对应的引物分别扩增目的基因片段,琼脂糖凝胶电泳结果见图5。
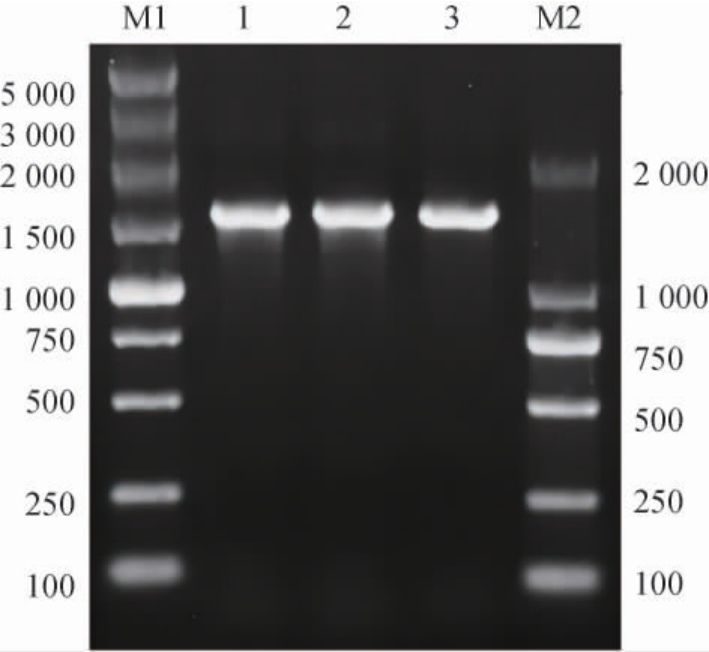
图5 CsLPMO重组质粒的PCR验证
Fig. 5 PCR validation of CsLPMO recombinant plasmid
M1为分子质量5 000 DNA Marker;1为以pET-22b-CsLPMO为模板获得的PCR产物;2为以pET-28a-CsLPMO为模板获得的PCR产物;3为以pCold-CsLPMO为模板获得的PCR产物;M2为分子质量2 000 DNA Marker。
由图5可知,三种重组质粒分别得到约为1 500 bp的条带,大小与预期相一致。三种重组质粒的测序结果也表明,重组质粒中含有的CsLPMO基因与C.sp.LY72基因组中的目标序列相一致,未发生碱基和移码突变。上述结果表明,三种重组质粒构建成功并成功获得相应的重组菌EBL-22、EBL-28和EBL-Co。
2.4 不同质粒表达效果对比
2.4.1 CsLPMO重组酶的表达产物验证及含量测定
按照1.3.4所述的方法对重组菌EBL-22、EBL-28和EBLCo进行诱导表达,利用亲和层析的方法,使用Ni-NTA亲和层析柱对三种重组菌表达的可溶性重组酶进行纯化。不同菌的可溶性蛋白及纯化的CsLPMO 蛋白产物经SDS-PAGE检测,结果见图6。
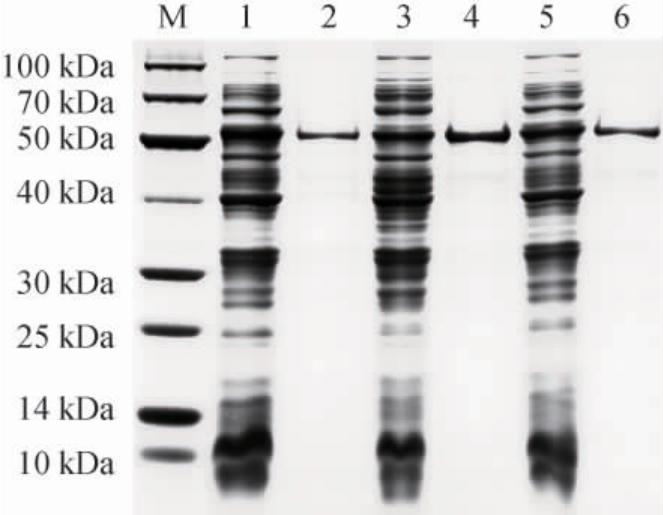
图6 菌株EBL-22、EBL-28和EBL-Co可溶性蛋白及CsLPMO纯化蛋白SDS-PAGE图
Fig. 6 SDS-PAGE maps of soluble proteins and CsLPMO purified proteins of strain EBL-22,EBL-28 and EBL-Co
M为蛋白DNA Marker;1为菌株EBL-22可溶性蛋白;2为来源于菌株EBL-22的CsLPMO纯化蛋白;3为菌株EBL-28可溶性蛋白;4为来源于菌株EBL-28的CsLPMO纯化蛋白;5为菌株EBL-Co可溶性蛋白;6为来源于菌株EBL-Co的CsLPMO纯化蛋白。
由图6可知,菌株EBL-22、EBL-28和EBL-Co均能表达出目的蛋白,各重组菌可溶性蛋白含量大小依次为菌株EBL-22(724.97 mg/L)>EBL-28(582.36 mg/L)>EBL-Co(498.71 mg/L)。3种重组菌利用亲和层析的方法均能获得纯的重组酶,且各重组酶的分子质量介于50~60 kDa之间与预期结果相一致。利用Quantity One软件(version 4.6.2)分析重组酶蛋白占菌体可溶性总蛋白量的百分比。结果表明,CsLPMO重组酶蛋白在菌株EBL-22、EBL-28和EBL-Co中的蛋白含量占比分别为5.9%、4.1%、5.4%。因此,虽然菌株EBL-28有较高的蛋白表达总量,但可溶性重组酶的蛋白含量占比却最低。菌株EBL-Co可溶性蛋白总量最小,其可溶性重组酶的蛋白含量占比高于EBL-28,但菌株EBL-Co需要进行低温表达且表达时间较长,因此不适合用于大规模的重组酶表达获取。菌株EBL-22可溶性蛋白总量最高,且重组酶的蛋白含量占比最高。因此,pET-22b是CsLPMO重组酶较好的表达质粒。
2.4.2 CsLPMO重组酶纯化前后比酶活力对比
按照1.3.5的方法对各重组酶纯化前后的比酶活力进行检测。菌株EBL-22、EBL-28和EBL-Co中CsLPMO重组酶纯化前后比酶活力比较结果见表2。
表2 菌株EBL-22、EBL-28和EBL-Co的CsLPMO重组酶纯化前后比酶活力比较
Table 2 Comparison of specific enzyme activities of CsLPMO recombinase before and after purification of strain EBL-22,EBL-28 and EBL-Co
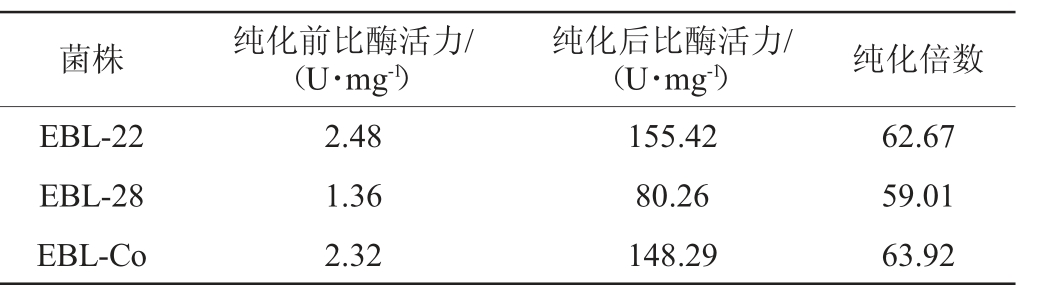
由表2可知,来源于菌株EBL-22的CsLPMO纯化前比酶活力最高为2.48 U/mg。来源于EBL-Co的重组酶比酶活力仅比菌株EBL-22稍低,为2.32 U/mg。而来源于EBL-28的重组酶比酶活力最低(1.36 U/mg),仅为菌株EBL-22的55%。纯化后,来源于菌株EBL-22、EBL-28和EBL-Co的CsLPMO比酶酶活力分别为155.42 U/mg、80.26 U/mg、148.29 U/mg。结果再次证实,pET-22b是CsLPMO较好的表达质粒。
2.5 菌株EBL-22诱导表达条件优化
2.5.1 诱导温度和时间对表达效果的影响
将菌株EBL-22在37 ℃培养至OD600nm值至0.6后添加诱导剂IPTG,对可溶性总蛋白的浓度及比酶活力进行测定。诱导温度和时间对重组酶表达效果的影响结果见图7。
由图7可知,在相同的诱导温度下,随着诱导时间的增加,可溶性总蛋白质量浓度呈增加趋势,且诱导时间为20 h时,可溶性总蛋白质量浓度达到最大值,而诱导16 h与20 h获得的可溶性总蛋白的质量浓度相差不大。因此,固定诱导时间为16 h。随着诱导温度在15~30 ℃范围内的升高,可溶性总蛋白质量浓度呈升高趋势;随着诱导温度在15~25 ℃的升高,比酶活力呈增加趋势,当诱导温度为25 ℃时,比酶活力达到最大值,为3.31 U/mL;当诱导温度高于25 ℃,比酶活力呈下降趋势。因此,菌株EBL-22较佳的诱导温度和时间分别为25 ℃和16 h。
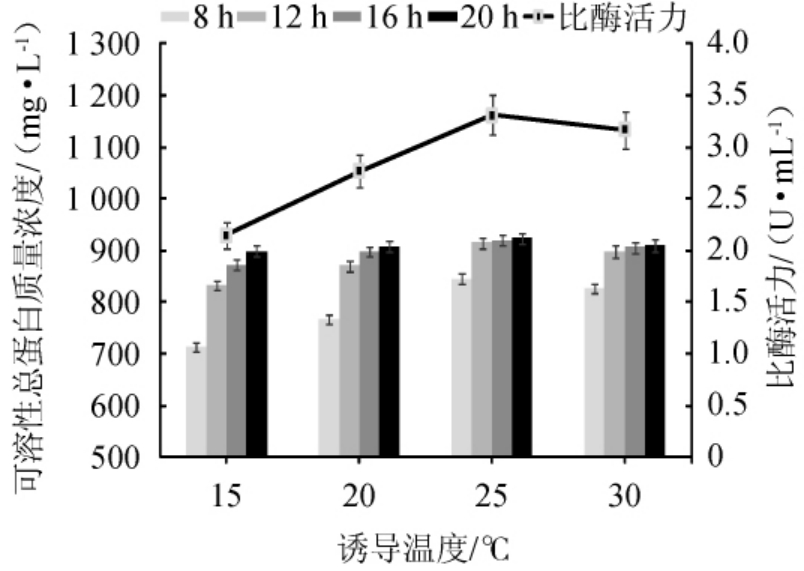
图7 不同诱导温度对重组酶表达效果的影响
Fig. 7 Effects of different induction temperature on the expression effects of recombinase
2.5.2 IPTG添加时间对表达效果的影响
为考察IPTG添加时间对可溶性总蛋白表达效果的影响,选取菌株EBL-22生长到OD600nm值分别为0.2、0.4、0.6、0.8和1.0时添加IPTG,使其终浓度为0.5 mmol/L,并在25 ℃条件下诱导培养16 h,检测可溶性总蛋白的质量浓度及比酶活力。不同诱导时间对可溶性重组酶表达效果的影响见图8。
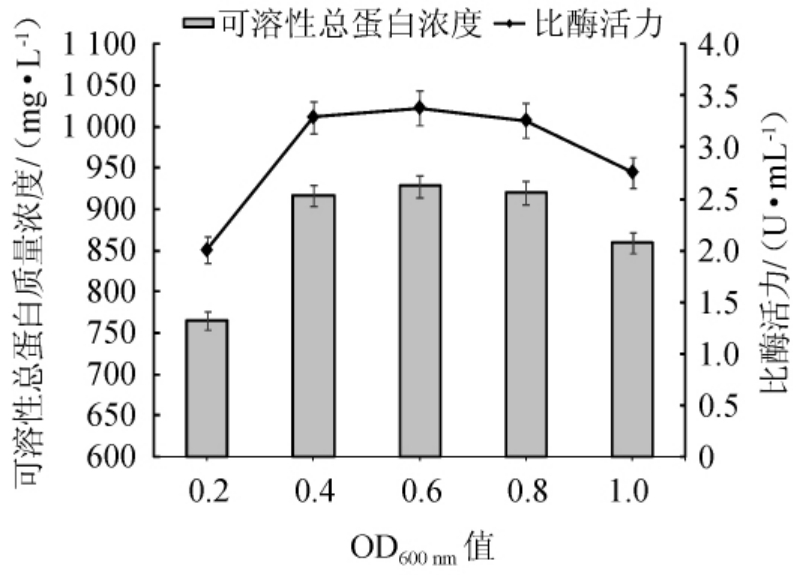
图8 不同诱导时间对可溶性重组酶表达效果的影响
Fig. 8 Effects of different induction time on the expression effects of soluble recombinase
由图8可知,可溶性总蛋白质量浓度与比酶活力变化趋势大致相似。当菌体OD600nm值为0.2时,添加诱导剂所获得的可溶性总蛋白质量浓度最少,仅为765.75 mg/L,且比酶活力也最低(2.01 U/mL)。随着OD600nm值在0.2~0.6范围内的增加,所获得的可溶性总蛋白质量浓度增加,比酶活力增加;当OD600nm值为0.6时,可溶性总蛋白质量浓度达到最大值,为927.9 mg/L,比酶活力为3.38 U/mL;当OD600nm值>0.8时,可溶性总蛋白质量浓度和比酶活力出现下降趋势,在OD600nm值为1.0时,降低最为明显,此时,可溶性总蛋白质量浓度为859.76 mg/L,比酶活力为2.76 U/mL。考虑到可溶性重组酶获取的经济性,选择菌株EBL-22生长到OD600nm值为0.4时,添加IPTG进行诱导。
2.5.3 IPTG添加量对重组酶表达效果的影响
在上述的诱导表达条件下对IPTG的添加量进行评估,以确定最佳的IPTG添加量。不同IPTG添加量对可溶性重组酶表达效果的影响见图9。
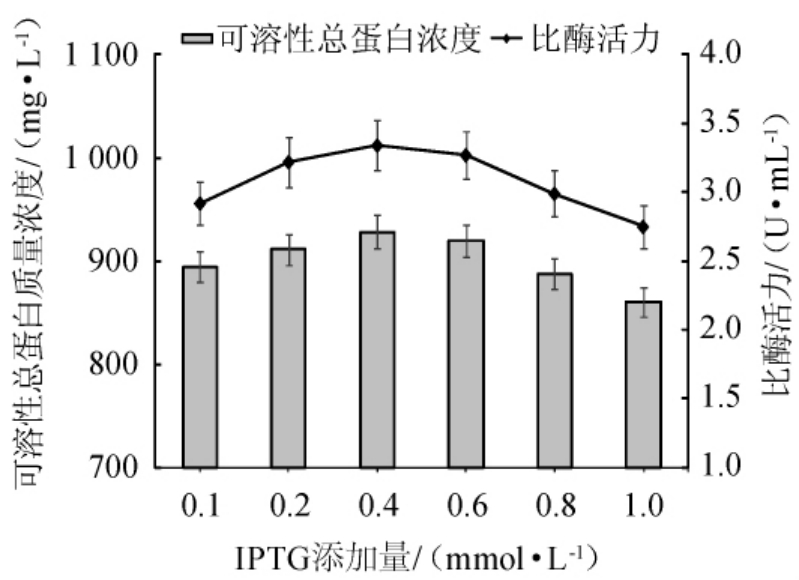
图9 不同IPTG添加量对可溶性重组酶表达效果的影响
Fig. 9 Effects of different IPTG addition on the expression effects of soluble recombinase
由图9可知,可溶性重组总蛋白质量浓度的变化趋势与比酶活力相似,均呈先升高后下降的趋势。随着IPTG添加量在0.1~0.4 mmol/L范围内的增加,可溶性重组总蛋白质量浓度与比酶活力增加;当IPTG添加量为0.4 mmol/L时,可溶性重组总蛋白质量浓度与比酶活力均达到最高值,分别是928.32 mg/L、3.34 U/mL;当IPTG添加量>0.6 mmol/L时,可溶性重组酶蛋白质量浓度与比酶活力呈下降趋势,当IPTG添加量>0.8 mmol/L时,可溶性重组酶蛋白的表达量受到较大影响,可能是由于较高浓度IPTG对菌体的毒性造成的。
2.6 重组CsLPMO与几丁质酶的协同作用
现有的研究表明,LPMO作为辅助型蛋白能有效提高几丁质酶的活力。CsLPMO来源菌株C.sp.LY72,能够产生较高活力的几丁质水解酶并具有较强的降解晶体几丁质的能力。为研究重组CsLPMO与C.sp.LY72产生的几丁质水解酶的协同,以几丁质细粉为底物分别对重组CsLPMO、C.sp.LY72产生的几丁质水解酶(ChiMix)以及不同浓度CsLPMO和ChiMix协同降解几丁质产生还原糖的浓度进行检测,CsLPMO和ChiMix协同降解几丁质的时间进程曲线见图10。

图10 CsLPMO和ChiMix协同降解几丁质的时间进程曲线
Fig. 10 Time progression curve of chitin degraded synergistically by CsLPMO and ChiMix
由图10可知,CsLPMO和ChiMix都能水解几丁质粉末产生还原糖,不同物质及其组合的降解曲线变化相似,当时间<12 h时,还原糖的生成量明显增加;当时间>12 h时,还原糖的生成量增加量有所减缓。当时间为48 h时,CsLPMO和ChiMix分别产生还原糖0.302 mmol/L和0.731 mmol/L,CsLPMO产生的还原糖含量最少。而CsLPMO和ChiMix协同作用使还原糖的产量得到大幅度提升,且随着CsLPMO添加量的增加,还原糖的产量明显升高。其中,ChiMix+CsLPMO(2 μmol/L)的产物生成量为1.949 mmol/L,分别是CsLPMO和ChiMix单独作用时的6.45倍和2.67倍。研究结果表明,CsLPMO不仅具有几丁质水解活性且对几丁质水解酶具有较好的协同作用,在其辅助下能有效提高酶解几丁质产生还原糖的生产效率和产量。
3 结论
本研究以Chitiniphilus sp.LY72为模板获取CsLPMO全基因序列,生物信息学分析结果表明CsLPMO是一种裂解性多糖单加氧酶,隶属于AA10家族。利用pET-22b、pET-28a和pCold三种质粒成功构建了CsLPMO的异源表达菌株EBL-22、EBL-28和EBL-Co。结果表明,pET-22b是CsLPMO的最佳表达质粒。对菌株EBL-22表达重组CsLPMO蛋白的条件进行优化,确定最优表达条件为:菌株EBL-22在37 ℃条件下培养至OD600nm值至0.4时,添加IPTG至终浓度为0.4 mmol/L,在25 ℃下诱导表达16 h。在此优化条件下,所得到的可溶性总蛋白质量浓度为928.32 mg/L,比酶活力为3.34 U/mL。CsLPMO与几丁质水解酶具有协同辅助作用,能有效提高对固体几丁质的水解效率,且CsLPMO添加量越多,辅助促进几丁质酶解的效果越明显。因此,CsLPMO在降解几丁质方面有一定的应用前景,裂解多糖单加氧酶对结晶多糖如纤维素和几丁质裂解特性的发现,为顽固生物质资源的高效利用提供了新的途径。对几丁质类生物质资源的利用具有较高的应用价值和社会意义。
[1] YAN N,CHEN X.Sustainability:Don't waste seafood waste[J].Nature,2015,524(7564):155-157.
[2] 吕梦圆,石佳仙,夏祥,等.大肠杆菌表达几丁质酶对不同底物的酶学性质及其降解产物分析[J].食品与发酵工业,2015,41(3):26-32.
[3] 姜红鹰,周玉玲,张桂敏,等.酶法制备甲壳素系列衍生物的研究进展[J].氨基酸和生物资源,2016,38(4):71-76.
[4] 马钦元,申雁冰,丁盼盼,等.常压室温等离子诱变与微生物微滴培养选育几丁质脱乙酰基酶高产菌株[J].中国酿造,2020,39(8):170-174.
[5] 柴金龙,王敏卜,杭加豪,等.产几丁质脱乙酰酶海洋细菌的筛选鉴定及产酶条件优化[J].中国酿造,2019,38(10):89-95.
[6] 魏丽蓉,秦汪艳,李永成.几丁质脱乙酰酶高产菌株的选育及其发酵特性研究[J].中国酿造,2018,37(7):61-66.
[7] 龚福明,何彩梅,唐小艳,等.微生物几丁质酶的研究进展及应用现状[J].中国酿造,2017,36(8):20-25.
[8] NAKAGAWA Y S,EIJSINK V G H,TOTANI K,et al.Conversion of a-chitin substrates with varying particle size and crystallinity reveals substrate preferences of the chitinases and lytic polysaccharide monooxygenase of Serratia marcescens[J].J Agr Food Chem,2013,61(46):11061-11066.
[9] VAAJE-KOLSTAD G,WESTERENG B,HORN S J,et al.An oxidative enzyme boosting the enzymatic conversion of recalcitrant polysaccharides[J].Science,2010,330(6001):219-222.
[10] COURTADE G,AACHMANN F L.Chitin-active lytic polysaccharide monooxygenases[J].Adv Exp Med Biol,2019,1142:115-129.
[11] SATO K,CHIBA D,YOSHIDA S,et al.Functional analysis of a novel lytic polysaccharide monooxygenase from Streptomyces griseus on cellulose and chitin[J].Int J Biol Macromol,2020,164:2085-2091.
[12] THADATHIL N,VELAPPAN S P.Recent developments in chitosanase research and its biotechnological applications:a review[J].Food Chem,2014,150:392-399.
[13] VAAJE-KOLSTAD G,HORN S J,SØRLIE M,et al.The chitinolytic machinery of Serratia marcescens-a model system for enzymatic degradation of recalcitrant polysaccharides[J].FEBS J,2013,280(13):3028-3049.
[14] 施贤卫,张伟涛,张小飞,等.Actinosynne mamirum DSM43827溶解性多糖单加氧酶的异源表达和酶学性质表征[J].中国生物工程杂志,2014,34(7):17-23.
[15] 李志敏,潘兴亮,杨雅麟,等.溶解性多糖单加氧酶CBP21的高效分泌表达及与几丁质酶的协同作用研究[J].中国农业科技导报,2017,19(1):58-65.
[16] NAKAGAWA Y S,KUDO M,ONODERA R,et al.Analysis of four chitin-active lytic polysaccharide monooxygenases from Streptomyces griseus reveals functional variation[J].J Agr Food Chem,2020,68(47):13641-13650.
[17] MA L,LIU Z Y,KONG Z J,et al.Functional characterization of a novel copper-dependent lytic polysaccharide monooxygenase TgAA11 from Trichoderma guizhouense NJAU 4742 in the oxidative degradation of chitin[J].Carbohyd Polym,2021,258:117708.
[18] PENTEKHINA I,HATTORI T,TRAN D M,SHIMA M,et al.Chitinase system of Aeromonas salmonicida,and characterization of enzymes involved in chitin degradation[J]. Biosci Biotechnol Biochem,2020,84(9):1936-1947.
[19] HAMRE A G,STRØMNES A G S,GUSTAVSEN D,et al.Treatment of recalcitrant crystalline polysaccharides with lytic polysaccharide monooxygenase relieves the need for glycoside hydrolase processivity[J].Carbohyd Res,2019,473:66-71.
[20] ZHANG Y,ZHOU X L,JI L S,et al.Enzymatic single-step preparation and antioxidant activity of hetero-chitooligosaccharides using non-pretreated housefly larvae powder[J].Carbohyd Polym,2017,172:113-119.
[21] ZHANG A L,MO X F,ZHOU N,et al.Identification of chitinolytic enzymes in Chitinolyticbacter meiyuanensis and mechanism of efficiently hydrolyzing chitin to n-acetyl glucosamine[J]. Front Microbiol,2020,11:572053.
[22] BRESLMAYR E,HANŽEK M,HANRAHAN A,et al.A fast and sensitive activity assay for lytic polysaccharide monooxygenase[J]. Biotechnol Biofuels,2018,11:79.
[23] 于晓男,刘霖,屈明博,等.一种几丁质裂解性多糖单加氧酶的活性评价及稳定性研究[J].微生物学报,2022,62(1):189-199.
[24] VAAJE-KOLSTAD G,HORN S J,VAN AALTEN D M F,et al.The noncatalytic chitin-binding protein CBP21 from Serratia marcescens is essential for chitin degradation[J].J Biol Chem,2005,280:28492-28497.
[25] VAAJE-KOLSTAD G,BØHLE L A,GÅSEIDNES S,et al.Characterization of the chitinolytic machinery of Enterococcus faecalis V583 and high-resolution structure of its oxidative CBM33 Enzyme[J].J Mol Biol,2012,416(2):239-254.