褐藻胶裂解酶是制备生物活性寡糖的重要工具酶,可通过β-消除反应将褐藻酸钠降解为在非还原端具有双键的不饱和寡糖,在食品、农业、工业等行业具有重要的应用价值[1-2]。根据底物特异性,褐藻胶裂解酶可分为聚古罗糖醛酸(polyguluronic acid,polyG)嵌段特异性裂解酶、聚甘露糖醛酸(polymannuronic acid,polyM)嵌段特异性裂解酶及两种嵌段都可裂解的双功能裂解酶[3]。迄今为止,已经从海洋生物(藻类、软体动物、细菌和真菌)、陆生细菌和一些病毒中鉴定出多种褐藻胶裂解酶[4],其中海洋细菌是褐藻胶裂解酶的重要来源,如弧菌[5]、黄杆菌[6]、交替单胞菌[7]、微泡菌[8]、芽孢杆菌[9]等。但是,由于现有微生物产酶量少、酶活低,限制了其进一步开发应用,寻找新的高效产酶菌、深入研究酶的产生条件、提高菌株发酵酶活力是迫切需要解决的问题。
诱变是提高微生物发酵产酶水平的有效方法之一,已成为微生物诱变育种的重要技术。常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变是一种基于大气环境温度和射频等离子体的新型微生物诱变育种技术,可在大气压和室温(25~40 ℃)条件下高效诱导脱氧核糖核酸(deoxyribonucleic acid,DNA)断链[10-11],具有条件温和、成本低、效率高的特点,成为微生物基因组的高效快速诱变育种技术,近几年在工业菌种育种中得到了广泛成功的应用[12-13]。CHENG G等[14]通过ARTP诱变成功选育高产L-精氨酸菌株;ZHANG C等[15]通过ARTP诱变成功选育高产木糖醇酵母菌;林杨等[16]针对蛋白酶活性高而产酸能力较弱的德氏乳植杆菌保加利亚亚种菌株,采用ARTP诱变技术获得一株蛋白酶活性稳定且高产酸的菌株Y8-6。
本研究从南海海域海藻、动物及沉积物样品中分离筛选产褐藻胶裂解酶菌株,并以高产褐藻胶裂解酶筛选菌株为出发菌株,利用ARTP诱变技术对其进行诱变处理,通过平板初筛及摇瓶发酵复筛获得高产褐藻胶裂解酶的突变菌株,为褐藻胶裂解酶的生产提供新的微生物资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
海藻、动物及沉积物样品:采集于我国海南岛周边及西沙海域。
1.1.2 试剂
细菌基因组提取试剂盒:北京康为世纪生物科技有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、Ladder Marker、脱氧核糖核酸(deoxyribonucleic acid,DNA)扩增引物,褐藻酸钠(分析纯):生工生物工程(上海)股份有限公司;2216E琼脂培养基:青岛海博生物科技有限公司;胰蛋白胨、酵母粉(均为生化试剂):英国Oxoid公司。
1.1.3 培养基
分离培养基:添加0.05%褐藻酸钠的2216E琼脂培养基。
检测培养基:褐藻酸钠5.0 g/L,(NH4)2SO4 5.0 g/L,K2HPO4 2.0 g/L,MgSO4·7H2O 1.0 g/L,FeSO4·7H2O 0.01 g/L,NaCl 5.0 g/L,琼脂18.0 g/L,pH 7.0。
种子培养基:褐藻酸钠5.0 g/L,胰蛋白胨5.0 g/L,酵母粉1.0 g/L,NaCl 20.0 g/L,pH 7.0。
发酵培养基:褐藻酸钠7.0 g/L,胰蛋白胨12.0 g/L,NaCl 30.0 g/L,MgSO4·7H2O 0.1 g/L,FeSO4·7H2O 0.02 g/L,K2HPO4 0.1 g/L,pH 7.0。
上述培养基灭菌条件均为121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
ARTP-Ⅱ常温常压等离子体诱变仪:无锡思清源生物科技有限公司;SP-756 PC紫外可见分光光度计:上海光谱仪器有限公司;ZHWY-2112B恒温振荡培养箱:上海智城分析仪器制备有限公司;5804R冷冻离心机:德国Eppendorf公司;Bioscreen C全自动微生物生长曲线分析仪:芬兰Oy Growth Curves Ab公司;SPECTRA MAX 190酶标仪:美国Molecular Devices公司;TP600 PCR仪:日本专业仪器制造厂;DYY-12D电泳仪:北京六一仪器厂;Tanon4100全自动数码凝胶成像仪:上海天能科技有限公司。
1.3 方法
1.3.1 细菌的分离
分别取海藻、动物胃肠道及沉积物样品各10 g,磨碎,加入90 mL灭菌海水,在30 ℃、200 r/min条件下振荡30 min,吸取上清液,梯度稀释,涂布于细菌分离培养基用于分离普通细菌。另取上述梯度稀释液(100~10-2),80 ℃水浴处理15 min后,涂布于细菌分离培养基用于分离产芽孢细菌。将平板置于30 ℃静置培养3~5 d后,根据菌落表型不同进行划线纯化。
1.3.2 产褐藻胶裂解酶菌株的筛选
初筛:采用平板酶解圈法[17]。挑取单菌落点接于检测培养基,30 ℃培养3 d,加入适量1 mol/L CaCl2覆盖平板,静置20~40 min显色,有透明圈或晕圈的为阳性菌株。测量菌株酶解圈直径,选取酶解圈直径>20 mm的菌株进行复筛。
复筛:将初筛得到的高产酶菌株接种到发酵培养基,180 r/min、30 ℃培养36 h,离心收集上清液,采用紫外吸收法[18]测定其酶活。取1.8 mL底物(3.0 g褐藻酸钠溶于1 L 50 mmol/L pH 7.0的磷酸盐缓冲液)40 ℃预热5 min,加入0.2 mL待测样品,40 ℃温浴10 min,以灭活的酶液体系为空白对照。100 ℃加热10 min灭活混合反应体系,测定在波长235 nm处的吸光度值(OD235nm值)。
褐藻胶裂解酶酶活定义:在上述测定方法下,定义OD235nm值每分钟增加0.01的酶量为酶的一个活力单位(U/mL)。
1.3.3 筛选菌株的分子生物学鉴定
采用细菌基因组提取试剂盒提取基因组DNA。利用细菌16S rDNA的通用引物27F和1492R进行聚合酶链式反应(PCR)扩增,PCR扩增体系(50 μL):双蒸水(ddH2O)20.0 μL,引物27F和1492R各1 μL,2×Taq PCR Master Mix 25 μL,模板3 μL。PCR扩增条件:94 ℃、5 min;94 ℃、30 s,48 ℃、30 s,72 ℃、90 s,30个循环;72 ℃、7 min[19]。PCR扩增产物经琼脂糖凝胶电泳检测合格后,送生工生物工程(上海)有限公司测序。将测序结果提交到EzBioCloud数据库(https://www.ezbiocloud.net/identify)中与已知的模式菌株序列进行16S rDNA同源性比对分析[20],鉴定菌株的种属关系,并利用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树[21]。
1.3.4 筛选菌株的ARTP诱变选育
生长曲线测定:挑取筛选菌株纯化培养后的单菌落接种于种子培养基,30 ℃、180 r/min摇床振荡培养至OD600nm值为0.5,用种子液培养基稀释1 000倍形成最终体系,点样于96孔板,设3个平行处理。将96孔板置于高通量微生物生长分析仪,设置培养温度为30 ℃、每小时测定一次OD600nm值、共48 h,统计数据,采用软件GraphPad Prism V8.0.2绘制生长曲线。
菌悬液的制备:从平板上挑取活化后的单菌落接种于种子培养基,30 ℃、180 r/min摇瓶振荡培养至对数生长期,取1 mL菌悬液离心并用生理盐水洗涤一次,调整OD600nm值在0.6~0.8之间,最终配制成甘油含量为5%的菌悬液。
ARTP诱变:在无菌条件下吸取配制好的细菌悬液10 μL均匀涂布于无菌金属载片表面,将金属载片转移至ARTP诱变仪对应凹槽,以氦气(He)作为工作气体,电源功率120 W,照射距离2 mm,气流量10 L/min,诱变时间分别为0、10 s、20 s、30 s、40 s、50 s、60 s、80 s、100 s,诱变后分别将载片放入含有1 mL生理盐水的离心管中振荡,取各照射剂量的菌悬液稀释涂板,于30 ℃培养箱中倒置培养3 d,以未经ARTP处理的菌悬液作对照。通过菌落数计算致死率[22],其计算公式如下:
一般而言,当致死率在90%左右时,菌株发生高产突变的概率较高,且在此突变率下的回复性更小,因此采用致死率90%的条件对细菌进行诱变[23-24]。
1.3.5 高产褐藻胶裂解酶诱变菌株的筛选
参考1.3.2中的平板酶解圈法[17]对诱变菌株进行初筛,测量酶解圈的直径,以原始菌株作对照,酶解圈变大则为正突变。对酶解圈明显变大的菌株,采用紫外吸收法[18]测定酶活力进行复筛,筛选出高产褐藻胶裂解酶诱变菌株。
1.3.6 诱变菌株遗传稳定性分析
诱变得到的高产菌株在添加0.05%褐藻酸钠的2216E琼脂培养基上连续传代培养6次,测定酶活力大小,检测诱变菌株的遗传稳定性。
2 结果与分析
2.1 产酶菌株的分离与筛选
将样品在分离培养基上挑取细菌菌落进行划线纯化,经平板酶解圈法[17]筛选获得产褐藻胶裂解酶菌株共131株,部分菌株酶解圈直径结果见图1。
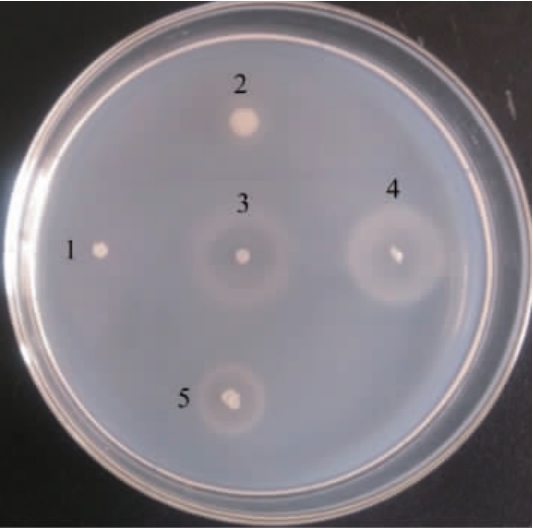
图1 部分筛选菌株酶解圈直径
Fig. 1 Enzymatic circle diameters of some screened strains
1:菌株HB 172110;2:菌株HB 161650;3:菌株HB172198T;4:菌株HB 161718;5:菌株HB161719。
由图1可知,在CaCl2的浸润下,未被降解的褐藻酸钠形成不透明白色背景,而被降解的褐藻酸钠形成透明酶解圈(白环)或白色晕圈(PloyM被裂解酶裂解后,剩余的PloyG与CaCl2结合生成白色凝胶,显现为白色晕圈)[17],酶解圈直径>20 mm的菌株有14株。
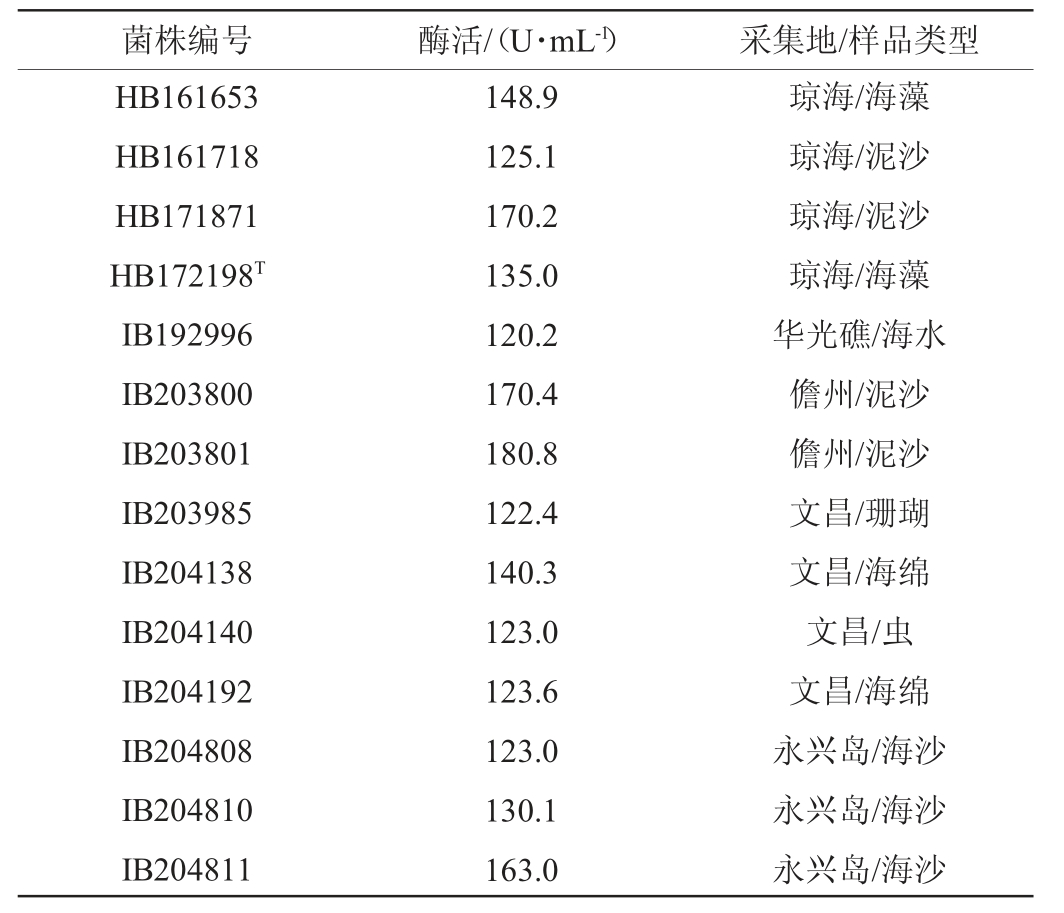
按1.3.2的方法对14株高产褐藻胶裂解酶菌株进行发酵,离心、收集上清液作为粗酶液,采用紫外吸收法测定酶活力,结果见表1。由表1可知,分离于海南文昌海域褐藻的菌株HB172198T,发酵36 h时酶活为135.0 U/mL。菌株HB171871、IB203801和IB203800酶活力较高,均>170 U/mL。
表1 14株高产褐藻胶裂解酶菌株的酶活测定结果
Table 1 Determination results of enzyme activities of 14 strains of high yield alginate lyase
2.2 产褐藻胶裂解酶菌株分子生物学鉴定
采用细菌通用引物27F-1492R,对14株高产酶菌株进行16S rDNA PCR扩增、测序与比对分析,高产褐藻胶裂解酶菌株鉴定结果见表2。由表2可知,它们隶属于3个门、5个纲、7个目、8个科、9个属。在门水平上,变形菌门(Proteobacteria)10株,其中α-变形菌纲3株(IB192996、IB204138、IB204140)、γ-变形菌纲7株(HB161653、HB161718、HB171871、IB203800、IB203801、IB204810、IB204811);其次是厚壁菌门(Firmicutes)(HB172198T、IB20480)和拟杆菌门(Bacteroidetes)(IB203985、IB204192)各2株,各占14.3%。在属水平上,弧菌属(Vibrio)最多(5株)(HB161653、HB171871、IB203800、IB203801、IB204811),占35.7%;其次是交替单胞菌属(Alteromonas)2株(HB161718、IB204810),占14.3%;类芽孢杆菌属(Paenibacillus)(HB172198)、海洋赤杆菌属(Pelagerythrobacter)(IB192996)、黄杆菌属(Flavobacterium)(IB203985)、拉布伦茨氏菌(Labrenzia)(IB204138)、袁其鹏属(Qipengyuania)(IB204140)、粉色杆状菌属(Roseivirga)(IB204192)、芽孢杆菌属(Bacillus)(IB204808)各1株。酶活力高的菌株HB171871、IB203801和IB203800均为弧菌属(Vibrio)细菌。
表2 14株高产褐藻胶裂解酶菌株鉴定结果
Table 2 Identification results of 14 strains of high yield alginate lyase
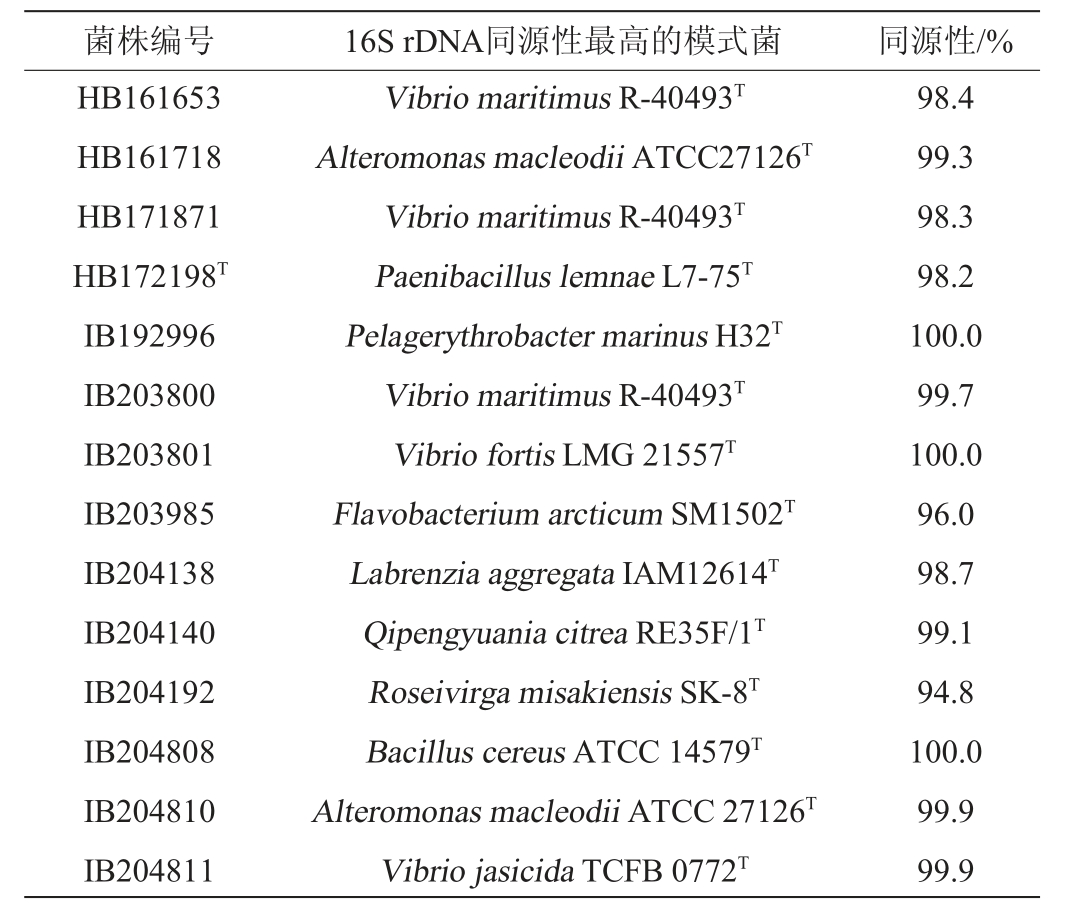
以16S rDNA相似度阈值98.65%为判断标准[25],有5株菌(HB161653、HB171871、HB172198T、IB203985和IB204192)与其同源性最高的模式菌株的相似性<98.65%(占35.7%),初步鉴定为新的分类单元,基于16S rDNA的14株菌株与其同源性最高模式菌株的系统发育树见图2。
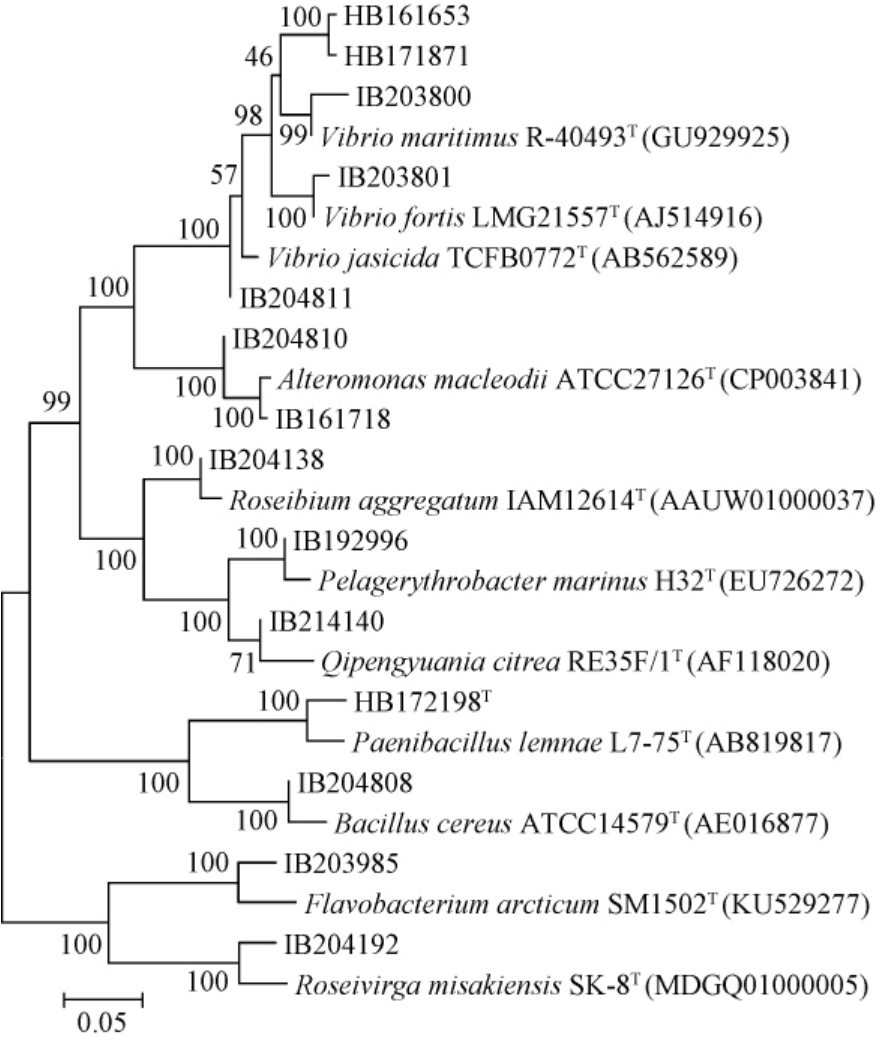
图2 基于16S rDNA基因序列14株产酶细菌系统发育树
Fig. 2 Phylogenetic tree of 14 enzyme-producing bacteria based on 16S rDNA gene sequence
由图2可知,分离菌株均与同源性最高菌株聚在同一分支。由此可见,在南海生境中,产褐藻胶裂解酶细菌资源非常丰富,蕴含着众多新的微生物等待被挖掘。此外,已利用细菌多相分类的方法,鉴定菌株HB172198T为类芽孢杆菌属的一株新种,命名为海藻类芽孢杆菌(Paenibacillus algicola sp.nov.)[26]。
2.3 产酶菌株HB172198T的ARTP诱变
在14株褐藻胶裂解酶活性高的菌株中,菌株HB172198T的活性不是最高的,但鉴于芽孢杆菌产生内生孢子,抵抗外界环境能力强,且能产生多种胞外酶,具有更为广阔的应用前景[27]。同时菌株HB172198T是海洋中不可多得的能够产生褐藻胶裂解酶的芽孢杆菌新种,因此,选择菌株HB172198T进行等离子体诱变选育。
2.3.1 菌株HB172198T生长曲线测定
对数生长期细菌代谢旺盛,比生长速率最大,微生物诱变应选择对数生长期的菌株。菌株HB172198T的生长曲线如图3所示,菌株HB172198T培养0~15 h区间处于迟缓期,培养15~25 h区间处于对数生长期,培养25~35 h区间处于平稳期。当菌株HB172198T培养22 h时细菌处于对数生长期后期,此阶段细胞生长繁殖旺盛,选用此时期的细胞进行等离子体照射。
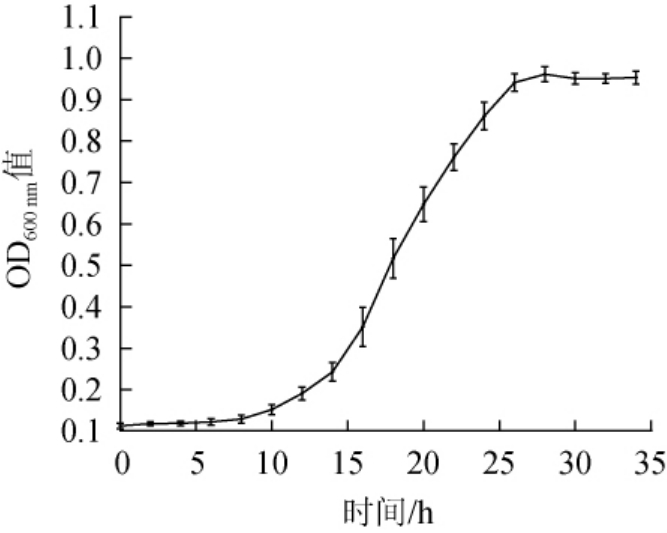
图3 菌株HB172198T生长曲线
Fig. 3 Growth curve of strain HB172198T
2.3.2 ARTP诱变菌株HB172198T致死曲线测定
致死率是诱变实验中的重要参考数据。菌株HB172198T在ARTP诱变中的致死率曲线如图4所示,致死率随诱变时间的增加不断升高。处理时长<10 s时致死率较低,20~40 s期间致死率急速增长,从31.6%增长到82.8%,50 s时致死率达91.5%,当ARTP处理100 s时菌体全部死亡。根据前人的研究报道,菌株致死率为90%左右时正突变率最高[25]。因此,选择菌株HB172198T的最适诱变时间为50 s。
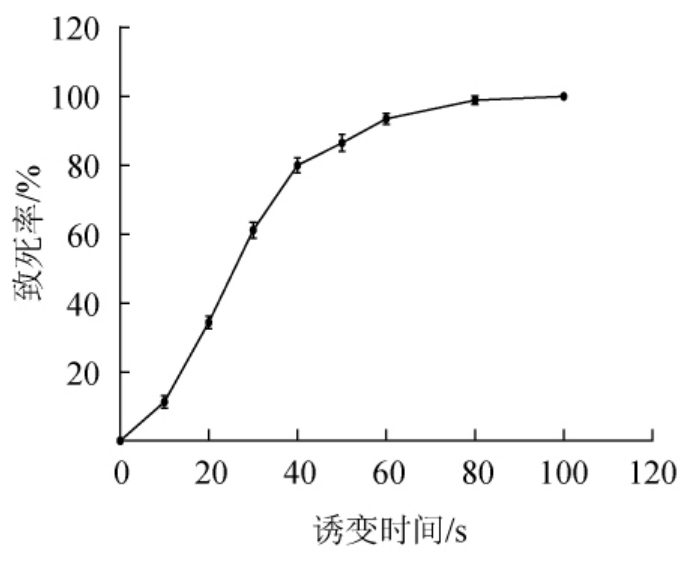
图4 ARTP诱变菌株HB172198T的致死率曲线
Fig. 4 Fatality rate curve of ARTP mutated strain HB172198T
2.3.3 高产褐藻胶裂解酶突变株筛选
选取原始菌株HB172198T作为对照,比较酶解圈直径大小初步确定正向突变菌株,该方法操作简便、实验周期短并且具有直观性[19]。诱变菌株筛选结果见图5。由图5可知,原始菌株HB172198T酶解圈直径为2.0 cm,以酶解圈明显增大的诱变菌作为目标菌株,通过初筛共得到16株正向突变菌株,分别编号为7、70-29、50-22、50-21、30-2、80-6、50-6、30-19、40-54、10-13、27、60-2、3、80-4、80-3和50-30。按1.3.2的方法对这16株诱变菌株进一步进行摇瓶复筛,获得2株酶活明显提高的突变菌株,编号为30-19和80-6,其产褐藻胶裂解酶酶活分别为179.9 U/mL和165.0 U/mL,比原始菌株HB172198T酶活分别提高了32.6%和21.6%。
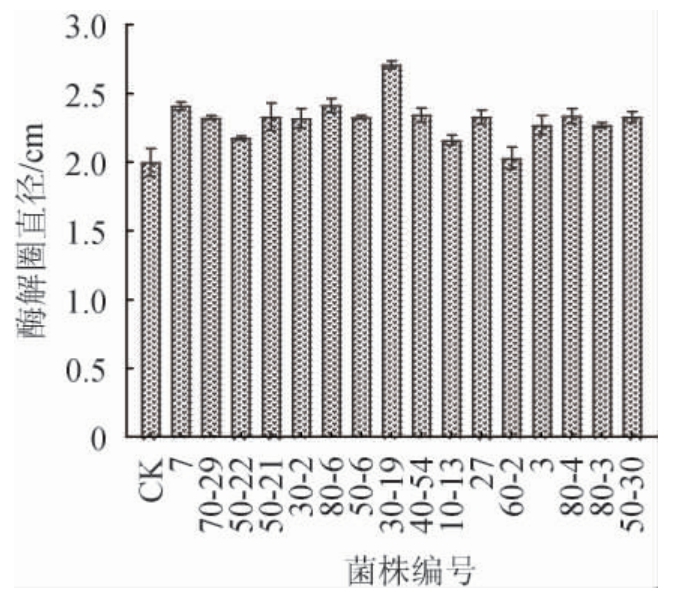
图5 高产褐藻胶裂解酶突变菌株筛选结果
Fig. 5 Screening results of mutant strains of high yield alginate lyase
CK为原始菌株HB172198T;其他为诱变菌株。
2.3.4 高产褐藻胶裂解酶突变株30-19和80-6产酶稳定性测定
对2株突变菌株30-19和80-6在分离培养基上连续进行6代传代培养,分别在30 ℃培养箱培养48 h后,采用紫外吸收法测定酶活力,结果见图6。由图6可知,突变菌株30-19和80-6六代传代的酶活力范围分别保持在172.2~187.4 U/mL和155.8~172.0 U/mL区间,虽有小幅波动,但总体来说具有较好的遗传稳定性。
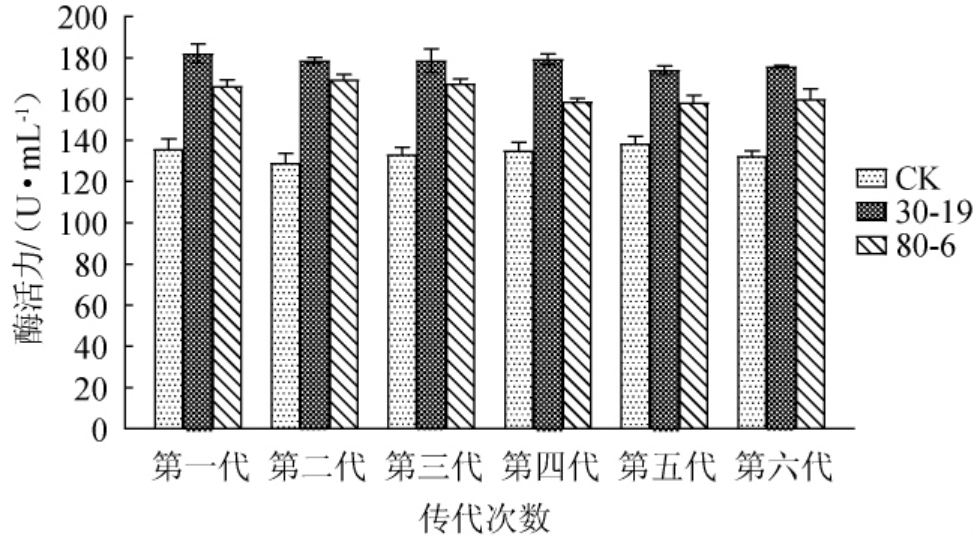
图6 高产褐藻胶裂解酶突变菌株遗传稳定性实验结果
Fig. 6 Genetic stability tests results of mutant strains of high yield alginate lyase
3 结论
本研究从南海海域采集的样品中共筛选得到高产褐藻胶裂解酶海洋细菌14株。经16S rDNA比对分析,发现这些菌株隶属于3个门、5个纲、7个目、8个科、9个属,其中来源于弧菌属的菌株最多(5株),占35.7%,并有5株菌可能代表着新的分类单元。由此可见,海洋细菌是褐藻胶裂解酶的重要来源,南海生境中产酶细菌资源多样性非常丰富,并存在着大量的未知资源有待于被挖掘。
新产酶菌种Paenibacillus algicola HB172198T的初始酶活力为135.0 U/mL,为进一步提高其酶活力,开展了ARTP诱变选育,筛选得到突变株30-19和80-6,其产褐藻胶裂解酶的酶活分别为179.9 U/mL和165.0 U/mL,比出发菌株酶活力分别提高32.6%和21.6%,并通过传代6次实验验证了其良好的产酶稳定性。本研究可为产褐藻胶裂解酶菌株的筛选和ARTP诱变选育提供参考。虽然ARTP诱变育种能提高菌株的产酶量,但突变效果最佳的菌株30-19酶活相比原始菌株只提高了32.6%,产酶量与酶活力还不能达到工业生产的要求,因而进一步挖掘环境中存在的新型高效褐藻胶降解菌、优化酶的产生条件、构建高效产酶工程菌是迫切需要解决的问题。
[1] LI J W,DONG S,SONG J,et al.Purification and characterization of a bifunctional alginate lyase from Pseudoalteromonas sp.SM0524[J]. Mar drugs,2011,9(1):109-123.
[2] ZHU B W,YIN H.Alginate lyase:Review of major sources and classification,properties,structure-function analysis and applications[J]. Bioengineered,2015,6(3):125-131.
[3] KAM N,PARK Y J,LEE E Y,et al.Molecular of a polyM-specific alginate lyase from Pseudomonas sp.strain KS-408 for degradation of identification glycosidic linkages between two mannuronates or mannuronate and guluronate in alginate[J].Can J Microbiol,2011,57(12):1032-1041.
[4] ERTESVÅG H.Alginate-modifying enzymes:biological roles and biotechnological uses[J].Front Microbiol,2015,27(6):523-532.
[5] WANG Y,GUO E W,YU W G,et al.Purification and characterization of a new alginate lyase from a marine bacterium Vibrio sp.[J]. Biotechnol Lett,2013,35(5):703-708.
[6] HUANG L S X,ZHOU J G,LI X,et al.Characterization of a new alginate lyase from newly isolated Flavobacterium sp.S20[J]. J Ind Microbiol Biot,2013,40(1):113-122.
[7] HUANG H Q,LI S,BAO S X,et al.Expression and characterization of a cold-adapted alginate lyase with exo/endo-type activity from a novel marine bacterium Alteromonas portus HB161718T[J].Mar Drugs,2021,19(3):155-168.
[8] HUANG H Q,MO K L,HU Y H,et al.Microbulbifer harenosus sp.nov.,an alginate-degrading bacterium isolated from coastal sand[J].Int J Syst Evol Microbiol,2020,70(3):1639-1643.
[9] CHEN P,ZHU Y M,MEN Y,et al.Purification and characterization of a novel alginate lyase from the marine bacterium Bacillus sp.Alg07[J].Mar Drugs,2018,16(3):86-90.
[10] XIN R Y,XIE W C,XU Z Y,et al.Efficient extraction of chitin from shrimp waste by mutagenized strain fermentation using atmospheric and room-temperature plasma[J].Int J Biol Macromol,2020,155(1):1561-1568.
[11] CAO S,ZHOU X,JIN W B,et al.Improving of lipid productivity of the oleaginous microalgae Chlorella pyrenoidosa via atmospheric and room temperature plasma (ARTP)[J]. Bioresource Technol,2017,244(2):1400-1406.
[12] ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma(ARTP)as a new powerful mutagenesis tool[J]. Appl Microbiol Biotechnol,2014,98(12):5387-5396.
[13] MA Y F,YANG H Q,CHEN X Z,et al.Significantly improving the yield of recombinant proteins in Bacillus subtilis by a novel powerful mutagenesis tool(ARTP):alkaline α-amylase as a case study[J].Protein Expr Purif,2015,114:82-88.
[14] CHENG G,XU J Z,XIA X H,et al.Breeding L-arginine-producing strains by a novel mutagenesis method:atmospheric and room temperature plasma(ARTP)[J]. Prep Biochem Biotechnol,2016,46(5): 509-516.
[15] ZHANG C,QIN J F,DAI Y W,et al.Atmospheric and room temperature plasma(ARTP)mutagenesis enables xylitol over-production with yeast Candida tropicalis[J].J Biotechnol,2019,296:7-13.
[16] 林杨,布丽根·加冷别克,孙建,等.乳酸菌的筛选及高产酸菌株的常压室温等离子体诱变选育[J].食品与发酵工业,2021,47(12):176-181.
[17] HISANO T,NISHIMURA M,YAMASHITA T,et al.A simple method for determination of substrate specificity of alginate lyases[J].J Ferment Bioeng,1994,78(2):182-184.
[18] BUDI S W,TUINEN D,ARNOULD C,et al.Hydrolytic enzyme activity of Paenibacillus sp.strain B2 and effects of the antagonistic bacterium on cell integrity of two soil-borne pathogenic fungi[J]. Appl Soil Ecol,2000,15(2):191-199.
[19] 徐凡.产褐藻胶裂解酶微生物的选育[D].福州:福州大学,2016.
[20] YOON S H,HA S M,KWON S,et al.Introducing EzBioCloud:a taxonomically united database of 16S rRNA gene sequences and wholegenome assemblies[J].Int J Syst Evol Microbiol,2017,67(5):1613-1617.
[21] KUMAR S,STECHER G,TAMURA K.MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Mol Biol Evol,2016,33(7):1870-1874.
[22] 戴剑漉,张晓婷,卢智黎,等.新型常压室温等离子体-紫外复合诱变选育埃莎霉素Ⅰ高产菌株[J].中国抗生素杂志,2018,43(2):182-188.
[23] 诸葛健,李华钟,王正祥.微生物遗传育种学[M].北京:化学工业出版社,2016:79-89.
[24] JIANG M,WAN Q,LIU R M,et al.Succinic acid production from corn stalk hydrolysate in an E.coli mutant generated by atomospheric and room-temperature plasmas and metabolic evolution strategies[J]. J Ind Microbiol Biotechn,2014,41(1):115-123.
[25] CHUN J,RAINEY F A.Intergrating genomics into the taxonomy and systematics of the Bacteria and Archaea[J].Int J Syst Evol Microbiol,2014,64(2):316-324.
[26] ZHU J,MO K L,ZHENG Z G,et al. Paenibacillus algicola sp.nov.,a novel marine bacterium producing alginate lyase[J]. Int J Syst Evol Microbiol,2020,70(9):5087-5092.
[27] 刘贯锋.芽胞杆菌分类学特征及其生防功能菌株筛选[D].福州:福建农林大学,2011.