漆酶最早由日本学者Yoshida发现,是一种多铜氧化酶,能够氧化降解多种酚类和酚胺类化合物,被广泛应用于生物质能源、生物基材料、食品科学、环境监测、生态修复、现代农业、以及医药领域,也被称为“绿色化学的蓝色酶”[1]。漆酶在微生物、植物和昆虫均有发现,白腐真菌被认为是漆酶的重要生产者。学者们以产漆酶真菌为研究对象,在新物种发现、分类系统、起源与进化、生态学功能、种质资源挖掘与保护、发酵体系的建立、酶学性质与酶工程、应用开发等进行了较深入研究[2-3]。产量低、生产成本高仍然是漆酶广泛应用的限制因素。因此,建立、完善生产工艺,提高生产效率,降低生产成本,就成为漆酶开发应用的关键。
固态发酵和液态发酵是漆酶生产的主要方式,相较于液态发酵,固态发酵模拟自然环境,利于微生物与氧气接触,避免产物反馈抑制,具有原料成本低、菌体产酶量大、下游产物回收率高、几乎无发酵废水等优点,是漆酶生产的理想方式之一[4]。固态发酵是一个包括固、液、气三相的生物反应过程。其中,固态基质是主体,是影响微生物生长,热质传递和产物代谢的核心因素。木质纤维素是地球上最丰富的有机物,包括了农业废弃物、林业废弃物和工业加工剩余物等。以木质纤维素为固态基质不但能够为微生物提供碳源、诱导物和微环境,而且有利于降低发酵成本,避免资源浪费与环境污染。
以木质纤维素为基质固态发酵产酶是当前研究方向。MARDETKO N等[5]以玉米芯为固态基质,建立了固态、液态顺序发酵工艺,提高了串珠镰刀菌(Fusarium verticilliodes)木聚糖酶和葡聚糖酶产量;SHARMA A等[6]以富含类黄酮的豆粕、豆腐渣等农工业残留物为固态基质,发现能够显著提高漆酶产量。实验室前期研究发现木质素相对含量是影响漆酶产量的重要因素,改变木质素相对含量可以显著提高漆酶产量[3];固态基质孔径分布直接影响微生物对于基质内部营养的利用,提高发酵效率[7];在此基础上建立了氨水预处理固态基质提高漆酶产量的方法,经过氨水预处理,固态基质理化结构发生变化,可消化性显著增强,漆酶产量提高3.4倍[8]。
此前研究是将木质纤维素生物质整体作为固态基质,忽略了不同器官或组织化学性质和物理结构的影响,这可能是造成固态基质利用率低,发酵效率低的重要因素。本研究以硬毛粗盖孔菌(Funalia trogii)为发酵菌株,根据宏观形态,将玉米秸秆分成鞘、茎、髓、叶四部分,分别以其为固态基质发酵产漆酶,在此基础上分析固态基质理化结构差别与漆酶产量间的内在关系,以期从本征结构上阐明固态基质对漆酶发酵的影响,使漆酶发酵工艺得到进一步优化,提高漆酶产量,推动固态发酵技术的发展,为木质纤维素资源的转化利用提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与原料
硬毛粗盖孔菌(Funalia trogii):由实验室前期分离并保藏。玉米秸秆:采自于内蒙古自治区包头市农业科学研究试验田。
1.1.2 试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、葡萄糖、磷酸氢二钠、2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis(3-ethylbenzothia-zoline-6-sulfonicacid)ammonium salt,ABTS)(均为分析纯):天津致远化学试剂有限公司;硫酸铜(分析纯):天津大茂化学试剂厂;乙二胺四乙酸二钠(分析纯):天津永晟精细化工有限公司;浓盐酸、浓硫酸(均为分析纯):成都渝荣化工有限公司;丙酮(分析纯):天津富宇精细化工公司;硼酸钠、柠檬酸(均为分析纯):天津科茂化学试剂有限公司。
1.1.3 培养基
种子培养基:麦芽浸粉18 g/L,琼脂粉17 g/L,葡萄糖5 g/L,pH自然,121 ℃灭菌20 min。
液态培养基:CuSO4 0.5 g/L,葡萄糖5 g/L,可溶性淀粉5 g/L,蛋白胨10 g/L,pH 4.5,121 ℃灭菌20 min。
固态培养基:固态基质2 g,加入液态培养基8 mL,121 ℃灭菌30 min。
1.2 仪器与设备
Empyream型X-射线衍射仪:荷兰帕纳科公司;X3F型台式冷冻离心机:赛默飞世尔科技(中国)有限公司;AL104型电子分析天平:赛多利斯科学仪器(北京)有限公司;CM1850型冷冻切片机、M165C体式显微镜成像系统:徕卡微系统有限公司;Axio Scope A1:德国蔡司公司。
1.3 方法
1.3.1 固态基质处理
玉米成熟后摘除玉米穗,距地面10cm以上处收割秸秆,分离成鞘、茎、髓、叶4部分,自然风干,粉碎过40目筛备用。
1.3.2 固态发酵
将F.trogii接种于种子培养基,待菌丝体覆盖平板表面二分之一时,用7 mm打孔器沿菌落边缘打孔,获得菌片。固态发酵在100 mL锥形瓶进行,接种菌片5个,29 ℃黑暗,静置培养12 d,每隔3 d测定酶活,并测定固态基质质量,计算质量损失率,其计算公式如下:
1.3.3 漆酶活力测定
发酵结束后,锥形瓶加入40 mL Na2HPO4-NaH2PO4缓冲溶液(25 mmol/L,pH 6.0),玻璃棒打散固态基质,4 ℃条件下静置24 h。提取液离心(8 000 r/min,20 min),上清液即为粗酶液。残渣105 ℃烘干至恒质量。漆酶酶活测定条件:波长420 nm,1 mmol/L ABTS,pH 3.5,反应温度为室温(约25 ℃)。漆酶酶活力单位定义为:25 ℃、1 min氧化1 μmol ABTS所需的酶量,为1个酶活力单位即1 U。
1.3.4 化学组分测定
依照范氏法测定固态基质化学组分,精确称取0.5 g固态基质,依次经中性洗涤剂,2 mol/L盐酸,7.34 mol/L硫酸反应,每一步反应结束后用蒸馏水冲洗至pH值中性,并用丙酮冲洗滤渣至无色,抽净丙酮后,105 ℃烘干至恒质量,称质量。差值法依次计算中性洗涤物(neutral detergent soluble,NDS)、半纤维素、纤维素和木质素含量。
1.3.5 结晶度测定
X射线衍射仪(X'Pert PRO)测定固态基质结晶度,测定条件为:40 kV,40 mA,扫描步长为0.02°,2Ø=5°~40°。结晶度(crystallinity index,CrI)计算公式如下:
式中:CrI为结晶度,%;ICr为结晶区衍射峰高度,I;Iam为无定形区衍射峰高度,I。
1.3.6 聚合度测定
参照GB/T 1548—1989《纸浆粘度的测定法》中的铜乙二胺法测定固态基质聚合度(degree of polymerization,DP)。
式中:DP为聚合度;[η]为固态基质特性黏度,mL/g。
1.3.7 酶解试验
称取固态基质2g,加入40mL柠檬酸缓冲溶液(20mmol/L,pH 4.8),酶用量20 U/g,50 ℃恒温振荡水浴48 h,反应结束后,取酶解液离心(8 000 r/min,20 min),DNS法测定还原糖含量。酶解还原糖得率(reducing sugar yield,RSY)计算公式如下:
式中:RSY为酶解还原糖得率,mg/g;Rs为样品被纤维素酶水解后生成的还原糖,mg;ωc为样品中纤维素的质量分数,%;ωhc为样品中半纤维素的质量分数,%;M为样品总质量,mg。
1.3.8 菌丝生长状况观察
将固态基质切成大小均一小块,接在长好的菌丝边缘,放在29 ℃恒温培养箱培养4 d。分别于2 d、4 d取样置于体式显微镜下观察。将上述发酵4 d的样品用冷冻切片机切片,厚度为8 μm,用苯胺蓝染液、染色,经脱色后于光学显微镜观察。
2 结果与分析
2.1 玉米秸秆不同部位对漆酶产量的影响
不同基质固态发酵过程中漆酶产量及质量损失变化结果见图1。
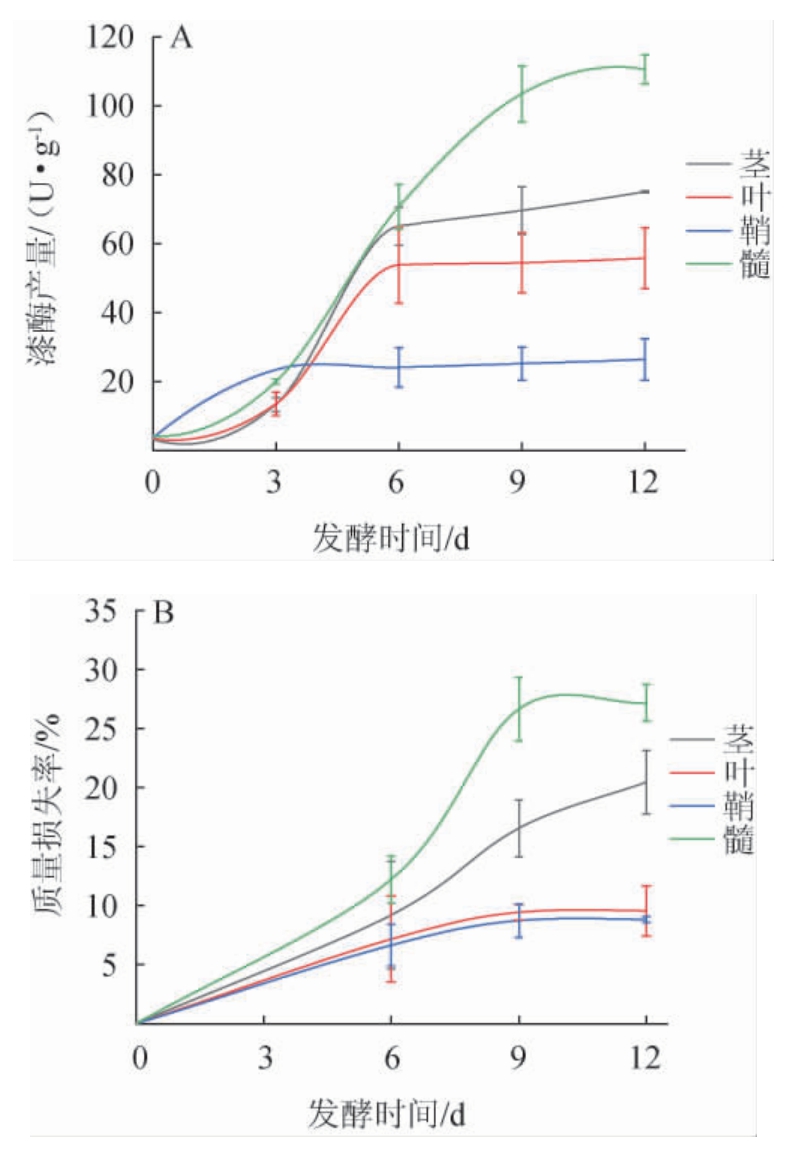
图1 不同基质固态发酵过程中漆酶产量(A)及质量损失(B)变化
Fig. 1 Changes of laccase production (A) and mass loss (B) during solid-state fermentation of different substrates
由图1A可知,以玉米秸秆不同器官或组织作为固态基质时,F.trogii均能生长产酶,但漆酶产量影响不同。随着发酵进行,漆酶产量逐渐增高;鞘漆酶产量最低,3 d后在26.40 U/g波动;而髓漆酶产量最高,达到110.70 U/g(12 d),其次为茎和叶。由图1B可知,固态基质的质量与漆酶产量变化相同,髓基质质量损失最高,其次为茎,鞘基质质量损失最低。发酵初期,固态基质可溶性营养物和液体培养基为微生物提供营养,随后营养耗尽,微生物需产酶分解底物为自身提供营养。由质量损失可知,F.trogii能够利用秸秆茎和髓,而对秸秆叶和鞘利用率较少。
2.2 固态基质理化性质对漆酶产量的影响
2.2.1 固态基质化学组分的测定
玉米秸秆不同器官或组织化学组分测定结果见图2。由图2可知,不同固态基质化学成分差异显著。茎的纤维素(34.33%)和木质素(16.73%)含量最高,叶的灰分(5.78%)含量最高,鞘的半纤维素(36.65%)含量最高,而髓含有最高的NDS(26.69%)。一般而言,茎发挥支撑和保护作用,更高含量的木质素和纤维素有利于提高刚性和强度,同时抵抗机械和病原体损伤。鞘主要发挥保护作用,更多的半纤维素含量使鞘的硬化组织更厚更硬,提高植物组织硬度,避免虫害。髓主要发挥贮存和输送营养作用,含大量海绵状薄壁细胞,而更容易被分解利用。
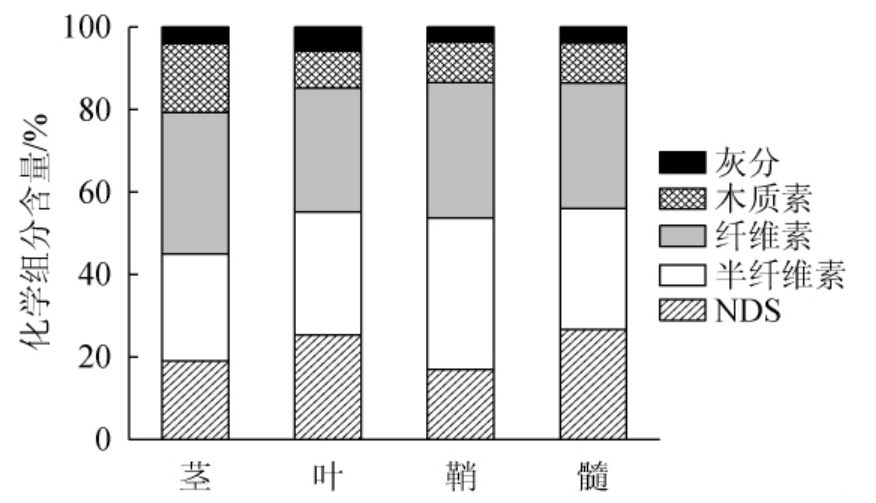
图2 不同固态基质化学组分测定结果
Fig. 2 Determination results of chemical components of various solid substrates
2.2.2 固态基质纤维素结构参数对酶解率的影响
CrI、DP和RSY是反映固态基质纤维素可利用性的重要参数,不同固态基质物理性质测定结果见表1。
表1 不同固态基质物理性质测定结果
Table 1 Determination results of physical properties of various solid substrates
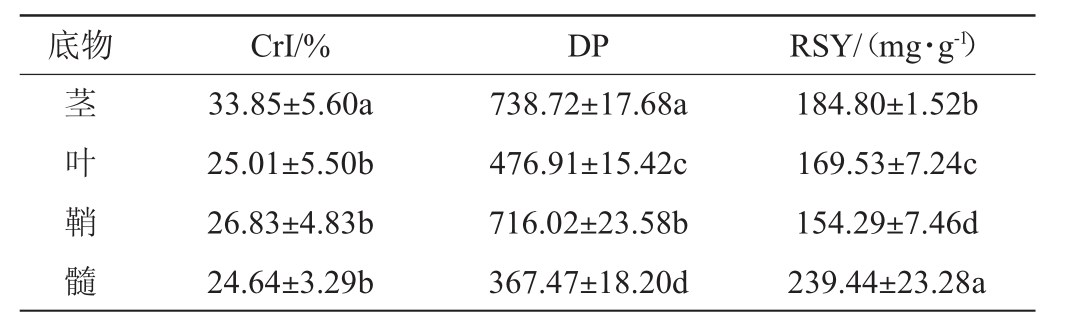
注:不同字母表示在P<0.05水平上差异显著。
由表1可知,茎的CrI(33.85%)和DP(738.72)最高,叶、鞘和髓CrI相近,且显著低于茎(P<0.05);髓的DP(367.47)最低,但RSY(239.44 mg/g)最高;鞘的RSY最低,仅为154.29 mg/g。学者们发现CrI影响纤维素RSY,但研究结果仍有争议[9-11]。LI F C等[12]认为DP是限制酶解率的重要因素,而KAFLE K等[13]研究显示,酶解速率与DP变化无相关性。本研究中CrI和DP对酶解率似乎并未起决定性作用。
2.2.3 固态基质理化性质与漆酶产量相关性分析
进一步分析了固态基质理化性质与漆酶产量(12 d)的相关性结果见图3。由图3可知,RSY和木质素含量与漆酶产量呈极显著正相关(P<0.01),而半纤维素和灰分含量则与漆酶产量呈极显著负相关(P<0.01),其他理化性质与漆酶产量间无显著相关性。
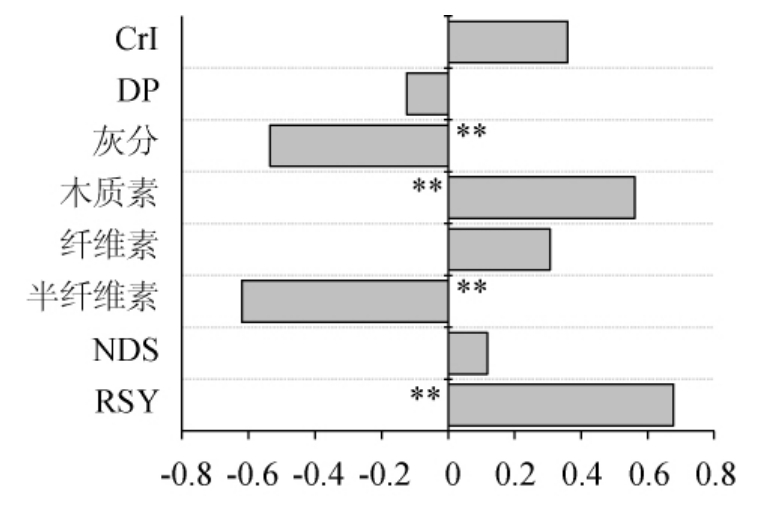
图3 固态基质理化性质与漆酶产量Pearson相关性分析
Fig. 3 Pearson correlation analysis between physicochemical properties of solid substrate and laccase production
“**”表示极显著相关(P<0.01)。
2.3 固态基质上微生物生长与漆酶产量的关联
不同固态基质中微生物生长及分布的差异结果见图4。

图4 不同固态基质中微生物生长及分布的差异
Fig. 4 Difference in growth and distribution of microorganisms in various solid substrates
由图4可知,不同固态基质均可见F.trogii菌丝,且第4天时菌丝更加浓密;菌丝在髓的生长速度最快,表现为菌丝分布最浓密,第4天时菌丝与固态基质几乎缠绕一起;其次为茎;而鞘和叶上仅有少量菌丝附着,第4天略有增加。ANNEPU S K等[14]报道了菌丝生长速率与酶产量的显著正相关。ZHOU S等[15]证明菌株利用不同底物作碳源表现出的菌丝生长状况不同,生长量较高的底物其酶活也较高。但是在COMAN C等[16]实验中,发现了漆酶活性与菌丝体生长之间的负相关。本研究与ANNEPU S K等[14-15]的结果相似,并认为菌丝产量与漆酶活性趋于正相关。
3 讨论
漆酶固态发酵适宜时间随着菌株和培养基组分的不同而异,但是过长的发酵时间不利于漆酶的高效生产。这是因为培养条件的不稳定性和营养成分的消耗[17]。GÓMEZ J等[18]研究发现,硬毛革孔菌(Coriolopsis rigida)发酵过程中,固态基质最初释放还原糖,4~11 d还原糖逐渐消耗直至消耗殆尽,而漆酶活性不断上升并于12 d达到峰值。高酶解还原糖得率意味着固态基质更容易被利用,可为真菌生长提供更多碳源,利于漆酶生产[8]。微生物对碳源的利用一方面受其自身磷酸转移酶的影响[19],另一方面微生物会调整其产酶策略,以更好的适应固态基质化学组分变化[20]。GARCÍA-TORREIRO M等[21]研究发现,以灵芝(Ganoderma lucidum)发酵产漆酶时,纤维素作碳源漆酶产量最高,而半纤维素作碳源产量最低;OTHMAN A M 等[22]研究发现,单糖是哈茨木霉菌(Trichoderma harzianum)S7113发酵产漆酶的最佳诱导剂,其中葡萄糖作诱导剂时漆酶产量最高,而多糖(可溶性淀粉/羧甲基纤维素(carboxymethylcellulose,CMC))对漆酶生产具有抑制作用;YAN L L等[23]报道称葡萄糖主要诱导香菇(Lentinula edodes)Lelcc1、Lelcc9、Lelcc8、Lelcc4、Lelcc14基因表达,纤维素只对Lelcc1有诱导作用,纤维素加0.1%木质素磺酸钠主要诱导Lelcc5和Lelcc6。DURÁN-SEQUEDA D等[24]发现碳源对平菇(Pleurotus ostreatus)漆酶基因的促进表达主要表现在Lacc2和Lacc10上。而本研究则认为更高的还原糖得率更易于微生物产酶,而具体单糖对其产酶的影响还有待深入。
木质素对漆酶生产具有诱导作用。ADEKUNLE A E等[25]在变色栓菌(Trametes versicolor)培养基中添加木质素,发现漆酶产量是不添加木质素的4.69倍;RODRIGUES E M 等[26]报道称木质素具有作为漆酶诱导剂的潜力。本研究中漆酶产量的提高可能是F.trogii暴露于木质素而对毒性酚类化合物产生的氧化应激反应,作为适应性反应系统的一部分[27]。此外,与木质素相关的芳香化合物及木质素衍生物对漆酶的产生也具有一定诱导效果[28],主要原因是芳香族化合物能与核易位蛋白形成异源二聚体,然后与异种生物反应元件(xenobiotic response element,XRE)结合,激活靶基因的转录[28],其对漆酶基因的转录也具有差异性。MOISEENKO K V等[29]报道称香兰素诱导lacE基因的表达,藜芦醇诱导lacG和lacF基因的表达,而香草酸诱导lacC基因的表达。MIN D Y 等[30]研究发现,与叶片木质素相比,玉米秸秆茎木质素显示出更高的对香豆酸(p-coumaric acid,pCA)、阿魏酸(ferulic acid,FA)含量,因其对漆酶的诱导作用,这似乎也可以解释茎比叶表现出更高的漆酶活性的原因。
从目前研究来看,半纤维素与漆酶活性相关性直接影响机制还未知。半纤维素对漆酶产量的影响主要是两方面,一方面半纤维素包裹纤维素,抑制葡萄糖的生成[31],另一方面也可以作为碳源为微生物生长提供营养,不过其影响较复杂。LU′-CHAU T A等[32]实验中以半纤维素作碳源时,灵芝(Ganoderma lucidum)和乳白耙齿菌(Irpex lacteus)降低了半纤维素流的毒性而使漆酶的生产具有经济可行性。本研究表现为负相关。半纤维素通过共价键与木质素形成了木质素-碳水化合物复合物(lignin-carbohydrate complexes,LCC)[33],XIE D 等[34]证明LCC具有抗氧化活性,其与碳水化合物部分密切相关,与木质素部分关系不大。并且发现与LCC茎和LCC叶相比,LCC鞘具有最高的抗氧化活性和多糖含量。前面提到漆酶的生产可能与氧化应激相关,所以推测LCC的抗氧化性抑制了漆酶的生产。LCC在植物不同器官结构特征不同,最终表现为不同器官分泌漆酶的能力也不同。
4 结论
玉米秸秆不同器官或组织化学组分与物理性质差异显著,其作为固态基质时产生高度异质性,这种固态基质的异质性显著影响微生物生长和产酶效率。本研究从固态基质入手,明确固态基质理化性质与目标产物间的联系,改性固态基质,优化固态基质配比,是提高固态发酵效率的重要手段。
[1] 张昱,赵倩,李冠华.漆酶在食品领域的应用研究进展[J].食品工业科技,2016,37(17):385-389.
[2] 王科,陈双林,戴玉成,等.新世纪中国菌物新名称发表概况(2000-2020)[J].菌物学报,2021,40(4):822-833.
[3] 何炜,白新月,李冠华,等.木质素对硬毛粗毛盖孔菌固态发酵漆酶的影响[J].纤维素科学与技术,2017,25(4):16-22.
[4] 刘敬然,李冠华.好氧固态发酵的研究现状与展望[J].食品与机械,2016,32(6):220-224.
[5] MAR-DETKO N,TRONTEL A,NOVAK M,et al.Screening of lignocellulolytic enzyme activities in fungal species and sequential solid-state and submerged cultivation for the production of enzyme cocktails[J]. Polymers,2021,13(21):3736.
[6] SHARMA A,GUPTA V,KHAN M,et al.Flavonoid-rich agro-industrial residues for enhanced bacterial laccase production bysubmerged and solidstate fermentation[J].3 Biotech,2017,7(3):1-13.
[7] LI G H,CHEN H Z.Synergistic mechanism of steam explosion combined with fungal treatment by Phellinus baumii for the pretreatment of corn stalk[J].Biomass Bioenerg,2014,67:1-7.
[8] LI G H,FU Y,DANG W X,et al.The effects of aqueous ammonia-pretreated rice straw as solid substrate on laccase production by solid-state fermentation[J].Bioproc Biosyst Eng,2019,42:567-574.
[9] LI X R,MA F M,LIANG C P,et al.Precise high-throughput online near-infrared spectroscopy assay to determine key cell wall features associated with sugarcane bagasse digestibility[J].Biotechnol Biofuels,2021,14(1):123.
[10] SUN Q N,FOSTON M,MENG X Z,et al.Effect of lignin content on the changes in poplar cellulose ultrastructure during dilute acid pretreatment[J].Biotechnol Biofuels,2014,7(1):150.
[11] THORESEN M,MALGAS S,GANDLA M L,et al.The effects of chemical and structural factors on the enzymatic saccharification of Eucalyptus sp.samples pre-treated by various technologies[J]. Ind Crop Prod,2021,166:113449.
[12] LI F C,XIE G S,HUANG J F,et al.OsCESA9 conserved-site mutation leads to largely enhanced plant lodging resistance and biomass enzymatic saccharification by reducing cellulose DP and crystallinity in rice[J].Plant Biot J,2017,15(9):1093-1104.
[13] KAFLE K,SHIN H,LEE C M,et al.Progressive structural changes of avicel,bleached softwood and bacterial cellulose during enzymatic hydrolysis[J].Sci Rep,2015,5(1):15102.
[14] ANNEPU S K,SHARMA V P P,KUMAR S,et al.Enzyme profile of Shiitake mushroom strains grown on wheat straw[J].Indian J Hortic,2018,75(3):475-481.
[15] ZHOU S,ZHANG J S,MA F Y,et al.Investigation of lignocellulolytic enzymes during different growth phases of Ganoderma lucidum strain G0119 using genomic,transcriptomic and secretomic analyses[J]. PloS One,2018,13(5):e0198404.
[16] COMAN C,MOT A C,GAL E,et al.Laccase is upregulated via stress pathways in the phytopathogenic fungus Sclerotinia sclerotiorum[J].Fungal Biol,2013,117(7-8):528-539.
[17] 李彩联,郭艳丽,张铁鹰,等.高产漆酶菌株的筛选、鉴定和固态发酵条件优化[J].动物营养学报,2021,33(11):6501-6509.
[18] GÓMEZ J,PAZOS M,COUTO S R,et al.Chestnut shell and barley bran as potential substrates for laccase production by Coriolopsis rigida under solid-state conditions[J].J Food Eng,2005,68(3):315-319.
[19] SHIMIZU K,MATSUOKA Y.Feedback regulation and coordination of the main metabolism for bacterial growth and metabolic engineering for amino acid fermentation[J].Biotechnol Adv,2022,55:107887.
[20] DILOKPIMOL A,PENG M,DI FALCO M,et al.Penicillium subrubescens adapts its enzyme production to the composition of plant biomass[J].Bioresource Technol,2020,311:123477.
[21] GARCÍA-TORREIRO M,MARTÍNEZ-PATIÑO J C,GULLÓN B,et al.Simultaneous valorization and detoxification of the hemicellulose rich liquor from the organosolv fractionation[J].Int Biodeter Biodegr,2018,126:112-118.
[22] OTHMAN A M,MAHMOUD M,ABDELRAOF M,et al.Enhancement of laccase production from a newly isolated Trichoderma harzianum S7113 using submerged fermentation:Optimization of production medium via central composite design and its application for hydroquinone degradation[J].Int J Biol Macromol,2021,192:219-231.
[23] YAN L L,XU R P,BIAN Y B,et al.Expression profile of laccase gene family in white-rot basidiomycete Lentinula edodes under different environmental stresses[J].Genes,2019,10(12):1045.
[24] DURÁN-SEQUEDA D,SUSPES D,MAESTRE E,et al.Effect of nutritional factors and copper on the regulation of laccase enzyme production in Pleurotus ostreatus[J].J Fungi,2022,8(1):7.
[25] ADEKUNLE A E,GUO C,LIU C Z.Lignin-enhanced laccase production from Trametes versicolor[J].Waste Biomass Valori,2017,8:1061-1066.
[26] RODRIGUES E M,KARP S G,MALUCELLI L C,et al.Evaluation of laccase production by Ganoderma lucidum in submerged and solid-state fermentation using different inducers[J].J Basic Microb,2019,59(8):784-791.
[27] LI W,LI P,ZHOU X F,et al.A Cytochrome B5-like heme/steroid binding domain protein,PlCB5L1,regulates mycelial growth,pathogenicity and oxidative stress tolerance in Peronophythora litchii[J].Front Plant Sci,2021,12:783438.
[28] JIAO X Y,LI G Q,WANG Y,et al.Systematic analysis of the Pleurotus ostreatus laccase gene(PoLac)family and functional characterization of PoLac2 involved in the degradation of cotton-straw lignin[J].Molecules,2018,23(4):880.
[29] MOISEENKO K V,VASINA D V,FARUKSHINA K T,et al.Orchestration of the expression of the laccase multigene family in white-rot basidiomycete Trametes hirsuta 072: evidences of transcription level subfunctionalization[J].Fungal Biol,2018,122(5):353-362.
[30] MIN D Y,JAMEEL H,CHANG H M,et al.The structural changes of lignin and lignin-carbohydrate complexes in corn stover induced by mild sodium hydroxide treatment[J].RSC Adv,2014,4(21):10845-10850.
[31] GAUR R,SEMWAL S,RAJ T,et al.Intensification of steam explosion and structural intricacies impacting sugar recovery[J].Bioresource Technol,2017,241:692-700.
[32]  -CHAU T A,MARTÍNEZ-PATIÑO J C,GULLÓN B,et al.Scale-up and economic analysis of the production of ligninolytic enzymes from a side-stream of the organosolv process[J].J Appl Chem,2018,93(11):3125-3134.
-CHAU T A,MARTÍNEZ-PATIÑO J C,GULLÓN B,et al.Scale-up and economic analysis of the production of ligninolytic enzymes from a side-stream of the organosolv process[J].J Appl Chem,2018,93(11):3125-3134.
[33] ZHAO Y,SHAKEEL U,REHMAN M S U,et al.Lignin-carbohydrate complexes (LCCs) and its role in biorefinery[J]. J Clean Prod,2020,253:120076.
[34] XIE D,GAN T,SU C,et al.Structural characterization and antioxidant activity of water-soluble lignin-carbohydrate complexes(LCCs)isolated from wheat straw[J].Int J Biol Macromol,2020,161:315-324.