黑果腺肋花楸(Aronia melanocarpa)又名为野樱莓、不老莓、黑涩石楠,属蔷薇科(Rosaceae)腺肋花楸属(Aronia)多年生落叶灌木[1]。黑果腺肋花楸具有较高抗逆性,耐寒,耐旱,耐瘠薄,且不易染病害虫害,适宜生长的范围十分广阔,具有较短栽培周期且兼具观赏价值与生态经济效益,为优良经济林树种[2-3]。黑果腺肋花楸种植历史约有百年之久,原产于北美,我国东北20世纪末引种以来,目前已形成一定种植规模[4-5]。黑果腺肋花楸果实富含多酚、多糖、维生素等多种营养物质,具有较强的抗氧化能力[6]。研究发现,黑果腺肋花楸及其提取物不仅对血脂异常[7]、高血压[8]、肥胖[9]等常见疾病具有明显的改善作用,而且还能够抑制乳腺癌等细胞的增殖[10-11]。
近年来,国家大力推行对水果的综合开发利用,尤其是深加工酿酒。政策引导下,以果酒代替粮食酒成为大势所趋[12]。随着人们生活水平的不断提高,对健康越发重视,因而具有较佳保健功能的果酒越来越受到青睐。黑果腺肋花楸果酒以其独特的香气和保健价值逐渐引起大家的关注。
目前研究主要聚焦于黑果腺肋花楸的栽培繁育及其果实成分的提取和生理功能,包括黑果腺肋花楸繁殖技术、栽培技术、生物活性物质的研究[13]。现有的对黑果腺肋花楸果酒的研究也仅集中在工艺的改良及条件优化,鲜有多手段对黑果腺肋花楸挥发性香气成分进行系统解析的研究。因此,本研究以干酒、甜酒、白酒和啤酒四种酒类的12款不同市售黑果腺肋花楸酒为实验对象,对其进行了气相色谱质谱联用技术(gas chromatography-mass spectrometry,GC-MS)及电子鼻检测,并对结果进行线性判别分析(linear discriminant analysis,LDA)及聚类分析(clustering analysis,CA),探究不同黑果腺肋花楸酒香气特征及差异,以期为黑果腺肋花楸酒不同类别的区分及鉴定研究提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 黑果腺肋花楸酒样
经调研考察,选择销量较高的12款国产黑果腺肋花楸酒产品为样品,样品信息见表1。
表1 12款市售黑果腺肋花楸酒产品信息
Table 1 Information of 12 commercially available Aronia melanocarpa wines
1.1.2 化学试剂
氯化钠(分析纯):四川西陇科学有限公司。
1.2 仪器与设备
PEN 3电子鼻:德国Airsense公司;GC-MS-QP2010气质联用仪:日本岛津公司;SPME萃取装置(50/30 μm,DVB/CAR/PDMS):美国Supelco公司。
1.3 试验方法
1.3.1 GC-MS分析
采用顶空固相微萃取法(headspace solid-phase microextraction,HS-SPME)结合气相色谱质谱联用技术(GC-MS)对不同市售黑果腺肋花楸酒样品的挥发性香气成分进行检测,在LAN T等[14]的测定方法上稍作修改。5 mL黑果腺肋花楸酒样品置于20 mL顶空瓶中,45 ℃平衡30 min,将已老化(250 ℃、120 min)的萃取头插入顶空瓶顶空部分萃取30 min,插入气相色谱进样口,250 ℃条件下解吸2 min,并启动仪器采集数据,以进行GC-MS的分离鉴定。
GC条件:DB-1MS熔融石英毛细管柱(30 m×0.25 mm×0.25 μm),载气为高纯氦气,流速1.93 mL/min。不分流进样。升温程序:初始温度40 ℃,保持3 min,以4 ℃/min升温至120 ℃,然后以6 ℃/min的速度升至240 ℃,并保持9 min。
MS条件:电子电离(electronic ionization,EI)源,电子能量为70 eV,离子源温度为230 ℃;全扫描模式:质量扫描范围是35~500 m/z。
定性方法[15]:黑果腺肋花楸酒挥发性物质根据美国国家标准技术研究所(National Institute of Standards and Technology,NIST)14质谱数据库通过匹配度和保留时间并结合保留指数确定,并选择匹配度>85%的成分为有效香气成分。保留指数(retention index,RI)根据以下公式计算,其中正构烷烃的碳原子数为C7~C30。
式中:n和n+1分别为待测组分前后正构烷烃的碳原子数,个;tn和tn+1为相应的正构烷烃出峰保留时间,min;tx为待测组分出峰保留时间,min;其中tn<tx<tn+1。
定量方法:采用峰面积归一化法计算各挥发性物质的相对含量。
1.3.2 电子鼻检测
采用电子鼻对不同市售黑果腺肋花楸酒产品的整体挥发性香气特征进行检测分析,在MA T T等[16]的测试方法上稍作修改。将5 mL黑果腺肋花楸酒样品置于20 mL样品瓶中,在25 ℃条件下平衡10 min,插入电子鼻探头进行检测,每个样品至少测定8次。电子鼻检测的具体参数如下:样品检测时间为60 s,清洗时间为300 s,载气速度为300 mL/min,进样流量为300 mL/min。
1.3.3 统计分析
挥发性物质数据采用SPSS 26.0.0.0进行方差分析及多重比较,P<0.05为显著相关。电子鼻数据利用Excel 2016进行整合,并采用SPSS 26.0进行线性判别分析。
2 结果与分析
2.1 黑果腺肋花楸酒挥发性香气物质GC-MS分析
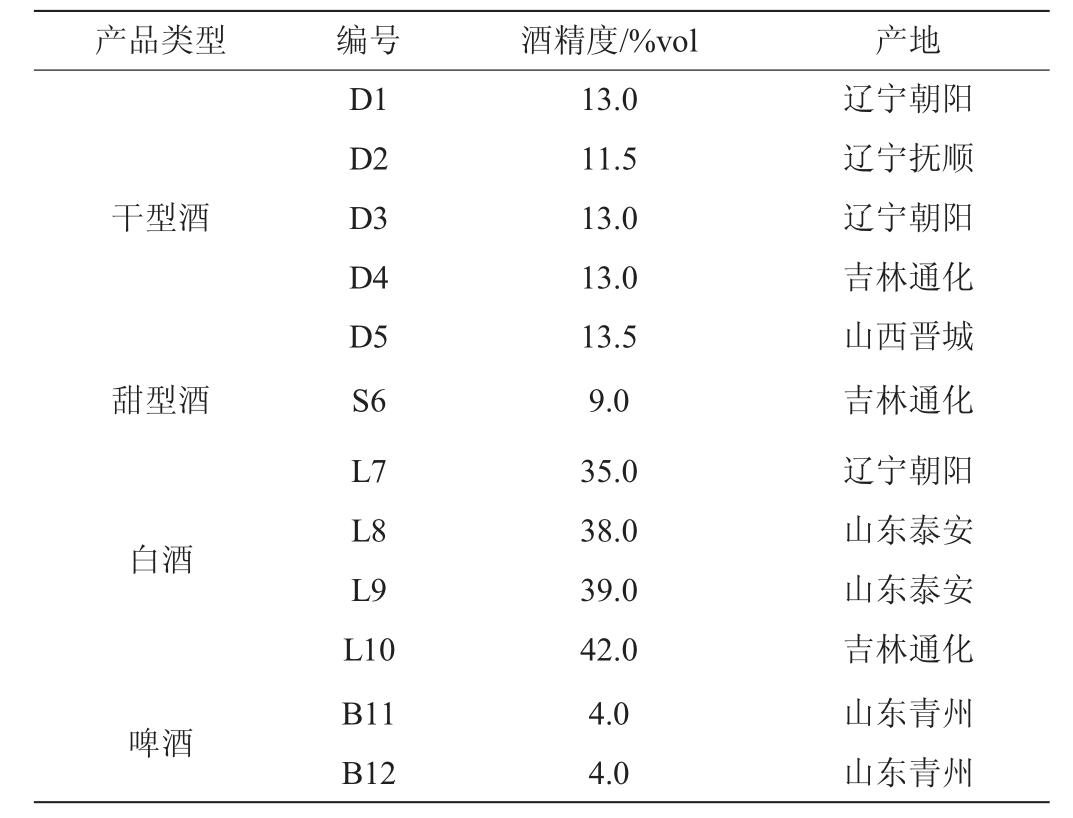
采用顶空固相微萃取法结合气相色谱质谱联用技术(HS-SPME-GC-MS)对12款黑果腺肋花楸酒样品进行挥发性香气物质的检测,结果见表2。黑果腺肋花楸酒样品挥发性物质种类维恩图见图1。
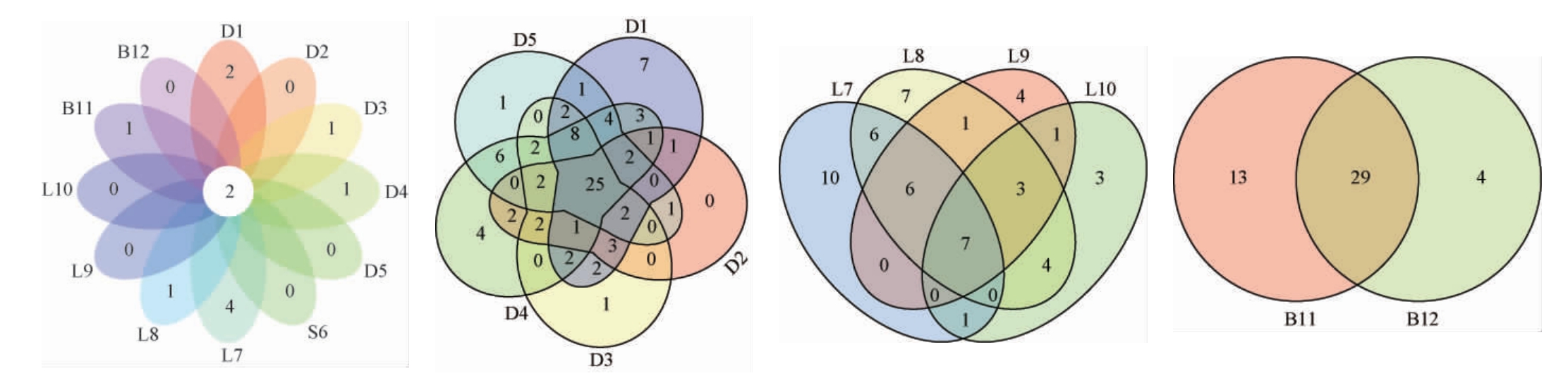
图1 黑果腺肋花楸酒样品挥发性物质种类维恩图
Fig.1 Venn diagram of volatile substance types in Aronia melanocarpa wine samples
A为黑果腺肋花楸酒样;B为黑果腺肋花楸干型酒;C为黑果腺肋花楸白酒;D为黑果腺肋花楸啤酒。



2.1.1 挥发性化合物种类分析
由表2和图1可知,所有样品酒中共检测出103种挥发性化合物,其中酯类42种,醇类21种,醛类7种,酮类6种,酸类10种,烯烃类4种。所有样品共有化合物为2种酯类,为辛酸乙酯、丁酸乙酯。
5种黑果腺肋花楸干型酒样品中共检测出64种挥发性物质,其中酯类31种,醇类17种,醛类6种,酮类5种,酸类10种,烯烃类4种。比高银璐[17]在黑果腺肋花楸果汁中检测到的42 种挥发性物质更丰富,说明发酵过程增加了果汁的复杂性。来自4个不同产地的5种干型酒中特有化合物有4种,分别为对二甲苯、十二烷异丙基醚、3-乙氧基丙醇和4-甲基-1-戊醇。5种干型酒中共有的挥发性物质有25种,其中10种为酯类。D1样品共检出挥发性物质种类最多,为64种,其特有挥发性化合物有7种,分别为对二甲苯、十二烷异丙基醚、乙氧基乙烯、己醛、3-甲基丁酸、己酸丙酯、甲苯;D2样品共检出挥发性物质42种,无特有化合物;D3样品共检出挥发性物质多少52种,其特有的挥发性物质为3-乙氧基丙醇;D4样品共检出挥发性物质64种,其特有的挥发性物质4种,分别为芳樟醇、4-甲基-1-戊醇、乙酸异丁酯、乙酸-2-甲基丁基酯;D5样品共检出挥发性物质56种,其特有挥发性化合物为4-乙基苯酚。黑果腺肋花楸甜酒样品中共检测出挥发性物质47种。
4种黑果腺肋花楸白酒中共检测出53种挥发性物质,其中酯类24种,醇类9种,醛类6种,酮类3种,酸类3种,烯烃类3种。多于南果梨风味白酒29种挥发性化合物[18]。4种白酒样品区别于其他酒种的特有挥发性物质有5种,为己酸戊酯、丁酸异戊酯、2-壬酮、丁酸-2-甲基丁酯。4种白酒样品共有挥发性物质有7种,分别为丁酸乙酯、戊酸乙酯、辛酸乙酯、异丁醇、乙醛缩二乙醇、乙醛和丙酰胺。与上述干型酒样品相比,白酒样品之间的差异更大。在4种白酒样品中,L7样品共检出挥发性物质30种,其特有挥发性化合物有10种,分别为乙基-2-甲基丙酸酯、2-甲基丁酸乙酯、3-甲基丁酸乙酯、丁酸异戊酯、丁酸-2-甲基丁酯、己酸戊酯、壬醛、癸醛、2-戊酮和2-壬酮;L8样品共检出挥发性物质34种,其特有挥发性化合物有7种,分别为辛醇、己醛、3-戊烯-2-酮、山梨酸、甲苯、十一烷和十二烷;L9样品共检出挥发性物质22种,其特有挥发性化合物有4种,正丙酸乙酯、3-甲基丁醛、氨基甲磺酸和2-蒈烯;L10共检出挥发性物质19种,其特有挥发性化合物有3种,分别为己酸乙酯、乙酸-2-苯基乙酯和苯甲醛。
2种黑果腺肋花楸啤酒样品共检测出46种挥发性物质,其中酯类21种,醇类11种,醛类5种,酮类2种,酸类4种,烯烃类1种以及2种其他类物质。啤酒样品区别于其他酒种的特有挥发性物质仅有α-呋喃甲醇,共有挥发性物质有29种。B11样品共检出挥发性物质42种,其特有挥发性化合物有13种,分别是正丙酸乙酯、庚酸乙酯、丁二酸二乙酯、9-癸烯酸乙酯,癸酸乙酯、2,2,4-三甲基-1,3-戊二醇二异丁酸酯、α-呋喃甲醇、乙醛、3-甲基丁醛、3-戊烯-2-酮、壬酸、苯乙烯、4-乙基苯酚;B12样品共检出挥发性物质33种,其特有挥发性化合物有4种,分别为乙基-2-甲基丙酸酯,3-甲基丁酸乙酯、丁二仲醇、(S)-(+)-1,2-丙二醇。
结果表明,12种市售黑果腺肋花楸酒样品挥发性香气成分组成具有共性,但更显示出差异。同一酒种挥发性香气组成成分较为相似,体现在含有较多共同挥发性香气物质成分而具有相似的气味感官特性。根据酒种内共有成分占总检出成分数的比例可得,不同黑果腺肋花楸干酒、白酒、啤酒间共有成分占比分别为39.06%、22.58%、63.04%,说明样品间挥发性物质成分组成差异较大。通过比较发现,不同酒种间挥发性香气物质的复杂程度也具有显著差异。干型酒最为丰富,白酒最为单一,仅检测出31种香气物质。此结果可能与其制作工艺有关,黑果腺肋花楸白酒通常采用酒基浸提、勾兑制作,而干型酒则为发酵产生,因而发酵酒香气更为丰富,如发酵型的猕猴桃白酒在陈酿期间检出香气物质共130种,且其香气成分复杂且在整个过程中富有变化,在不同时间酒样品中分别检出香气成分88种、99种、100种、104种、108种[19],远多于黑果腺肋花楸白酒。所有样品检测到的挥发性成分都以酯类物质为主。
对产地酒样数目>3个的产地酒样进行分析。产自辽宁朝阳的酒样共有成分有14种。为探究该地区是否具有挥发性香气化合物上的共性,由于涉及干型酒和白酒两个品类,去除干型酒共有成分11种,辽宁朝阳地区的酒样共有成分为3种,分别为2-戊酮、苯甲酸乙酯、2-己烯酸乙酯。产自吉林通化的酒样共有成分有12种。同上去除干型酒和白酒共有成分11种,得吉林通化地区的酒样共有成分仅1种,为丁二仲醇。因此不同产地的黑果腺肋花楸可能具有挥发性香气化合物可能具有共同的地区特异性成分。
2.1.2 挥发性化合物相对含量分析
黑果腺肋花楸酒样品不同类别挥发性化合物占总挥发性物质占比热图见图2。由表2可知,12种酒样中除了样品D2、D4、S6外,剩余酒样中酯类物质相对含量最高,含量均超过50%,且在4个白酒样品中酯类物质占比均超过90%。其中己酸乙酯为主要的酯类物质,平均占比超过20%,其被报道具有苹果的香气[20],在D1、D3、L10样品中为相对含量最高的酯类物质,分别为14.8%、27.4%、78.0%。值得一提的是,丁酸乙酯在所有样品中均有检出(0.37%~58.50%),该物质具有香蕉、草莓的香气[21]。除了D2和L10样品外,苯甲酸乙酯在剩余样品中均检测出(0.54%~3.14%)。丁酸异戊酯和丁酸-2-甲基丁酯仅在L7样品中检出,相对含量分别为0.47%和0.18%。D2、D4、S6酒样中醇类物质占比最高。样品D4醇类物质占比高达50%以上。具有苦杏仁味道的异戊醇[21]为主要的醇类物质,平均占比超过20%,除样品L7外,其在剩余样品中为相对含量最高的醇类物质。苯甲醇为样品L7中相对含量最高的醇类物质,达1.81%。醇类物质所得结论与魏春雨等[22]得出的一致,但是其在5种黑果花楸酒中测定出的主要香气成分还包括乙酸乙酯、乙酸异戊酯、异丁醇和2,3-戊二酮。对黑果腺肋花楸酒挥发性化合物含量总体特征进行分析得出,所有酒样中己酸乙酯相对含量最高,甲酸乙酯相对含量最低。
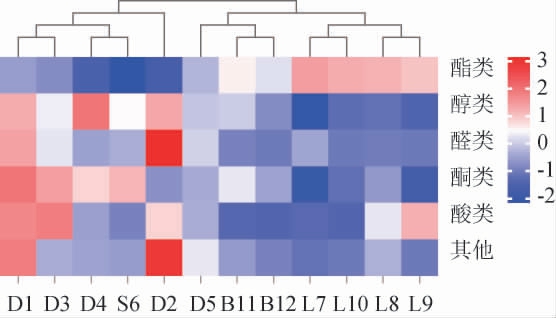
图2 黑果腺肋花楸酒样品不同类别挥发性化合物占总挥发性物质占比热图
Fig.2 Heat map of the percentage of different types of volatile compounds in the total volatile matter Aronia melanocarpa wine samples
除了酯类和醇类物质外,酸类物质也是黑果腺肋花楸酒挥发性物质较为重要的一部分。其中山梨酸和乙酸为占比相对较高。除L7、L9、B11、B12样品外的其余所有样品中均检出乙酸(0.05%~1.62%)。除了上述提及的挥发性物质外,样品中还检测出了烷烃、烯烃等多种挥发性物质。对二甲苯和十二烷异丙基醚仅在样品D1中检出,相对含量分别为0.66%和0.37%。十一烷仅在样品L8中检出(0.31%)。
根据挥发性物质成分种类相对含量可将样品大致分为两类。由图2可知,样品D1、D2、D3、D4、S6挥发性物质成分种类相对含量较为相似,可划分为一簇。而样品D5与L7、L8、L9、L10挥发性物质成分种类相对含量较为相似,可划分为另一簇。产地方面,聚类结果得出同一酒类样品的挥发性化合物化学类别含量上的共性要显著大于产地效应。结果表明,同一酒类的酒样间的共性大于同一产地的酒样间共性。综上,本实验通过GC-MS技术检测了不同种类黑果腺肋花楸酒的挥发性化合物特征,GC-MS聚类分析结果显示,黑果腺肋花楸酒样品之间香气特征存在着与酒种相关的差异和共性。
2.2 电子鼻结果分析
电子鼻是一种模拟嗅觉功能的人工嗅觉仪器,包含气敏传感器阵列、信号处理系统和模式识别系统3部分。样品气味分子被气敏传感器吸附后产生信号,信号被传送到信号处理系统处理后最终由模式识别系统对信号处理的结果做出判断[23]。电子鼻作为一种可以快速检测食品风味的工具,在行业中得到广泛应用。本试验采用PEN3电子鼻的金属氧化物电子鼻传感器吸附了各组样品不同气味分子后在其表面进行信号转化,从而得到不同的响应值。PEN3电子鼻10个传感器特征见表3[24]。
表3 电子鼻传感器性能
Table 3 Performance of electronic nose sensor

不同黑果腺肋花楸酒样品电子鼻传感器响应信号平衡后的平均响应值柱状图见图3。由图3可知,黑果腺肋花楸酒样品在传感器W5S、W1S、W1W、W2S平均响应值较高,而在传感器W1C响应值最低。由上述对GC-MS的结果可知,挥发性香气成分中芳烃成分相对含量较低(0.31%~3.84%)。与电子鼻传感器所得结果一致。白酒样品L7、L8、L9、L10在各个传感器响应值均较高,其中在W5S平均响应值最高。啤酒样品B11和B12在各传感器响应值普遍偏低,尤其在W5S传感器上与高值样品差距明显。
图3 不同黑果腺肋花楸酒样品电子鼻检测平均响应值柱状图
Fig.3 Histogram of average response value of electronic nose detection of Aronia melanocarpa wine samples
不同市售黑果腺肋花楸酒产品电子鼻响应值进行线性判别分析(liner discriminant analysis,LDA)的结果见图4。LDA是一种是将高维的模式样本投影到最佳鉴别矢量空间的的典型算法。通过LDA可以抽取分类信息和压缩特征空间维数,其中空间距离较为接近的样品在性质上也较为相似[26]。由图4可知,样品LD1和LD2的总方差贡献率为96.4%,其中样品LD1的方差贡献率为64.6%,样品LD2的方差贡献率为31.8%。大部分样品间无重叠部分,表示大部分样品间香气特征存在差异,可以进行区分。样品D2和D3间有重叠区域表示二者香气特征难以完全区别。由各样品间的空间距离可得,一般情况下同酒种间距离较近,如啤酒样品B11和B12以及干型酒和甜型酒样品D1、D2、D3、D4、S6距离较近。特别的是,干型酒样品D5更接近于白酒样品L7、L8、L9、L10,这一结果与上述由图2所得到的聚类结果一致。综上,通过电子鼻检测不同种类黑果腺肋花楸酒的挥发性化合物特征,电子鼻线性判别分析显示了黑果腺肋花楸酒样品之间可进行区分。
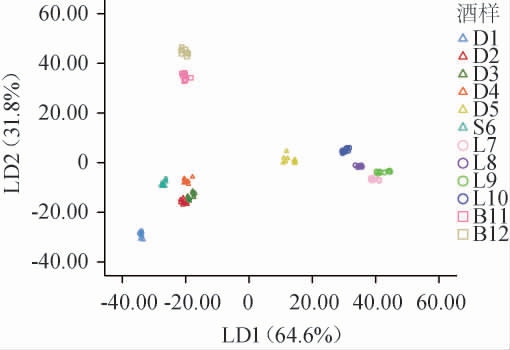
图4 黑果腺肋花楸酒样品电子鼻检测响应值线性判别分析结果
Fig.4 Linear discriminant analysis results of response value of e-nose detection of Aronia melanocarpa wine samples
3 结论
对12种市售黑果腺肋花楸酒产品进行GC-MS分析结合电子鼻分析,系统、全面、多维度的表征了黑果腺肋花楸酒香气风味物质的差异。12种酒样共检测出103种挥发性化合物,其中酯类42种,醇类21种,醛类7种,酮类6种,酸类10种,烯烃类4种。辛酸乙酯和丁酸乙酯是12种酒样的共同化合物,其平均相对含量分别为12.86%和13.70%。电子鼻检测LDA结果与GC-MS检测CA结果显示,黑果腺肋花楸酒样品之间香气特征存在差异和共性,利用其挥发性香气成分的GC-MS及电子鼻检测结果进行区分和鉴别。本研究结果为未来更精确探究黑果腺肋花楸酒样品的香气风味特征提供了理论基础。
[1]CHRUBASIK C,LI G,CHRUBASIK S.The clinical effectiveness of chokeberry:a systematic review[J]. Phytother Res,2010,24(8):1107-1114.
[2]赵明优.黑果腺肋花楸的应用价值[J].果树实用技术与信息,2020(3):44-46.
[3]吴鹏.黑果腺肋花楸果实的质量评价研究[D].沈阳:辽宁中医药大学,2020.
[4]张晓燕,陶梅,李春晓.黑果腺肋花楸引种栽培初报[J].中国林副特产,2018(3):33-34.
[5]于军.黑果腺肋花楸在我国的引种栽培和发展现状[J].现代农业科技,2020(8):166-167.
[6]廖霞,李苇舟,郑少杰,等.不同品种黑果腺肋花楸活性物质含量与抗氧化活性相关性研究[J].食品与机械,2017,33(7):145-148,174.
[7]于雪,胡文忠,姜爱丽,等.黑果腺肋花楸营养物质与功效的研究进展[J].食品工业科技,2016,37(10):396-400.
[8]BRONCEL M,MARZENA K,ANDRYSKOWSKI G,et al.Effect of anthocyanins from Aronia melanocarpa on blood pressure,concentration of endothelin-1and lipids in patients with metabolic syndrome[J].Pol Merkur Lekarski,2007,23(134):116-119.
[9]ZHU Y,ZHANG J Y,WEI YL,et al.The polyphenol-rich extract from chokeberry(Aronia melanocarpa L.)modulates gut microbiota and improves lipidmetabolismindiet-inducedobeserats[J].Nutr Metab,2020,17(1):1-15.
[10]KEDZIERSKA M,OLAS B,WACHOWICZ B,et al.The nitrative and oxidative stress in blood platelets isolated from breast cancer patients:The protectory action of Aronia melanocarpa extract[J].Platelets,2010,21(7):541-548.
[11]KEDZIERSKA M,OLAS B,WACHOWICZ B,et al.An extract from berries of Aronia melanocarpa modulates the generation of superoxide anion radicals in blood platelets from breast cancer patients[J]. Planta Med,2009,75(13):1405-1409.
[12]戴桂芝.浅谈我国目前果酒行业现状及发展对策[J].保鲜与加工,2002,2002(6):3-5.
[13]景安麒,朱月.基于文献计量的黑果腺肋花楸国内研究现状分析[J].食品工业科技,2018,39(23):351-356.
[14]LAN T,BAO S H,WANG J Q,et al.Shelf life of non-industrial fresh mango juice:Microbial safety,nutritional and sensory characteristics[J].Food Biosci,2021,42:101060.
[15]胡荣锁,郭培培,宗迎,等.基于HS-SPME/GC-MS的8种露兜树属叶片挥发性组分差异分析[J].热带作物学报,2021,42(3):897-907.
[16]MA T T,WANG J Q,WANG H L,et al.Is overnight fresh juice drink-able? The shelf life prediction of non-industrial fresh watermelon juice based on the nutritional quality,microbial safety quality,and sensory quality[J]. Food Nutr Res,2020,64:4237.
[17]高银璐.黑果腺肋花楸干酒发酵工艺研究[D].长春:吉林农业大学,2017.
[18]王子康,陈佳怡,李瑞,等.南果梨风味白酒香气成分分析[J].山东化工,2021,50(11):97-98.
[19]王孝荣.猕猴桃白酒酿造技术研究[D].重庆:西南大学,2014.
[20]江飞凤,胡鹏刚,田太江,等.柚子酒酶法脱苦工艺优化及香气成分分析[J].现代食品科技,2021,37(8):275-285.
[21]金宇宁,舒楠,曹炜玉,等.吉林省通化产区北冰红冰酒香气成分研究[J].中国酿造,2021,40(5):113-118.
[22]魏春雨,朱道洋,上官修蕾,等.不同酿酒酵母对黑果腺肋花楸酒成分的影响[J].食品与发酵工业,2021,47(12):182-188.
[23]田晓静.基于电子鼻和电子舌的羊肉品质检测[D].杭州:浙江大学,2014.
[24]马会杰,蒋宾,潘玉兰,等.电子鼻对不同产地名优绿茶和红茶香气特征的判别研究[J].食品科技,2019,44(1):336-344.