随着当前抗生素在动物饲料中不合理使用后负面现象的频繁显露,导致其在动物机体内大量残留并通过食物链引起食品安全问题,间接使人们的生命健康受到食源性致病菌的威胁以致安全得不到有效的保障[1-3]。有研究发现,中国部分儿童尿液中至少含有一种乃至多种金霉素、恩诺沙星、泰乐菌素等只限用于畜禽的抗生素。因此,国际上关于在养殖环节中滥用抗生素的法律法规开始减少,甚至有些法律法规明文禁止在养殖环节中滥用抗生素[4]。至此,枯草芽孢杆菌(Bacillus subtilis)作为自然界中广泛存在的有益菌型之一[5],开始成为安全高效的天然替抗产品及研究热点逐渐进入我国畜禽养殖行业的视野[6-7]。
枯草芽孢杆菌(Bacillus subtilis)作为一种新的绿色益生菌型饲料添加剂,被我国农业部允许使用并获得欧洲食品安全局(European food safety authority,EFSA)以及美国食品和药物管理局(food and drug administration,FDA)的双重安全认证[8-11],其在发酵过程中会产生某种具有抑菌作用的代谢产物,如枯草菌素、多粘菌素、制霉菌素等细菌素;蛋白酶、淀粉酶、脂肪酶等较强活性酶类;同时还有小分子抗菌肽、抗菌蛋白、多糖等多种抑菌物质[12],其中天然抗菌肽是动物机体产生的主要抑菌物质,但其自身产生的抗菌物质浓度较低不能起到抑制致病菌生长的作用,所以针对微生物发酵通过菌体自身分泌安全高效的抑菌物质是当务之急[13],并使之成为抗菌肽生产的有效途径,对生物饲料工业发展的促进具有极其重要的意义[14-15]。
本实验所用的枯草芽孢杆菌(Bacillus subtilis)ZX-11是由本实验室在河北科星药业有限公司提供的鸡粪便中筛选出来的可饲用益生菌,前期针对该菌种进行了筛选、鉴定及抑菌性能等多项研究,结果表明,枯草芽孢杆菌ZX-11发酵液中能够产生抑制大肠杆菌的代谢产物,通过进一步的研究发现,该发酵液中的代谢产物蛋白起主要抑菌作用,而抗菌蛋白在动物饲料研发以及在生物防治等多方面具有一定研究意义[16-17]。长期以来,研究益生菌活菌制剂的有关报道较多[18-19],但由于其代谢产物抑菌性能较低,同时针对其活性代谢产物的研究相对较少[20]。本实验针对枯草芽孢杆菌ZX-11的培养条件进行了优化,从而提高枯草芽孢杆菌的抑菌性能,以期为其后期抑菌物质的分离、纯化与结构鉴定奠定扎实的理论基础[21]。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
枯草芽孢杆菌(Bacillus subtilis)ZX-11:河北科技大学食品与生物学院工业微生物技术研究室筛选;黑曲霉(Aspergillus niger)、黄曲霉(Aspergillus flavus)、酵母菌、大肠杆菌(Escherichiacoli)、血清型致病菌、沙门氏杆菌(Salmonella enterica)、金黄色葡萄球菌(Staphylococcus aureus):均保存于河北科技大学食品与生物学院工业微生物技术研究室。
1.1.2 试剂
蔗糖、葡萄糖、硫酸铵、甘油、NaCl、KCl、CaCl2(均为分析纯):天津市永大化学试剂有限公司;酵母浸粉(生化试剂):天津市永大化学试剂有限公司;胰蛋白胨(生化试剂):北京奥博星生物技术有限责任公司;K2HPO4(分析纯):天津欧博凯化工有限责任公司;MgSO4(分析纯):天津市百世化工有限公司;糖蜜、淀粉、玉米粉、豆粕、豆饼粉(生化试剂):河北科技大学实验室;木瓜蛋白酶(80万U/g)、蛋白酶K(30.3 U/mg)、胰蛋白酶(10 000 U/mg)、蛋白酶E(50 U/mg)、胃蛋白酶(30 U/mg)(均为生化试剂):上海麦克林生化科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
种子培养基(LB液体培养基):胰蛋白胨10.0 g/L,氯化钠10.0 g/L,酵母浸粉5.0 g/L,pH值7.2±0.2,121 ℃高压蒸汽灭菌20 min。
营养琼脂培养基:蛋白胨10.0 g/L,氯化钠5.0 g/L,牛肉膏粉3.0 g/L,琼脂15.0 g/L,pH值7.3±0.2,121 ℃高压蒸汽灭菌20 min。
发酵培养基:酵母浸粉2.5 g/L,蔗糖8.6 g/L,胰蛋白胨8.4 g/L,NaCl 6.4 g/L,蒸馏水1 000 mL,pH值7.4,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
PHS-3C pH计:上海仪电科学仪器股份有限公司;PX224ZH电子天平:奥豪斯仪器(常州)有限公司;LRH-250生化培养箱:上海一恒科学仪器有限公司;MJ-54A高压灭菌锅:施都凯仪器设备(上海)有限公司;SW-CJ-1FD洁净工作台:苏州安泰空气技术有限公司;5804R冷冻离心机:上海洪纪仪器有限公司。
1.3 实验方法
1.3.1 枯草芽孢杆菌ZX-11种子液的制备
菌株的活化:将甘油管保藏的枯草芽孢杆菌ZX-11划线接种于营养琼脂培养基,32 ℃条件下培养28 h。
种子液的制备:将活化的单菌落接种到种子培养基中,32 ℃、200 r/min条件下培养28 h。
1.3.2 枯草芽孢杆菌ZX-11生长曲线及抑菌活性的测定
以2%(V/V)的接种量将种子液接种于发酵培养基中,装液量为100 mL/250 mL,32 ℃、200 r/min条件下培养32 h,每隔2 h取样,使用紫外分光光度计在波长600 nm处测定OD600nm值及抑菌活性。以培养时间(x)为横坐标,OD600nm值(y)为纵坐标绘制枯草芽孢杆菌ZX-11的生长曲线。
1.3.3 枯草芽孢杆菌ZX-11发酵条件研究
以2%(V/V)的接种量将种子液接种到发酵培养基中,装液量为100 mL/250 mL,32 ℃、200 r/min条件下培养28 h。在此基础上分别考察不同初始pH值(5.0、6.0、7.0、8.0、9.0)、接种量(1%、2%、3%、4%、5%)、转速(150 r/min、180 r/min、210 r/min、240 r/min、270 r/min)和培养温度(28 ℃、31 ℃、34 ℃、37 ℃、40 ℃)对枯草芽孢杆菌ZX-11抑菌活性和OD600nm值的影响。
1.3.4 抑菌活性的测定
无菌上清液的制备:取100 mL发酵液在4 ℃条件下10 000 r/min离心20 min,取上清液,再经过0.22 μm滤膜过滤去除菌体,4 ℃保存备用。
抑菌活性的测定:吸取100 μL大肠杆菌指示菌液涂布于营养琼脂培养基,采用平板打孔法在培养基打孔,孔径为8 mm,每孔分别加入100 μL无菌上清液,37 ℃静置培养24 h,每组三个平行,使用直尺测量并记录抑菌圈直径,当抑菌圈直径>8 mm,说明具有抑菌活性[22]。
1.3.5 抑菌广谱的测定
用打孔器在涂有指示菌液平板的不同方向均匀打孔,并添加100 μL发酵上清液后放置恒温培养箱,细菌在37 ℃恒温条件下培养12 h,真菌在28 ℃恒温条件下培养18~36 h,每组试验重复3次,培养结束后测定抑菌活性。
1.3.6 抑菌物质稳定性的测定
热稳定性:将无菌上清液分别于50℃、60℃、70℃、80℃、90 ℃、100 ℃水浴分别处理15 min、20 min、30 min,121 ℃处理20 min,冷却至室温后测其抑菌活性。
酸碱稳定性:将无菌上清液的pH值分别调至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,37 ℃温育2 h,再调回至初始pH 6.8±0.2,测定抑菌活性。
蛋白酶稳定性:分别取0.1 mL质量浓度为5 mg/mL的木瓜蛋白酶、蛋白酶K、胰蛋白酶、蛋白酶E、胃蛋白酶,分别加入0.4 mL无菌上清液,使不同酶在其最适pH值下反应,同时设不加酶的无菌上清液为空白组,加酶的生理盐水为对照组,37 ℃温育3 h后将pH调回最适pH值,测定抑菌活性[23]。
2 结果与分析
2.1 枯草芽孢杆菌ZX-11的生长曲线和抑菌活性
枯草芽孢杆菌ZX-11的生长曲线和抑菌活性曲线见图1。
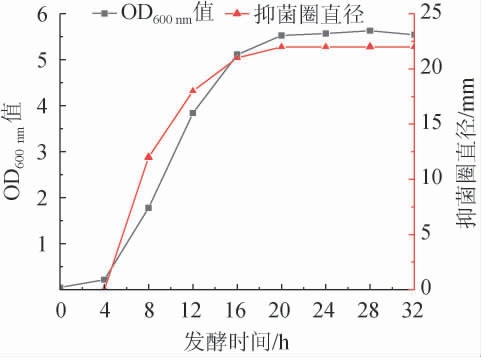
图1 枯草芽孢杆菌ZX-11的生长曲线及培养过程中的抑菌活性
Fig.1 Growth curve of Bacillus subtilis ZX-11 and its antibacterial activity during cult
由图1可知,枯草芽孢杆菌ZX-11发酵过程中,其生长曲线与抑菌活性曲线呈半偶联关系。发酵0~4 h时,菌株ZX-11生长缓慢,处于延滞期,未开始产生有关抑菌的代谢产物;发酵4~16 h时,菌株ZX-11快速生长,处于对数生长期,抑菌物质开始产生并随着菌体浓度的增长快速上升;发酵16~28 h时,菌株ZX-11的生长基本趋于稳定,处于稳定期,相关抑菌的代谢产物抑菌性能基本趋于稳定;发酵28 h后,菌株ZX-11的生长开始下降,进入衰退期,但代谢产物的抑菌性能并未跟随菌体浓度开始下降仍然保持其最高抑菌活性。
2.2 培养条件对枯草芽孢杆菌ZX-11生长及抑菌活性的影响
2.2.1 初始pH值对枯草芽孢杆菌ZX-11生长及抑菌活性的影响
初始pH值对枯草芽孢杆菌ZX-11生长及抑菌活性的影响见图2。
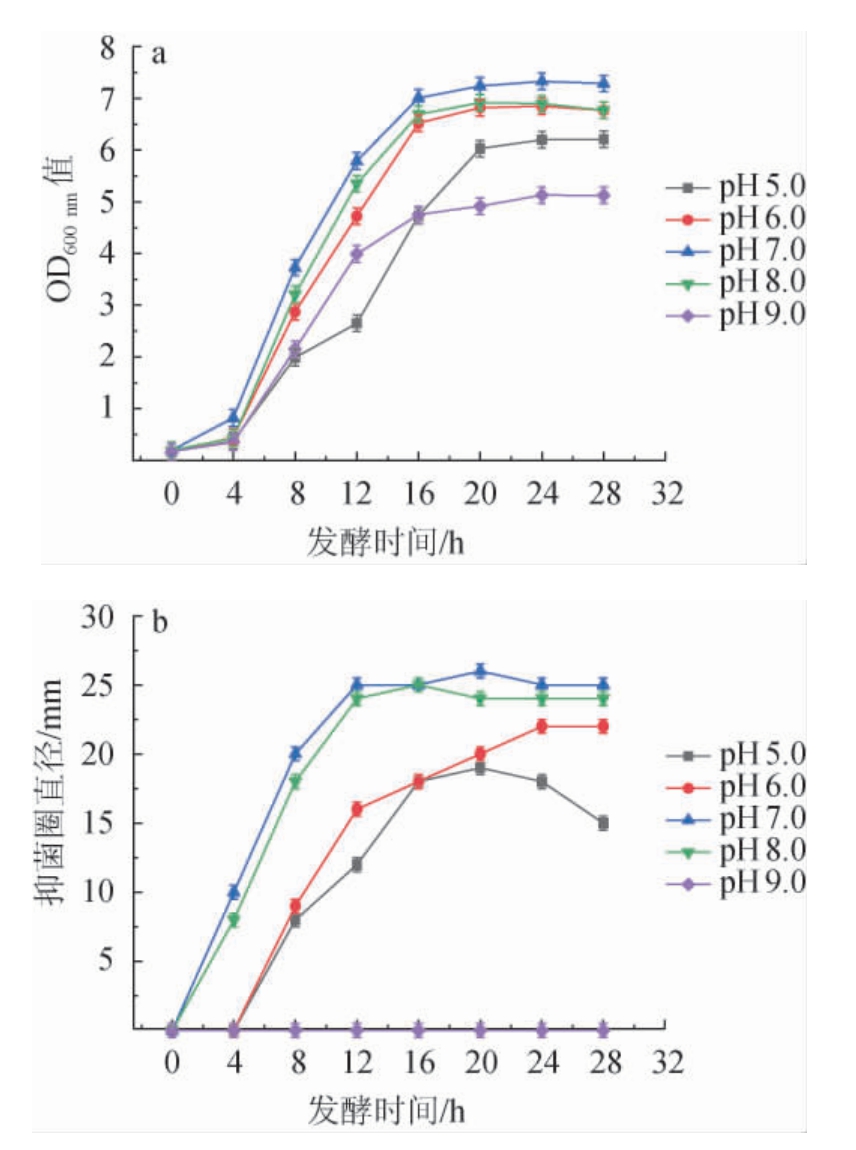
图2 初始pH值对枯草芽孢杆菌ZX-11生长(a)及抑菌活性(b)的影响
Fig.2 Effect of initial pH on the growth (a) and antibacterial activity(b) of Bacillus subtilis ZX-11
由图2可知,发酵28 h时,随着初始pH值的升高,菌株ZX-11的OD600nm值及抑菌活性均呈先升高后下降的趋势,当初始pH值为7.0时,菌株ZX-11的生长情况(OD600nm值7.42)及抑菌活性(抑菌圈直径达26 mm)均最好,分析原因可能是初始pH值过高,发酵液整体的内环境呈碱性,降低了枯草芽孢杆菌ZX-11对营养物质的吸收及利用率,间接导致代谢产物的抑菌活性;初始pH值过低使发酵液整体环境呈现酸性,导致菌体多种酶的活性降低,从而影响菌体的生长状况及抑制代谢产物的抑菌活性[24]。因此,确定枯草芽孢杆菌ZX-11的最适初始pH值为7.0。
2.2.2 接种量对枯草芽孢杆菌ZX-11生长及抑菌活性的影响
接种量对枯草芽孢杆菌ZX-11生长及抑菌活性的影响见图3。
由图3可知,发酵28 h时,随着接种量的增大,菌株ZX-11的OD600nm值呈先升高后下降的趋势,抑菌活性呈先升高后趋于稳定的趋势,当接种量为4%时,菌株ZX-11的生长情况(OD600nm值7.73)及抑菌活性(抑菌圈直径27 mm)均最好,分析原因可能是接种量过小,会导致发酵液中初始浓度偏低,延长菌体的发酵周期,降低菌体在单位时间内产抑菌物质的产量;接种量过大,会导致发酵液中初始菌浓度偏高,减小菌体扩增倍数,抑制菌体代谢生长,从而降低发酵液内细菌素的产生,还会导致菌体溶氧量的竞争性抑制,降低菌体产抑菌物质的活性[24]。因此,确定枯草芽孢杆菌ZX-11的最适接种量为4%。
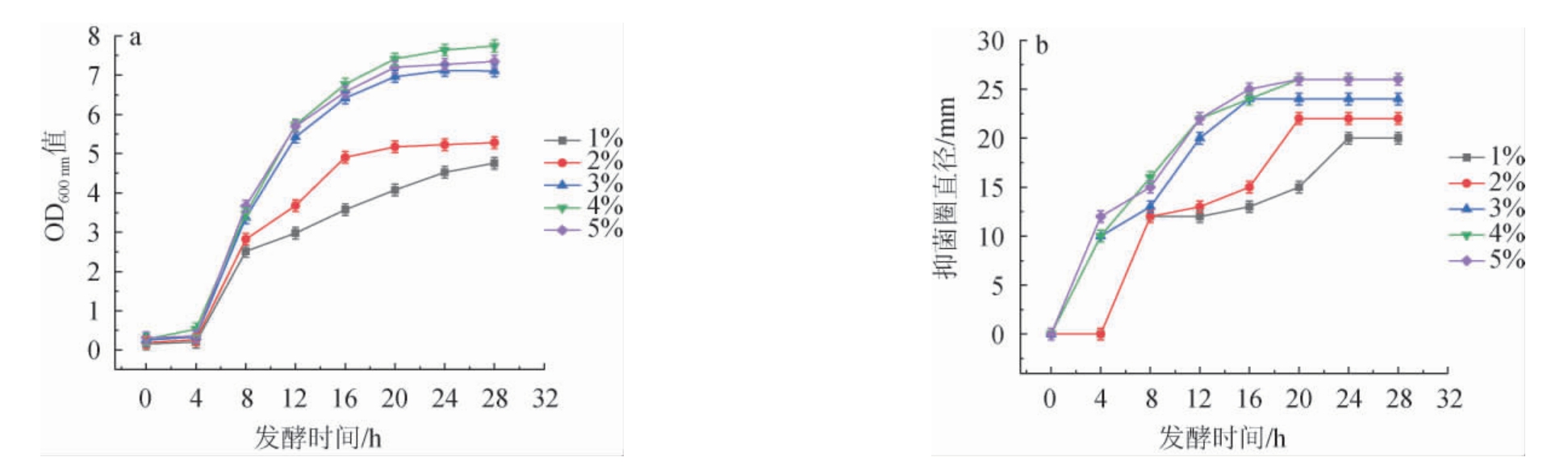
图3 接种量对枯草芽孢杆菌ZX-11生长(a)及抑菌活性(b)的影响
Fig.3 Effect of inoculum on the growth (a) and antibacterial activity (b) of Bacillus subtilis ZX-11
2.2.3 转速对枯草芽孢杆菌ZX-11生长和抑菌活性的影响
搅拌转速的首要作用是调节培养基溶氧量,使枯草芽孢杆菌能够得到充分的氧气需求。转速对枯草芽孢杆菌ZX-11生长及抑菌活性的影响见图4。

图4 转速对枯草芽孢杆菌ZX-11生长(a)及抑菌活性(b)的影响
Fig.4 Effect of rotate speed on the growth (a) and antibacterial activity (b) of Bacillus subtilis ZX-11
由图4可知,发酵28 h时,随着转速的增加,菌株ZX-11的OD600nm值及抑菌活性呈先升高后下降的趋势,分析原因可能是转速过快会导致培养基内的各种营养物质混合不均匀,出现分层现象,无法充分满足菌体生长的营养物质条件,从而导致菌体产生一定的机械损伤,造成发酵液内菌体大量衰亡现象,导致代谢产物的合成量过少;转速过慢,溶氧量的供给不充足,培养基易形成沉淀,不利于菌体的生长和繁殖,代谢产物的合成量会大大减少[24]。当转速达到210 r/min时,菌株ZX-11的生长情况最优(OD600nm值7.50),但当转速达到240 r/min时,抑菌性能最强(抑菌圈直径27 mm)。因此,在同一转速条件下很难同时实现菌体生长和抑菌性能的最优化,基于枯草芽孢杆菌ZX-11菌体生长与抑菌物质合成的半偶联特性,提出转速的分阶段调控策略,以实现发酵转速结果的最优化。
2.2.4 培养温度对枯草芽孢杆菌ZX-11生长及抑菌活性的影响
培养温度对枯草芽孢杆菌ZX-11生长及抑菌活性的影响见图5。

图5 培养温度对枯草芽孢杆菌ZX-11生长(a)和抑菌活性(b)的影响
Fig.5 Effect of culture temperature on the growth (a) and antibacterial activity (b) of Bacillus subtilis ZX-11
由图5可知,当菌体发酵环境处于28~34 ℃时,由于温度相对较低,会延长菌体发酵时间,同时延迟枯草芽孢杆菌ZX-11的生长,严重影响到发酵的效率,从而对抑菌物质的合成有一定的影响;当菌体发酵环境处于40 ℃时,由于温度过高会导致微生物体内的酶失活,发酵内环境的很多反应无法顺利进行,以致降低抑菌物质合成的产量或改变其抑菌性能。当发酵温度为37 ℃时,菌株ZX-11的生长情况最好。然而当发酵温度为31 ℃时,菌株ZX-11的抑菌活性达到最优状态,因此,在同一温度条件下很难同时实现菌体生长和抑菌性能的最优化,基于枯草芽孢杆菌ZX-11菌体生长与抑菌物质合成的半偶联特性,提出温度的分阶段调控策略,以实现发酵温度结果的最优化。
2.2.5 两阶段培养模式对菌体生长和抑菌活性的影响
在前期研究的基础上,设计两阶段培养模式,即发酵0~12 h,37 ℃、210 r/min条件下培养,使菌体快速繁殖;发酵12 h后,切换为31 ℃、240 r/min,强化抑菌物质合成。两阶段培养模式对菌体生长和抑菌活性的影响见图6。
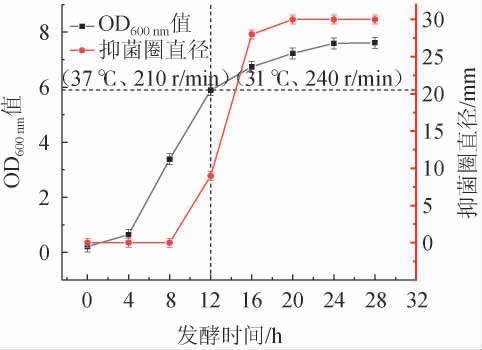
图6 两阶段培养模式对枯草芽孢杆菌ZX-11生长和抑菌活性的影响
Fig.6 Effect of two-stage culture pattern on the growth and antibacterial activity of Bacillus subtilis ZX-11
由图6可知,在整个发酵过程中,枯草芽孢杆菌ZX-11的生长曲线呈典型的S曲线,发酵至28 h时,OD600nm值达7.614。在37 ℃、210 r/min条件下,枯草芽孢杆菌ZX-11发酵8 h时开始有抑菌性能并随着时间的延长而缓慢增长,培养时间为12 h时切换培养条件为31 ℃、240 r/min,抑菌性能随时间的延长而开始迅速增长,抑菌性能最终在20 h时逐渐趋于稳定,抑菌圈直径为30 mm,比单一培养模式31 ℃、210 r/min,31 ℃、240 r/min,37 ℃、210 r/min,37 ℃、240 r/min分别提高15%、7%、20%和11%,比优化前(抑菌圈直径20 mm)提高50%。结果表明,采用发酵温度及转速分阶段调控策略可显著提高合成抑菌物质的效率。
2.3 枯草芽孢杆菌ZX-11代谢产生抑菌物质的抑菌谱
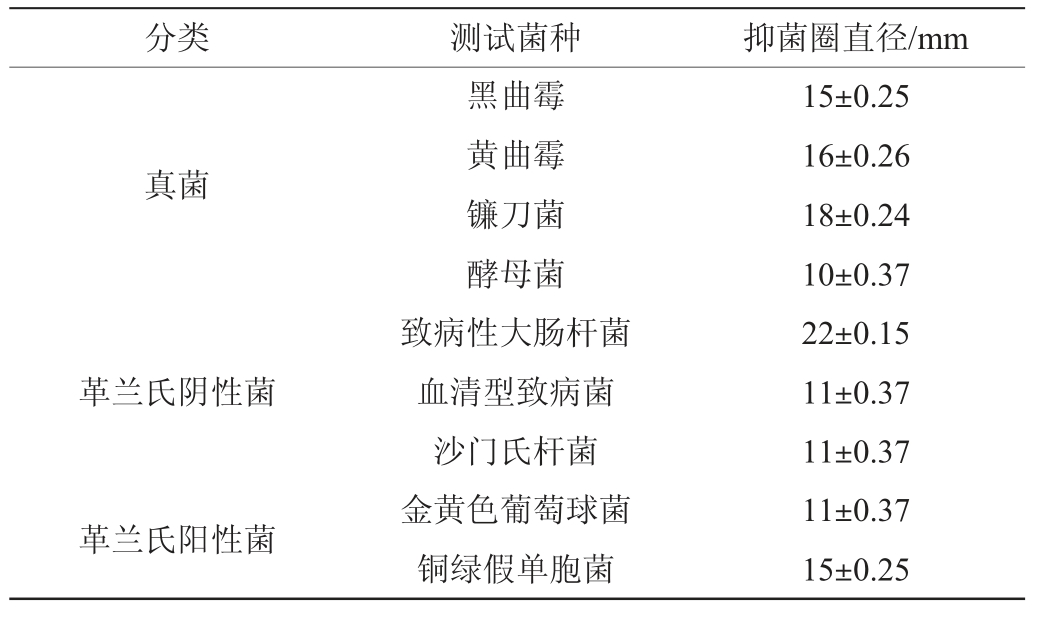
枯草芽孢杆菌ZX-11对真菌、革兰氏阳性细菌、革兰氏阴性细菌的抑菌效果见表1。由表1可知,枯草芽孢杆菌ZX-11的抑菌谱比较广,对各种霉菌、酵母、细菌均具有抑菌活性,且对致病性大肠杆菌的抑菌活性要明显高于其他菌。
表1 枯草芽孢杆菌ZX-11代谢物的抑菌谱
Table 1 Antibacterial spectrum of metabolites of strain ZX-11
2.4 枯草芽孢杆菌ZX-11代谢产生抑菌物质的稳定性
2.4.1 热稳定性
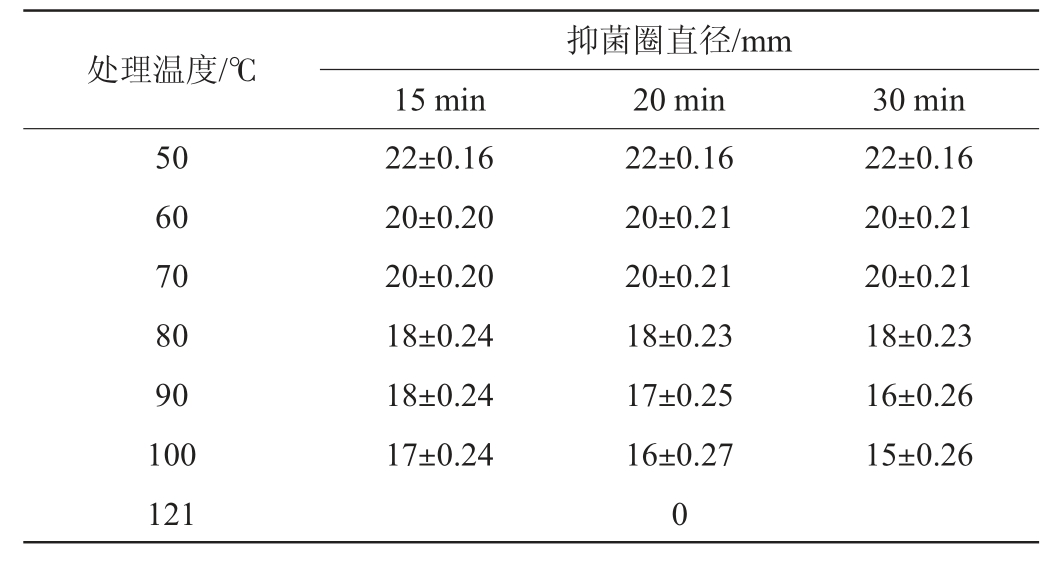
枯草芽孢杆菌ZX-11无菌上清液的热稳定性见表2。由表2可知,枯草芽孢杆菌ZX-11在50~70 ℃条件下均分别处理15 min、20 min、30 min后,不同处理时间下的抑菌性能均无明显变化。在80 ℃和100 ℃条件下处理不同时间,抑菌圈直径呈阶梯性下降。121 ℃条件下处理20 min,抑菌活性丧失。结果表明,枯草芽孢杆菌ZX-11的无菌上清液具有较高的热稳定性。
表2 抑菌物质的热稳定性
Table 2 Thermal stability of antibacterial substances
2.4.2 酸碱稳定性
枯草芽孢杆菌ZX-11无菌上清液的酸碱稳定性见图7。
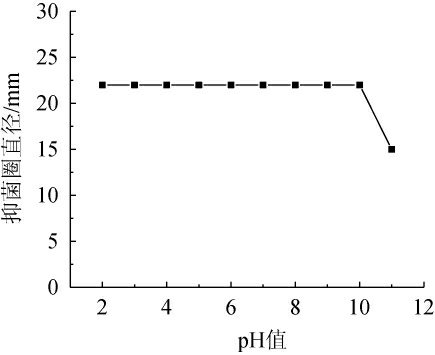
图7 抑菌物质的酸碱稳定性
Fig.7 Acid-base stability of antibacterial substances
由图7可知,该抑菌物质在pH值为2~10时均无明显变化,表明其在酸性、中性以及弱碱条件下稳定性较好,尤其能够耐受较强的酸性,低pH对抑菌物质几乎没有影响[20,25]。但是在pH值为11(强碱)的条件下,抑菌性能下降。结果表明,枯草芽孢杆菌ZX-11发酵过程中所产生的抑菌物质具有较强的酸碱稳定性,尤其在酸性、中性及弱碱条件下稳定性更好。
2.4.3 蛋白酶稳定性
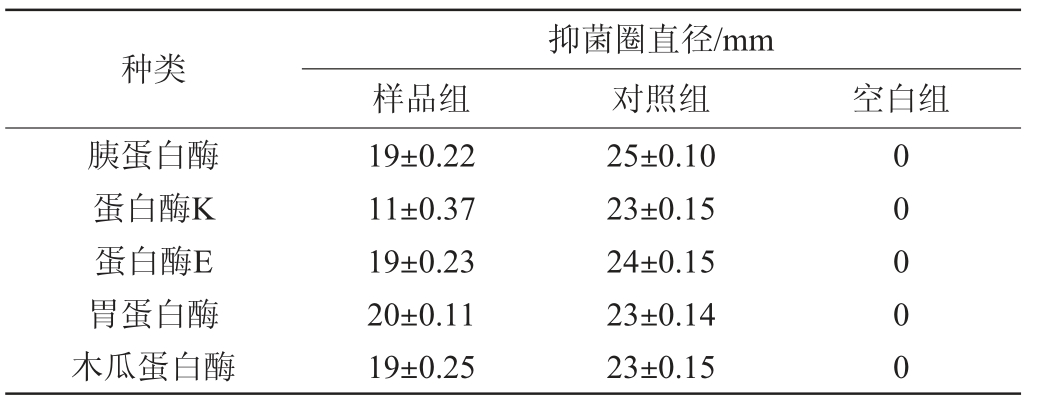
由表3可知,经过胰蛋白酶、蛋白酶E、木瓜蛋白酶和胃蛋白酶处理的组分与对照组分相比抑菌活性影响较小。而蛋白酶K处理的组分与对照组分相比抑菌圈直径显著减小,说明该发酵过程中产生抑菌的代谢产物主要有小分子抗菌肽和蛋白类等物质。但仍有部分抗菌活性,可能存在多糖或者脂类等其他具有抗菌作用的代谢产物,或因蛋白酶的浓度较低、处理时间较短导致部分活性蛋白没有失活。综上可知,枯草芽孢杆菌发酵过程中产生的抑菌物质对蛋白酶具有一定的稳定性。
表3 抑菌物质的蛋白酶稳定性
Table 3 Stability of bacteriostatic substance to protease
3 结论
通过对枯草芽孢杆菌ZX-11发酵条件的研究,确定最佳培养条件为:接种量4%、pH值7.0、培养时间18 h、两阶段培养模式(发酵0~12 h,37 ℃、210 r/min条件下培养,使菌体快速繁殖;发酵12 h后,切换为31 ℃、240 r/min,强化抑菌物质合成)。在此条件下,菌株ZX-11对大肠杆菌的抑菌性能(抑菌圈直径30 mm)比优化前、单一培养模式31 ℃、210 r/min,31 ℃、240 r/min,37 ℃、210 r/min,37 ℃、240 r/min分别提高50%、15%、7%、20%和11%。菌株ZX-11的代谢产物具有较广的抑菌谱,具有较强的耐酸、耐碱、耐高温能力,且对蛋白酶具有一定的稳定性。该研究可为后续抑菌物质进一步的分离纯化及抗菌蛋白的鉴定研究提供理论基础,为其他枯草芽孢杆菌抑菌性能及其抑菌物质的研究提供借鉴。
[1]于佳民,赵倩,张志焱.多黏类芽孢杆菌抗菌肽的分离纯化及特性研究[J].中国畜牧兽医,2021,48(8):2830-2837.
[2]马涛,刁其玉.益生菌调控幼龄畜禽消化道微生物研究进展[J].生物技术通报,2020,36(2):17-26.
[3]BARTON M D.Impact of antibiotic use in the swine industry[J]. Curr Opin Microbiol,2014,19:9-15.
[4]刘韶娜,张斌,相德才.贝莱斯芽孢杆菌对猪生长性能、微生物群落和代谢产物的影响[J].动物营养学报,2020,32(12):5622-5635.
[5]黄潇航,陈志,陈欢.枯草芽孢杆菌在养殖业中的应用及展望[J].畜牧兽医科技信息,2017(12):8-9.
[6]张海林,刘占燕,张梦宇.一种芽孢杆菌广谱细菌素的分离纯化及其性质研究[J].济宁医学院学报,2020,43(5):321-325.
[7]TYAGI A K,SAHDEO P.Commentary:Probiotic and technological properties of Lactobacillus spp.strains from the human stomach in the search for potential candidates against gastric microbial dysbiosis[J].Front Microbiol,2015,6:766.
[8]LEE S G,CHANG H C.Purification and characterization of mejucin,a new bacteriocin produced by Bacillus subtilis SN7[J].LWT-Food Sci Technol,2018,87(6):8-15.
[9]张慧,林陈强,吴大华,等.枯草芽孢杆菌(Bacillus subtilis)CS27液体发酵条件优化[J].热带作物学报,2019,40(5):995-1001.
[10]WORAPRAYOTE W,PUMPUANG L,TOSUKHOWONG A.Two putatively novel bacteriocins active against Gram-negative food borne pathogens produced by Weissella hellenica BCC 7293[J].Food Control,2015,55(3):176-184.
[11]ABRIOUEL H,FRANZ C M A P,OMAR N B.Diversity and applications of Bacillus bacteriocins[J].FEMS Microbiol Rev,2015,35(1):201-232.
[12]朱瑾,朱红军.枯草芽孢杆菌的作用机制及其在动物生产中的应用[J].粮食与饲料工业,2019(8):47-51.
[13]秦楠,杨金梅,梁莹支.解淀粉芽孢杆菌HRH317菌株抗菌肽发酵条件优化及其抑菌活性研究[J].食品安全质量检测学报,2021,12(15):6169-6176.
[14]CAO S,LI D,MA X.A novel unhairing enzyme produced by heterologous expression of keratinase gene(kerT)in Bacillus subtilis[J].World J Microbiol Biotechn,2019,35(8):122.
[15]NAVONE L,MOFFITT K,HANSEN K A.Closing the textile loop:Enzymatic fibre separation and recycling of wool/polyester fabric blends[J].Waste Manage,2020,102:149-160.
[16]季冠宁,汪志鹏,焦加国.枯草芽胞杆菌M29产抑菌物质培养条件的优化及抑菌物质组成初探[J].中国生物防治学报,2019,35(6):930-939.
[17]胡飞,胡本进,周子燕.解淀粉芽胞杆菌JDF-6液态发酵条件优化及抑菌蛋白的分析[J].中国生物防治学报,2017,33(4):561-570.
[18]饶犇,周荣华,闵勇,等.枯草芽孢杆菌的发酵培养基优化研究[J].湖北农业科学,2018,57(21):127-129.
[19]郭亚兰,周雨朦,吴斌,等.葡萄糖醛酸木聚糖酶在枯草芽孢杆菌中的表达及发酵条件优化[J].生物加工过程,2019,17(4):379-384.
[20]HU Y,LIU X,SHAN C.Novel bacteriocin produced by Lactobacillus alimentarius FM-MM4 from a traditional Chinese fermented meat Nanx Wudl:Purification,identification and antimicrobial characteristics[J].Food Control,2017,77(9):290-297.
[21]杨可,郑柯斌,黄晓慧.海洋生境贝莱斯芽孢杆菌TCS001的鉴定及抑真菌活性[J].农药学学报,2018,20(3):333-339.
[22]熊涛,宋苏华,黄涛.植物乳杆菌NCU116抑菌性能的研究[J].食品与发酵工业,2012,38(6):97-101.
[23]孙珊,郝林,王倩.枯草芽孢杆菌W321产抑菌物质的理化性质及抑菌谱研究[J].食品工业,2012,33(11):110-112.
[24]任玉文,任媛媛,刘雅祯.抗植物软腐病枯草芽孢杆菌的高密度发酵优化[J].河北科技大学学报,2020,41(5):433-441.
[25]KIM N,KIM W J,KANG S.Anti-biofilm effect of crude bacteriocin derived from Lactobacillus brevis DF01 on Escherichia coli and Salmonella typhimurium[J].Food Control,2019,98(7):274-280.