葡萄酒是一种常见的酒精饮品,在葡萄酒自然发酵过程中,葡萄酒的风味及品质除了受到品种的影响以外,微生物对葡萄酒的特征也具有较大影响[1-2]。葡萄果实的表面聚集着大量不同种群的微生物,微生物种类、数量及所占比例均不相同。
VARANDA C M R等[3]在不同管理模式下探究了几种不同品种的葡萄的真菌内生群落的差异,表明葡萄生产的不同产物对内生真菌的组成有影响。NEMCOVA K等[4]研究发现葡萄中的酵母的多样性和分布取决于许多因素,如葡萄的品种、葡萄的物理破坏、天气条件和葡萄汁的化学成分等。BRYSCH-HERZBERG M等[5]通过26S rDNA D1/D2序列来分析德国酿酒葡萄的酵母多样性,结果表明葡萄汁中分离出的酵母菌株主要属于有孢汉逊酵母和梅氏酵母,还发现两个潜在的新物种近粉红锁掷孢酵母(Sporidiobolus pararoseus)和花形丝状杆菌(Filobasidium floriforme)。BOKULICH N A等[6]通过高通量测序方法研究了美国加利福尼亚地区‘霞多丽’、‘赤霞珠’、‘仙粉黛’酿酒葡萄汁中的微生物群落,发现其中枝孢霉菌、假单胞菌、青霉菌是主要的真菌类群。
目前我国对不同品种葡萄表皮微生物群落的研究相对较少。赵昱等[7]研究了不同产区的‘赤霞珠’葡萄果皮上微生物的多样性,发现在门水平4个产区的优势真菌门为子囊菌门(Ascomycota)和担子菌门(Basidiomycota),而不同产区酿酒葡萄上的优势微生物在属水平存在较大的差异。王慧等[8]利用26S rDNA D1/D2序列分析,并结合形态及生理学特征,探讨中国主要酿酒葡萄产区葡萄果粒上酵母菌物种的多样性及其分布,结果表明,在新疆、甘肃、陕西、宁夏、山东五个地域酵母菌种构成基本相似。其中优势属为汉逊酵母属(Hanseniaspora)(5种)、假丝酵母属(Candida)(4种)、毕赤酵母属(Pichia)(4种)和伊萨酵母属(Issatchenkia)(2种)。张世伟等[9]应用高通量测序技术,分析沙城地区不同品种酿酒葡萄表皮的微生物群落,表明葡萄品种是影响微生物群落的最重要的因素。
高通量测序技术又称下一代测序(next-generationse quencing,NGS)技术,是目前应用最普遍的测序技术,克服了传统培养技术及分子鉴定方法的缺陷,可以快速对微生物多样性进行分析,对微生物的群落结构分析具有独特的优势[11]。本实验基于葡萄表皮的真菌展开研究,真菌中影响葡萄酒发酵酿造的主要是酵母菌,酵母菌包括酿酒酵母和非酿酒酵母。酵母菌群微生物的特点及结构,是成功酿造优质酒水,充分发挥不同区域不同品类葡萄特质的关键因素。非酿酒酵母作为葡萄酒非接种发酵酿造中的主要菌群,是造成葡萄酒品质下降的原因之一,但其所发挥的代谢作用可能对酒的口感味道有着重要的影响[10]。‘黑提’、‘玫瑰香’、‘阳光玫瑰’、‘红提’在本地种植相对丰富,是主要的食用品种,本实验对常见葡萄的表皮微生物进行比较分析,探究不同品种葡萄表皮上真菌的多样性,明确优势物种,对于葡萄酒品质的提高,挑选优质原料和特色发酵菌株具有理论指导意义。
1 材料与方法
1.1 材料与试剂
随机选取山东省济宁市曲阜市石门山的‘黑提’、‘玫瑰香’、‘阳光玫瑰’、‘红提’各20株生长良好的葡萄植株,采集同一植株上、中、下三个部位的成熟果实,置于无菌袋中,并混合均匀。
DNeasy PowerSoil试剂盒、QIAamp 96 PowerFecal QIAcube HT试剂盒:美国QIAGEN公司;Qubitds脱氧核糖核酸(deoxyribonucleic acid,DNA)Assay试剂盒:美国Life Technologies公司;Tks Gflex DNA聚合酶(1.25 U/μL):大连Takara公司。
PBS缓冲液(pH=7.4):在800 mL蒸馏水中溶解8 g NaCl、0.2 g KCl、1.44 g Na2HPO4和0.24 g KH2PO4,用HCl溶液调节溶液的pH值至7.4,加水定容至1 L,在121 ℃下高压蒸汽灭菌20 min。保存于室温,待用[7]。
1.2 仪器与设备
Centrifuge 5418型台式高速离心机:德国Eppendorf公司;580BR10905型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-rad公司;SN 002358型QIAxtractor高通量核酸提取仪:美国QIAGEN公司;HE-120型电泳仪、2500凝胶成像仪:上海Tanon公司;2100 Bioanalyzer生物分析机:美国Aglient公司;NanoDrop 2000微量分光光度计:美国Thermo Fisher公司;XH-D漩涡混合器:深圳沃信科技有限公司。
1.3 方法
1.3.1 样品处理
用75%酒精消毒后的剪刀采集新鲜的葡萄(‘黑提’、‘玫瑰香’、‘阳光玫瑰’、‘红提’)果实,放置于无菌自封袋中,低温保存并带回实验室,-20 ℃保存备用。
1.3.2 DNA提取、PCR扩增
称50 g葡萄果实,加入200 mL PBS缓冲液(0.1 mol/L,pH7.0),200 r/min涡旋振荡30 min,超声15 min,0.22 μm微孔滤膜过滤,用无菌剪刀剪碎滤膜并放入无菌离心管中[12]。采用DNeasyPowerSoilKitDNA抽提试剂盒对样本的基因组DNA进行提取,之后利用琼脂糖凝胶电泳和NanoDrop2000检测DNA的浓度。
采用真菌ITS 区引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')[13],使用Tks Gflex DNA聚合酶进行PCR扩增。PCR产物使用电泳检测,检测后使用磁珠纯化,纯化后作为二轮PCR模板,并进行二轮PCR扩增,并再次使用电泳检测,检测后使用磁珠纯化,纯化后对PCR产物进行Qubit定量。根据PCR产物浓度进行等量混样,并上机测序。
取5 μL纯化过的二轮产物进行琼脂糖凝胶电泳检测,检测是否有条带和条带是否单一。取1 μL纯化过的二轮产物使用Qubit进行浓度检测。根据PCR产物浓度进行等量混样,并上机测序。高通量测序过程由上海欧易生物医学科技有限公司完成。
1.3.3 高通量测序
使用Trimmomatic(version 0.35)[14]软件采用滑动窗口法对原始测序序列进行质控,使用Flash(version 1.2.11)[15]软件进行拼接。使用QIIME中的split libraries(version 1.8.0)[16]软件去除paired end序列中含有N碱基的序列,去除单碱基重复>8的序列,去除长度<200 bp的序列,得到clean tags序列。使用UCHIME(version 2.4.2)[17]软件去除clean tags中的嵌合体,最终得到用于OTU划分的valid tags。
1.3.4 数据处理与统计学分析
采用Vsearch[16]软件进行操作分类单元(operational taxonomic units,OTU)聚类,对质控得到的优质序列valid tags按照97%的相似度进行OTU分类,并选取每个OTU中丰度最大的序列作为该OTU的代表序列。采用RDP classifier Naive Bayesian分类算法[18]将OTU代表序列与Unite数据库进行比对,注释使用blast[19]软件。使用QIIME软件计算Chao1、Shannon、Simpson和样本覆盖率Alpha多样性指数的计算。通过基于Bray Curtis距离矩阵算法的主坐标分析(principal coordinate analysis,PCoA),进行Beta多样性分析。通过ANOVA统计算法,计算不同分组间的差异物种,并进行差异物种热图等的绘制。最后,通过计算物种间的相关性(Spearman系数等),将获得的数值矩阵直观的展示到相关性heatmap图中,将丰度前30的属,使用R软件进行绘图。
2 结果与分析
2.1 OTU分析
Venn图用于统计多个样本中所共有和独有的OTU数目,可直观地表现样本的OTU数目组成相关性及重叠情况[20],将每个品种的三个平行组拥有的菌种合并,葡萄皮中真菌OTUs Venn图见图1。由图1可知,‘红提’的OTU数为2 910个,‘阳光玫瑰’的OTU数为2 597个,‘玫瑰香’的OTU数为3 028个,‘黑提’的OTU数为1 525个,从四个品种的葡萄检测出的真菌共有OTU数为1 004个,‘红提’特有的OTU数为448个,占其总数的15.40%;‘阳光玫瑰’特有的OTU数为359个,占其总数的13.82%;‘玫瑰香’特有的OTU数为562个,占其总数的18.56%;‘黑提’特有的OTU数为155个,占其总数的10.16%。

图1 葡萄表皮中真菌OTUs Venn图
Fig.1 OTUs Venn of fungi on grape surface
H代表‘黑提’,M代表‘玫瑰香’,Y代表‘阳光玫瑰’,D代表‘红提’。下同。
2.2 不同品种葡萄表皮上真菌菌群的Alpha多样性分析
α-多样性是评价微生物群落丰富性和多样性的指标[21]。计算丰富度指数Chao1,反映样品的丰富度,数值越高说明群落物种的丰富度越高。计算多样性指数Shannon,反映样品的多样性程度,Shannon和Simpson数值越高说明群落物种的多样性越高[9]。不同品种的葡萄表皮上真菌菌群α样品多样性指数见表1。
由表1可知,不同品种的葡萄表皮所有样本覆盖率均在0.99以上,表明样本的测序结果能真实反映样本条件。不同品种葡萄表皮上真菌菌群多样性指数分析显示,Chao1指数最大的为‘红提’,最小的为‘阳光玫瑰’,说明这4种葡萄表皮‘红提’真菌群落最丰富,‘阳光玫瑰’则最稀少。真菌菌群的α多样性指数Shannon最大的为‘红提’,‘黑提’和‘玫瑰香’较小,Simpson与之基本相同,说明这4种葡萄表面‘红提’真菌群落多样性最高,‘玫瑰香’和‘黑提’较低。
表1 不同品种的葡萄表皮真菌菌群样品α多样性指数
Table 1 Alpha diversity indexes of fungal community diversity from grape surface of different varieties
丰度等级曲线用于同时解释样品多样性的两个方面:物种的丰富程度由曲线在横轴上的长度来反映,横轴的跨度越大,表示物种的组成越丰富;物种组成的均匀程度由曲线的形状来反映,曲线越平坦(纵轴的跨度越小),表示物种组成的均匀程度越高,4种葡萄表皮菌落的丰度等级曲线见图2。由图2可知,‘红提’的物种丰富程度最大,物种组成的均匀程度也最高。随着测序深度的增加,每个样品的稀释曲线均趋于平缓,表明测序深度足够大,可以充分反应样品中真菌菌群的多样性情况。
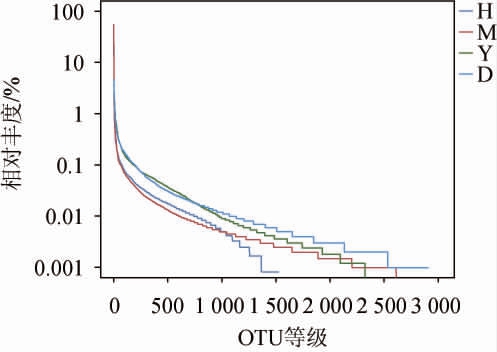
图2 4种葡萄表皮真菌的丰度等级曲线
Fig.2 Rank abundance curves of fungi in grape surface of four grape varieties
2.3 不同品种葡萄表皮上的真菌群落组成及其相关性
2.3.1 真菌群落组成
在样品中共检测并鉴定到种的真菌有1 085种,隶属于13门、37纲、109目、238科、532属,其中部分菌只能鉴定到属未能鉴定到种。不同品种葡萄表皮微生物在门和属水平上的比较结果见图3。
由图3A可知,不同品种的葡萄表皮在真菌门水平的优势菌群主要为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)。在这三个门中,占比最高的是子囊菌门,在‘黑提’总真菌中占比最高为87.05%,在‘阳光玫瑰’总真菌中占比最低也达到68.36%。
由图3B可知,不同品种的葡萄表皮真菌菌群主要分布在6个属:威克汉姆酵母(Wickerhamomyces)、镰刀菌属(Fusarium)、毕赤酵母属(Pichia)、小画线壳属(Monographella)、念珠菌属(Candida)、古根菌属(Archaeorhizomyces)。

图3 不同品种葡萄表皮真菌在门(A)和属(B)水平上的比较
Fig.3 Comparison of fungi on grape surface with different grape varieties at phylum (A) and genus (B) level
2.3.2 真菌群落组成的相关性
排名前10的差异物种丰度结果见图4。由图4可知,‘黑提’中的威克汉姆酵母菌属(Wickerhamomyces)和毕赤酵母属(Pichia)的相对丰度远高于其他品种,镰刀菌属(Fusarium)、小画线壳属(Monographella)、念珠菌属(Candida)、古根菌属(Archaeorhizomyces)在四种品种的葡萄表皮中丰度无显著性差异(P>0.05)。
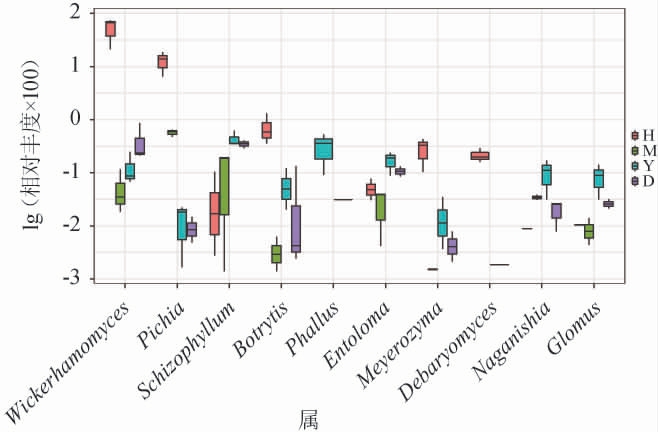
图4 排名前10的差异物种丰度箱型图
Fig.4 Boxplot of the abundance of the top 10 differential genus species
排名前30的差异物种相关性结果见图5。由图5可知,真菌菌群的不同属之间存在显著的相关性。威克汉姆酵母(Wickerhamomyces)与毕赤酵母属(Pichia)呈明显的正相关,它们都与镰刀菌属(Fusarium)呈现负相关。而小画线壳属(Monographella)、古根菌属(Archaeorhizomyces)和镰刀菌属(Fusarium)这三种属之间呈现明显的正相关。
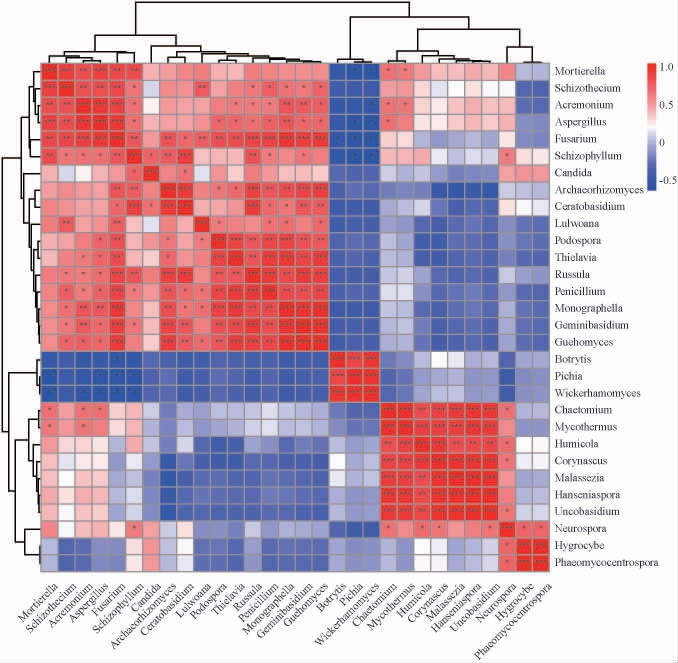
图5 排名前30的差异物种相关性热图
Fig.5 Heatmap of the top 30 differential species correlations
2.4 不同品种葡萄表皮上真菌的Beta多样性分析
真菌群落主坐标分析及UPGMA聚类分析结果见图6。由图6A可知,对四种葡萄表皮上细菌群落进行分析绘制PCoA分析图,当PC1为62.49%,PC2为34.51%时,四种葡萄在真菌菌落上存在一定的差异和相似性,‘阳光玫瑰’和‘红提’的真菌群落相似性较高,‘玫瑰香’与‘阳光玫瑰’‘红提’的相似性较低,‘黑提’与这三种葡萄距离较远,相似性更低。
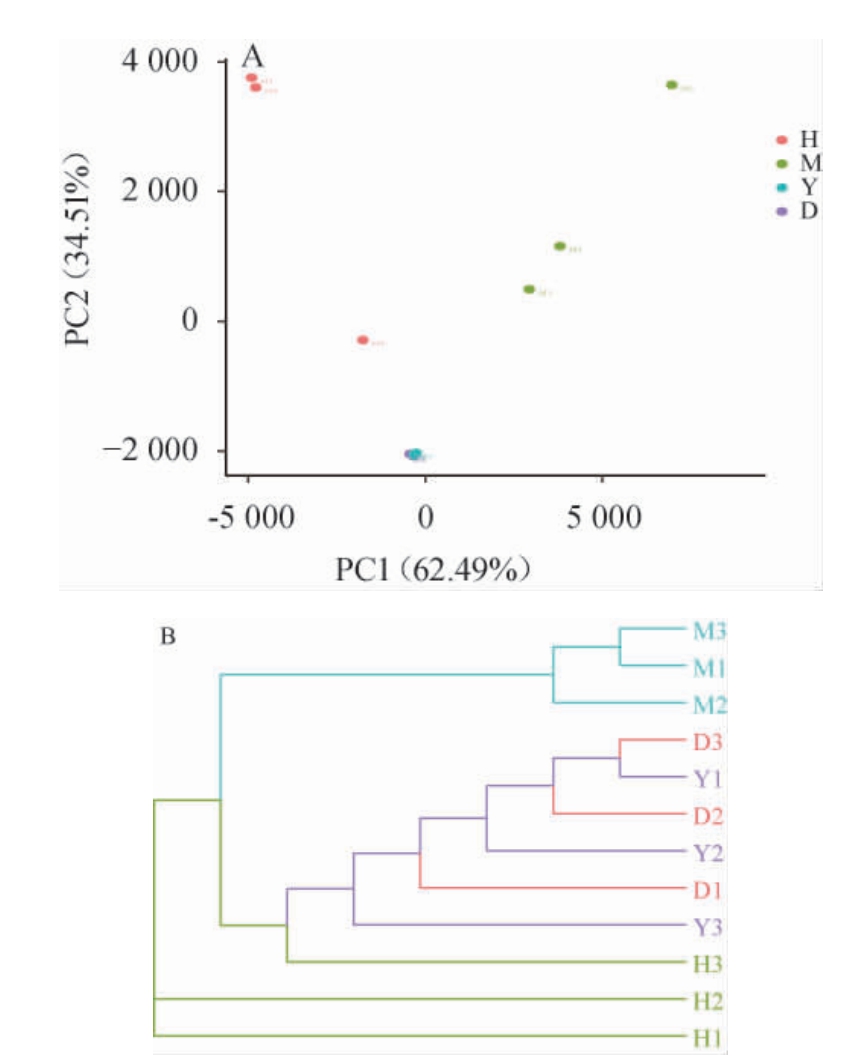
图6 真菌群落主坐标分析(A)及UPGMA聚类分析(B)结果
Fig.6 Principal coordinate analysis (A) and UPGMA clustering (B)analysis results of fungal community
由图6B可知,将所有样品的真菌群落进行聚类分析,结果显示与主坐标分析结果基本一致。‘黑提’的样品首先与其他品种产生分支,然后‘玫瑰香’的所有样品与‘阳光玫瑰’、‘红提’产生分支,而‘阳光玫瑰’和‘红提’的样品交互在一起,无明显差异。
2.5 中心OTU及最相似序列分析
将所有样本中均出现的OTU定义为中心OTU,得到28个相对丰度较高的真菌OTU,将这些OTU的代表序列在美国国立生物技术信息中心(national center for biotechnology information,NCBI)上进行Blast序列比对,结果见表2。由表2可知,不同品种葡萄表面真菌主要有镰刀菌(Fusarium sp.)(OTU254、OTU2028、OTU4312)、粪壳菌(Sordariales sp.)(OTU241)、尖孢镰刀菌(Fusarium oxysporum)(OTU46)、异常威克汉姆酵母(Wickerhamomycesanomalus)(OTU115)、出芽短梗霉(Aureobasidium pullulans)(OTU157)、南极低温酵母(Guehomyces pullulans)(OTU175)等。
表2 不同品种葡萄表皮真菌中心OTU及对应相似序列
Table 2 Central OTU of fungus of grape surface of different varieties and its corresponding similar sequences
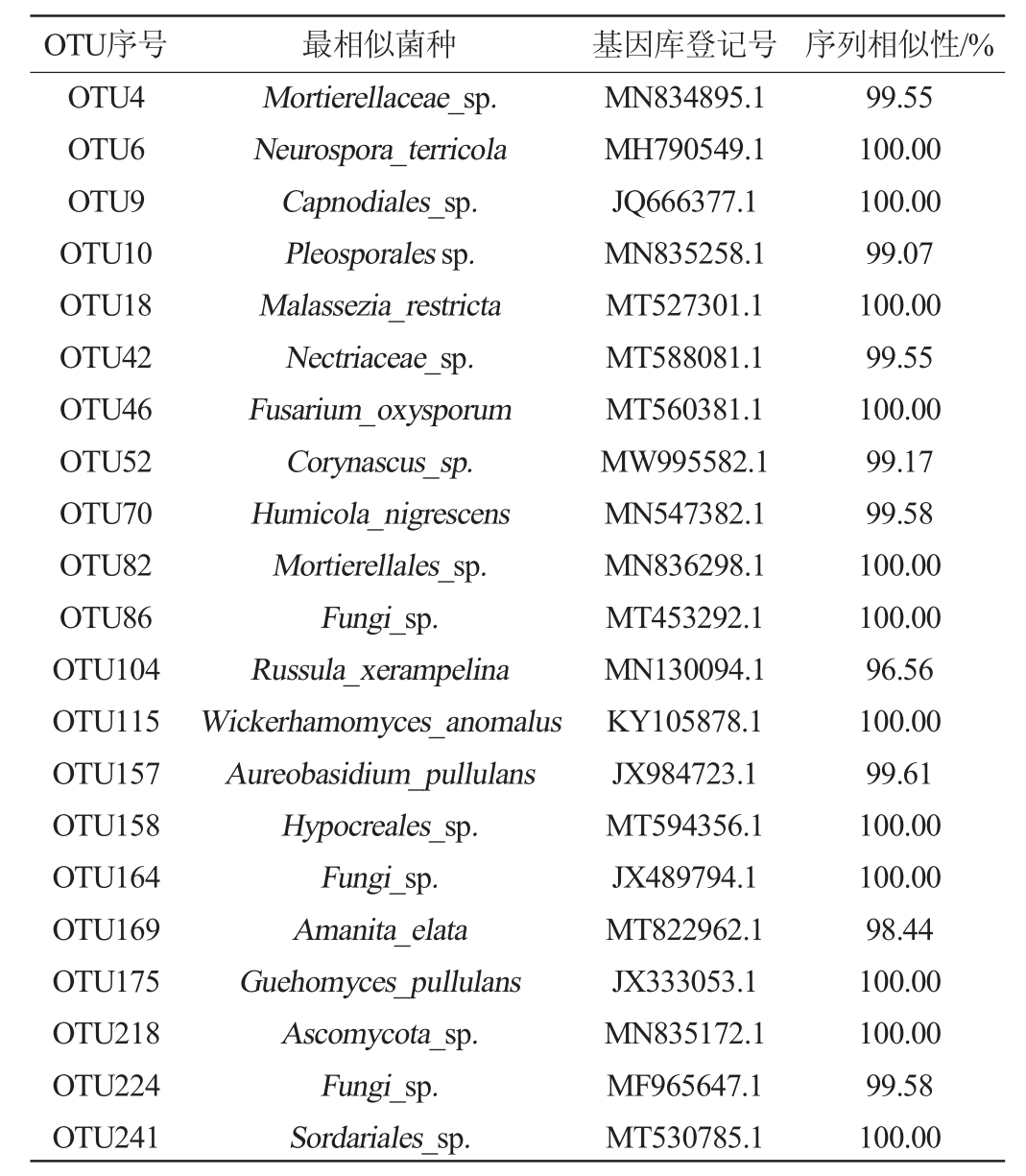
续表

2.6 讨论
葡萄酒的特征性风味不仅来自葡萄品种和酿酒手法,酵母菌对葡萄酒的酿造也有很大的影响,决定了葡萄酒的风味及品质。在葡萄酒酿造过程中酵母菌分为酿酒酵母和非酿酒酵母,威克汉姆酵母属(Wickerhamomyces)、毕赤酵母属(Pichia)和念珠菌属(Candida)都属于非酿酒酵母。早期非酿酒酵母是从变质的葡萄酒中分离出来的,因其产生高水平的挥发性酸和一些负化合物且对二氧化硫和酒精敏感,因此最初会导致葡萄酒的腐败。但是近年来研究发现,非酿酒酵母的参与使得葡萄酒有着良好的风味和品质。毕赤酵母属(Pichia)和念珠菌属(Candida)具有不同程度的β-葡萄糖苷酶活性,可帮助葡萄中的风味和香气化合物等的非挥发性前体分解,释放挥发性化合物,从而改善葡萄酒的风味品质[22]。
根据真菌中心OTU,得到葡萄表面的一些主要菌种。真菌中心OTU结果显示酿酒葡萄表面含有镰刀菌(Fusarium sp),研究表明其可产生脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON),对动物和人类健康有着潜在的危害,DON具有多方面的毒性作用,而厌食和呕吐是机体摄入DON后出现的最典型症状,厌食和呕吐的产生主要归因于DON对中枢神经系统和胃肠道食欲因子的影响[23]。粪壳菌属(Sordariales sp.)通常为葡萄根部的内生菌,而尖孢镰刀菌(Fusarium oxysporum)也是葡萄内生真菌的优势菌群[24]。出芽短梗霉(Aureobasidium pullulans)是一类酵母真菌[25],是葡萄表皮菌群中最主要的溶解果胶的物种(果胶分解菌株),在酒色的发展和稳定性方面具有重要的作用[26]。异常威克汉姆酵母(Wickerhamomyces anomalus)具有很强的产酯能力,能够提高酒的含酯量,对于酒香的产生具有重要作用[27]。
本研究有助于对不同品种葡萄表皮真菌多样性的认知,后续可在此基础上进一步分析含有真菌的具体代谢途径和生理生化反应来探究其对发酵葡萄酒的风味和品质的影响,可为筛选发酵葡萄酒优良酿酒酵母和非酿酒酵母提供指导意义。
3 结论
本研究以常见食用品种葡萄为研究对象,通过高通量测序技术探究了不同品种葡萄表皮真菌的多样性。不同品种酿酒葡萄表皮微生物群落结构具有一定的差异,‘红提’表皮真菌的多样性和丰度均高于其他品种。本实验研究的几种酿酒葡萄表面真菌在门水平上的优势菌群主要为:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)。在属水平上的优势菌群主要为:威克汉姆酵母属(Wickerhamomyces)、镰刀菌属(Fusarium)、毕赤酵母属(Pichia)、小画线壳属(Monographella)、念珠菌属(Candida)、古根菌属(Archaeorhizomyces)。不同品种的葡萄表面的真菌优势菌群在门水平差异相对较小,3个优势门的真菌占‘黑提’总真菌数最高,为93.53%,在‘红提’中占比最低,为84.67%。但在属水平差异较大,其中‘黑提’中的威克汉姆酵母菌属(Wickerhamomyces)和毕赤酵母属(Pichia)的相对丰度远高于其他品种,镰刀菌属(Fusarium)、小画线壳属(Monographella)、念珠菌属(Candida)、古根菌属(Archaeorhizomyces)在四种品种的葡萄表皮中丰度无显著性差异。真菌菌群的不同属之间存在显著的相关性,威克汉姆酵母(Wickerhamomyces)与毕赤酵母属(Pichia)呈明显的正相关,它们都与镰刀菌属(Fusarium)呈现负相关。而小画线壳属(Monographella)、古根菌属(Archaeorhizomyces)和镰刀菌属(Fusarium)这三种属之间呈现明显的正相关。
[1]佚名.微生物给葡萄酒风味作贡献[J].中国食品学报,2015(9):1.
[2]魏玉洁,邹弯,马文瑞,等.应用高通量测序技术研究新疆产区葡萄果实、叶片及果园土壤微生物多样性[J].食品科学,2018,39(6):162-170.
[3]VARANDA C M R,OLIVEIRA M,MATERATSKI P,et al.Fungal endophytic communities associated to the phyllosphere of grapevine cultivars under different types of management[J].Fungal Biology,2016,120(12):1525-1536.
[4]NEMCOVA K,BREIEROVA E,VADKERTIOVA R,et al.The diversity of yeasts associated with grapes and musts of the Strekov winegrowing region,Slovakia[J].Folia Microbiologica,2015,60(2):103-109.
[5]BRYSCH-HERZBERG M,SEIDEL M.Yeast diversity on grapes in two German wine growing regions[J].Int J Food Microbiol,2015,214:137-144.
[6]BOKULICH N A,THORNGATE J H,RICHARDSON P M,et al.Microbial biogeography of wine grapes is conditioned by cultivar,vintage,and climate[J].P Natl Acad Sci,2014,111(1):E139-E148.
[7]赵昱,李静媛,解万翠,等.四个不同产区酿酒葡萄果皮微生物多样性的研究[J].食品与发酵工业,2021,47(11):53-60.
[8]王慧,张立强,刘天明,等.葡萄果粒表皮酵母菌多样性研究[J].微生物学通报,2008,35(1):10-14.
[9]张世伟,陈曦,钟其顶,等.不同品种酿酒葡萄表皮微生物群落多样性分析[J].生物技术通报,2017,33(3):128-137.
[10]范蕊.浅谈酿酒葡萄与微生物[J].食品工程,2021(2):14-16.
[11]WANG X H,XU X,BAO Z,et al.High-throughput sequencing analysis of microbial diversity in the combined fermentation stages of cow dung and corn straw[J].Food Ferment Ind,2019,45(3):47-55.
[12]张二豪,赵润东,尹秀,等.西藏产区葡萄表皮及根际土壤真菌群落结构组成分析[J].食品工业科技,2021,42(16):106-111.
[13]MUKHERJEE P K,CHANDRA J,RETUERTO M,et al.Oral mycobiome analysis of HIV-infected patients:identification of Pichia as an antagonist of opportunistic fungi[J].PLoS Pathog,2014,10:e1003996.
[14]BOLGER A M,LOHSE M,USADEL B.Trimmomatic:a flexible trimmer for Illumina sequence data[J].Bioinformatics,2014,30(15):2114-2120.
[15]MAGOCˇT,SALZBERG S L.FLASH:fast length adjustment of short reads to improve genome assemblies[J].Bioinformatics,2011,27(21):2957-2963.
[16]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J]. Nat Meth,2010,7(5):335-336.
[17]EDGAR R C,HAAS B J,CLEMENTE J C,et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[18]WANG Q,GARRITY G M,TIEDJE J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73:5261-5267.
[19]ALTSCHUL S F,GISH W,MILLER W.Basic Local Alignment Search Tool(BLAST)[J].J Mol Biol,1990,215(3):403-410.
[20]赵德庆,于平,乔飞.基于高通量测序分析海南粗榧树皮和叶片中微生物多样性[J].山东农业科学,2021,53(8):54-59.
[21]于佳琦,夏亚男,乔晓宏,等.锡林郭勒牧区鲜马奶风味物质与微生物多样性分析[J].中国乳品工业,2021,49(5):8-14.
[22]JOLLY N P,VARELA C,PRETORIUS I S.Not your ordinary yeast:non-Saccharomyces yeasts in wine production uncovered[J]. FEMS Yeast Res,2014,14(2):215-237.
[23]张馨培,范瑞祺,罗荪琳,等.脱氧雪腐镰刀菌烯醇导致厌食和呕吐的机制研究进展[J].中国畜牧杂志,2021,57(1):24-31.
[24]王朝霞,程显好,李维焕,等.烟台地区葡萄根部内生真菌多样性研究[J].中外葡萄与葡萄酒,2014(6):12-17.
[25]崔堂兵,郭勇,郑穗平.出芽短梗霉的研究进展[J].工业微生物,2002(2):4147.
[26]MERIN G,MORATA V I.Application of a grape surface majority pectinolytic species, Aureobasidium pullulans,to low-temperature red winemaking:development and stability of wine colour[J].J Wine Res,2020,31(1):218-239.
[27]魏玉洁.新疆地产葡萄酒优良酿酒微生物的选育[D].乌鲁木齐:新疆农业大学,2016.