浆水主要是将莲花菜、芹菜等蔬菜切条后放入发酵器皿,而后加入煮沸的面汤,待冷却后以旧浆水做引子进行发酵而成。主要分布在我国陕西、甘肃、宁夏等西北地区[1-2],其气味清香、口感酸爽,可止渴消食、利小便、止呕吐、治泻痢等[3]。近年,研究者发现,浆水的风味和发酵品质与参与发酵的微生物的特性有关[4]。同时,浆水中含有许多功能性乳酸菌株,浆水的许多功能性被认为与乳酸菌及其代谢产物息息相关。
γ-氨基丁酸(γ-aminobutyric acid,GABA),是由α-谷氨酸(α-aminoglutaric acid,GA)通过谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)催化脱羧生成的非蛋白氨基酸[5]。GABA具有改善睡眠[6]、降血压[7]、防止动脉硬化[8]和改善肝、肾脏功能[9]等多种生理功效。生产GABA的方法有三种[10],分别为微生物发酵法、化学合成法和植物富集法。微生物发酵法相比于化学合成法和植物富集法,具有操作简单、专一性高且环保等优点[11]。微生物发酵法是将L-谷氨酸(L-glutamic,L-Glu)通过谷氨酸脱羧酶将其转化为GABA。目前,乳酸菌因为其本身较安全且性能优良,已成为微生物法生产GABA的优势菌种[12]。
产GABA的乳酸菌株由于其分离源不同,GABA产量及发酵特性存在很大的差异。肖秋颖等[13]从川西高原传统发酵牦牛乳中分离出发酵乳杆菌84,GABA产量为1.587 g/L;国立东等[14]从东北酸菜中筛选出植物乳杆菌HUCM115,GABA产量为101.3 μg/mL;刘璐等[15]从发酵鱼酱酸中分离出植物乳杆菌Y279,GABA产量为0.209 g/L。PARK S Y等[16]从泡菜中分离出的植物乳杆菌K154,GABA产量为0.170 g/L;SANTOS-ESPINOSA A等[17]从墨西哥干酪中分离出的乳酸乳球菌L-571,GABA产量为(1 153.1±13.5)mg/L。
本研究以宁夏地区传统发酵食品浆水为原料,采用纯培养、薄层层析法及高效液相色谱法分离筛选出具有GABA生产能力的菌株,并对其进行形态学观察、生理生化试验及分子生物学鉴定,通过耐酸耐胆盐性试验及生长特性分析,筛选出最优菌株,并采用单因素试验及响应面试验对菌株产GABA发酵条件进行优化,以期为生产食品级GABA及下一步应用到果蔬汁的发酵提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
浆水(主要成分莲花菜、芹菜、面汤):采自宁夏当地农户。
1.1.2 化学试剂
细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;乙腈(色谱纯):天津市大茂化学试剂厂;γ-氨基丁酸标准品(纯度>98%):上海爱解生物科技有限公司;丹磺酰氯(分析纯):上海麦克林生化科技有限公司;酵母粉(生化试剂)、乙酸钠(分析纯):银川伟博鑫生物科技有限公司;琼脂粉(分析纯)、L-谷氨酸(L-Glu)(纯度>98%):上海优宁维生物科技有限公司。
1.1.3 培养基
MRS固体培养基、MRS肉汤培养基:青岛高科技工业园海博生物技术有限公司。
含L-Glu的发酵培养基:MRS肉汤培养基中加入2%琼脂粉、1.5%L-谷氨酸。121 ℃灭菌20 min。
1.2 仪器与设备
LRH-250生化培养箱:广东省医疗器械厂;WFZ UV-2000型紫外可见分光光度计:尤尼柯(上海)仪器有限公司;安捷伦1260高效液相色谱仪:安捷伦(中国)科技有限公司;BXM-30R 立式压力蒸汽灭菌锅:上海博讯实业有限公司;TGL-16M高速台式冷冻离心机:长沙湘仪离心机仪器有限公司;C200凝胶电泳成像分析系统:美国Azure Biosystems生物公司;PHSJ-3F pH计:上海仪电科学仪器股份有限公司;Mastercycler X50聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;164-5050电泳仪:美国Bio-Rad公司。
1.3 实验方法
1.3.1 乳酸菌的分离纯化
将浆水汁稀释至10-3、10-4,均匀涂布于MRS固体培养基,37 ℃静置培养48 h,挑选形态外观良好、具有典型乳酸菌菌落特征的单菌落再次分离纯化,最后采用脱脂乳保藏法保藏用于后续实验。
1.3.2 产GABA乳酸菌的定性和定量分析
(1)薄层层析法定性测定GABA
将预先保藏好的菌株接种到MRS液体培养基连续活化两代,以4%的接种量接种到含L-Glu的发酵培养基,37 ℃培养48 h,从离心后的培养液取上清液,利用薄层层析法[18]定性测定GABA,展开剂为正丁醇、冰醋酸、水(4∶3∶1,V/V),以0.6%的茚三酮溶液作为显色剂,以0.1%的GABA标准品作为对照,进行薄层层析,层析完毕干燥后喷显色剂进行显色,比较比移值(Rf值)。若样品与GABA标准品出现相同的Rf值,说明样品中有GABA产生。
(2)高效液相色谱法定量测定GABA
将利用薄层层析法定性后具有产GABA能力的菌株采用高效液相色谱法[19-20]测定GABA产量。衍生化反应:取发酵液样品/GABA标品200μL,加入200μLNaHCO3-Na2CO3缓冲液(pH=11.2)和400 μL 9 g/L的丹磺酰氯溶液,充分振荡5 s,30 ℃反应30 min,过0.45 μm滤膜。
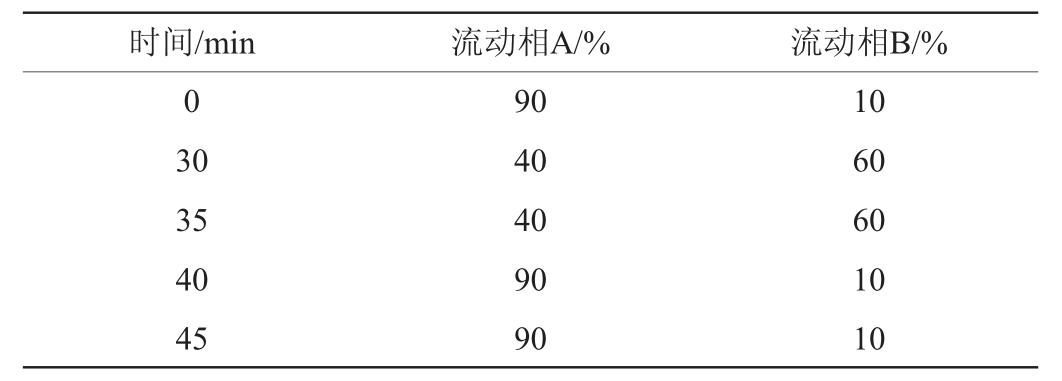
高效液相色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm),流动相A为0.025mol/L乙酸钠,用4%的乙酸调pH至6.2±0.05,流动相B为乙腈,流速为1.0 mL/min;梯度洗脱表见表1,柱温40 ℃,进样量20 μL,检测波长386 nm。
表1 流动相梯度洗脱程序
Table 1 Gradient elution program of mobile phase
1.3.3 产GABA菌株的鉴定
(1)形态学特征和生理生化鉴定
形态学观察:根据《伯杰细菌鉴定手册》[21]中对乳酸菌进行菌落及细胞形态观察。
生理生化试验:参考《乳酸细菌分类鉴定及实验方法》[22]和《伯杰细菌鉴定手册》,对初筛的优良菌株进行明胶液化、过氧化氢酶、硝酸还原、淀粉水解、硫化氢(H2S)、糖发酵等生理生化特性试验。
(2)16S rDNA分子生物学鉴定
DNA的提取使用细菌基因组DNA 提取试剂盒,通用引物为:27F(5'-AGAGTTTGATCCTGGCTCAG-3'),1492R(5'-CTACGGCTACCTTGTTACGA-3')。PCR扩增体系(25 μL)[23]:Premix Taq酶12.5 μL,正反向引物各1 μL,模板DNA 1 μL,双蒸水(ddH2O)9.5 μL。PCR扩增条件[24]:94 ℃预变性15 min;94 ℃变性30 s,58.5 ℃退火30 s,72 ℃延伸1 min,进行30个循环;72 ℃再延伸10 min。PCR 扩增产物进行电泳后,用凝胶成像仪进行观察,将有效PCR扩增产物在低温下送至生工(上海)股份有限公司进行测序。测序后的16S rDNA基因序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Gen-Bank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源搜索比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA7.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 筛选菌株耐受性及生长特性
(1)耐酸性试验
益生菌在进入人体肠道的过程中需要耐受胃部的酸性环境[25],只有当活菌进入胃肠道后,益生功能才能发挥出来。所以,耐酸性是衡量乳酸菌优良特性的重要指标。将MRS液体培养基初始pH值调至2.5,在此条件下将试验菌在37 ℃下进行恒温培养,分别将0 h和3 h的培养液进行活菌平板计数。
(2)耐胆盐试验
以MRS为基础培养基,添加0.3%的猪胆盐[26],将试验菌37 ℃恒温培养,分别将0 h和3 h的培养液进行活菌平板计数。
(3)生长曲线及产酸曲线
将连续活化两代后的菌株在37 ℃培养,每隔4 h取样,测定其OD600nm值及pH值的变化,绘制菌株生长曲线及产酸曲线。
1.3.5 存活率计算公式
式中:N1表示培养3 h 测定的活菌数对数,lg(CFU/mL);N0表示培养0 h 测定的活菌数对数,lg(CFU/mL)。
1.3.6 发酵条件的优化
(1)单因素试验
以发酵液初始pH值为5.0、发酵温度为37 ℃、培养时间为48 h为初始试验条件,在此基础上分别考察初始pH值(4.5、5.0、5.5、6.0、6.5)、发酵温度(31 ℃、33 ℃、35 ℃、37 ℃、39 ℃)、发酵时间(24 h、36 h、48 h、60 h、72 h)对GABA产量的影响。
(2)响应面试验
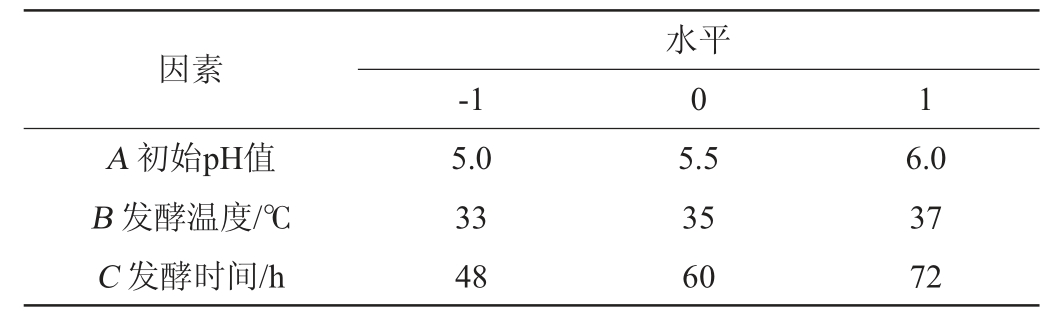
在单因素试验结果基础上,以初始pH值(A)、发酵温度(B)、发酵时间(C)为自变量,以GABA产量(Y)为响应值,采用响应面试验优化发酵条件,响应面试验因素与水平见表2。
表2 发酵条件优化响应面试验设计因素与水平
Table 2 Factors and levels of response surface experiments design for fermentation conditions optimization
2 结果与分析
2.1 产GABA菌株的定性、定量测定结果
本实验共分离出21株乳酸菌株(分别编号1~11,①~⑩),采用薄层层析法定性检测结果见图1。

图1 筛选菌株发酵液薄层层析色谱图
Fig.1 Thin layer chromatography of fermentation broth of screened strain
由图1可知,21株乳酸菌中有6株菌(编号为2、6、7、③、⑦、⑧)与GABA标准品有相同的Rf值,其中菌株2颜色最深,说明其GABA产量最高。采用高效液相色谱法对6株分离菌发酵液中GABA含量进行测定,结果见图2。
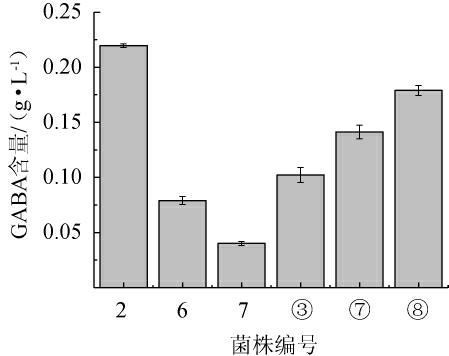
图2 筛选菌株发酵液中γ-氨基丁酸含量HPLC测定结果
Fig.2 Determination results of γ-aminobutyric acid contents in fermentation broth of screened strain by HPLC
由图2可知,6株分离菌株产GABA的能力存在一定差异,其中分离菌株2、⑧发酵液中GABA产量相对较高,而其他分离菌发酵液中产量较低。根据其他学者的研究,刘晓飞等[27]从寒土地中筛选出的5株乳酸菌,GABA产量最低为0.56 g/L,最高为0.81g/L;田蕊等[28]从酸马奶中分离出的17株乳酸菌的GABA产量为0.015~0.731 g/L;王兴洁等[29]从四川泡菜中筛选出的4株乳酸菌的GABA产量为1.54~2.18 g/L。分析发现,从同一种分离源中筛选出来的乳酸菌GABA产量有所不同,与本研究的结果一致。结果表明,菌株2产GABA能力最强,其GABA产量为0.22 g/L。
2.2 产GABA菌株的生理生化及其分子生物学鉴定结果
2.2.1 筛选菌株形态学观察
6株筛选菌株形态学观察结果见图3。由图3a可知,6株分离菌菌落呈现白色圆形状,表面干净,中间凸起,具有微微的酸味;由图3b可知,经革兰氏染色后显现紫色,说明为革兰氏阳性菌,在显微镜下观察呈杆状。
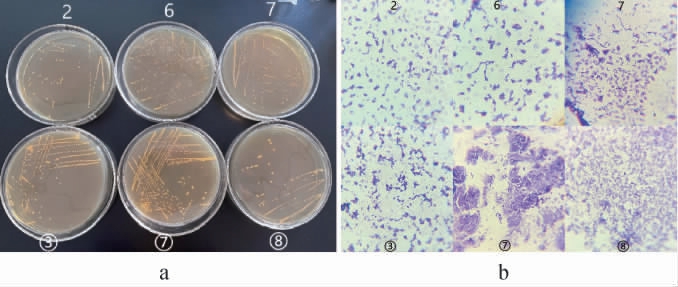
图3 6株筛选菌株的菌落(a)及细胞(b)形态
Fig.3 Colony (a) and cell (b) morphology of 6 screened strains
2.2.2 筛选菌株生理生化试验
6株筛选菌株生理生化试验结果见表3。由表3可知,糖发酵实验中菌株2、6、7、③、⑦、⑧不能利用鼠李糖、乳糖,结果呈阴性,其他实验结果均呈阳性。6株分离菌的明胶液化、淀粉水解、过氧化氢酶等实验结果均呈阴性,根据《伯杰细菌鉴定手册》[21]可初步判定这6株菌为乳杆菌属。
表3 6株筛选菌株生理生化试验结果
Table 3 Results of physiological and biochemical tests of 6 screened strains
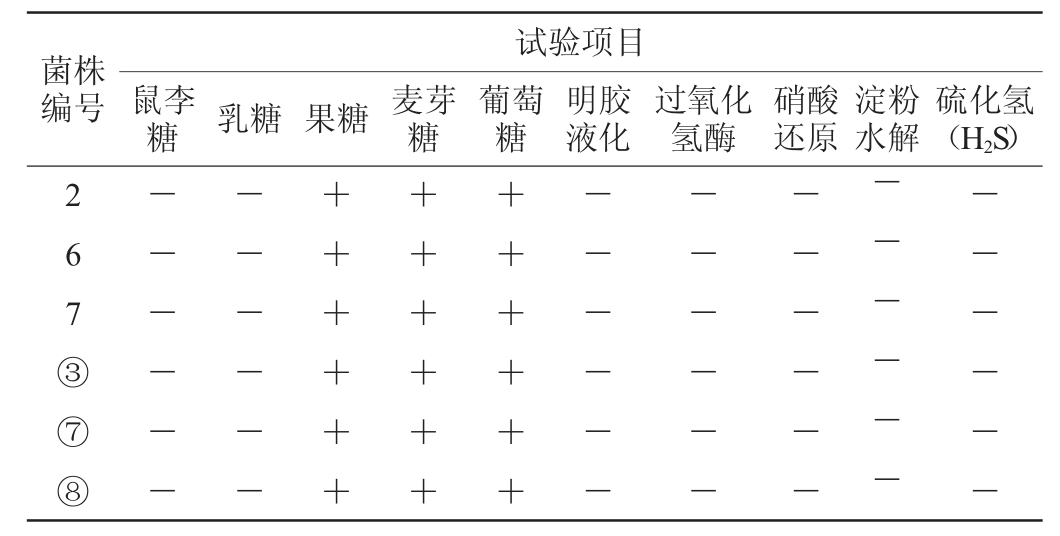
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.2.3 分子生物学鉴定结果
6 株筛选菌株16S rDNA基因的PCR扩增产物琼脂糖凝胶电泳图见图4。由图4可知,在1 500 bp左右有明显的条带出现。测序后,将测序结果提交至GenBank数据库进行BLAST比对,选取同源性较高的模式菌株的16SrDNA序列,用MEGA 7.0软件构建系统发育树,结果见图5。由图5可知,菌株2、6、7、③、⑦与植物乳杆菌同源性最高,均被鉴定为植物乳杆菌(Lactobacillus plantarum),菌株⑧与发酵乳杆菌同源性最高,被鉴定为发酵乳杆菌(Lactobacillus fermentium)。
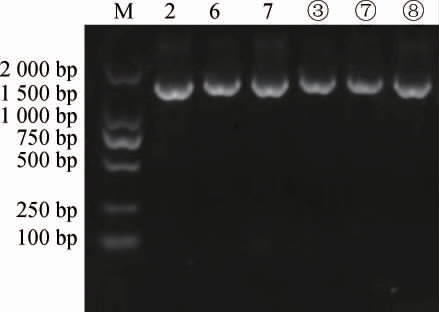
图4 6株筛选菌株16S rDNA序列的PCR扩增产物琼脂糖凝胶电泳图
Fig.4 Agarose gel electrophoresis of PCR amplification products of 16S rDNA of 6 screened strains
M为DNA Marker;2、6、7、③、⑦、⑧为筛选菌株。
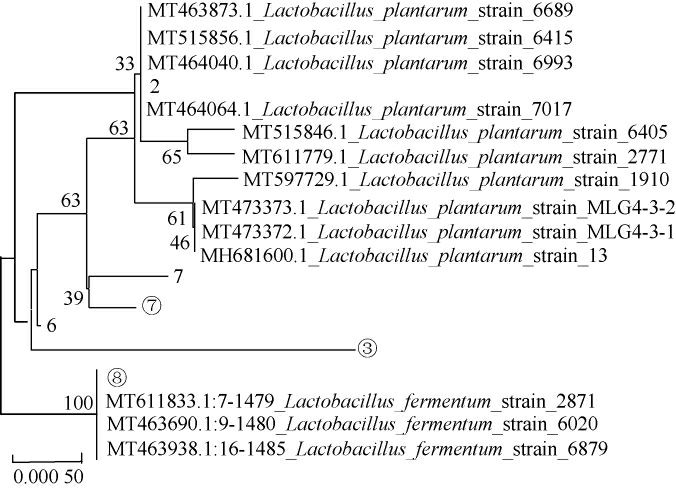
图5 基于16S rDNA基因序列6株筛选菌株的系统发育树
Fig.5 Phylogenetic tree of 6 screened strains based on 16S rDNA gene sequence
2.3 菌株的耐受性实验结果
耐受能力是益生菌的重要特性之一。将筛选的6株菌株进行耐受性实验,结果见图6。由图6a可知,当胆盐含量为0.3%,培养3 h后6株菌的存活率均>88%,且活菌数符合乳酸菌发挥作用的最低值,说明这6株菌胆盐耐受性良好,其中菌株2胆盐耐受性最好。在相同胆盐含量下,王祎然等[30]从酸汤中筛选出的6株乳酸菌培养3 h后存活率均>88%;胡斌等[31]对8株菌培养2 h后存活率为24.1%~91.1%;李洋等[32]对6株菌培养3 h后存活率为5.37%~41.64%。可以看出,本实验6株菌对胆盐的耐受能力更好。由图6b可知,在pH为2.5的酸性条件下培养3 h后,6株菌存活率均>86%,活菌数达到了107 CFU/mL,说明这6株菌均具有良好的耐酸性,其中菌株2耐酸性最好。云月英等[33]对4株乳酸菌在pH值为3时培养3 h,存活率为5.4%~80%;王帅静等[34]对7株菌在pH为2和3时培养时几乎不生长。可见本实验6株菌对酸的耐受能力更强。
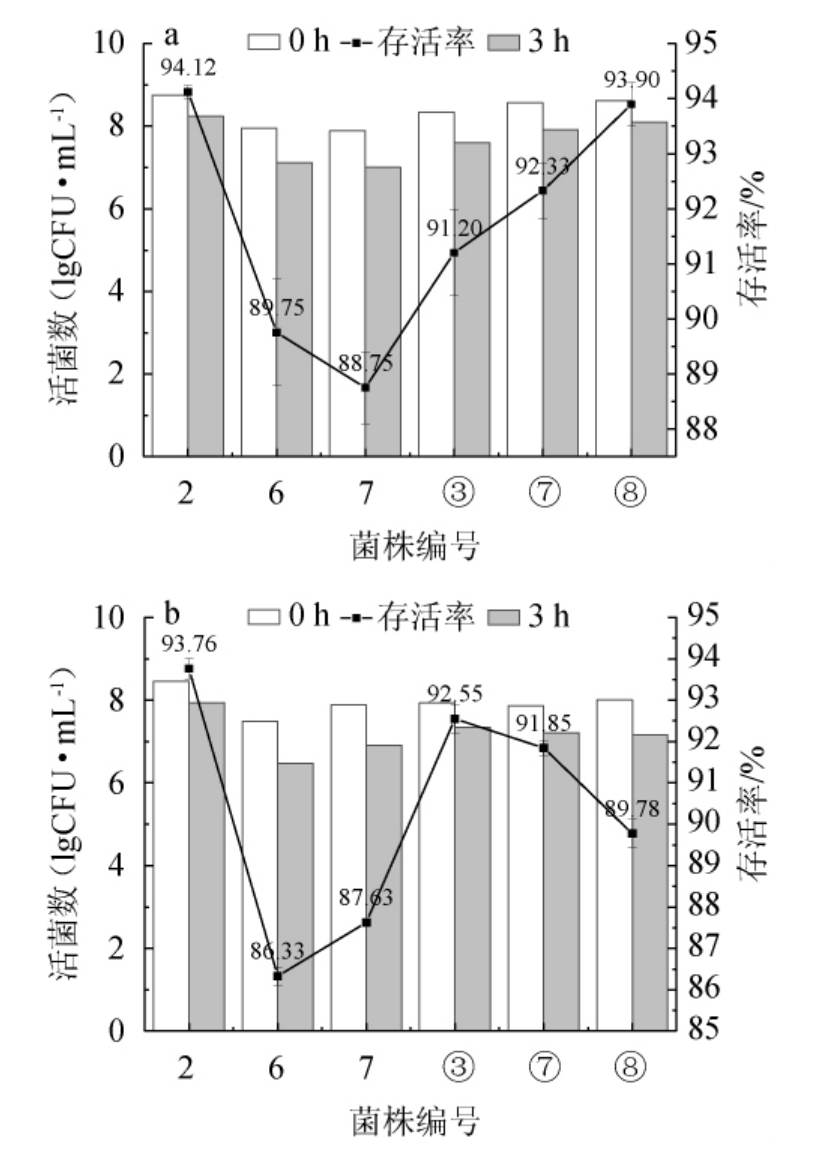
图6 6株筛选菌株的胆盐(a)及酸(b)耐受性
Fig.6 Tolerance of bile salt (a) and acid (b) of 6 screened stains
2.4 菌株2的生长及产酸曲线
将产GABA能力最强的菌株2进行生长及产酸曲线测定,结果见图7。由图7可知,菌株2在4 h后生长速率加快,呈指数增长,在16 h后趋于稳定。同时,能否快速产酸也标志着乳酸菌活力是否良好。由图7可知,菌株2在16 h内快速产酸,因此说明该菌具有良好的生长和产酸能力。
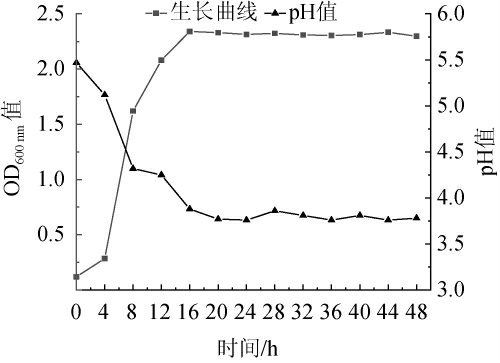
图7 菌株2的生长曲线及产酸曲线
Fig.7 Growth and acid production curves of strain 2
2.5 发酵条件优化单因素试验结果
将产GABA能力最强的菌株2发酵条件进行单因素试验优化,结果见图8。适宜的pH值对菌株的生长有很大的促进作用,pH值也是控制酶活的重要因素,有相关研究表明[35],谷氨酸脱羧酶(GAD)的活性在pH值为4~6时表现最佳,pH值升高会导致脱羧作用减弱,从而使GABA分解加快。
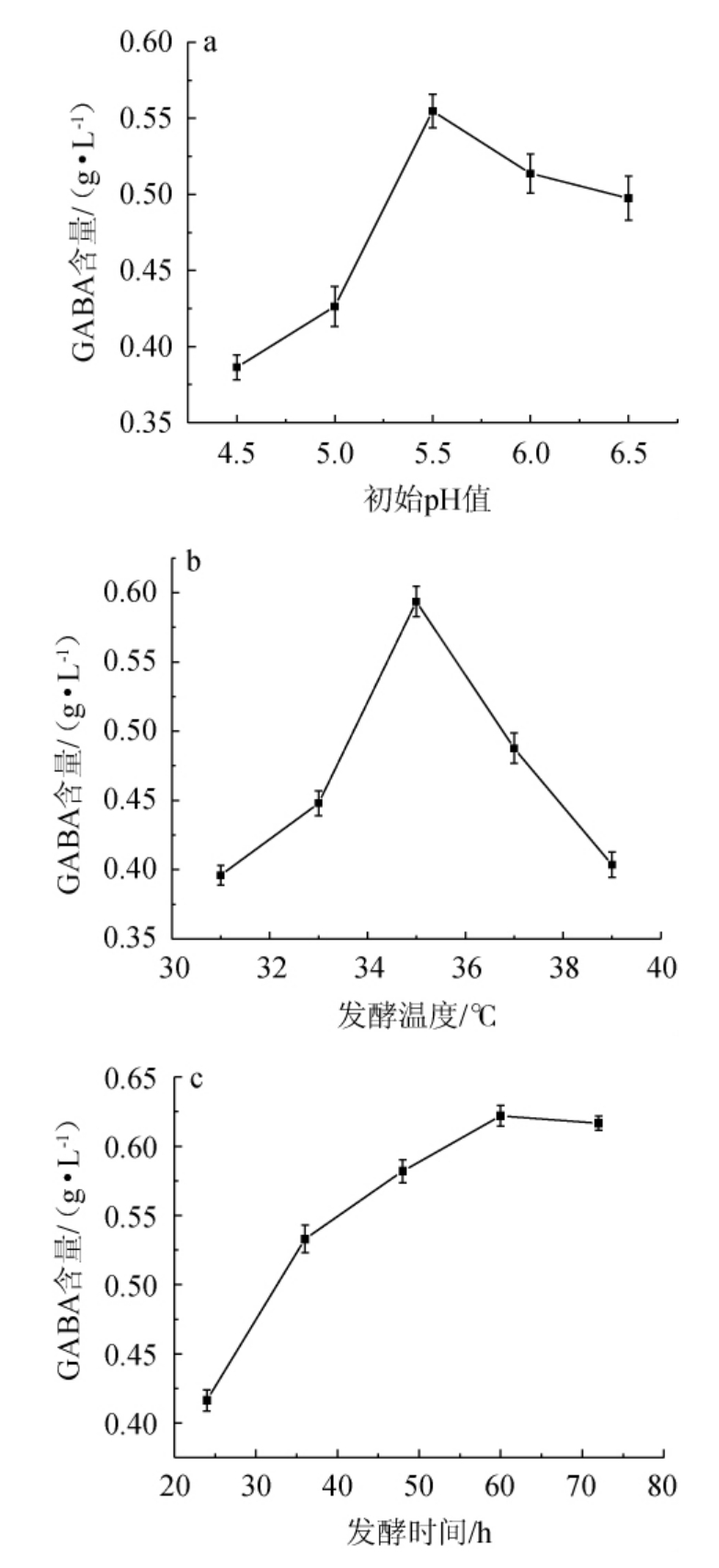
图8 初始pH值(a)、发酵温度(b)和发酵时间(c)对γ-氨基丁酸产量的影响
Fig.8 Effect of initial pH (a),fermentation temperature (b) and time (c) on γ-aminobutyric acid yield
由图8a可知,当初始pH值为4.5~5.5时,发酵液中GABA产量随初始pH值增加而升高;当初始pH值为5.5时,发酵液中GABA产量最高,为0.55 g/L;当初始pH值>5.5之后,发酵液中GABA产量有所下降。因此,选择最适发酵初始pH值为5.5。适宜的温度是微生物生长和代谢的前提。由图8b可知,当发酵温度为31~35 ℃时,发酵液中GABA产量随温度增加而升高;当发酵温度为35 ℃时,发酵液中GABA含量达到峰值为0.59 g/L;当发酵温度>35 ℃之后,发酵液中GABA产量有所下降。因此,选择最适发酵温度为35 ℃。由图8c可知,当发酵时间为24~60 h时,发酵液中GABA随发酵时间增加而升高;当发酵时间到达60 h时,发酵液中GABA产量达到最高,为0.62 g/L;当发酵时间>60 h之后,随着时间的增加GABA产量无明显变化,可能是因为发酵液中底物已经完全分解。因此,选择最适发酵时间为60 h。
2.6 发酵条件优化响应面试验分析
在单因素试验基础上,以初始pH值(A)、发酵温度(B)、发酵时间(C)为自变量,以GABA产量(Y)为响应值,采用响应面试验优化发酵条件,响应面试验设计及结果见表4。
表4 发酵条件优化响应面试验设计及结果
Table 4 Design and results of response surface experiments for fermentation conditions optimization
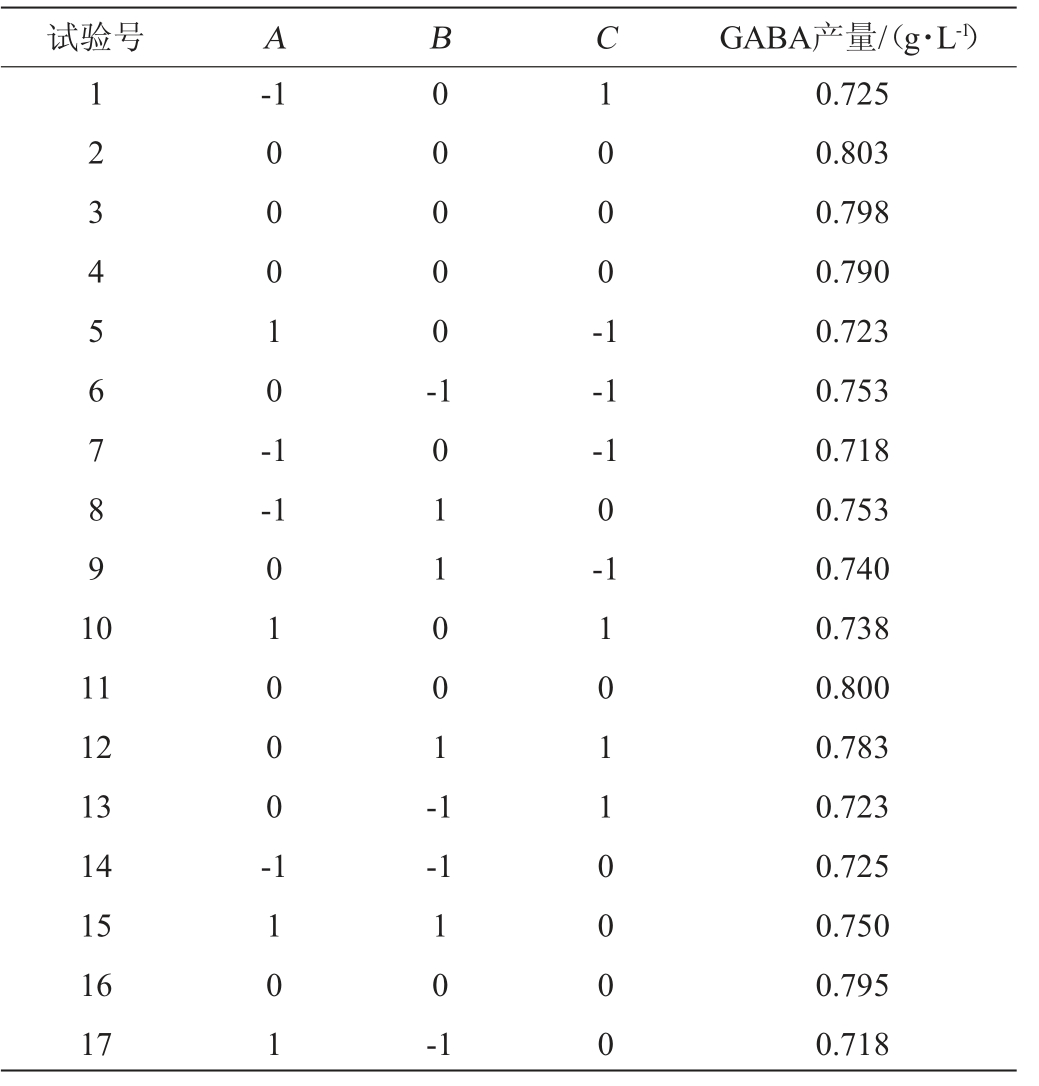
以GABA产量为(Y)为响应值,以发酵液初始pH值(A)、发酵温度(B)、发酵时间(C)为自变量建立回归方程如下:
由表5可知,该模型P值<0.000 1,表明该回归模型中每项对结果的影响极显著,失拟项P值=0.296 0>0.05,表明该回归模型拟合度良好,具有一定的可信度。回归方程的决定系数R2为0.986 5,校正决定系数R2adj为0.969 2。由P值可知,该模型一次项B、交互项BC和二次项A2、B2、C 2对结果影响极显著(P<0.01),其他项的对结果影响不显著(P>0.05)。由F值可知,3个因素对GABA产量的影响强弱顺序为:发酵温度>发酵时间>初始pH值。
表5 回归模型方差分析
Table 5 Variance analysis of regression model
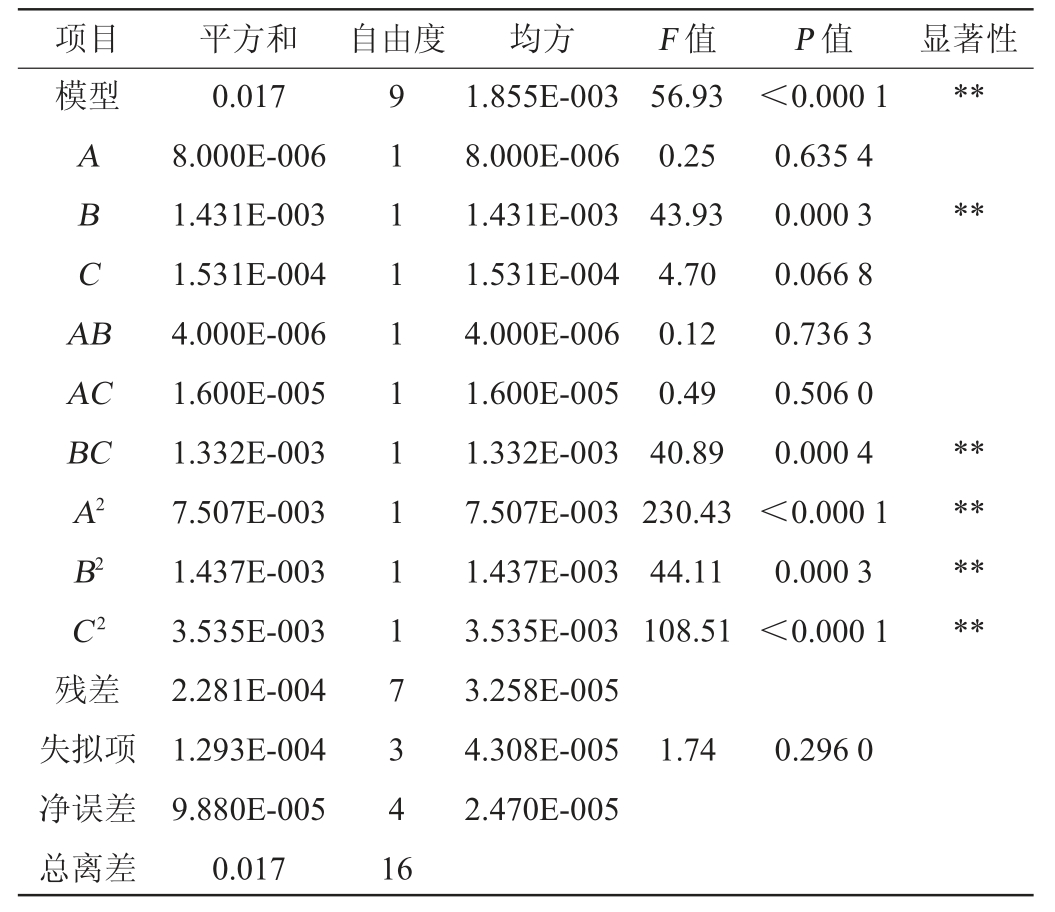
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
各因素间交互作用对GABA产量影响的响应面及等高线见图9。由图9可知,GABA产量随着各因素数值的不断增加呈先增高后降低的趋势,说明各因素之间具有一定的交互作用。其中BC曲面弯曲程度最大,等高线呈现椭圆状,说明BC交互作用及极显著(P<0.01),而AB和AC等高线更偏向圆形,说明其交互作用不显著,表明交互作用对GABA产量影响相对较小。该结果与方差分析结果一致。
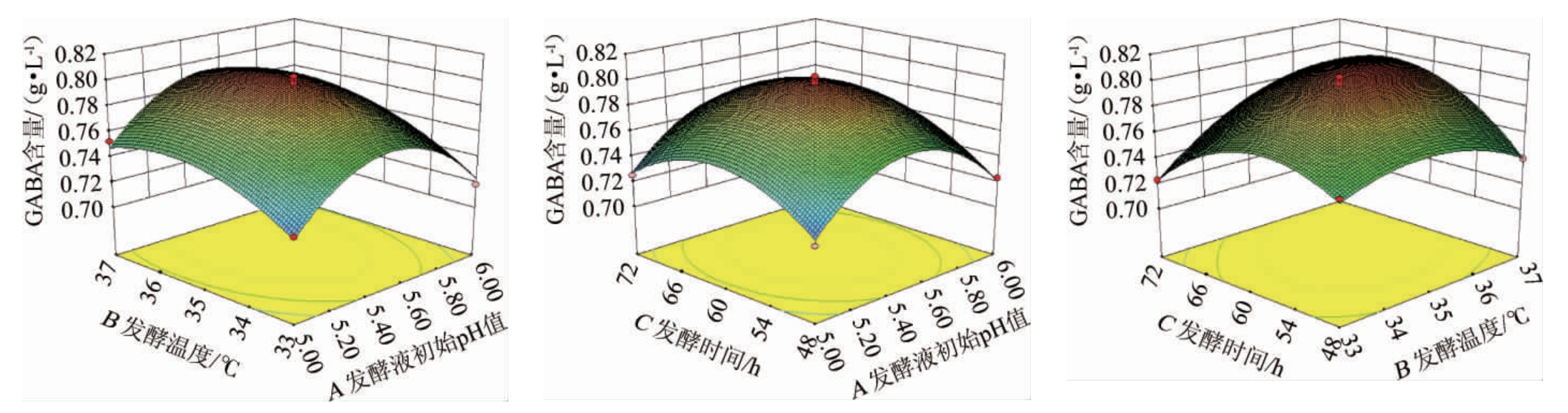
图9 初始pH值、发酵温度和发酵时间间交互作用对γ-氨基丁酸产量影响的响应面和等高线
Fig.9 Response surface plots and contour lines of effects of interaction between initial pH,fermentation temperature and time on γ-aminobutyric acid yield
通过响应面软件对方程求解,得到最佳发酵条件为:发酵液初始pH值5.78、发酵温度36 ℃、发酵时间63.03 h,在此条件下,GABA产量理论值为0.788 7 g/L。为了验证模型的可靠性,同时考虑到操作及成本问题,将上述发酵条件修正为:发酵液初始pH值5.8、发酵温度36 ℃,发酵时间60 h。在此优化条件下,GABA 产量实际值为0.778 g/L,与理论值相接近,表明该方案可行。
3 结论
本研究从宁夏当地浆水中分离出21株菌株,利用薄层层析法、高效液相色谱法筛选出6株具有产GABA能力的菌株,经形态学观察、生理生化试验及分子生物学鉴定,确定5株为植物乳杆菌(Lactobacillus plantarum),1株为发酵乳杆菌(Lactobacillus fermentium)。将GABA产量最高的植物乳杆菌2为试验菌株,其优化发酵条件为初始pH值5.8,发酵温度36 ℃,发酵时间60 h。在此优化条件下,GABA的产量为0.778 g/L,比优化之前产量提高了3.5倍,为生产食品级GABA及下一步应用到果蔬汁的发酵提供研究基础。
[1]赵利花.浆水中益生功能乳酸菌的筛选[D].西安:西北大学,2020.
[2]吴燕.特色自然发酵浆水中乳酸菌的筛选、表征及应用[D].无锡:江南大学,2019.
[3]李雪萍.浆水中可培养微生物多样性及特性的研究[D].兰州:兰州交通大学,2014.
[4]叶陵,李勇,王蓉蓉,等.我国传统发酵蔬菜中乳酸菌多样性的研究进展[J].食品科学,2018,39(15):296-301.
[5]WANG D,WANG Y,LAN H,et al.Enhanced production of γ-aminobutyric acid in litchi juice fermented by Lactobacillus plantarum HU-C2W[J].Food Biosci,2021,42(5):101155.
[6]李科,俞兰秀,刘小雨,等.γ-氨基丁酸改善睡眠作用机制的研究进展[J].食品工业科技,2019,40(14):353-358.
[7]张杜,杨艳.裸大麦中γ-氨基丁酸的降血压功效研究[A].//四川省营养学会.第十三届中国西部营养与健康高峰论坛论文集[C].四川省营养学会:四川省营养学会,2018:1.
[8]TILAHUN S,CHOI H R,BAEK M W,et al.Antioxidant properties,γ-aminobutyric acid(GABA)content,and physicochemical characteristics of tomato cultivars[J].Agron,2021,11(6):11061204.
[9]谭俊峰,林智,彭群华,等.γ-氨基丁酸超微绿茶粉辅助降血压功能研究[J].茶叶科学,2012,32(5):461-464.
[10]宁亚维,马梦戈,杨正,等.γ-氨基丁酸的制备方法及其功能食品研究进展[J].食品与发酵工业,2020,46(23):238-247.
[11]闫朝阳,李旭,查士银,等.γ-氨基丁酸的研究与应用进展[J].济南大学学报(自然科学版),2020,34(4):395-401.
[12]渠岩,李平兰,王夫杰,等.发酵食品中γ-氨基丁酸植物乳杆菌S35的筛选鉴定[J].中国农业大学学报,2010,15(5):104-109.
[13]肖秋颖,王翔宇,陈炼红.川西高原传统发酵牦牛酸乳中高产γ-氨基丁酸乳酸菌筛选及鉴定[J].食品工业科技,2021,42(6):111-117,124.
[14]国立东,张文文,刘艳,等.传统发酵东北酸菜中植物乳杆菌HUCM115的分离及益生特性[J].食品科学,2020,41(18):140-145.
[15]刘璐,吴江丽,杨金桃,等.发酵鱼酱酸产GABA乳酸菌的分离筛选及发酵特性[J].食品科学,2021,42(18):73-79.
[16]PARK S Y,LEE J W,LIM S D.The probiotic characteristics and GABA production of Lactobacillus plantarum K154 isolated from kimchi[J].Food Sci Biotechnol,2014,23(6):1951-1957.
[17]SANTOS-ESPINOSA A,BELTRÁN-BARRIENTOS L A,REYES-DÍAZ R,et al.Gamma-aminobutyric acid(GABA)production in milk fermented by specific wild lactic acid bacteria strainsisolated from artisanal Mexican cheeses[J].Ann Microbiol,2020,70(1):1-11.
[18]李欢,潘道东,吴振,等.产GABA乳酸菌的筛选鉴定及其发酵条件研究[J].食品工业科技,2020,41(23):78-84.
[19]周婷,程威威,林亲录,等.丹磺酰氯柱前衍生发芽糙米中γ-氨基丁酸的HPLC分析[J].食品科技,2014,39(1):282-286.
[20]程威威,吴跃,林亲录,等.HPLC法测定发芽糙米中γ-氨基丁酸中不同衍生方式的比较研究[J].中国农学通报,2014,30(9):279-284.
[21]布坎南,吉本斯.伯杰细菌鉴定手册[M].[第8版].北京:科学出版社,1984:797-870.
[22]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:117-158.
[23]LY D,MAYRHOFER S,YOGESWARA I,et al.Identification,classification and screening for γ-amino-butyric acid production in lactic acid bacteria from Cambodian fermented foods[J].Biomolecules,2019,9(12):768-784.
[24]LEE B J,KIM J S,KANG Y M,et al.Antioxidant activity and g-aminobutyric acid (GABA) content in sea tangle fermented by Lactobacillus brevis BJ20 isolated from traditional fermented foods[J]. Food Chem,2010,122:271-276.
[25]陈仪婷,张红星,谢远红,等.降胆固醇乳酸菌的筛选鉴定及其耐酸耐胆盐性能研究[J].食品与发酵工业,2018,44(5):29-33.
[26]MANCINI A,CARAFA I,FRANCIOSI E,et al.In vitro probiotic characterization of high GABA producing strain Lactobacilluas brevis DSM 32386 isolated from traditional"wild"Alpine cheese[J].Ann Microbiol,2019,69:1435-1443.
[27]刘晓飞,宋洁,郑志辉,等.寒地黑土中产γ-氨基丁酸乳酸菌筛选及发酵培养基优化[J].食品工业科技,2019,40(10):122-126,132.
[28]田蕊,萨如拉,段晓霞,等.产γ-氨基丁酸乳酸菌的筛选鉴定及其紫外诱变研究[J].食品工业科技,2018,39(17):128-132.
[29]王兴洁,魏超,廖光敏,等.产γ-氨基丁酸乳酸菌的分离鉴定及发酵条件优化[J].食品与机械,2016,32(7):40-44.
[30]王祎然,韦明明,张涵,等.酸汤中乳酸菌的鉴定及其耐酸、耐胆盐和抗氧化活性[J].食品工业科技,2020,41(16):121-126,139.
[31]胡斌,田丰伟,张灏,等.植物乳杆菌脂肪酸构成与胆盐耐受性的相关性分析[J].中国食品学报,2017,17(9):27-32.
[32]李洋,赵欣,张玉,等.牦牛酸乳中耐酸耐胆盐乳酸菌的分离筛选和鉴定[J].食品与机械,2018,34(7):23-28,33.
[33]云月英,徐娟,张小利.4株乳酸菌对模拟胃肠环境的耐受性及生长特性研究[J].中国酿造,2018,37(3):53-56.
[34]王帅静,李啸,刘玲彦,等.西藏牦牛粪和乳源中益生菌的筛选与鉴定[J].中国酿造,2021,40(7):43-48.
[35]林杨.高产γ-氨基丁酸乳酸菌的选育及其发酵工艺优化[D].乌鲁木齐:新疆农业大学,2021.