葡萄酒富含有维生素、氨基酸、肌醇、花青素等营养成分[1-2],深受大众的喜爱。随着经济全球化发展和人民生活水平的提高,人们对葡萄酒品质的要求也越来越高。苹果酸-乳酸发酵(malolactic fermentation,MLF)是酿造高品质葡萄酒的重要环节,可以降低葡萄酒的酸度,使之不再酸涩和粗糙,口感变得圆润柔和,而且可提高葡萄酒的感官质量和增加微生物稳定性,更重要的是它能够修饰葡萄酒的风味,显著增强葡萄酒的香气品质[3-5]。苹果酸-乳酸发酵一般在酒精发酵结束后启动,但在酒精发酵结束之后,葡萄酒会成为低pH值、高乙醇浓度、高二氧化硫浓度等恶劣环境组成的非生物胁迫环境[6-7]。作为苹果酸乳酸发酵的主要启动者和承担者—酒酒球菌(Oenococcus oeni)在这些恶劣环境下的生长和代谢均会受到抑制,MLF进程也会受到抑制,从而影响葡萄酒的降酸能力,其中乙醇是重要的抑制因子,而酒酒球菌可以耐受这种高乙醇环境,并且较为专一地启动MLF,还能提高葡萄酒的感官品质,因此,它是葡萄酒苹果酸-乳酸发酵过程常用的菌种[6-7]。
葡萄酒的香气是高品质葡萄酒的标志之一,这也与酒酒球菌有着密切联系[8]。具有浓郁香味的萜烯类化合物是葡萄酒香气的主要来源,在葡萄酒中其主要以无味的糖苷结合态存在,β-葡萄糖苷酶可以酶解香气前体物质以增加葡萄酒香气的多样性,而酒酒球菌具有较高的β-葡萄糖苷酶活性,会加速香气前体物的快速分解,对增加葡萄酒香气的多样性意义重大[9]。葡萄酒的恶劣生境,尤其是高浓度的乙醇会对酒酒球菌的糖苷酶活性产生影响[10]。因此,酒酒球菌在葡萄酒恶劣环境下的抗胁迫能力和糖苷酶活性将直接影响苹果酸-乳酸发酵的启动、进行、完成,以及葡萄酒的色泽、口感、香气等感官品质[11]。所以,培育出耐受高浓度乙醇的酒酒球菌对于酿造香气独特的高品质葡萄酒至关重要。
酒酒球菌(Oenococcus oeni)SD-2a是西北农林科技大学葡萄酒学院自行选育的1株优良酒酒球菌,具有较强的耐乙醇能力,能耐受乙醇体积分数10%[12]。目前,研究较多的是低pH、高浓度乙醇、高浓度二氧化硫对酒酒球菌生理特性的影响及耐受机制,但对如何培育和筛选出耐高浓度乙醇的酒酒球菌却鲜有报道[13]。紫外线(ultraviolet,UV)是有效的诱变剂,其可以提高菌体突变率且操作简单可行,工业上用这种方法选育了许多优良生产菌株。因此,本研究以酒酒球菌(Oenococcus oeni)SD-2a为出发菌株,通过紫外诱变处理,经过多代的乙醇胁迫适应性培养,筛选获得正向突变菌株,并评价其不同胁迫条件下的生长情况、β-葡萄糖苷酶活性、模拟酒条件下苹果酸、乳酸含量及活菌数的变化,以期为国产葡萄酒产业积累优良菌种资源,促进国产葡萄酒工业发展。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酒酒球菌(Oenococcus oeni)SD-2a:由西北农林科技大学葡萄酒学院从山东烟台自然发酵葡萄酒中分离出的一株具有良好的苹果酸-乳酸发酵性能的菌株;对照菌株L-450(LACTOENOS 450 PreAc):法国LAFFORT公司。
450 PreAc):法国LAFFORT公司。
1.1.2 试剂
苹果酸、乳酸(均为色谱纯)、对硝基苯-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,pNPG)(分析纯):上海源叶生物科技有限公司;盐酸半胱氨酸(分析纯):北京索莱宝科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
ATB液体培养基[14-15]:蛋白胨10 g,葡萄糖10 g,酵母浸出粉5 g,MgSO4·7H2O 0.2 g,MnSO4·4H2O 0.05 g,盐酸半胱氨酸0.5 g,番茄汁250 mL,蒸馏水750 mL,pH 4.8,121 ℃高压蒸汽灭菌20 min。ATP固体培养基:将ATB液体培养基pH调节至5.0,添加1.5%的琼脂。
模拟酒培养基[14]:葡萄汁10 mL,L-苹果酸3 g,D-葡萄糖2 g,D-果糖2 g,CaCl2 0.13 g,KCl 0.45 g,(NH4)2SO4 1 g,CH3COONa 2 g,KH2PO4 0.6 g,MgSO4·7H2O 0.2 g,MnSO4 0.05 g,酵母浸出粉4 g,蒸馏水990 mL,pH 3.8。110 ℃高压蒸汽灭菌10 min,待模拟酒培养基温度降至室温水平再添加100 mL无水乙醇。
1.2 仪器与设备
Icount全自动菌落计数仪:杭州迅数科技有限公司;ST16R型离心机:赛默飞世尔科技(中国)有限公司;T6紫外可见分光光度计:北京普析通用仪器有限责任公司;FE20实验室pH计:梅特勒-托利多仪器(上海)有限公司;GI80DWS高压蒸汽灭菌锅:致微(厦门)仪器有限公司;1220高效液相色谱(high performance liquid chromatography,HPLC)仪:安捷伦科技有限公司;JY96-IIN超声波细胞粉碎仪:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 酒酒球菌SD-2a的活化
吸取甘油保藏的酒酒球菌SD-2a 100 μL接种到ATB液体培养基中,26 ℃恒温培养2 d,转接一次,监测OD600nm值,培养至对数生长期(OD600nm值约为1)即得到活化好的菌液。
1.3.2 酒酒球菌SD-2a的紫外诱变处理
取活化好的菌液,在紫外灯下分别照射45 s、50 s、55 s、60 s、65 s、70 s、75 s、80 s、85 s、90 s,平板与紫外灯距离为20 cm,紫外照射完毕,按10倍梯度稀释至10-5,取稀释液在无菌避光操作条件下涂布于ATB固体培养基上,于26 ℃避光培养4 d[16],对平板上生长的单菌落进行菌落计数[17],根据诱变菌株在平板上的单菌落数与出发菌株在平板上的单菌落数之比,得出致死率。
选择致死率在80%~90%对应的照射时间进行紫外诱变,诱变完成后,吸取诱变后的菌液1 mL于含有体积分数14%乙醇的ATB液体培养基中,26 ℃条件下静置培养7 d作为种子液。将种子液按2%(V/V)的接种量转接到含有体积分数14%乙醇的ATB液体培养基中,26 ℃静置培养7 d,此为第二代,以此类推,共转接五代,对突变菌群进行乙醇胁迫适应性定向筛选,以提高获得乙醇胁迫耐受菌株的概率。
1.3.3 突变菌株的分离及纯化
取转接五代的菌液,按10倍梯度稀释至10-5,取稀释度为10-3、10-4、10-5的稀释液涂布于ATB固体平板上,26 ℃静置培养7 d。长出单菌落后,挑选三个长势较好的单菌落,进一步的划线纯化,获得突变菌株。
1.3.4 不同体积分数乙醇胁迫下酒酒球菌生长曲线的绘制
测定出发菌株和突变菌株种子液的OD600nm值,通过稀释或浓缩调整OD600nm值,获得相同的初始接种量,以2%(V/V)的接种量分别接种到含体积分数为10%、12%、14%乙醇的ATB液体培养基中,每个处理做3个平行,26 ℃静置培养216 h,每隔12 h测一次OD600nm值,以培养时间为横坐标,以OD600nm值为纵坐标,绘制生长曲线,以此反应突变菌株与出发菌株对乙醇胁迫的耐受性。
1.3.5 β-葡萄糖苷酶活性的测定
配制浓度为10~60 μmol/L的对硝基苯酚(p-nitrophenol,pNP)溶液,测定OD400nm值,以pNP浓度(x)为横坐标,OD400nm值(y)为纵坐标绘制标准曲线。
以出发菌株SD-2a和商业菌株L-450为对照,吸取活化好的菌液各1 mL,4 ℃条件下8 000 r/min离心2 min,弃上清,采用0.85%的生理盐水洗涤菌体沉淀两次,留菌体沉淀,加入0.5 mL 0.85%的生理盐水,再加入0.5 mL柠檬酸磷酸缓冲溶液(pH 5.0)配制的5 mmol/L对硝基苯-β-D-吡喃葡萄糖苷(pNPG),混合,在37 ℃条件下反应1 h,立即加入2 mL的1 mol/L Na2CO3溶液终止反应,4 ℃条件下8 000 r/min离心15 min,转移上清液至另一试管中,利用紫外分光光度计测定OD400nm值,按照标准曲线回归方程计算酶活[9-10,18]。对照样品用0.85%的生理盐水代替菌悬液制备空白样品,其他处理与样品相同。
β-葡萄糖苷酶酶活定义:以pNPG为底物,每克菌体(干质量)每分钟水解该底物生成pNP的量为一个酶活力单位,单位为U/g。
1.3.6 模拟酒发酵
测定出发菌株和突变菌株种子液的OD600nm值,通过稀释或浓缩调整OD600nm值,获得相同的初始接种量,以2%(V/V)的接种量分别接种到模拟酒培养基中,18 ℃静置培养8 d。
1.3.7 苹果酸消耗量和乳酸生成量的测定
分别在发酵0 d、2 d、4 d、6 d、8 d时取模拟酒液500 μL,4 ℃条件下12 000 r/min离心2 min,取上清液,采用高效液相色谱法检测苹果酸及乳酸的含量。
高效液相色谱条件:安捷伦ZORBAX SB-Aq色谱柱(4.6 mm×150 mm,5 μm),流动相为1%甲醇,99%磷酸盐缓冲液(pH 2.8),流速1 mL/min,柱温35 ℃,检测波长210 nm[19-20]。
定性定量方法:根据标准品保留时间进行定性,采用外标法定量。
1.3.8 存活率的测定
分别在发酵0 d、2 d、4 d、6 d、8 d时取模拟酒样500 μL,用0.9%生理盐水按10倍梯度稀释到10-6,取稀释液5 μL点接于ATB固体培养基上,26 ℃静置培养4~5 d,长出单菌落后,利用菌落计数器拍照,参照文献[21]进行菌落计数并计算存活率。
1.3.9 数据处理
采用SPSS statistic 20对数据进行统计学分析,使用Illustrator CC 2018与OriginPro 8.5进行绘图。
2 结果与分析
2.1 最佳紫外诱变时间的确定
紫外照射后,酒酒球菌SD-2a的致死曲线见图1。由图1可知,当紫外诱变时间为65 s、70 s时,致死率分别为85%、87%,致死率在80%~90%之间,因此,选定65 s为最佳诱变时间。
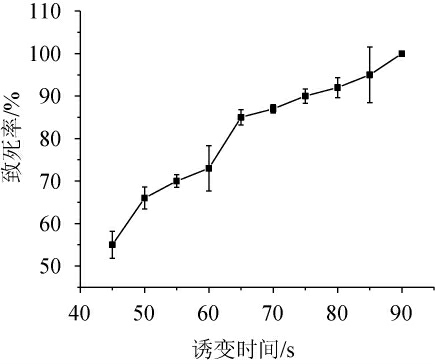
图1 紫外照射后酒酒球菌SD-2a的致死曲线
Fig.1 Death curve of Oenococcus oeni SD-2a after UV irradiation
2.2 突变菌株的分离纯化
选择65 s作为诱变时间,对活化好的SD-2a进行紫外诱变,诱变后进行乙醇胁迫适应性定向筛选,共转接五代,取第五代菌液进行稀释涂布,在平板上挑取3个单菌落,分别命名为UVe1、UVe2、UVe3,划线纯化后进行后续试验。
2.3 不同体积分数乙醇胁迫条件下酒酒球菌的生长曲线
不同体积分数乙醇胁迫条件下酒酒球菌SD-2a及其3株突变菌株的生长曲线见图2。
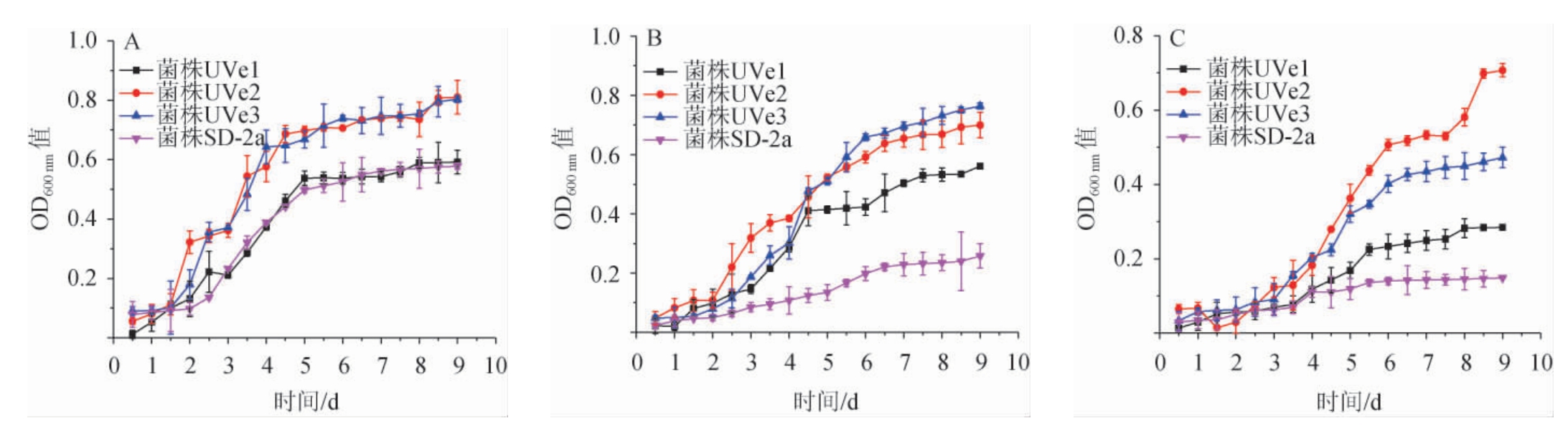
图2 不同体积分数乙醇胁迫条件下酒酒球菌SD-2a及其3株突变菌株的生长曲线
Fig.2 Growth curves of Oenococcus oeni SD-2a and 3 mutant strains under different volume fraction ethanol stress
A:乙醇体积分数为10%;B:乙醇体积分数为12%;C:乙醇体积分数为14%。
由图2A可知,在体积分数10%的乙醇条件下,突变菌株UVe2和UVe3的生长状况均显著优于出发菌株(P<0.05),突变菌株UVe1的生长情况与出发菌株无显著差异(P>0.05)。在到达稳定期(9 d)时,突变菌株UVe2和UVe3的OD600nm值(0.810和0.803)是出发菌株(0.578)的1.40倍和1.39倍,表现出了较强的乙醇胁迫耐受性。
由图2B和2C可知,在体积分数12%和14%乙醇的胁迫条件下,突变菌株UVe1、UVe2、UVe3的生长速度均显著优于出发菌株SD-2a(P<0.05)。在乙醇体积分数12%的胁迫条件下,到达稳定生长期(9 d)时,突变菌株UVe1、UVe2和UVe3的OD600nm值(0.561、0.699和0.764)分别是出发菌株(0.258)的2.18倍、2.71倍和2.97倍;在乙醇体积分数14%的胁迫条件下,到达稳定生长期(9 d)时,突变菌株UVe1、UVe2和UVe3的OD600nm值(0.284、0.707和0.472)分别是出发菌株(0.149)的1.89倍、4.72倍和3.16倍。因此,在高乙醇体积分数条件下,突变菌株拥有更强的乙醇胁迫耐受性,且突变菌株UVe2和UVe3的乙醇胁迫耐受性更好。
2.4 β-葡萄糖苷酶活性的测定
β-葡萄糖苷酶是结合态香气物质产生的关键酶,其可以裂解葡萄酒中链烷醇和烯醇、莽草酸衍生物等风味活性苷元物质的糖苷键,糖苷中的糖苷配基将被释放来增强葡萄酒香气[8]。以出发菌株SD-2a和商业菌株L-450为对照菌株,突变菌株的β-葡萄糖苷酶活力见图3。由图3可知,3株突变菌株的β-葡萄糖苷酶活性显著高于对照菌株L-450(P<0.05),其中突变菌株UVe2的β-葡萄糖苷酶活性最高(1.07 U/g),显著高于出发菌株SD-2a(0.92 U/g)(P<0.05),是出发菌株SD-2a的1.16倍,对照菌株L-450的1.55倍;突变菌株UVe3的β-葡萄糖苷酶活性(0.99 U/g)与出发菌株SD-2a无显著差异(P>0.05);突变菌株UVe1的β-葡萄糖苷酶活性(0.87 U/g)显著低于出发菌株SD-2a(P<0.05)。
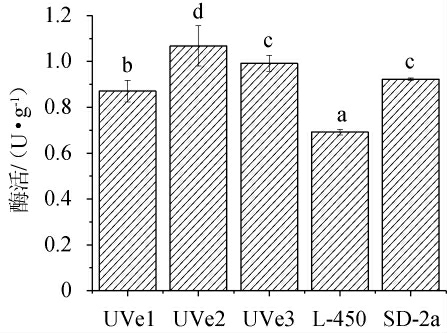
图3 酒酒球菌SD-2a及其3株突变菌株的β-葡萄糖苷酶活性
Fig.3 β-glucosidase activities of Oenococcus oeni SD-2a and 3 mutant strains
不同字母表示差异显著(P<0.05)。下同。
2.5 模拟酒条件下酒酒球菌的发酵性能
2.5.1 苹果酸和乳酸含量的变化
苹果酸-乳酸发酵是酿造葡萄酒过程中的关键环节,是指在乳酸菌作用下将L-苹果酸脱羧基形成L-乳酸的过程,整个过程苹果酸含量会下降,乳酸含量会上升,葡萄酒的口感会由尖锐变得柔和[22-23]。酒酒球菌在模拟酒培养基中苹果酸和乳酸含量的变化见图4。
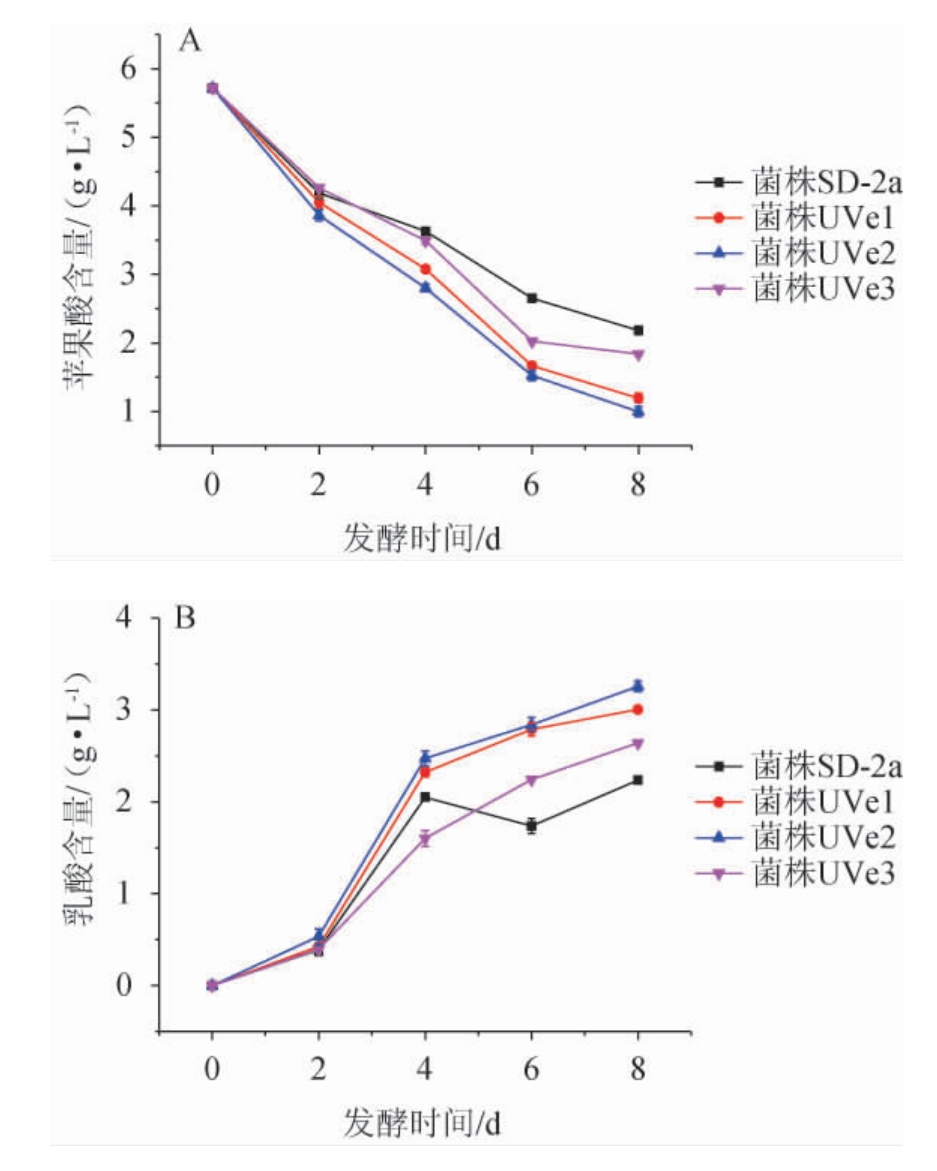
图4 酒酒球菌SD-2a及其3株突变菌株在模拟酒培养基中苹果酸和乳酸含量的变化
Fig.4 Changes of malic acid and lactic acid contents in simulated wine medium of Oenococcus oeni SD-2a and 3 mutant strains
由图4A可知,在模拟酒环境下,突变菌株UVe1、UVe2和UVe3的苹果酸降解速度显著高于出发菌株SD-2a,在发酵第8天时,苹果酸含量分别是出发菌株的0.55倍、0.46倍和0.84倍。由图4B可知,突变菌株UVe1、UVe2和UVe3的乳酸生成速度显著高于出发菌株SD-2a,这与突变菌株的苹果酸降解速度对应,在第8天时,乳酸含量分别是出发菌株的1.34倍、1.46倍和1.18倍。苹果酸乳酸酶是苹果酸-乳酸发酵过程中的关键酶[11],其活性将会影响菌株L-苹果酸降解速率,突变菌株可能增强了苹果酸乳酸酶活性,使之苹果酸-乳酸发酵能力更强。
2.5.2 存活率
葡萄酒发酵是一个相对漫长的过程,此过程中菌株的存活情况对苹果酸-乳酸发酵的启动与顺利进行十分重要[24],较强的存活能力也是培育优良商业菌株所必需的特性[25-27]。发酵过程中,酒酒球菌在模拟酒培养基中存活率的变化见图5。由图5可知,在初始接种量一致的情况下,三种突变菌株及出发菌株在0~8 d的存活率普遍较高,在发酵第2天时,突变菌株UVe1与出发菌株SD-2a的存活率无显著差异(P>0.05),突变菌株UVe2的存活率显著低于出发菌株SD-2a(P<0.05),突变菌株UVe3的存活率是出发菌株的3.9倍;在第4天和第6天时,所有突变菌株的存活率均显著高于出发菌株(P<0.05),其中存活率从高到低分别为菌株UVe1、UVe2、UVe3;在第8天时,突变菌株UVe1和UVe2的存活率显著高于出发菌株SD-2a(P<0.05),分别是出发菌株的5.0倍和3.3倍,突变菌株UVe3与出发菌株SD-2a无显著差异(P>0.05)。综上,突变菌株UVe1和UVe2的胁迫适应性更强,在葡萄酒发酵的环境中更易存活,可以更好地进行苹果酸-乳酸发酵,突变菌株UVe1和UVe2具有成为优良商业酒酒球菌的潜力。
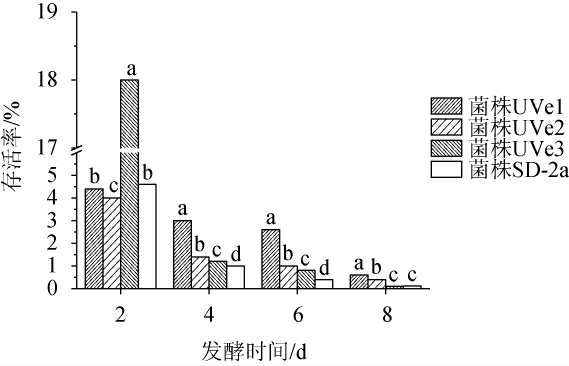
图5 酒酒球菌SD-2a及其3株突变菌株在模拟酒培养基中存活率的变化
Fig.5 Changes of survival rates of Oenococcus oeni SD-2a and 3 mutant strains in simulated wine
3 结论
酒酒球菌SD-2a经过紫外诱变处理和乙醇胁迫适应性培养后,筛选获得了3株乙醇胁迫耐受突变菌株,分别为UVe1、UVe2、UVe3,在高体积分数乙醇(12%和14%)胁迫环境下,3株突变菌株的生长速度均显著高于出发菌株SD-2a(P<0.05);突变菌株UVe2的β-葡萄糖苷酶活性显著高于出发菌株SD-2a和对照菌株L-450(P<0.05);在模拟酒培养基中,3株突变菌株的苹果酸降解与乳酸生成速度均显著高于出发菌株SD-2a(P<0.05),且突变菌株UVe1和UVe2的存活率显著高于出发菌株SD-2a(P<0.05);综上,突变菌株UVe2具有优良商业酒酒球菌的潜力。
[1]文向圆,原雨欣,余东亮,等.诱变酒酒球菌中抗酸候选基因ATPase和FtsH的表达差异分析及功能验证[J].中国食品学报,2021,21(1):215-224.
[2]袁林,赵红玉,刘龙祥,等.苹果酸-乳酸发酵对葡萄酒中活性成分的影响[J].食品工业科技,2020,41(7):358-364.
[3]王婧,高娉娉,田秀,等.粟酒裂殖酵母与酿酒酵母顺序接种发酵对干红葡萄酒品质的影响[J].食品与发酵工业,2021,47(9):84-90.
[4]谢昉书.诱变酒酒球菌菌株苹果酸-乳酸发酵及其对葡萄酒香气的影响[D].杨凌:西北农林科技大学,2018.
[5]谢昉书,文向圆,刘树文.酒酒球菌(Oenococcus oeni)耐酸突变株苹果酸-乳酸发酵能力分析[J].食品科学,2019,40(2):93-101.
[6]李莹莹,刘叶.葡萄酒乳酸菌发酵剂研究进展[J].酿酒科技,2016(11):100-103.
[7]赵现华,李翠霞,李华.共发酵对蛇龙珠葡萄酒发酵动力学和香气成分的影响[J].中国酿造,2019,38(7):48-53.
[8]LUCIANA D V R,CARMEN M,MARÍA J R,et al.Utilization of Oenococcus oeni strains to ferment grape juice:Metabolic activities and beneficial health potential[J].Food Microbiol,2022,101:103895.
[9]ZHANG J,ZHAO N,XU J,et al.Homology analysis of 35 β-glucosidases in Oenococcus oeni and biochemical characterization of a novel β-glucosidase BGL0224[J].Food Chem,2021,334:127593.
[10]ZHANG J,WANG T,ZHAO N,et al.Performance of a novel β-glucosidase BGL0224 for aroma enhancement of Cabernet Sauvignon wines[J].LWT-Food Sci Technol,2021,144(7):111244.
[11]陈其玲,任晓宁,王玲,等.酒酒球菌β-葡萄糖苷酶活性与耐酸胁迫能力的相关性分析[J].食品科学,2017,38(2):115-120.
[12]李莹莹,苏静,杨世玲,等.直投式酒酒球菌SD-2a发酵剂对葡萄酒品质的影响[J].西北农林科技大学学报(自然科学版),2016,44(12):192-200.
[13]苏静.高抗氧化活性酒酒球菌的筛选及提升葡萄酒品质的研究[D].杨凌:西北农林科技大学,2016.
[14]曹颖,郑玉娟,刘龙祥,等.葡萄酒苹果酸-乳酸发酵优良菌株的筛选与发酵性能分析[J].食品研究与开发,2021,42(11):138-144.
[15]CHEN Q,YANG X,MENG Q,et al.Integrative multiomics analysis of the acid stress response of Oenococcus oeni mutants at different growth stages[J]. Food Microbiol,2022,102:103905.
[16]刘堂浩,李由然,张梁,等.高通量筛选高产酪氨酸的酿酒酵母菌株[J].生物工程学报,2021,37(9):3348-3360.
[17]LIU X D,LUO Y T,LI Z F,et al.Role of exopolysaccharide in salt stress resistance and cell motility of Mesorhizobium alhagi CCNWXJ12-2T[J].Appl Microbiol Biot,2017,101(7):2967-2978.
[18]ZHANG J,ZHAO N,XU J,et al.Exploring the catalytic mechanism of a novel β-glucosidase BGL0224 from Oenococcus oeni SD-2a:Kinetics,spectroscopic and molecular simulation[J]. Enzyme Microb Technol,2021,148:109814.
[19]莫润明,林海燕,陈金发,等.陈香型铁观音陈化过程中特征有机酸变化分析[J].食品研究与开发,2021,42(20):21-27.
[20]WANG P X,LI A X,DONG M,et al.Induction,purification and characterization of malolactic enzyme from Oenococcus oeni SD-2a[J].Eur Food Res Technol,2014,239(5):827-835.
[21]IWATA H,KOBAYASHI Y,MIZUSHIMA D,et al.Complementary function of two transketolase isoforms from Moniliella megachiliensis in relation to stress response[J].AMB Expr,2017,7:45.
[22]IÑAKI D O,MARÍA L,FÉLIX A.Effect of inoculation strategy with autochthonous Oenococcus oeni strains on aroma development in Rioja Alavesa Tempranillo wines[J]. LWT-Food Sci Technol,2022,162:113399.
[23]DEVI A,ANU-APPAIAH K A,LIN T F.Timing of inoculation of Oenococcus oeni and Lactobacillus plantarum in mixed malo-lactic culture along with compatible native yeast influences the polyphenolic,volatile and sensory profile of the Shiraz wines[J].LWT-Food Sci Technol,2022,158:113130.
[24]赵红玉,李华,刘龙祥,等.酒酒球菌胁迫适应性机制的研究进展[J].中国食品学报,2019,19(7):292-299.
[25]PENG S,LIU L X,ZHAO H Y,et al.Selection and validation of reference genes for quantitative real-time PCR normalization under ethanol stress conditions in Oenococcus oeni SD-2a[J].Front Microbiol,2018,9:892.
[26]YUAN L,ZHAO H Y,LIU L X,et al.Heterologous expression of the puuE from Oenococcus oeni SD-2a in Lactobacillus plantarum WCFS1 improves ethanol tolerance[J].J Basic Microb,2019,59:1134-1142.
[27]ZHAO H Y,LIU L X,PENG S,et al.Heterologous expression of argininosuccinate synthase from Oenococcus oeni enhances the acid resistance of Lactobacillus plantarum[J].Front Microbiol,2019,10:1393.