酱香型白酒作为我国12大香型白酒之一,其酿造工艺最复杂,生产周期最长,参与发酵的微生物种类最多,而且酒体内涵丰富、醇厚,风味独特,酱香突出,回味悠长,越来越受到消费者的青睐[1-2]。酱香型白酒是以高粱为原料,以大曲为糖化发酵剂[3-4],经两次投料,九次蒸煮,八次发酵,七次取酒,长时间贮藏,精心勾兑而成[5]。在烤出来的七个轮次的酒中,第1轮次酒称为糙沙酒,生涩味重但产量较多;第2轮次酒称为回沙酒,醇和略有涩味,产量为7个轮次最多[6-7];第3~5轮次的酒称为大回酒,其酱香味明显,酒体丰满,产量较高[8-9];第6轮次的酒称为小回酒,小回酒醇和,糊香好,味长,产量较低。第7轮次的酒称为丢糟酒,丢糟酒醇和、有糊香,但味苦、槽味较大,产量是7个轮次中最低的[10-11]。众所周知,酱香型白酒成品酒是由7个轮次的基酒按一定比例勾兑、储藏而成。所以,轮次酒品质的优劣直接决定成品酒品质的高低[12-13]。
酱香型白酒各轮次基酒特点和品质各不相同,这与其不同轮次发酵过程中的温度、湿度、微生物等因素不同有关。但是目前对于酱香型白酒发酵过程研究多集中在对于某一或某几轮次酒醅中微生物研究以及轮次酒的风味物质研究。如胡峰等[14]采用了高通量测序揭示在下沙和糙沙期间,细菌优势菌属均为乳酸菌、乳酸杆菌属、片球菌属、魏斯氏菌属。唐维川等[15]通过气相色谱法(gas chromatography,GC)定量检测白酒中的风味化合物,结果显示,前两个轮次的轮次酒中乙酸、乙酸乙酯和正丙醇含量极高,分别占14.77%~15.55%、14.16%~22.90%、37.78%~37.98%。而对于轮次酒的研究多集中在风味物质、感官分析方面[16-17],如孟望霓等[18]通过气质联用(gas chromatography-mass spectrometry,GC-MS)测定不同轮次酒样中的风味化合物,发现不同轮次所酿造基础酒的风味化合物总量的变化趋势以3轮次酿造为转折点,1、2轮次基酒先升后降,3轮次基酒又上升。
君丰大曲酱香型白酒是以酱香型白酒传统“12987”工艺酿制而成,但是目前对于酱酒型白酒轮次出窖酒醅特性研究尤其是关于君丰大曲酱香出窖酒醅特性研究较少,同时目前对于酱香型白酒的发酵过程研究多集中在某一轮次的理化、风味或者微生物的研究,但是关于酱香型白酒整个生产周期追踪以及对于其轮次酒醅理化、微生物结构、风味以及相关性研究较少[19-20]。因此,本研究对君丰大曲酱香白酒七个轮次出窖酒醅及各轮次基酒进行全程跟踪,采用中国酒业协会团体标准T/CBJ 004—2018《固态发酵酒醅通用分析方法》、气相色谱-火焰离子化检测器(gas chromatography-flame ionization detector,GC-FID)、离子色谱(ion chromatography,IC)分析技术和高通量测序技术对出池酒醅的理化性质、挥发性风味物质以及微生物群落结构进行解析,并建立三者之间的相关性,系统阐释酱香型白酒出池酒醅特性(理化性质、微生物菌群)与风味物质之间的关联性,这对于酱香型白酒产量及品质的提升以及推动酱香型白酒智能化酿造具有重要指导意义。
1 材料与方法
1.1 材料与试剂
酱香型白酒第1~7轮次出窖酒醅及轮次基酒:贵州酣客君丰酒业有限公司。
TIANamp Bacteria 脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;氢氧化钠、葡萄糖、盐酸、酒石酸钾钠、硫酸铜(均为分析纯):北京化工厂有限责任公司;甲醇、苯乙醇、丙二醇、丁二醇、糠醛、苯甲醛、丁酸、己酸、乳酸乙酯、乙酸乙酯、己酸乙酯等标准品(均为色谱纯):美国Sigma-Aldrich公司。
1.2 仪器与设备
ICS-3000离子色谱分析仪(配EG40淋洗液自动发生器、电导检测器和Chromeleon 6.80色谱工作站):美国DIONEX公司;Clarns 600气相色谱仪(配火焰离子检测器(flame ionization ditector,FID)):美国Perkin Elmer公司;Agilent-1260高效液相色谱分析仪:美国Agilent公司;KQ100-DE超声波清洗器:昆山市超声仪器有限公司;ABI GeneAmpR9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;DYY-8C电泳仪:北京六一仪器厂。
1.3 实验方法
1.3.1 酒醅的取样方法
酒醅:在准备出池的酒窖中,按照五点取样法,分别在窖面、窖中、窖底三层,每层各设5个取样点,共计15个取样位点进行样品收集,充分混合后作为此轮次出窖酒醅,保存4 ℃冰箱,用于后续的理化和微生物高通量测序分析。
1.3.2 酒醅的理化指标分析
水分、酸度、淀粉和还原糖含量:根据中国酒业协会团体标准T/CBJ 004—2018《固态发酵酒醅通用分析方法》检测[21]。
1.3.3 酒醅中微生物菌群基因组DNA的提取及高通量测序
(1)总DNA 的提取[14]
称取不同类型酒醅5 g用液氛速冻后迅速研磨。酒醅总DNA提取方法按照土壤DNA提取试剂盒(E.Z.N.A.Soil DNA Kit)操作说明书。
(2)PCR扩增
为了保证所提取的基因组的浓度及纯度,对其进行PCR扩增及产物纯化,对细菌16S rRNA基因的V3-V4高变区进行PCR扩增,所用引物338F/806R(5'-ACTCCTACGGGAGGCAGCA-3'/55'-GGACTACHVGGGTWTCTAAT-3');对真菌的内部转录间隔区(ITS1)进行扩增,所用引物为ITS5F/ITS1R(5'-GGAAGTAAAAGTCGTAACAAGG-3'/5'-GCTGCGTTCTTCATCGATGC-3')。扩增后用1%琼脂糖凝胶电泳进行检测。PCR扩增体系(50 μL):模板DNA 1 μL,上下游引物各1 μL,2×Taq PCR Master Mix 25 μL,双蒸水22 μL。PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸45 s,30个循环;72 ℃再延伸10 min。
(3)Illumina MiSeq测序
将检测合格样品送往天津诺和致源生物信息科技有限公司,通过高通量测序(Illumina Miseq PE250)平台进行高通量测序。
1.3.4 轮次酒中挥发性化合物分析[15]
轮次酒中挥发性化合物分析采用GC-FID 法。
GC条件:CP-WAX 57 CB毛细管柱(50 m×0.25 mm×0.2 μm),升温程序:起始温度35 ℃,恒温6 min;以4 ℃/min升温至60 ℃;以6 ℃/min程序升温至110 ℃,恒温3 min,以6 ℃/min程序升温至205 ℃,恒温13 min。进样量1 μL;载气为高纯氮气(N2),流速1 mL/min,分流比10∶1;氢气(H2)流速为45 mL/min;空气流速为450 mL/min;检测器温度270 ℃;进样器温度240 ℃。
定性方法:采用外标法定性。定量方法:采用内标法半定量风味物质含量,内标物选用叔戊醇(1%)、乙酸正丁酯(1%)、2-乙基丁酸(1%)。
1.3.5 数据分析
实验样品均进行3次平行实验,结果采用Excel 2016绘制不同轮次酒醅理化指标图和主要风味物质图,利用SPSS24.0进行斯皮尔曼相关性分析,气泡图采用GephiV0.92版本绘制。
2 结果与分析
2.1 酱香型白酒各轮次基酒出窖酒醅理化指标的变化规律
2.1.1 酱香型白酒各轮次酒醅水分变化规律
在白酒的酿造过程中,酒醅的水分含量至关重要。若水分含量过高,则酒醅中的好氧性微生物的生长繁殖受到抑制,会使得酒醅的透气性差,容易造成酸败;若酒醅中水分含量过低,则会不利于微生物的生长代谢活动。由图1可知,酒厂窖池出窖酒醅的水分含量在40%~60%之间,其变化趋势为:第1~3轮次酒醅水分含量不断增加,分析认为这是人为控制的结果,为了保证出酒率;第3~5轮次酒醅水分含量有所下降,分析认为这是人为控制的结果,保证3~5轮次可以出好酒;第5~6轮酒醅水分含量增加,并在第6轮酒醅水分含量达到最高,第6~7轮酒醅水分含量略微下降,分析认为这是因为此时淀粉被逐渐消耗造成水分含量略有回升[22]。
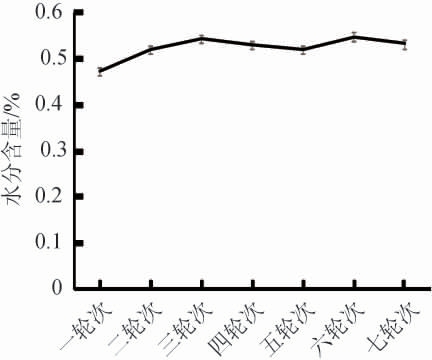
图1 不同轮次基酒出窖酒醅水分含量的变化
Fig.1 Changes of moisture contents in unloading pit fermented grains of different rounds base liquor
2.1.2 酱香型白酒各轮次酒醅酸度变化规律
在白酒的酿造过程中,酒醅的酸度同样作为重要指标来反映发酵情况,适宜的酸度有利于酒醅的糖化、糊化过程,有利于微生物正常的生长代谢,防止杂菌污染,有利于酒质品质的提升。本实验采用酸碱滴定法测定了不同轮次中的酱香型白酒中的酸度并分析其变化,如图2所示。
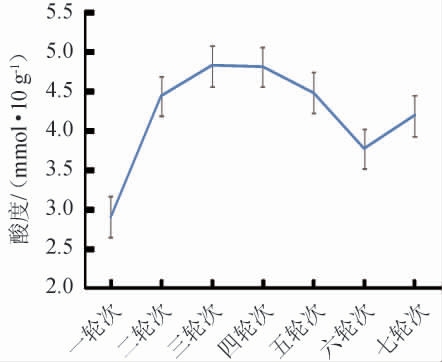
图2 不同轮次基酒出窖酒醅酸度变化
Fig.2 Changes of acidity in unloading pit fermented grains of different rounds base liquor
由图2可知,酒厂出窖酒醅的酸度的变化趋势为:第1~3轮次酒醅酸度不断增加,最高值达到4.83 mmol/10 g,这可能是因为刚开始的时候,酒醅中酵母菌、醋酸菌这些生酸微生物的含量较多,并且占优势,这些生酸微生物在生长繁殖过程中易产生乙酸等酸类物质,造成出窖酒醅的酸度不断升高;第3~4轮次酒醅酸度平稳,此时的产酸微生物的数量和产酸能力处于平衡状态;第4~6轮次酒醅酸度有所下降,第6~7轮次酒醅酸度上升,分析认为这与此时醋酸菌的数量及产酸能力有关[23]。
2.1.3 酱香型白酒各轮次酒醅还原糖含量变化规律
在白酒的酿造过程中,还原糖的含量反映了酒醅的糖化速度和发酵速度间的动态平衡情况。如图3所示,酒厂出窖酒醅的还原糖含量的变化趋势为:第1~4轮次酒醅还原糖含量不断增加,并在第4轮酒醅中还原糖含量达到最高,最高值为2.38 g/100 g,分析认为可能是因为前期主要进行糖化酶产生菌的富集,糖化酶产生菌将淀粉转化为还原糖,所以还原糖含量逐渐增高;第4~7轮酒醅还原糖含量总体有所下降(5轮次与6轮次之间有个略微回升的趋势),分析认为此时酒醅微生物生长代谢消耗还原糖的速度相对较快[24]。
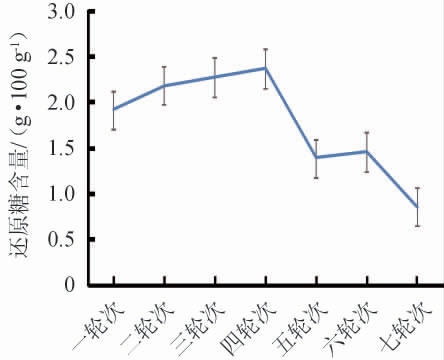
图3 不同轮次基酒出窖酒醅还原糖含量变化
Fig.3 Changes of reducing sugar contents in unloading pit fermented grains of different rounds base liquor
2.1.4 酱香型白酒各轮次酒醅淀粉含量变化规律
在白酒的酿造过程中,淀粉是微生物生长繁殖的主要来源,而且淀粉的含量与出酒率之间呈正比。如图4所示,酒厂出窖酒醅淀粉含量整体呈现逐渐降低趋势,开始的时候,淀粉的含量很高,但是随着轮次的推移,微生物的数量逐渐增多,越来越多的淀粉需要转化成还原糖供微生物消耗。越到后期,淀粉含量的下降速率越慢,这是因为在前期,可以利用的淀粉已经逐渐被转化为还原糖被消耗掉,后期不可利用的变性淀粉所占的比例越来越高造成淀粉的消耗速率减慢[25]。
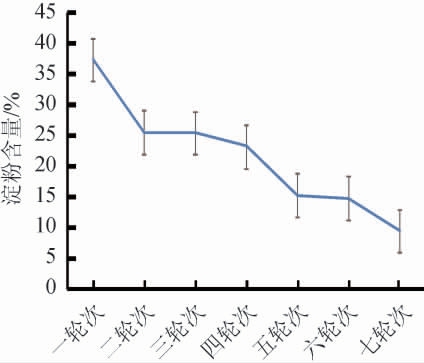
图4 不同轮次基酒出窖酒醅淀粉含量变化
Fig.4 Changes of starch contents in unloading pit fermented grains of different rounds base liquor
2.2 酱香型白酒各轮次酒醅微生物变化规律
进一步对茅台地区大曲酱香白酒酒醅的微生物群落结构进行研究,结果见图5。由图5a可知,在轮次酒醅中细菌属水平上,乳酸杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、海洋芽孢杆菌属(Oceanobacillus)、unidentified_Mitochondria、克罗彭斯特菌属(Kroppenstedtia)等为相对优势细菌属,其中Lactobacillus为第1轮次优势菌属,其相对丰度高达81.6%,占据主导地位,其次是片球菌属(Pediococcus),相对丰度达到5.3%,第2轮次优势菌属为Acetobacter、unidentified_Mitochondria、Kroppenstedtia、Lactobacillus等;第3轮次Bacillus相对丰度最高,为42.2%,其次是Oceanobacillus(13.4%)和Kroppenstedtia(8.1%)等菌属;第4轮次酒醅细菌属中,Oceanobacillus、unidentified_Mitochondria的相对丰度较高,分别为19.6%、13.1%;unidentified_Mitochondria在第5轮次酒醅中有较高的相对丰度,为3.8%;第6轮次酒醅的优势细菌属为Ralstonia、unidentified_Mitochondria,分别达到46.5%和16.0%;在第7轮次检出的细菌属中,unidentified_Mitochondria的相对丰度最高,达到了21.9%。整体而言,Lactobacillus整体随着轮次逐渐降低,unidentified_Mitochondria与之相反,整体呈现逐渐增加的趋势,尤其是3轮次后,此时烤酒一般处于夏季,可以推断出夏季更适合unidentified_Mitochondria的生长。另外,Bacillus、Oceanobacillus、Kroppenstedtia随着轮次呈现先增后降趋势,在第3、4轮次具有较高的相对丰度,这可能是酿造品质较好轮次酒的微生物基础。
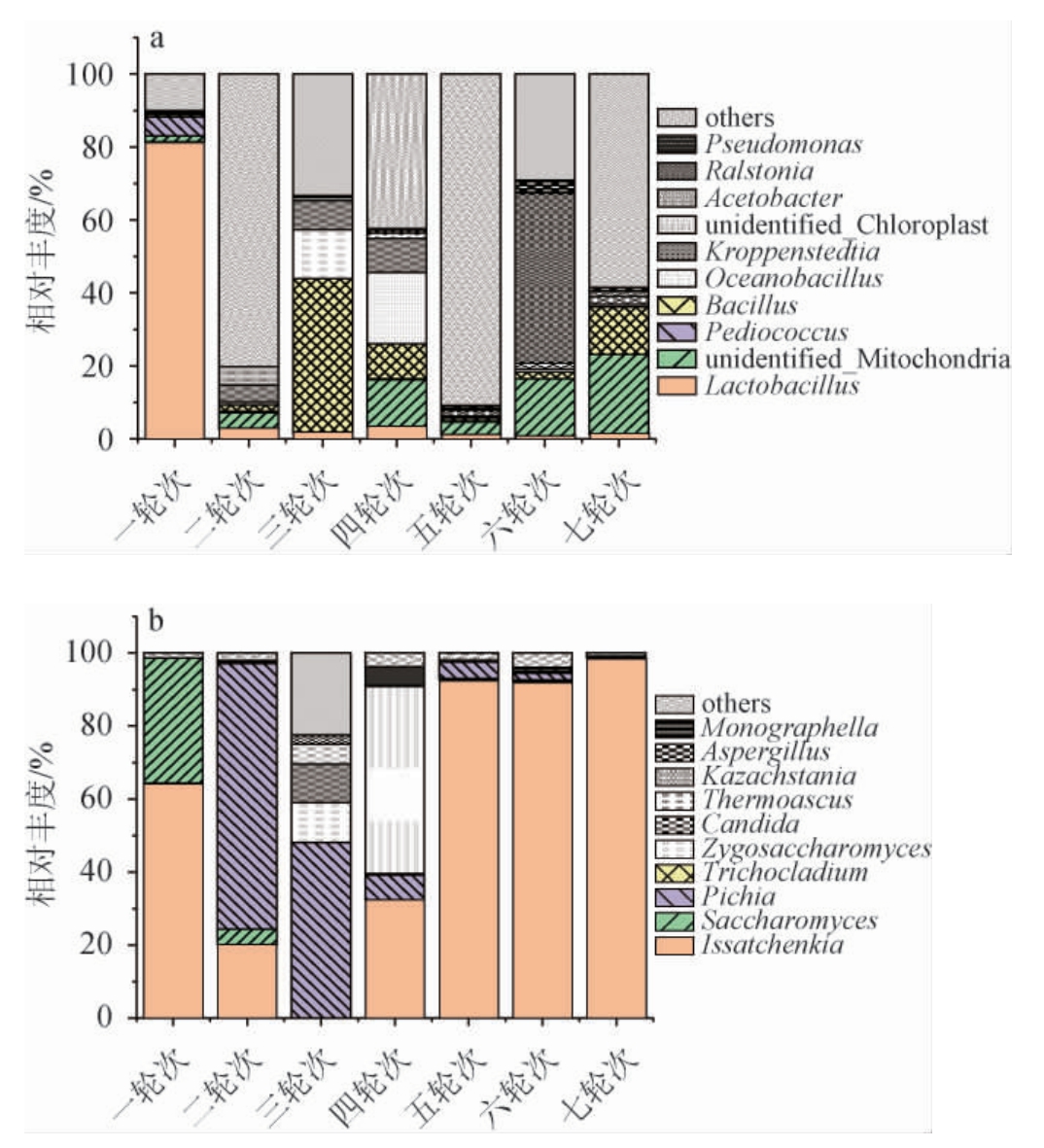
图5 不同轮次酒醅细菌(a)及真菌(b)在属水平上相对丰度
Fig.5 Relative abundance of bacteria (a) and fungi (b) in different rounds of fermented grains at genus level
由图5b可知,在真菌的属水平上,轮次酒醅的相对优势菌属有伊萨酵母属(Issatchenkia)、毕赤酵母属(Pichia)、接合酵母属(Zygosaccharomyces)、酿酒酵母属(Saccharomyces)等,其中Issatchenkia随着轮次呈现先降后增趋势,在3轮次达到最低的相对丰度,在1、5、6、7轮次为优势菌种,尤其是5、6、7轮次相对丰度占比达到90%以上;第2、3轮次优势菌属为Pichia,相对丰度达到了72.8%和48.1%;而第4轮次优势菌属为Zygosaccharomyces,相对丰度达51.3%,不同轮次真菌优势菌属有较大的差异,菌群结构变化较大,这可能与环境温度和水分含量的不同有关[20]。
2.3 酱香型白酒各轮次基酒风味化合物的变化
分别对轮次基酒挥发性风味物质含量进行GC-FID分析,结果见表1,不同轮次基酒挥发性风味化合物总含量结果见图6。
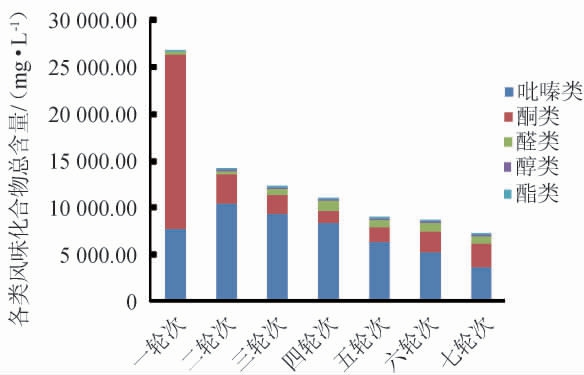
图6 不同轮次基酒中各类挥发性风味化合物总含量分析结果
Fig.6 Analysis results of total contents of various volatile flavor compounds in different rounds base liquor
表1 不同轮次基酒挥发性风味化合物含量GC-FID分析结果
Table 1 Results of volatile flavor compounds contents in different rounds base liquor analyzed by GC-FID mg/L
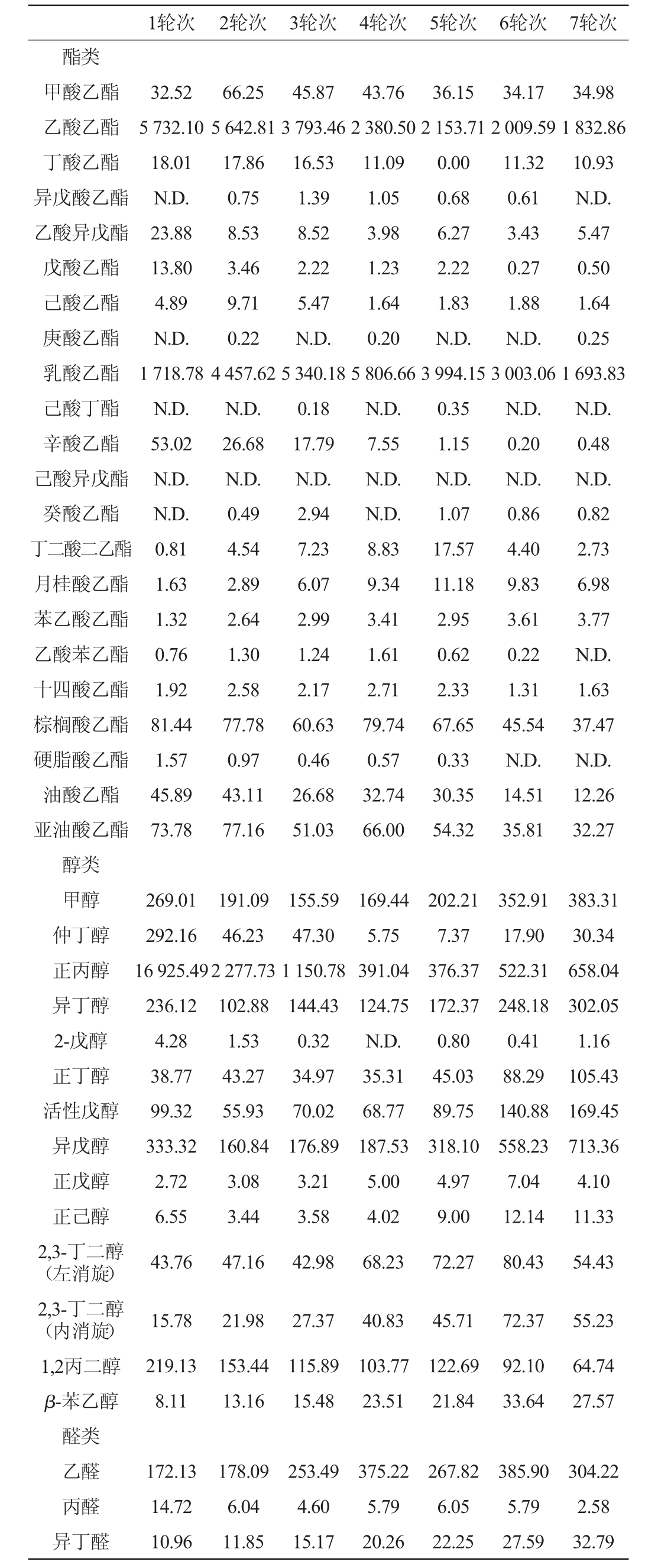
续表

注:“N.D.”表示未检出。
由表1可知,不同轮次基酒中酯类化合物含量的变化先增高然后从第2轮次开始缓慢减少,最高值为10447.37mg/L;不同轮次基酒中醇类化合物含量的变化趋势为开始快速下降然后从第4轮次开始缓慢增加,最低值为1 227.94 mg/L;不同轮次基酒中醛类风味化合物含量的变化趋势为随着轮次的增加先增加,后从第5轮次降低,最高值为1039.92mg/L;不同轮次基酒中酮类化合物含量的变化趋势为随着轮次的增加先增加,后从第5轮次降低,最高值为190.42 mg/L;不同轮次基酒中吡嗪类化合物含量随着轮次的增加变化相对较小。
酯类化合物是酱香型白酒中的重要风味化合物,尤其是乳酸乙酯、乙酸乙酯、丁酸乙酯、己酸乙酯,它可以赋予酒体一定的果香,在酯类化合物中,乙酸乙酯、戊酸乙酯等低碳脂肪酸乙酯呈现逐渐递减的趋势,乳酸乙酯、油酸乙酯等高碳脂肪酸乙酯呈现先增后降的趋势,而同为4大酯的丁酸乙酯和己酸乙酯均呈现缓慢增加的趋势,这与胡峰等[14]的研究结果相似;醇类化合物也是酱香型白酒中重要的风味化合物,适量的醇类化合物可以增加酱香型白酒的醇甜味,而过量的醇类化合物则会给酱香型白酒带来苦味,正丙醇是酒精发酵的产物,可以赋予酒体水果香以及醇香,异丁醇具有酒精和杂醇油的气味,异戊醇和活性戊醇均是杂醇油的主要成分,可以赋予酒体奶酪香和腐败臭[26-27],这4种高级醇都是酒体中重要的醇但是含量过高会引起上头,这4种高级醇均随着轮次的增加而呈现先减后增的趋势,这与韩兴林等[26]的研究结果相似,其3~5轮次的含量要明显低于其他轮次,而3~5轮次的酒是整个生产周期中酒质最好的酒,所以可以推测在同一周期内,这4种高级醇的含量与酒的品质呈负相关;适量的醛类化合物可以赋予酒体杏仁香味以及草香,在醛类化合物中,糠醛的变化趋势与醛类化合物的变化趋势基本相同,而苯甲醛和乙缩醛均呈现波浪式变化,这与尚柯等[24]的研究结果基本相似;适量的酮类化合物和吡嗪类化合物可以增加酒体的焙烤香及坚果香,丙酮随着轮次的增加而增加,而作为双乙酰的还原产物、可以赋予酒体水果香、酶腐香、木香[28]的乙偶姻随着轮次的增加呈现一个先增后降的趋势,最高值为170.35 mg/L;在吡嗪类化合物中,可以赋予酒体焦糖香和牛奶香的四甲基吡嗪随着轮次的增加也呈现一个先增后降的趋势,最高值为3.22 mg/L;醛类化合物、酮类化合物及吡嗪类化合物均在第四轮次达到峰值,随后从第五轮次开始降低,其3~5轮次的含量在7个轮次中最高。
由图6可知,根据变化趋势来看,轮次酒的风味化合物总含量呈现不断降低的趋势,第1轮次达到最高值,为26 687.46 mg/L(其中酯类化合物总含量为7 806.11 mg/L,醇类化合物总含量为18 494.52 mg/L,醛类化合物总含量为372.67 mg/L),第7轮次达到最低值,最低值为7 168.66 mg/L,有研究报道,淀粉的利用率越高,微生物就会越多,作为微生物发酵代谢产物的风味化合物数量就会增多[28],是因为前两轮次粉碎的原料高粱中有大量的淀粉可以利用,所以它的淀粉利用率就会慢慢增高,微生物含量就会随之增高,风味化合物数量也随之增高,而3轮次之后原料高粱中的淀粉渐渐被消耗,糊化的整粒高粱又不足以弥补,所以淀粉的利用率开始降低,其微生物含量也开始降低,风味化合物数量也随之降低。
2.4 相关性分析
酱香型白酒不同轮次酒醅理化指标及微生物的主成分散点图如图7所示,7个轮次,20个微生物、4个理化指标被分到不同区域,其中淀粉、还原糖与毕赤酵母属(Pichia)、醋酸杆菌属(Acetobacter)、热子囊菌属(Thermoascus)、假丝酵母属(Candida)、曲霉属(Aspergillus)、克罗彭斯特菌属(Kroppenstedtia)、毛霉属(Trichocladium)分到同一区域,说明淀粉、还原糖与这些微生物相关性较大,这些微生物在很大程度上影响着淀粉、还原糖的数值;酸度、水分与芽孢杆菌属(Bacillus)、Unidentified Chloroplast、海洋芽孢杆菌(Oceanobacillus)、接合酵母属(Zygosaccharomyces)、明梭孢属(Monographella)分到同一区域,说明水分、酸度与这些微生物相关性较大。

图7 不同轮次基酒酒醅理化指标及微生物的主成分散点图
Fig.7 Main components scatter diagram of physicochemical indexes and microorganisms in fermented grains of different rounds base liquor
不同轮次酒醅微生物-风味物质相关性气泡图如图8所示,与风味物质关联性最大的微生物是假单胞菌属(Pseudomonas),其与辛酸乙酯、油酸乙酯、硬脂酸乙酯、亚油酸乙酯、苯乙醇、异丁醛、丁二醇右、异戊醛、戊酸乙酯、乙酸乙酯呈极显著性相关,与乙酸异戊酯、棕榈酸乙酯、正戊醇、正己醇、丙二醇、乙醛、月桂酸乙酯、丙酮、苯乙酸乙酯呈显著性相关。片球菌属(Pediococcus)是另一个与风味物质关联性较大的微生物,其与油酸乙酯、硬脂酸乙酯、亚油酸乙酯、戊酸乙酯呈极显著性相关,与乙酸异戊酯、辛酸乙酯、棕榈酸乙酯、丙二醇、苯乙醇、乙醛、丙醛、异丁醛、2,3-丁二醇、苯乙酸乙酯、乙酸乙酯呈显著性相关。除此之外,毕赤酵母属(Pichia)、接合酵母属(Zygosaccharomyces)、假丝酵母属(Candida)都是与风味物质相关性较强的微生物,其中Pichia与异戊醇、异戊酸乙酯、甲酸乙酯呈极显著相关,与乳酸乙酯、甲醇、异丁醇、活性戊醇呈显著性相关,Zygosaccharomyces与戊醇、乙偶姻呈极显著性相关,与乳酸乙酯、乙缩醛呈显著性相关,Candida与癸酸乙酯呈极显著相关,与油酸乙酯、亚油酸乙酯、棕榈酸乙酯呈显著性相关。
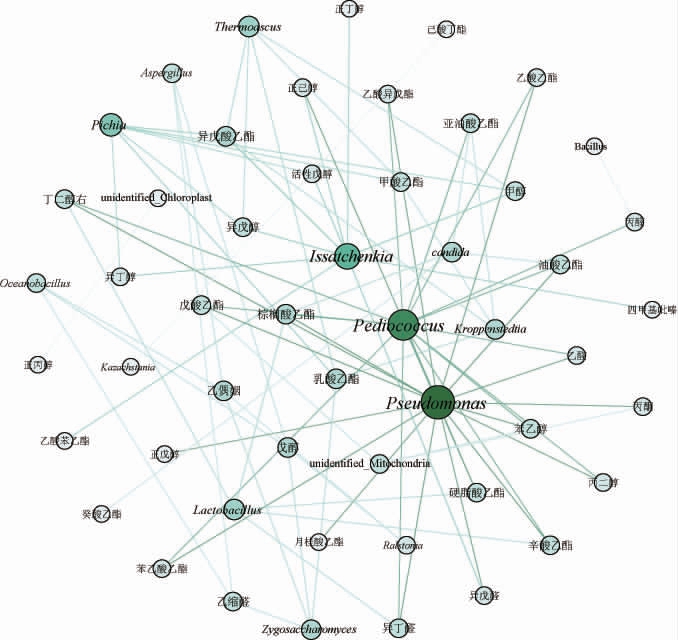
图8 不同轮次基酒酒醅微生物与风味相关性气泡图
Fig.8 Correlation bubble chart between microorganisms in fermented grains of different rounds base liquor and flavor
3 结论
在酱香型白酒整个生产周期中,出池酒醅的水分含量、酸度、还原糖含量均是一个先增加后缓慢减低的趋势,第4轮次最高,淀粉含量是一个不断降低的过程,最低值为9.49%。在整个生产周期中共检测到71种细菌属和43种真菌属。其中前二优势细菌属为:乳酸杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus),前二优势真菌属为:伊萨酵母属(Issatchenkia)、毕赤酵母属(Pichia)。风味化合物总含量呈现随着轮次的递增不断下降的趋势,第一轮次达到最高值,为26 687.46 mg/L。将理化指标与微生物之间进行相关性分析,结果发现淀粉、还原糖与毕赤酵母属(Pichia)、醋酸杆菌属(Acetobacter)等相关性较大,酸度、水分与芽孢杆菌属(Bacillus)、Unidentified Chloroplast、海洋芽孢杆菌(Oceanobacillus)等相关性较大;将风味物质与微生物之间进行相关性分析,结果发现与风味物质关联性最大的微生物是假单胞菌属(Pseudomonas)、片球菌属(Pediococcus)、毕赤酵母属(Pichia)、接合酵母属(Zygosaccharomyces)、假丝酵母属(Candida)。
[1]郭世鑫,姚孟琦,马文瑞,等.酱香型白酒的研究现状[J].中国酿造,2021,40(11):1-6.
[2]孙燕明.酱香型白酒缘何风景这边独好[N].中国消费者报,2022-01-20(003).
[3]陈萍,连宾,尹祚莹,等.茅型酒酱香物质的本质和影响因素分析研究进展[J].食品科学,2013,34(15):403-408.
[4]ZHANG R,WU Q,XU Y.Aroma characteristics of Moutai-flavor liquor produced with Bacillus licheniformis by solid state fermentation[J]. Lett Appl Microbiol,2013,57(1):11-18.
[5]孙金旭,朱会霞,杨晓红,等.酵母添加量对酱香型白酒中杂油醇影响[J].食品研究与开发,2010,31(12):67-70.
[6]张建华,王邦坤.北方酱香型白酒工艺探讨[J].酿酒科技,2011(3):52-54.
[7]张晓成.酱香型白酒酿造过程主要影响因素的分析[J].管理学家,2014(12):456-456.
[8]邓皖玉,许永明,程伟,等.摊晾面积对酱香型白酒窖池产出差异性的影响[J].酿酒科技,2019(12):32-35.
[9]尚柯,韩兴林,王德良,等.酱香白酒高温堆积酒醅挥发性风味物质的检测分析[J].中国酿造,2016,35(2):139-143.
[10]邓皖玉,许永明,程伟,等.润粮工艺对酱香型白酒生产的影响[J].酿酒科技,2021(1):36-41,49.
[11]潘和勇.酱香型白酒酿造关键工艺原理分析[J].中国食品,2021(17):89-90.
[12]CHEN S,SHA S,QIAN M,et al.Characterization of volatile sulfur compounds in Moutai liquors by headspace solid-phase microextraction gas chromatography-pulsed flame photometric detection and odor activity value[J].J Food Sci,2017,82(12):2816-2822.
[13]HANAI T,ANDO K,NOGUCHI H,et al.Modeling of sensory evaluation for interior tiles using a fuzzy neural network[J]. Kagaku Kogaku Ronbun,1998,24(1):18-23.
[14]胡峰,钟方达,胡建锋,等.酱香型白酒窖内不同层次酒醅微生物与酒体风格的研究[J].酿酒科技,2014(9):48-52.
[15]唐维川,孔祥凯,王婷,等.基于主成分分析法评价酱香型白酒的不同轮次基酒[J].现代食品科技,2021,37(7):269-277,268.
[16]陆伦维,钟敏,冯小兵,等.基于主成分分析判别不同等级酱香型白酒的研究[J].酿酒科技,2020(2):17-21,28.
[17]韩兴林,尚柯,王德良.酱香白酒堆积发酵过程中代谢风味生成规律的分析[J].酿酒,2018,45(4):43-50.
[18]孟望霓,田志强.酱香型白酒风味物质贮藏周期变化规律分析[J].酿酒科技,2015(7):21-27.
[19]戴奕杰,李宗军,田志强.酱香型白酒酒醅酶活性和轮次酒理化指标分析[J].中国酿造,2019,38(2):31-36.
[20]赵金松,张良,孙啸涛,等.酱香型大曲微生物群落特征与理化指标的相关性研究[J].基因组学与应用生物学,2019,38(1):199-204.
[21]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 10345—2007白酒分析方法[S].北京:中国标准出版社,2007.
[22]王贵军,沈才洪,张洪远,等.酱香型白酒糟醅堆积与窖内发酵工艺研究[J].酿酒科技,2011(5):36-37,41.
[23]卢君,山其木格,王丽,等.酱香型白酒糟醅理化指标规律研究[J].酿酒科技,2018(6):60-64.
[24]尚柯,韩兴林,潘学森,等.酱香型白酒高温堆积过程相参数变化情况的初步分析[J].酿酒科技,2015(10):1-4.
[25]王晓丹,张小龙,陈孟强,等.酱香型白酒窖内发酵过程中酒醅理化指标与细菌的变化趋势研究[J].酿酒,2014,41(3):21-24.
[26]韩兴林,潘学森,刘民万,等.云门酱香型白酒各轮次基酒风味构成分析[J].酿酒科技,2015(8):46-49,54.
[27]张振东,杜娟,黄利科,等.永不分梨酱香型白酒生产中风味物质变化分析[J].酿酒,2021,48(4):47-49.
[28]李俊,王震,郭晓关,等.基于全二维气相飞行时间质谱联用法分析贵州酱香型白酒挥发性风味成分[J].酿酒科技,2016(12):102-106.